丙酮醛降低人脑微血管内皮细胞系hCMEC/D3细胞活力及线粒体膜电位
2023-10-31李婷婷韩臻平王思懿严洁萍
李婷婷,韩臻平,高 立,王思懿,钟 恺,黄 萍,3,严洁萍,3*
1.浙江省人民医院 杭州医学院附属人民医院 临床药学中心 药学部,浙江 杭州 310014;2.浙江工业大学 药学院 药学系,浙江 杭州 310014;3.浙江省内分泌腺体疾病诊疗重点实验室,浙江 杭州 310014
脑血管并发症(cerebrovascular complications)是常见的糖尿病并发症,增加疾病不良预后,并与病程呈正相关,因此脑血管并发症的深入机制研究及有效防治是降低糖尿病不良预后的关键环节[1]。
丙酮醛(methylglyoxal,MGO)是葡萄糖和果糖氧化反应的中间产物之一,其糖基化活性比葡萄糖高200~50 000倍[2]。临床研究发现在糖尿病患者的血清中可检测到比健康者高2~4倍的MGO浓度。此外,研究发现晚期糖基化终末产物(advanced glycation end products,AGEs)比健康人群高出数倍[3]。高糖状态可导致包括内皮细胞等多种细胞胞内高浓度活性氧、诱导细胞凋亡、线粒体功能发生障碍以及血管生成受阻[4]。高浓度的MGO和AGEs不仅可能导致糖尿病患者血管内皮损伤,还与血脂异常、高血压、卒中等血管并发症密切有关[2,5]。因此,MGO可能是糖尿病脑血管并发症的重要因素,但其病理学意义尚不明确。
本研究试图探讨MGO对人脑微血管内皮细胞系hCMEC/D3的损伤作用,并进一步考察线粒体活性氧(mitochondrial reactive oxygen species,mROS)和线粒体膜电位等变化,对脑血管并发症的病理机制及临床防治都具有重要临床意义。
1 材料和方法
1.1 材料
1.1.1 主要试剂:DMEM、胎牛血清(Gibco公司);胰蛋白酶-EDTA(HyClone公司);二甲基亚砜(dimethyl sulfoxide,DMSO)(Sigma-Aldrich公司);JC-1探针,MGO(MCE公司);CCK-8试剂盒、LDH试剂盒、SOD试剂盒(碧云天生物技术公司);MitoSOX(Thermo Fisher Scientific公司)。
1.1.2 细胞:人脑微血管内皮细胞系hCMEC/D3、DMEM培养液(含10%胎牛血清)(浙江美森细胞科技有限公司)。
1.2 方法
1.2.1 细胞的分组及处理:分组如下:对照组,加入25 μL培养基;MGO组,加入25 μL不同浓度的MGO,使其终浓度为0.25、0.50、0.75、1.00和1.25 mmol/L。
1.2.2 CCK-8法检测活力:收集正常培养的hCMEC/D3细胞,按每孔约6 000~10 000个细胞接种到96孔板中,常规培养24 h后加入不同浓度的MGO继续培养,吸弃孔中原有液体,将稀释好的CCK-8工作液(100 μL)加入96孔板中,并检测吸光度(A450 nm)值。
1.2.3 细胞内LDH和SOD的检测:将hCMEC/D3细胞接种于96孔板,MGO(0.75 mmol/L)处理细胞6 h和12 h后,按测试盒说明书测定。
1.2.4 JC-1荧光探针检测线粒体膜电位:用不同浓度的MGO分别孵育增殖汇合至60%的hCMEC/D3细胞,接着用2 μmol/L的JC-1工作液在37 ℃下孵育15 min,最后用稀释至1×的缓冲液清洗3次,镜下观察荧光强度。
1.2.5 MitoSOX荧光探针检测线粒体活性氧(mROS):hCMEC/D3细胞培养在35 mm的共聚焦皿中,以不同浓度的MGO孵育10 h后,接着用稀释的200 nmol/L MitoSOX在37 ℃孵育10 min,镜下观察荧光强度。
1.3 统计学分析
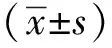
2 结果
2.1 MGO呈浓度依赖地诱导hCMEC/D3细胞损伤
不同浓度的MGO作用于hCMEC/D3细胞24 h,细胞活力较对照组,呈浓度依赖性明显下降(P<0.01)(图1)。后续实验选用MGO浓度为0.75 mmol/L。

*P<0.5,**P<0.01 compared with control.
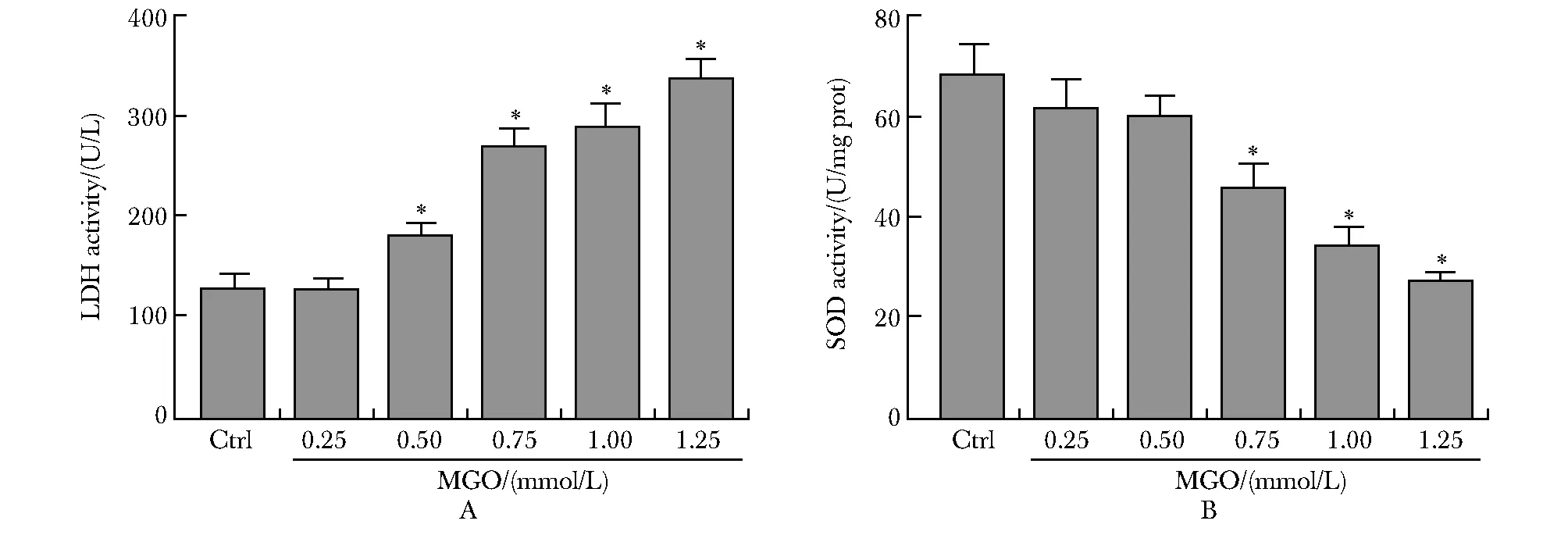
2.2 MGO对hCMEC/D3细胞 LDH和SOD活性的影响
与对照组相比,MGO(0.75 mmol/L)处理24 h后,hCMEC/D3胞内LDH活性呈浓度依赖性上调(P<0.01),而SOD活性呈浓度依赖性显著降低(P<0.01)(图2)。
A.observing by MitoSOX probe; B.determining by kits; 0.01 compared with control.
2.3 MGO对hCMEC/D3细胞 mROS水平的影响
与对照组相比,MGO(0.75 mmol/L)作用6 h和12 h后,经MitoSOX染色后,hCMEC/D3胞内可见红色荧光,随时间显著增强(P<0.01)(图3)。

0.01 compared with control.
2.4 MGO对hCMEC/D3细胞线粒体膜电位的影响
与对照组相比,MGO(0.75 mmol/L)作用6 h和12 h后,hCMEC/D3细胞红绿荧光比值降低(P<0.01)(图4)。

0.01 compared with control.
3 讨论
脑微血管内皮损伤是糖尿病脑血管并发症的关键环节[5-6]。临床研究表明,糖尿病患者的MGO水平明显高于健康人群[7],可能是脑血管并发症的关键因素之一。本研究发现MGO可降低hCMEC/D3细胞活力,导致胞内LDH过量释放,降低细胞SOD活性和线粒体膜电位,并可导致胞内mROS过量发生。本研究利用人脑微血管内皮细胞系hCMEC/D3作为体外研究对象,确认了MGO浓度依赖的hCMEC/D3细胞损伤,并采用0.75 mmol/L MGO作为后续损伤浓度,与目前报道的研究一致[8-9]。
人脑微血管内皮细胞是血脑屏障的重要组成部分,其功能障碍会造成脑组织损伤,增加糖尿病患者脑血管并发症的发生。有研究显示,MGO能抑制人脐静脉内皮细胞活性,导致细胞炎性损伤并进一步促进细胞凋亡[10]。MGO还可抑制人主动脉内皮细胞网络的形成和增殖,诱导细胞凋亡[11]。本研究也发现hCMEC/D3细胞经MGO处理后,细胞活力降低,LDH释放增加,提示MGO增加了hCMEC/D3细胞膜通透性,可能造成血脑屏障破坏。SOD作为体内的一种自由基清除剂,抑制体内氧化损伤,参与维持体内代谢平衡。MGO作用后hCMEC/D3细胞SOD的活性降低,提示MGO可能影响胞内正常的氧化代谢,可能造成机体氧化损伤。
当线粒体ETC系统有缺陷时,线粒体活性氧生成增加,导致MGO诱导的组织损伤的病理机制上调[12]。细胞线粒体膜电位下降时线粒体通透性转换孔开放,这将使线粒体内的氧化物质释放到细胞基质中,造成细胞损伤[13]。本研究中MGO诱导早期hCMEC/D3细胞内mROS过量生成,伴线粒体膜电位下降,提示MGO诱导了细胞线粒体功能损伤。因此MGO对细胞损伤的早期作用,诱导线粒体功能损伤可能是导致糖尿病脑血管并发症发生的重要原因之一。有研究显示MGO上调了hCMEC/D3细胞中线粒体凋亡途径相关的caspase-8,caspase-9的表达,促进线粒体凋亡[14]。以上研究均提示MGO可能是糖尿病脑血管并发症中的一个高危因素,其损伤作用可能与线粒体损伤相关。
综上所述,MGO降低hCMEC/D3细胞活力,增加LDH的水平,降低SOD的活性及胞内线粒体膜电位,同时伴mROS过量产生。MGO致hCMEC/D3细胞活力下降和mROS过量产生之间的相关机制还有待进一步探讨。
