类风湿关节炎血浆D-二聚体水平与颈动脉粥样硬化的相关性分析
2023-10-30王瑞张翊一罗改莹
王瑞 张翊一 罗改莹
类风湿关节炎(rheumatoid arthritis,RA)是临床上常见的一种慢性、炎症性自身免疫性疾病,其基本病理改变为进行性、对称性、侵蚀性的关节滑膜炎症,不仅致畸致残率高,同时在疾病进展过程中可出现如心、肺、肾等关节外的系统损害。有国内外研究显示,RA患者动脉粥样硬化性疾病的发病率逐年上升,且合并心血管疾病(cardiovascular arthritis,CVD)已成为RA患者的重要死亡原因之一[1,2]。RA患者CVD发病率高,除了传统的动脉硬化危险因素增加外,还要考虑慢性炎症的存在导致血管功能受损、动脉壁增厚以及动脉僵硬度增加。有研究表明,RA患者全身性的炎性反应与血管的凝固性增加及血栓的形成有一定关系[3]。而RA患者关节腔内大量纤维蛋白原以及凝血酶原沉积可诱发全身凝血及纤溶系统激活[4]。血浆D-聚体(D-Dimer)为凝血酶及因子Ⅻ作用的交联纤维蛋白降解的终末产物,是反映机体继发性纤溶功能亢进的高度敏感的分子标志物。近年有一些文献报道,在RA患者中可出现血浆D-Dimer体及纤维蛋白降解产物(fibrin degradation product,FDP)等实验室指标的升高[5]。另一方面,颈动脉为最常见的动脉粥样硬化受累血管,超声下检测颈部动脉粥样硬化的程度可间接地反映全身动脉硬化的情况[6]。本研究通过实验室检测RA患者的血浆D-Dimer水平以探讨血浆D-Dimer在RA患者及RA合并颈动脉粥样硬化(CAS)患者中的临床意义。
1 资料与方法
1.1 一般资料 收集2018年1月至2019年1月西安市第五医院门诊及住院就诊的RA患者75例(RA组),其中男26例,女49例;平均年龄(56.3±15.8)岁;病程(67.9±48.6)个月;同时收集同期健康体检者70例作为对照组,其中男35例,女35例;平均年龄(52.1±11.6)岁。2组在性别比、年龄比较差异无统计学意义(P>0.05),且2组均排除吸烟、酗酒、高血压、高脂血症、感染、肿瘤、糖尿病、血液系统疾病、妊娠及其他代谢异常疾病或合并严重肝肾功能障碍者,且2周内未使用抗凝溶栓类药物。
1.2 分组标准
1.2.1 RA疾病活动性分组:按照RA的DAS28评分标准,可将RA患者分为2个亚组:DAS28≤ 2.6分为非活动期RA组,其中男11例,女17例;年龄35~69岁,平均(51.20±10.09)岁。DAS28> 2.60为活动期RA组,其中男15例,女32例;年龄33~71岁,平均(51.08±16.09)岁。
1.2.2 RA是否合并CAS分组(根据超声检查结果[7]):颈动脉中膜厚度(IMT)>0.9 mm即判断为增厚,提示早期动脉粥样硬化。颈动脉粥样硬化斑块定义为IMT>1.2 mm,不均匀地累及左右颈总动脉分叉部,伴有或不伴有血流障碍。颈动脉粥样硬化的改变被定义为颈动脉IMT增加或斑块的存在。RA合并CAS组,其中男18例,女30例;年龄30~68岁,平均(49.08±15.09)岁。RA未合并CAS组,其中男8例,女19例;年龄33~71岁,平均(50.18±14.39)岁。
1.3 纳入与排除标准
1.3.1 纳入标准:RA组患者均符合以下条件:1987年美国风湿病学会(ACR)发布的RA分类标准与2009年美国风湿病学会(ACR)/欧洲抗风湿病联盟(EULAR)发布的RA分类标准。
1.3.2 排除标准:合并其他结缔组织病,如系统性红斑狼疮等,无相关动静脉血栓病史,近半年无手术及外伤史。
1.4 血浆D-Dimer水平的检测 采用ACL TOP 700全自动凝血仪;免疫比浊法;采用BECKMAN COULTER原厂配套试剂。标本要求:空腹采用凝血真空采血管采血1.8 ml,采样后轻轻颠倒混匀 4~6 次后尽快分离血浆(3 000 r/min,离心 10 min)进行检测。
1.5 其他实验室指标测定 C-反应蛋白(CRP):采用BECKMAN COULTER Immage 800 特种蛋白分析仪;免疫散射比浊法;BECKMAN COULTER 原厂配套试剂。标本要求:空腹,采用无添加剂真空采血管采取静脉血3 ml,静置,分离血清(3 000 r/min,10 min)。红细胞沉降率(ESR):ESR-30 全自动动态血沉仪;红外线阻挡法。标本要求:采用3.8%柠檬酸钠真空采血管采集静脉血1.28 ml,采样后轻轻颠倒混匀6~8次,2 h 内完成检测。肿瘤坏死因子-α(TNF-α):TNF-α采用双抗体夹心酶联免疫吸附法(ELISA) 检测,试剂盒由美国RB(RAPIDBIO)公司提供,仪器应用雷杜RT-6100型酶标仪所有操作均严格按产品说明书进行。标本要求:空腹,采用无添加剂真空采血管采取静脉血3 ml,静置,分离血清(3 000 r/min,10 min)。
1.6 DAS28评分标准 使用DAS28评分程序,计算28个关节的肿胀数及压痛数[28个关节包括膝关节(n=2),肩关节(n=2),肘关节(n=2),腕关节(n=2),掌指关节(n=10),近端指间关节(n=10)]以及CRP和ESR水平。DAS28 > 2.60表示疾病活动;DAS28 ≤ 2.60表示疾病缓解。
1.7 超声检查 采用EsaoteDU6彩色超声诊断仪对2组进行检查,探头LA523,频率5~13 MHz。受试者取平卧位,充分暴露颈部,检查时头偏向对侧,探头置于颈部,分别连续测量3次双侧颈总动脉内中膜厚度(CIMT),取平均值。颈动脉超声是在对研究对象进行资料采集的同一天完成,均由1名经验丰富的超声医生进行检测。根据2013年欧洲高血压学会(ESH)/欧洲心脏病学会(ESC)高血压患者心血管危险因素控制指南,异常颈动脉IMT增厚通常定义为厚度>0.9 mm。颈动脉粥样硬化斑块定义为局部增厚>1.2 mm,不均匀累及整个左侧或右侧颈总动脉分叉,无论是否存在血流障碍[7]。
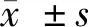
2 结果
2.1 2组血浆D-Dimer水平、ESR、CRP、CIMT值比较 活动期、非活动期RA组血浆D-Dimer水平、ESR、CRP、CIMT值明显高于对照组,其中活动期RA组血浆D-Dimer水平、ESR、CRP、CIMT值高于非活动期RA组(P<0.05)。见表1。

表1 2组血浆D-Dimer、ESR、CRP、CIMT值比较
2.2 RA合并CAS与RA未合并CAS患者血浆D-Dimer水平比较 RA患者中合并CAS患者血浆D-Dimer水平、ESR、CRP、TNF-α高于RA未合并CAS患者(P<0.05)。见表2。

表2 RA合并CAS组与RA非合并CAS组血浆D-Dimer、ESR、CRP、TNF-α比较
2.3 RA患者血浆D-Dimer水平与RA疾病活动及CIMT值的相关分析 血浆D-Dimer水平与RA疾病活动的及CIMT值呈正相关(rs=0.154,P<0.05)。Logistic回归分析显示,血浆D-Dimer水平升高为RA患者发生CAS的危险因素(OR=2.52,P<0.05)。见表3。

表3 RA患者血浆D-Dimer水平与RA疾病活动及CIMT值的相关分析
3 讨论
有研究显示,RA患者心血管疾病的病死率比一般人群高出50%[8]。RA患者罹患急性心肌梗死的风险较一般人群可增加2~3倍,罹患急性心力衰竭(CHF)和心源性猝死的风险可增加2倍,罹患缺血性脑卒中的风险可上升1.7倍[9]。Del Rincón等[10]研究表明,RA发病初期就可出现动脉粥样硬化,RA病程越长,动脉粥样硬化就越严重,罹患CVD的风险越高。因此,近年RA患者合并动脉硬化性疾病备受关注。甚至权威组织欧洲抗风湿联盟(EULAR)也提出应加强类风湿关节炎患者心血管疾病的监测。
在RA患者疾病进展中,尤其是在疾病活动期,炎性反应不断增强,致大量炎性细胞因子(C-反应蛋白、白细胞介素-1、白细胞介素-6、肿瘤坏死因子-α等)由关节滑膜组织不断释放进入全身体循环,导致机体血管内皮细胞功能障碍、血管平滑肌细胞的迁移和增生、巨噬细胞吞噬脂质、斑块破裂和血栓形成等[11]。其次,传统风险因素影响可能加速RA患者动脉硬化进展,如吸烟、高血压、脂质代谢异常、糖尿病、胰岛素抵抗等。RA相关炎性因子不仅在调节机体免疫反应过程中发挥作用,而且可作用于外周组织如肝脏、骨骼肌、脂肪组织、血管内皮等组织,致机体脂代谢紊乱、胰岛素抵抗、氧化应激、高凝活性、内皮功能障碍等,从而加速RA患者动脉粥样硬化加速进展。Hassen Zrour等[12]一项关于RA患者血脂方面的研究发现,HDL-C水平与hx-CPR、ESR呈负相关,Van den Oord等[13]提出HDL-C水平降低可导致动脉粥样硬化。最后,RA患者关节腔内异常增多的纤维蛋白原或纤维蛋白的沉积促使机体纤溶亢进使微血栓溶解、血管通透性增加。当已经变性的微血管再灌注时,可导致出血、免疫复合物沉积、纤溶系统亢进、微循环障碍[14],促进动脉硬化进展。与此同时,上述各项危险因素又通过复杂的病理生理机制相互影响,进一步促进RA患者动脉壁增厚、动脉僵硬度增加,从而加速动脉硬化的发生及发展,以致RA患者急性血管事件的发生率不断攀升。
众所周知,全身各个大中小动脉均可发生动脉粥样硬化,其中颈动脉、冠状动脉等大中动脉是最常见的发病部位。由于颈动脉位置较其他大中动脉表浅,易于被体表超声探及,可作为反应全身动脉硬化情况的缩影,从而证明全身动脉硬化的存在。而且属于无创性检测方法,易于操作。通过颈动脉超声对标准切面的扫描及探查,不仅可以显示动脉内中膜的厚度[15]、斑块的部位和大小、管腔狭窄部位和严重程度,还能进行血流动力学测定,并可对斑块进行形态学评价;因此是目前公认的预测大血管粥样硬化病变可靠的定量指标[16]。本研究中对RA组及对照组进行颈动脉粥样硬化检查,发现RA组CIMT值明显高于对照组;疾病活动期RA患者较非疾病活动期RA患者CIMT值明显升高,(P<0.05),提示RA患者特别是RA疾病活动期患者为发生颈部动脉硬化的高危群体,与古丽米热·喀热等[17]研究基本一致。
在自身免疫性疾病中,血浆D-Dimer水平升高、纤溶活性增强报道逐渐增多[14]。但是关于类风湿关节炎患者中血浆D-Dimer水平与颈部动脉硬化的相关性研究并不多。类风湿关节炎为慢性、炎症性自身免疫病,异常增多的纤维蛋白原或纤维蛋白的沉积是RA患者关节滑膜炎症的特征病理表现之一,RA疾病活动时纤溶亢进、微循环障碍,可能是RA患者血管炎形成的原因之一[18]。免疫性血管炎的广泛存在预示病情活动及疾病进展。有国外研究人员实验发现,RA患者的血浆D-Dimer水平与类风湿关节炎患者疾病活动度密切相关,血清D-Dimer长时间处于高水平,也是RA患者愈后不良的预测指标[19]。在凝血纤溶系统中,可溶性纤维蛋白在纤溶系统的作用下形成稳定的交联纤维蛋白,在纤维蛋白酶作用下分解的产物称为D-Dimer。RA患者的D-Dimer水平升高反映了RA患者高凝纤溶状态的存在,早期检测RA患者的D-Dimer水平有利于对高凝状态的早期预防治疗。俞烜华等[20,21]研究发现,FIB、FDP及D-Dimer与RA疾病活动相关指标正相关,FIB、FDP及D-Dimer升高提示体内存在高凝状态及继发纤溶亢进,可反映RA疾病活动。通过本研究发现,RA组患者整体血浆D-Dimer水平较对照组显著升高,且疾病活动期RA患者较非疾病活动期RA患者血浆D-Dimer水平升高,RA合并CAS患者的血浆D-Dimer水平高于无CAS者,差异均有统计学意义(P<0.05),提示高水平的血浆D-Dimer水平可能是RA患者合并CAS的原因之一。相关性分析显示RA患者CIMT值与血浆D-Dimer水平呈正相关,CIMT值随血浆D-Dimer水平的升高而升高,由此说明血浆D-Dimer是动脉硬化发生的重要因素。RA患者是动脉硬化发生的高危人群的原因不仅与免疫、血脂代谢紊乱等有关,也与患者血浆D-Dimer的变化密切相关。
综上所述,RA患者是动脉硬化发生的高危人群且与疾病发展息息相关,在临床工作中不仅要关注已知因素如免疫、血脂代谢紊乱等的作用,同时也要进一步重视RA、血浆D-Dimer、CAS之间因果关系的变化,以便更有效地综合评估患者健康状况,做到疾病一级预防,切实降低患者心脑血管疾病发生率。
