清热化湿方通过上调miRNA-155抑制Wnt/β-catenin信号通路治疗胃癌的作用机制研究Δ
2023-10-16尹硕鑫敖先伟陈远能南阳市中心医院河南南阳7000荆州市第二人民医院消化内科湖北荆州000南阳市中心医院呼吸内科河南南阳7000广西中医药大学附属瑞康医院消化内科南宁50011
尹硕鑫,敖先伟,李 博,张 涛,陈远能#(1.南阳市中心医院,河南 南阳 7000;.荆州市第二人民医院消化内科,湖北 荆州 000;.南阳市中心医院呼吸内科,河南 南阳 7000;.广西中医药大学附属瑞康医院消化内科,南宁 50011)
胃癌是全球第五大常见癌症[1],全球每年约有100万人诊断为胃癌,其中约40%的新发病例和死亡病例发生在中国[2]。目前,胃癌的主要治疗方法包括手术和放化疗,但术后复发率高,并且晚期胃癌患者化疗后5年生存率低于5%[3]。中医药作为我国医疗事业中不可或缺的一部分,不仅能提高化疗药的疗效、减少副作用、提高患者生活质量,还能减慢肿瘤生长速度、缓解临床症状,在肿瘤患者治疗中的应用也日益广泛。
清热化湿方为经典方“藿朴夏苓汤”加黄连、栀子化裁而成。藿朴夏苓汤出自清代的《医原》,能宣通气机、燥湿利水[4]。本课题组前期研究证实,清热化湿方能够防治幽门螺杆菌感染相关的胃癌[5—6]。近年来miRNA与胃癌的关系被广泛报道。本课题组前期通过基因芯片分析发现,胃癌组织中的miRNA-155 会被明显下调[7],且稳定沉默miRNA-155 可促进胃癌的进展[8]。此外,有研究显示,miRNA能够通过调节Wnt/β-catenin信号通路参与调控胃癌细胞的生物学行为[9]。基于此,本研究通过构建胃癌荷瘤裸鼠模型探讨清热化湿方是否能够通过干预miRNA-155 抑制Wnt/β-catenin 信号通路中Wnt7、β-catenin、T 细胞因子4(T-cell factor-4,TCF-4)表达进而治疗胃癌,以期为清热化湿方的临床应用提供依据。
1 材料
1.1 主要仪器
IX71 型荧光倒置显微镜购自日本Olympus 公司;RM2135 型切片机购自德国Leica 公司;3K15 型低温冷冻离心机购自德国Sigma 公司;Mini Protean 3 Cell 型电泳仪购自美国BioRad公司;MK3型酶标仪、ChemiScope 5300 Pro 型一体式化学发光成像仪均购自美国Thermo Fisher Scientific公司。
1.2 药品与试剂
清热化湿方(包括藿香6 g、白豆蔻1.8 g、淡豆豉9 g、川厚朴3 g、姜半夏4.5 g、杏仁9 g、赤茯苓9 g、猪苓4.5 g、泽泻4.5 g、生薏苡仁12 g、黄连12 g、栀子12 g)购自广西中医药大学附属瑞康医院。过表达miRNA-155 慢病毒由汉恒生物科技(上海)有限公司构建;DMEM高糖培养基、胎牛血清(批号分别为SH30022.01、SH30406.05)均购自美国HyClone 公司;青链双抗(批号E607011)购自生工生物工程(上海)股份有限公司;嘌呤霉素、Trizol RNA 提取试剂、SYBRGreen PCR 试剂盒、逆转录试剂盒(批号分别为A1113803、15596026、F-415XL、K1622)均购自美国Thermo Fisher Scientific 公司;0.25%胰蛋白酶(批号C0201)购自上海碧云天生物技术有限公司;BCA蛋白定量试剂盒(批号BL521A)购自广州硕谱生物科技有限公司;磷酸盐缓冲液(PBS,批号422300)购自北京索莱宝科技有限公司;ECL发光液购自美国Millipore公司;兔源Wnt 单克隆抗体(批号10605-1-AP)购自美国Proteintech 公司;兔源β-catenin 单克隆抗体(批号ab32572)购自英国Abcam公司;山羊抗小鼠免疫球蛋白G二抗(批号223120412)购自北京中杉金桥生物技术有限公司。
1.3 实验动物
本研究所用动物为SPF 级裸鼠,雄性,4 周龄,实验动物生产许可证号为SCXK(苏)2021-0010,动物合格证号为202235128。本研究经广西中医药大学动物伦理委员会审核批准,批准号为DW20220621-122。
1.4 细胞株
人胃腺癌AGS 细胞购自赛百慷(上海)生物技术股份有限公司。
2 方法
2.1 清热化湿方药液的制备
按处方量称取清热化湿方药材,捣碎,先以8倍量水煮沸30 min,用8层纱布过滤;药渣再以6倍量水煮沸30 min 后同法过滤;合并两次滤液,浓缩成质量浓度为1 g/mL的药液(以生药量计),于4 ℃条件下保存备用。
2.2 miRNA-155过表达AGS细胞株的构建
将AGS细胞铺板于培养皿中,密度为5×104个/皿;待细胞汇合度为80%时,以最佳感染复数(200)进行病毒感染;继续培养24 h后更换为DMEM高糖培养基;感染72 h 后,加入含5 µg/mL 嘌呤霉素的完全培养基进行筛选,以后每天用荧光显微镜观察细胞荧光及细胞状态,当荧光效率在90%以上时表明miRNA-155 过表达AGS细胞株构建成功。
2.3 胃癌荷瘤模型裸鼠的构建及分组给药
将裸鼠适应性喂养1 周后按体重随机分为模型组、对照组、过表达组和清热化湿方低、中、高剂量组,每组5只。将裸鼠置于超净台内,以75%乙醇消毒裸鼠右侧腋部皮肤后,除过表达组裸鼠接种过表达miRNA-155 AGS细胞外,其余各组裸鼠接种AGS细胞悬液(密度为1×107个/mL)。清热化湿方低、中、高剂量组裸鼠从造模第2 天起分别按2.71、5.43、10.86 g/kg 灌胃相应药液(剂量参考文献[10]设置),对照组腹腔注射顺铂(0.004 g/kg)+氟尿嘧啶(0.02 g/kg)(剂量根据临床等效剂量换算),每天1次,连续3周;模型组和过表达组灌胃等体积生理盐水。末次给药后禁食不禁水,于24 h后采用颈椎脱臼法处死,并取肿瘤组织进行检测分析。
2.4 裸鼠肿瘤抑制率的测定
以生理盐水冲洗各组裸鼠肿瘤组织,然后测量其质量,并计算肿瘤抑制率。肿瘤抑制率=(模型组肿瘤组织质量—干预组肿瘤组织质量)/模型组肿瘤组织质量×100%。
2.5 裸鼠肿瘤组织的病理学形态观察
取各组裸鼠部分肿瘤组织,以10%甲醛固定液固定,切开病灶,流水冲洗干净后放入生物脱水机中逐级脱水、透明、石蜡浸泡、包埋,切片4 μm,以常规苏木素-伊红(HE)染色后,采用显微镜观察并拍照。
2.6 裸鼠肿瘤组织中miRNA-155 和Wnt7、β-catenin、TCF-4 mRNA表达水平的检测
采用实时荧光定量聚合酶链式反应(qRT-PCR)法进行检测。取各组裸鼠肿瘤组织各20 mg,加入Trizol裂解液1 mL后提取总RNA;取适量总RNA将其反转录成cDNA,然后进行PCR 扩增。PCR 反应条件为:95 ℃预变性30 s;95 ℃变 性15 s;循 环60 次。以U6 或GAPDH为内参,采用2—ΔΔCt法计算miRNA-155和目的基因mRNA 的表达水平。PCR 引物序列及扩增产物长度见表1。

表1 PCR引物序列及扩增产物长度
2.7 裸鼠肿瘤组织中Wnt7、β-catenin、TCF-4蛋白表达水平的检测
采用Western blot 法进行检测。取各组裸鼠肿瘤组织各20 mg,剪碎,加入250 μL RIPA 裂解液,并加入适量的PMSF 蛋白酶抑制剂,反复吹打裂解,置于冰上2 h后以12 000 r/min 离心10 min;取上清液加入适量蛋白上样缓冲液,沸水加热5 min 变性,采用BCA 试剂盒定量后,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转膜;以4%脱脂奶粉封闭2 h,加入Wnt(稀释度为1∶1 000)、β-catenin(稀释度为1∶1 000)、TCF-4(稀释度为1∶2 000)、GAPDH(稀释度为1∶1 000)一抗,于4 ℃孵育过夜;以1%TBST洗膜,加入相应二抗室温孵育2 h;以1% TBST洗膜后加入适量ECL显色液显影,采用凝胶成像仪曝光成像,并用Image J软件分析图像,以目的蛋白与内参的灰度值比值表示其表达水平。
2.8 统计学方法
采用SPSS 21.0 软件进行统计分析,计量资料采用-±s表示。方差齐性时组间比较采用方差分析,不符合正态分布的采用秩和检验。检验水准α=0.05。
3 结果
3.1 miRNA-155稳定过表达AGS细胞株的构建情况
荧光显微镜下观察细胞荧光及细胞状态发现,在嘌呤霉素筛选后,细胞初期死亡较多,荧光较弱;随着时间延长,细胞状态好转,荧光增强且能稳定传代,说明miRNA-155 过表达AGS 细胞株构建成功。结果见图1。
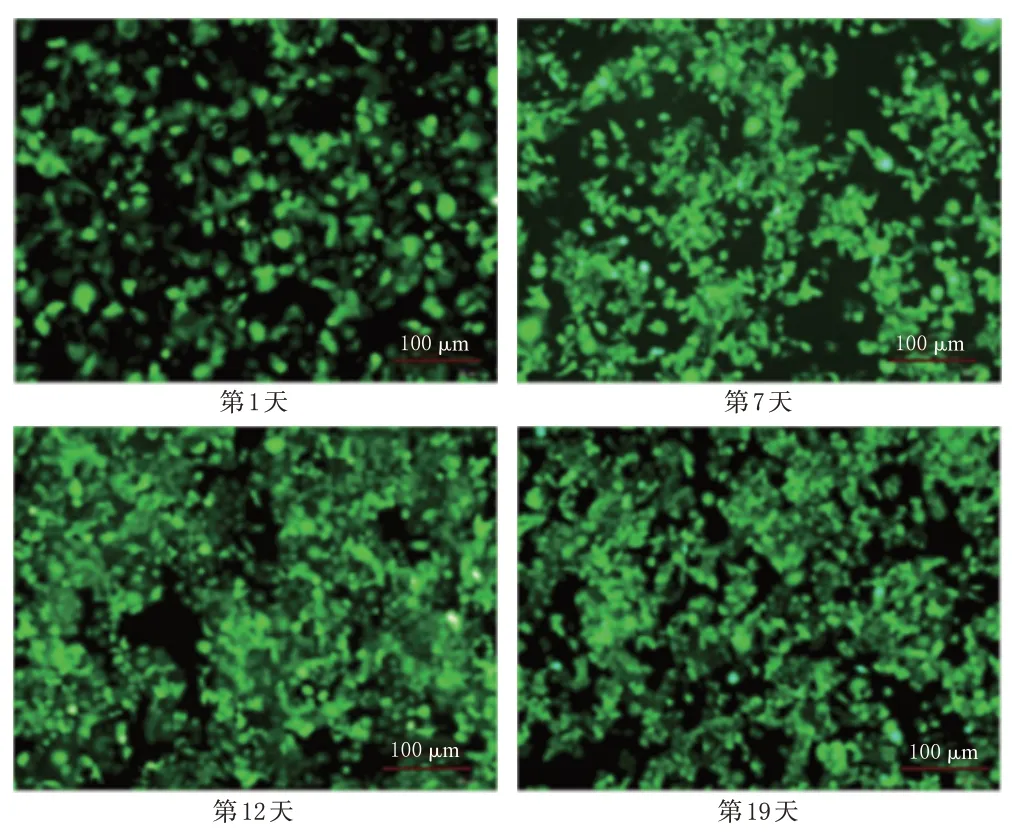
图1 miRNA-155过表达AGS细胞株的构建过程
3.2 裸鼠肿瘤组织生长情况的观察结果
与模型组比较,过表达组、对照组和清热化湿方中、高剂量组裸鼠肿瘤组织质量均显著降低(P<0.05),肿瘤抑制率分别为90.23%、63.79%、27.01%、44.25%。结果见图2、表2。

图2 各组裸鼠肿瘤组织的观察结果
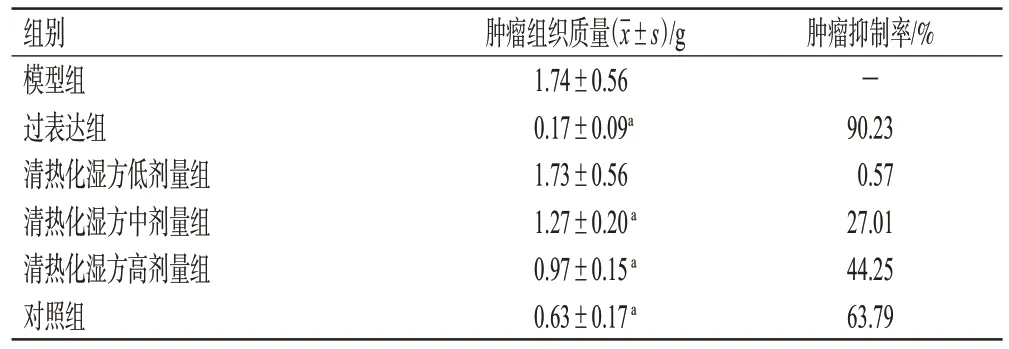
表2 各组裸鼠肿瘤组织质量和抑制率的测定结果(n=5)
3.3 裸鼠肿瘤组织病理形态学的观察结果
模型组裸鼠肿瘤细胞排列紧实,核大且染色较深;与模型组相比,过表达组、对照组及清热化湿方低、中、高剂量组裸鼠的肿瘤细胞均出现不同程度的排列疏松,核染色较浅,出现坏死灶。其中,过表达组裸鼠肿瘤组织的损伤程度最高,对照组次之;清热化湿方低、中、高剂量组肿瘤组织的损伤程度表现出剂量依赖性。结果见图3。
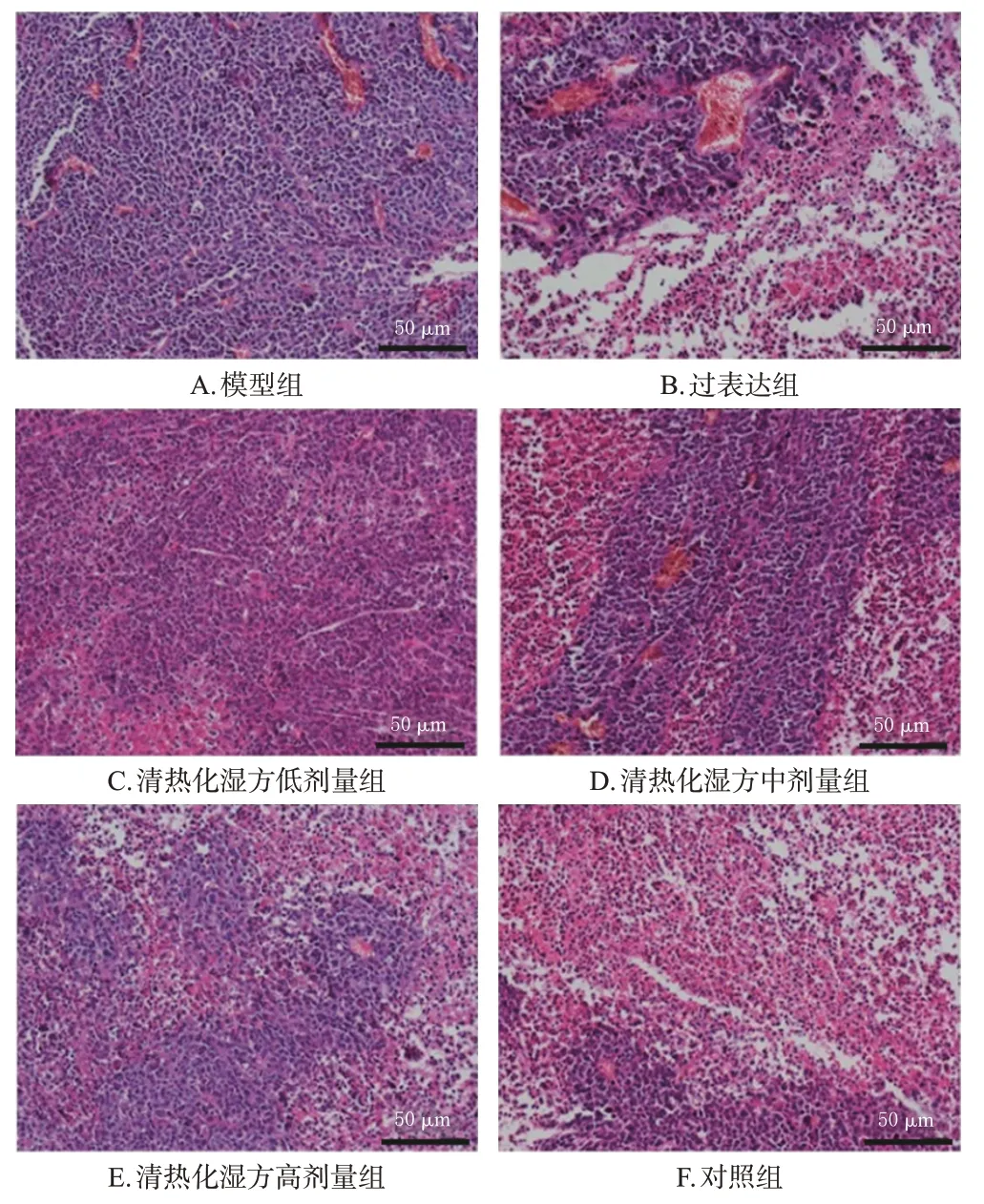
图3 各组裸鼠肿瘤组织的病理变化观察结果
3.4 清热化湿方对裸鼠肿瘤组织中miRNA-155、Wnt7、β-catenin和TCF-4 mRNA表达的影响
与模型组比较,过表达组、对照组和清热化湿方中、高剂量组裸鼠肿瘤组织中Wnt7、β-catenin、TCF-4 mRNA 表达水平均显著降低(P<0.05),miRNA-155 表达水平均显著升高(P<0.05)。结果见图4。
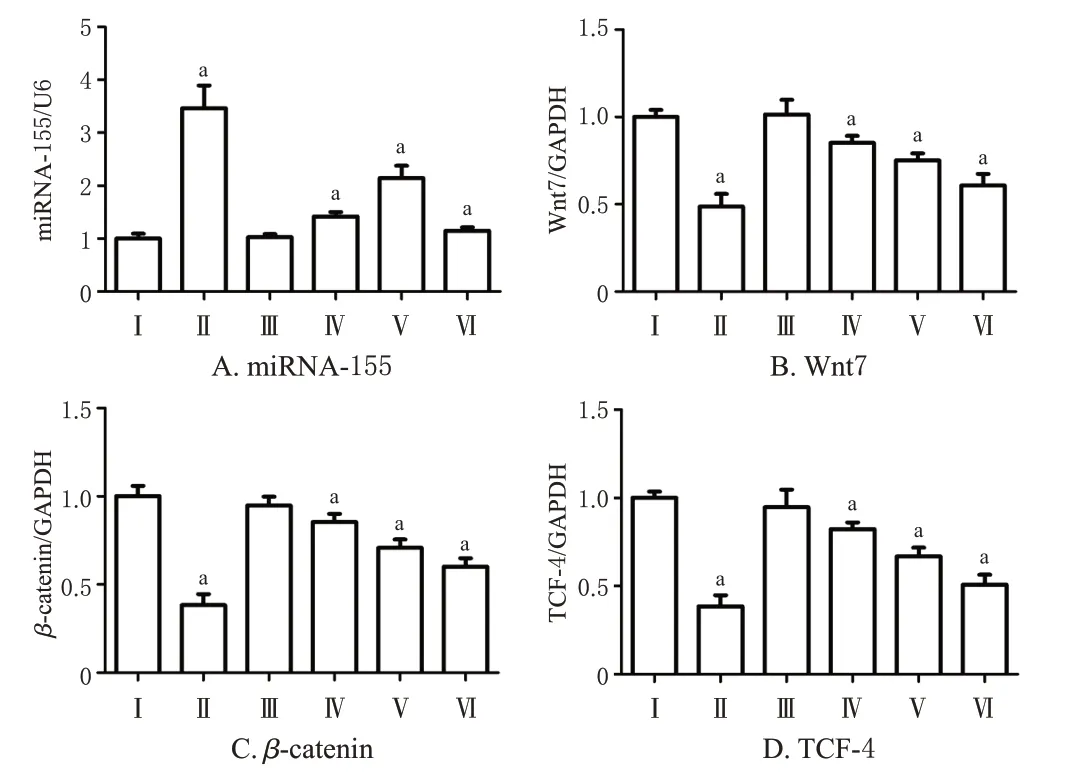
图4 各组裸鼠肿瘤组织中miRNA-155、Wnt7、β-catenin、TCF-4 mRNA表达水平的检测结果(n=5)
3.5 清热化湿方对裸鼠肿瘤组织中Wnt7、β-catenin、TCF-4蛋白表达的影响
与模型组比较,过表达组、对照组和清热化湿方高剂量组裸鼠肿瘤组织中Wnt7、β-catenin、TCF-4 蛋白表达水平,以及清热化湿方中剂量组Wnt7 蛋白表达水平均显著降低(P<0.05)。结果见图5。
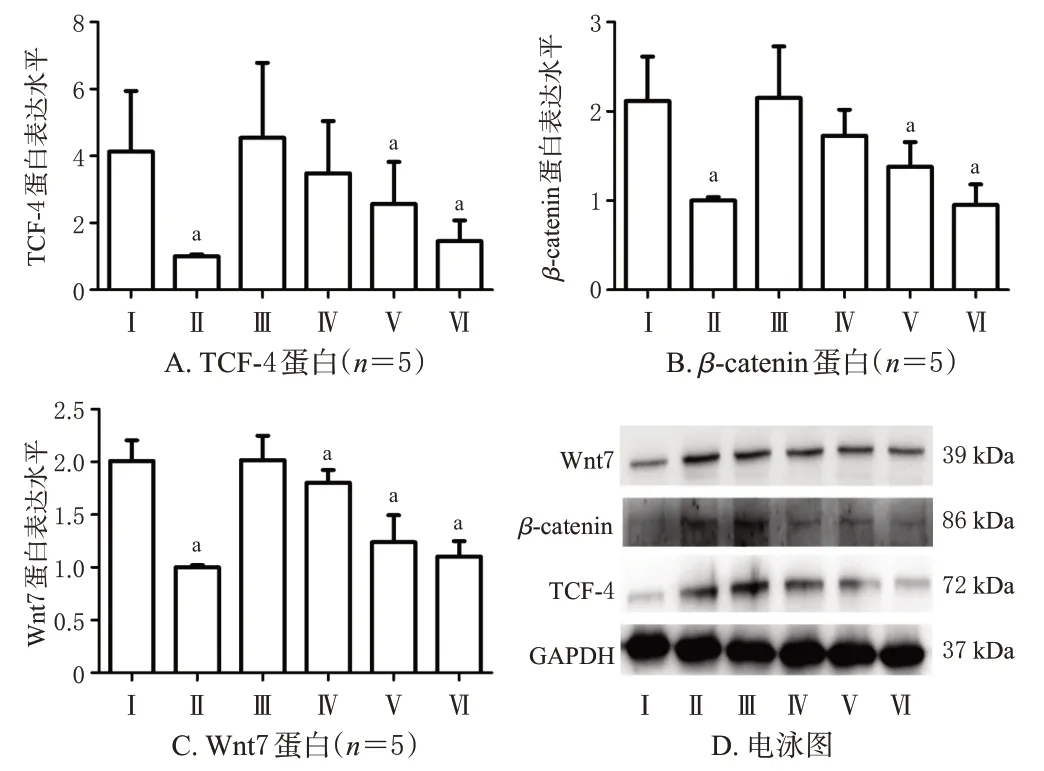
图5 各组裸鼠肿瘤组织中Wnt7、β-catenin、TCF-4 蛋白的表达情况
4 讨论
中医理论认为,胃癌的形成是在脾胃虚寒的基础上,饮食生冷,感受湿热寒邪,日久郁积引起的气血运行不畅;最常见的证型为脾气虚证、肝胃不和证、痰湿证、热毒证、血虚证、血瘀证等;治疗原则一般以益气补脾、活血化瘀、清热解毒为主[4]。清热化湿方为经典方“藿朴夏苓汤”加黄连、栀子化裁而成,可宣化表里之湿邪,对胃癌有一定的疗效[11]。
miRNAs 是一种长度为19~25 个核苷酸的短链非编码RNA[12],已被证明参与了多种肿瘤的发生发展[13]。一项研究发现,miRNA-155是胃癌组织中下调程度最高的miRNAs之一,可能是胃癌的肿瘤抑制因子[14],这一结果与本课题组前期的基因芯片分析结果一致[7]。本研究发现,过表达的miRNA-155可显著抑制胃癌荷瘤模型裸鼠肿瘤的生长,与上述研究结果一致。
Wnt/β-catenin 信号通路是一个关键的级联反应,对许多生理过程至关重要,如细胞增殖和分化、干细胞更新、胚胎发生和组织稳态[15]。既往研究也提示,Wnt信号通路的病理紊乱可能与胃癌进展有关[16]。其中,Wnt 家族蛋白成员中的Wnt7a蛋白在胃癌组织中高表达,且与患者恶性病理特征显著相关[17]。β-catenin是Wnt信号通路的关键下游效应因子,当Wnt配体与其膜受体复合体结合时,β-catenin 稳定并在细胞质中积累,然后与TCF一起进入细胞核,从而驱动多重增殖和凋亡相关基因的转录[18]。本研究证实清热化湿方能够上调miRNA-155表达,抑制Wnt/β-catenin 信号通路中Wnt7、β-catenin 和TCF-4的表达,从而抑制胃癌细胞的生长,进一步阐明了清热化湿方防治胃癌的效用机制。
综上所述,清热化湿方可通过上调miRNA-155,抑制Wnt/β-catenin信号通路,进而抑制胃癌荷瘤模型裸鼠瘤体生长。但本研究只对miRNA-155进行过表达处理,未进行沉默,后续笔者将从正反两方面研究清热化湿方和miRNA-155之间的关系,积极阐明清热化湿方治疗胃癌的作用机制,为清热化湿方在临床中的应用提供更多、更可靠的循证依据。
