苓桂术甘汤调控自噬对多柔比星抗非酒精性脂肪肝病相关肝细胞癌的增效作用Δ
2023-10-16曹慧敏隋国媛贾连群辽宁中医药大学中医脏象理论及应用教育部重点实验室沈阳0847辽宁中医药大学药学院辽宁大连6600
曹慧敏,孔 亮,隋国媛,吴 瑾,贾连群#(.辽宁中医药大学中医脏象理论及应用教育部重点实验室,沈阳 0847;2.辽宁中医药大学药学院,辽宁 大连 6600)
据国际癌症研究机构最新发布的《2020全球癌症报告》,肝癌是全球第六大常见癌症,也是导致癌症相关死亡的第三大常见原因[1]。原发性肝癌主要有两种类型——肝细胞癌(hepatocellular carcinoma,HCC)和肝内胆管癌,HCC占全世界原发性肝癌的80%以上。随着肥胖和糖尿病的流行,非酒精性脂肪肝病相关肝细胞癌(non-alcoholic fatty liver disease-hepatocellular carcinoma,NAFLD-HCC)发病率不断攀升,非酒精性脂肪肝病已成为全球HCC发病和死亡增长最快的病因。相比病毒相关的HCC,NAFLD-HCC 缺乏有效的治疗手段,手术根治率低,患者病死率高、生存期更短[2]。目前,进行肿瘤切除后化疗已成为大多数癌症治疗的主要策略。多柔比星(doxorubicin,DOX)是一线化疗药物,也是肝癌患者全身化疗的有效药物之一,通过抑制肿瘤细胞核酸的合成发挥抗肿瘤活性[3]。虽然DOX的作用机制明确、疗效显著,但其具有一定的毒性及耐药性[4],因此,降低DOX使用剂量,提高化疗敏感性,是目前亟须解决的问题。中药复方具有多种作用成分,可通过多靶点、多途径产生抗肿瘤作用,配合放化疗,在肿瘤治疗过程中可实现增效减毒效果[5]。
自噬参与机体的许多病理生理过程,与肿瘤的发生、发展及治疗有着密切的联系。诱导肿瘤细胞凋亡,一直以来是各类肿瘤治疗的根本目标。凋亡耐受是产生肿瘤耐药的重要机制,自噬性细胞死亡是凋亡耐受肿瘤细胞的一种死亡方式。但是,细胞自噬又可防止抗肿瘤药物诱导的凋亡,促进肿瘤耐药。因此,自噬在肿瘤化疗耐药性中发挥着促进或抑制耐药的双重作用[6]。从细胞自噬角度探索中医药治疗肿瘤、降低化疗药物耐药性的新靶点,具有重要的临床意义和广泛的应用前景。
苓桂术甘汤(Linggui zhugan decoction,LGZG)出自《伤寒杂病论》,为健脾温阳化浊的代表方,本课题组前期研究表明LGZG 可抑制NAFLD-HCC 的发生发展[7]。但是,LGZG对DOX治疗NAFLD-HCC耐药的影响及分子机制尚不清楚。本研究拟以自噬为切入点,深入探讨LGZG对DOX治疗NAFLD-HCC效果的影响及机制,以期为提高DOX治疗NAFLD-HCC敏感性提供实验依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有SpectraMaxi3 型多功能全波长酶标仪(美国Molecular Devices公司),ASP 6025型高性能组织脱水机、RM2235 型手动石蜡切片机、EG1150H型包埋机(德国Leica公司),M8型数字扫描显微成像系统(德国PreciPoint 公司),1658001 型Mini-PROTEAN Tetra垂直板电泳装置、1704150型Trans-Blot SD型半干转印仪(美国Bio Rad公司),5200型全自动化学发光图像分析系统(上海天能科技有限公司)等。
1.2 主要药品与试剂
茯苓(批号230301)、桂枝(批号230201CP0494)、白术(批号2301)、甘草(批号230301)均购自辽宁中医药大学附属医院,全部饮片经辽宁中医药大学药学院中药鉴定教研室翟延君教授鉴定为真品,且质量均符合2020年版《中国药典》(一部)的相关要求。
二乙基亚硝胺(批号D0516)购自梯希爱(上海)化成工业发展有限公司;盐酸多柔比星(批号MB1087)购自大连美仑生物技术有限公司;苏木素染液(批号C0105S)购自上海碧云天生物技术有限公司;改良Masson三色染色试剂盒(批号G1346)购自北京索莱宝科技有限公司;甲胎蛋白(alpha fetoprotein,AFP)、癌胚抗原(carcinoembryonic antigen,CEA)(批号分别为F2632-A、F2630-A)均购自上海科兴生物科技有限公司;总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)测定试剂盒(批号分别为20210806、20210809、20210806、20210809)均购自南京建成生物工程研究所有限公司;兔源微管相关蛋白1A/1B-轻链3(microtubule-associated proteins 1A and 1B,LC3)、苄氯素1(Beclin1)、选择性自噬接头蛋白P62、B 细胞淋巴瘤2 相关X 蛋白(B-cell lymphoma-2 associated X,Bax)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、增殖标志物Ki-67蛋白多克隆抗体和鼠源B 细胞淋巴瘤2(B-cell lymphoma-2,Bcl-2)单克隆抗体(批号分别为14600-1-AP、11306-1-AP、18420-1-AP、50599-2-Ig、60004-1-Ig、28074-1-AP、68103-1-Ig)均购自武汉Proteintech公司;山羊抗兔IgG二抗、山羊抗鼠IgG二抗(批号分别为CW0103、CW0102)均购自江苏康为世纪生物科技有限公司。
1.3 实验动物与饲料
3周龄SPF级C57BL/6雄性小鼠50只,体重(10±2)g,购于辽宁长生生物技术股份有限公司,动物生产许可证号为SCXK(辽)2021-0001。小鼠饲养于辽宁中医药大学实验动物中心,自由饮水进食。实验符合辽宁中医药大学实验动物伦理委员会标准(伦理批准号21000042022042)。高脂饲料(10%猪油、5%蔗糖、1%胆固醇、0.5%胆酸钠、0.2%甲基硫氧嘧啶、83.3%普通饲料)购自小黍有泰(北京)生物科技有限公司,批号为200426012。
2 方法
2.1 LGZG水提液的制备
取茯苓25 g、桂枝25 g、白术15 g、甘草10 g,混合后加入10倍量水浸泡1 h后,加热回流提取2 h;过滤,回收溶剂,再加入10 倍量水继续回流提取2 h;合并2 次滤液,浓缩成质量浓度为1 g/mL 的溶液(以生药量计),于4 ℃保存备用[7]。
2.2 动物分组干预及取材
50只小鼠适应性喂养1周后,采用随机数字表法分为空白组、NAFLD-HCC 组、LGZG 组、DOX 组、DOX+LGZG 组,每组10 只。除空白组外,其余各组小鼠腹腔注射二乙基亚硝胺溶液(50 mg/kg),每周1 次,连续8周[8]。小鼠在给予二乙基亚硝胺溶液4 周后,再同时以高脂饲料喂养,连续12 周,建立NAFLD-HCC 小鼠模型[7];空白组小鼠给予普通饲料喂养。建模后,按人与小鼠体表面积比换算给药等效剂量,各给药组小鼠分别灌胃LGZG 水提液(20 g/kg[7])和/或腹腔注射DOX 溶液(8 mg/kg[7]),空白组、NAFLD-HCC组小鼠灌胃等量生理盐水,每日1 次,干预4 周。药物干预结束后,小鼠眼球取血后静置2 h,以3 000 r/min离心20 min,取上清液,—80 ℃保存。取一半小鼠的肝脏组织用4%多聚甲醛固定,另一半小鼠的肝脏组织冻存于—80 ℃冰箱,备用。
2.3 小鼠的一般情况、体重、肝重及肝脏系数的比较
在模型建立及药物干预期间,对小鼠的饮食、毛色和状态等一般情况进行监测;药物干预结束后,眼球采血前称量小鼠体重,取材时,快速取出肝脏,肉眼观察小鼠肝脏形态并称重,每组随机选取6只小鼠计算肝脏系数。肝脏系数=肝重(g)/体重(g)×100%。
2.4 小鼠肝脏组织病理形态学观察
采用苏木素-伊红(HE)染色法观察小鼠肝脏组织病理形态。每组随机选取固定在4%多聚甲醛中的3只小鼠肝脏组织,经乙醇梯度脱水、二甲苯透明后,进行石蜡包埋和切片;取部分石蜡切片按HE 染色常规方法进行染色(剩余部分用于后续Masson 染色及免疫组化染色),然后采用数字扫描显微成像系统观察肝脏组织病理形态。
2.5 小鼠肝脏组织纤维化程度检测
采用Masson染色法检测小鼠肝脏组织中胶原纤维含量的变化情况以明确小鼠肝脏组织纤维化程度。取“2.4”项下各组小鼠肝脏组织石蜡切片,按Masson 染色常规方法进行染色,切片经脱蜡、染色、分化、复染、脱水、透明后封固,以数字扫描显微成像系统观察。每张切片随机选取3个不重复视野,采用Image J软件计算肝脏胶原面积百分比以表示胶原纤维含量。肝脏胶原面积百分比(%)=肝脏胶原面积/所测视野面积×100%。
2.6 小鼠血脂水平及血清中肿瘤标记物AFP、CEA 含量检测
随机选取6 只小鼠的血清,采用微板法检测小鼠血脂水平(TG、TC、LDL-C和HDL-C水平),采用ELISA法检测小鼠血清中AFP、CEA 含量,均严格按照试剂盒说明书进行操作。
2.7 小鼠肝脏组织中Ki-67 蛋白及凋亡标志蛋白表达水平检测
采用免疫组化法进行检测。取“2.4”项下各组小鼠(每组3只)肝脏组织石蜡切片,经热抗原修复、灭活内源酶、封闭后,滴加Ki-67 和凋亡标志蛋白(Bax、Bcl-2)一抗(稀释比均为1∶200)孵育1 h;PBS 清洗后加入二抗(稀释比为1∶100)孵育30 min;以PBS 清洗后进行DAB显色、苏木素复染、盐酸乙醇分化、脱水、封片和观察。利用Image Pro plus 6.0 软件进行免疫组化结果分析,以平均光密度值表示蛋白表达水平。
2.8 小鼠肝脏组织中自噬相关蛋白表达水平的检测
采用Western blot 法进行检测。每组随机选取3 只小鼠的肝脏组织,每只取0.1 g,加入1 mL RIPA裂解液,充分匀浆并置于冰上裂解30 min,离心后取上清液;采用BCA 试剂盒检测各组蛋白浓度,混合蛋白样品和上样缓冲液,在95 ℃条件下加热5 min,以充分变性蛋白。以50 μg蛋白上样,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后,转至PVDF膜;加 入LC3、Beclin1、P62 及GAPDH一抗(稀释比分别为1∶1 000、1∶1 000、1∶1 000、1∶5 000),4 ℃封闭过夜;以TBST 洗涤3 次,每次15 min,加入相应二抗(稀释比为1∶10 000)室温孵育1 h;经曝光、显影后,应用化学发光成像系统观察,利用AlphaView 凝胶图像分析软件进行图像处理,以GAPDH作为内参蛋白,计算目标蛋白与内参蛋白的灰度值比值,以表示蛋白表达水平。LC3 在细胞中以LC3Ⅰ和LC3Ⅱ两种形式存在,LC3Ⅱ/LC3Ⅰ的比值表示LC3 蛋白的表达水平。
2.9 统计学方法
采用SPSS 17.0 软件进行统计学处理,计量资料以±s表示,多组间数据比较用单因素方差分析,组间两两比较用LSD-t检验。检验水准α=0.05。
3 结果
3.1 小鼠一般情况、体重、肝重及肝脏系数的比较结果
在模型建立及药物干预期间各组小鼠的饮食、活动均无明显异常,NAFLD-HCC 组小鼠随着给药时间延长活动逐渐减少,精神萎靡,毛发蓬乱无光泽;给药组小鼠整体情况均有改善。实验结束时,与空白组比较,NAFLD-HCC组小鼠体重显著降低(P<0.05),肝重有上升趋势,肝脏系数显著增加(P<0.05);与NAFLD-HCC组比较,DOX组、LGZG组、DOX+LGZG组小鼠肝重和肝脏系数均显著降低(P<0.05)。结果见表1。
表1 各组小鼠体重、肝重和肝脏系数结果(±s,n=6)

表1 各组小鼠体重、肝重和肝脏系数结果(±s,n=6)
a:与空白组比较,P<0.05;b:与NAFLD-HCC组比较,P<0.05。
组别空白组NAFLD-HCC组DOX组LGZG组DOX+LGZG组体重/g 26.99±1.72 20.38±2.90a 18.64±2.96 23.47±1.39 21.73±1.64肝重/g 1.30±0.05 1.43±0.12 1.02±0.23b 1.14±0.05b 1.01±0.11b肝脏系数/%0.048±0.00 0.071±0.01a 0.054±0.01b 0.049±0.00b 0.047±0.01b
3.2 小鼠肝脏组织病理形态学观察结果
肉眼观察结果显示,空白组小鼠肝脏大小正常,表面光滑,颜色红润,质地柔软;NAFLD-HCC组小鼠肝脏肿大,边缘钝而厚,表面粗糙,触之有油腻感,仔细观察有灰白色肿瘤结节;LGZG组小鼠肝脏表面颜色稍微改善,肿瘤结节数目较干预前减少;DOX组改善效果不明显;DOX+LGZG 组小鼠肝脏表面颜色较干预前有较大改善,肿瘤结节数目明显减少。结果见图1。
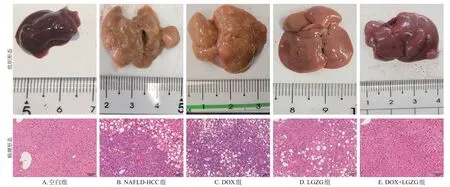
图1 各组小鼠肝脏组织形态图及HE染色图
HE染色结果显示,空白组小鼠肝小叶结构清晰、完整,细胞排列整齐,无脂肪变性,未见炎症细胞浸润;NAFLD-HCC 组小鼠肝细胞体积增大,有大量的空泡状细胞,炎症细胞大量浸润,脂肪变性明显,部分细胞出现气球样变、细胞密度增大、小细胞性增生的病变;LGZG组小鼠肝脏细胞质内可见细小空泡,炎症细胞浸润减轻;DOX组小鼠肝脏空泡样变及炎症细胞浸润有改善效果但不明显,DOX+LGZG组小鼠肝小叶结构恢复明显,空泡样变及炎症细胞浸润明显减轻。结果见图1。
3.3 小鼠肝脏组织纤维化程度的结果
Masson染色结果(见图2)显示,空白组小鼠肝脏组织无明显染色;与空白组比较,NAFLD-HCC 组小鼠肝脏组织癌细胞周围纤维化,视野内有广泛致密的蓝色胶原沉积,蓝染纤维间隔形成,胶原面积百分比显著增加(P<0.05),胶原纤维含量增多,纤维化程度加重;与NAFLD-HCC 组比较,LGZG 组、DOX+LGZG 组小鼠肝脏组织纤维化范围均有所减轻,尤其以DOX+LGZG 组小鼠改善最为显著,胶原面积百分比显著降低(P<0.05),胶原纤维含量减少,纤维化程度减轻;与DOX 组比较,DOX+LGZG 组小鼠胶原面积百分比显著降低(P<0.05),肝脏纤维化程度减轻。

图2 各组小鼠肝脏组织Masson染色图及胶原面积百分比柱状图(n=3)
3.4 小鼠血脂水平及血清中AFP、CEA含量的检测结果
与空白组比较,NAFLD-HCC 组小鼠血清中TC、TG、LDL-C 水平及AFP、CEA 含量均显著升高,HDL-C水平显著降低(P<0.05);与NAFLD-HCC组比较,DOX组小鼠血清中CEA 含量显著降低,LGZG 组、DOX+LGZG 组小鼠血清中TC、TG、LDL-C 水平及AFP、CEA含量均显著降低(P<0.05),DOX+LGZG 组小鼠血清中HDL-C水平显著升高(P<0.05)。结果见表2。
表2 各组小鼠血脂水平及血清中AFP、CEA含量的检测结果(±s,n=6)
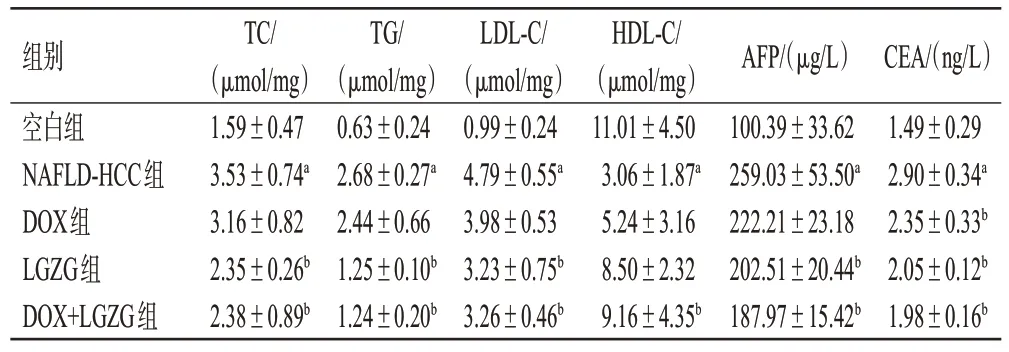
表2 各组小鼠血脂水平及血清中AFP、CEA含量的检测结果(±s,n=6)
a:与空白组比较,P<0.05;b:与NAFLD-HCC组比较,P<0.05。
组别空白组NAFLD-HCC组DOX组LGZG组DOX+LGZG组TC/(μmol/mg)1.59±0.47 3.53±0.74a 3.16±0.82 2.35±0.26b 2.38±0.89b TG/(μmol/mg)0.63±0.24 2.68±0.27a 2.44±0.66 1.25±0.10b 1.24±0.20b LDL-C/(μmol/mg)0.99±0.24 4.79±0.55a 3.98±0.53 3.23±0.75b 3.26±0.46b HDL-C/(μmol/mg)11.01±4.50 3.06±1.87a 5.24±3.16 8.50±2.32 9.16±4.35b CEA/(ng/L)1.49±0.29 2.90±0.34a 2.35±0.33b 2.05±0.12b 1.98±0.16b AFP/(μg/L)100.39±33.62 259.03±53.50a 222.21±23.18 202.51±20.44b 187.97±15.42b
3.5 小鼠肝脏组织中Ki-67蛋白表达水平的检测结果
与空白组比较,NAFLD-HCC组小鼠肝脏组织中Ki-67 蛋白表达水平显著升高(P<0.05);与NAFLD-HCC组比较,LGZG组、DOX+LGZG组小鼠肝脏组织中Ki-67蛋白表达水平均显著降低(P<0.05);与DOX 组比较,DOX+LGZG 组小鼠肝脏组织中Ki-67 蛋白表达水平显著降低(P<0.05)。结果见表3和图3。
表3 各组小鼠肝脏组织中Ki-67、Bax、Bcl-2 蛋白表达水平的检测结果(±s,n=3)
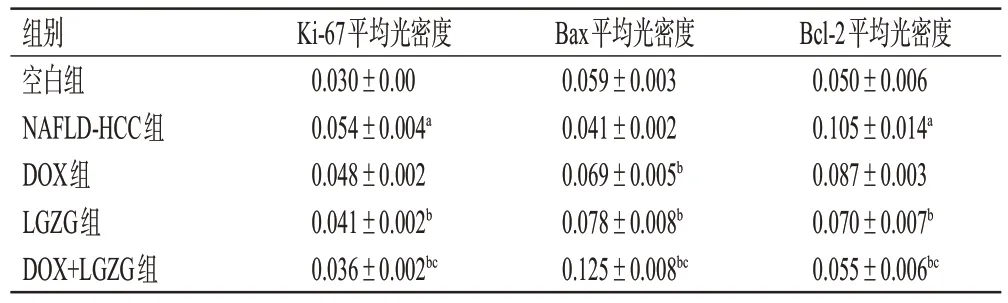
表3 各组小鼠肝脏组织中Ki-67、Bax、Bcl-2 蛋白表达水平的检测结果(±s,n=3)
a:与空白组比较,P<0.05;b:与NAFLD-HCC组比较,P<0.05;c:与DOX组比较,P<0.05。
Bcl-2平均光密度0.050±0.006 0.105±0.014a 0.087±0.003 0.070±0.007b 0.055±0.006bc组别空白组NAFLD-HCC组DOX组LGZG组DOX+LGZG组Ki-67平均光密度0.030±0.00 0.054±0.004a 0.048±0.002 0.041±0.002b 0.036±0.002bc Bax平均光密度0.059±0.003 0.041±0.002 0.069±0.005b 0.078±0.008b 0.125±0.008bc

图3 各组小鼠肝脏组织中Ki-67蛋白免疫组化染色图
3.6 小鼠肝脏组织中凋亡标志蛋白表达水平的检测结果
与空白组比较,NAFLD-HCC 组小鼠肝脏组织中Bcl-2 蛋白表达水平显著升高(P<0.05),Bax 蛋白表达水平有降低趋势,但差异无统计学意义(P>0.05);与NAFLD-HCC 组比较,DOX 组、LGZG 组、DOX+LGZG组小鼠肝脏组织中Bcl-2 蛋白表达水平均显著降低(DOX 组除外),Bax 蛋白表达水平均显著升高(P<0.05);与DOX 组比较,DOX+LGZG 组小鼠肝脏组织中Bcl-2蛋白表达水平显著降低,Bax蛋白表达水平显著升高(P<0.05)。结果见表3和图4。
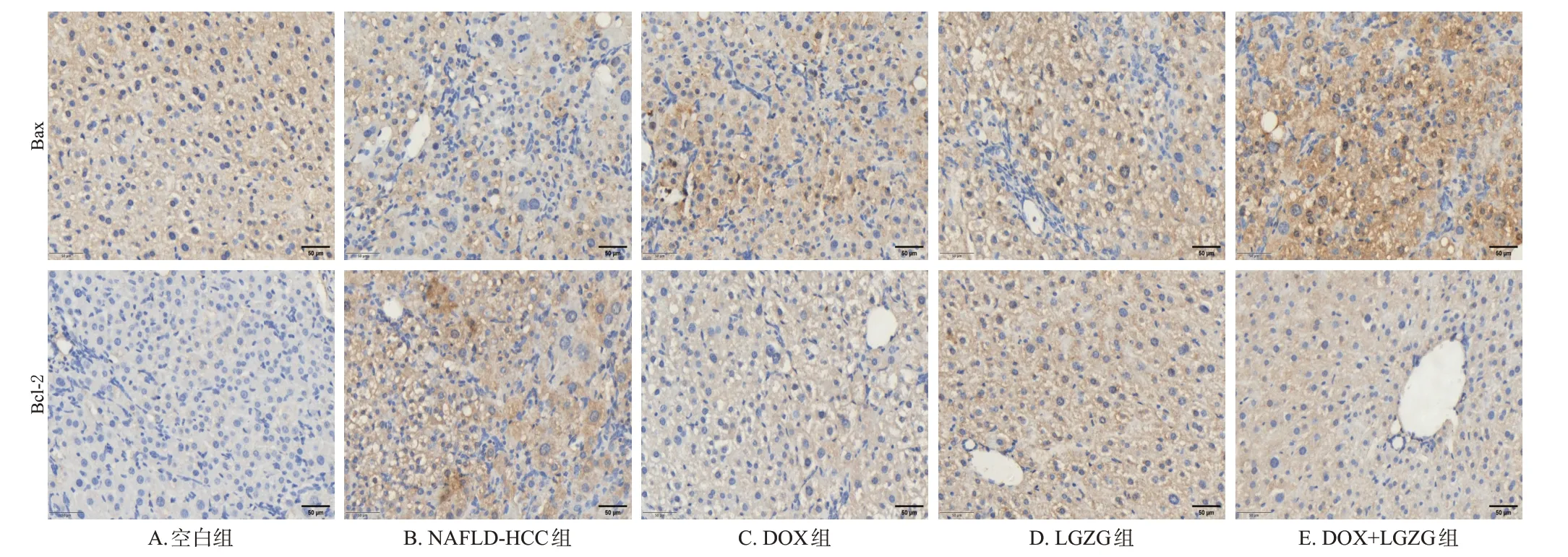
图4 各组小鼠肝脏组织中Bax、Bcl-2蛋白免疫组化染色图
3.7 小鼠肝脏组织中自噬相关蛋白表达水平的检测结果
与空白组比较,NAFLD-HCC 组小鼠肝脏组织中Beclin1蛋白表达水平显著降低(P<0.05),LC3Ⅱ/LC3Ⅰ比值降低,P62蛋白表达水平升高,但差异均无统计学意义(P>0.05);与NAFLD-HCC 组比较,DOX 组、LGZG组及DOX+LGZG 组小鼠肝脏组织中Beclin1 蛋白表达水平和LC3Ⅱ/LC3Ⅰ比值均显著升高,P62 蛋白表达水平均显著降低(P<0.05);与DOX 组比较,DOX+LGZG组小鼠肝脏组织中Beclin1蛋白表达水平和LC3Ⅱ/LC3Ⅰ比值显著升高,P62 蛋白表达水平显著降低(P<0.05)。结果见图5。
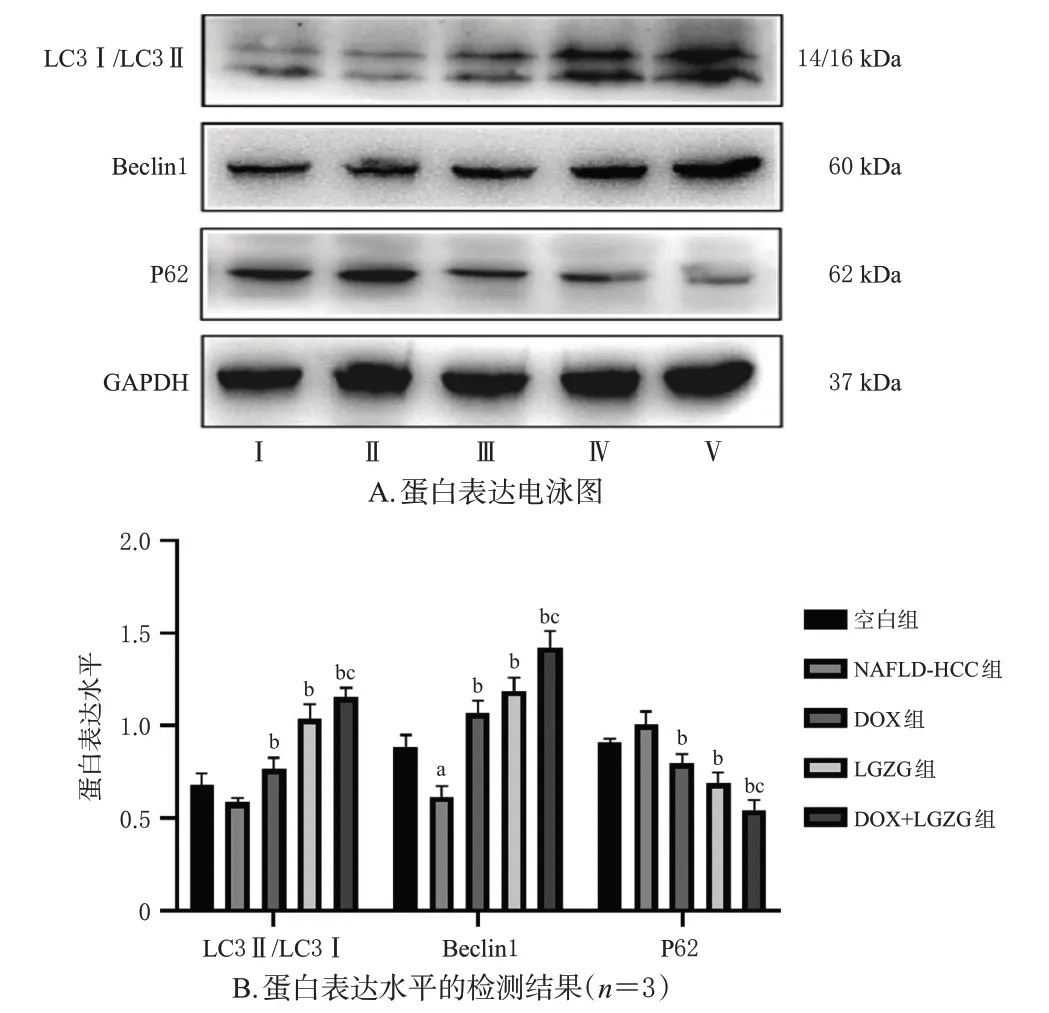
图5 各组小鼠肝脏组织中自噬相关蛋白的表达结果
4 讨论
NAFLD-HCC 发病较为隐匿,多数患者确诊时已是中晚期,丧失手术治疗的时机,因此治疗上以化疗为主。虽然化疗可以杀灭肝癌细胞,但其特异性差,长时间的化疗有很大毒性,易损伤脾胃运化功能。因此,脾虚亦是肝癌化疗后的重要病机,NAFLD-HCC 治疗应采取扶正兼顾祛邪的原则。中药联合化疗,能增加肿瘤细胞对化疗药物的敏感性、提高机体对化疗的耐受力、延长生存期[9]。LGZG为健脾温阳化浊的代表方,其中茯苓为君药,健脾以化痰湿;桂枝为臣药,温通阳气;白术为佐药,健脾燥湿,又可补益脾阳;甘草为使药,补中益气,调和诸药;四药合用可使脾气健运。故应用LGZG 作为NAFLDHCC治疗或辅助化疗用药,符合中医治病求本的治则。
本研究造模后肉眼观察发现,NAFLD-HCC 组小鼠肝脏有灰白色肿瘤结节。病理形态学染色可见肝组织细胞体积增大、脂肪变性,炎症细胞大量浸润,部分细胞出现气球样变,有小细胞性增生;肝脏组织中可见大量蓝色胶原纤维表达。AFP与肝癌细胞的增殖密切相关,是原发性肝癌特异性最高的肿瘤标志物,CEA是一种广谱性的肿瘤标志物,AFP、CEA 的联合检测是诊断原发性肝癌的重要指标[10]。本研究检测发现,NAFLD-HCC组小鼠血清中AFP和CEA含量明显升高。Ki-67又称为核增殖抗原,是细胞增生指数的一种标志,其阳性表达率越高,肿瘤恶性程度越高[11]。本研究免疫组化结果显示,NAFLD-HCC 组小鼠肝脏组织中Ki-67 蛋白表达水平明显升高。上述结果均提示NAFLD-HCC 模型建立成功。本文对DOX、LGZG 及LGZG 联合DOX 干预NAFLD-HCC 效果的影响进行了研究,结果显示,以DOX、LGZG 及LGZG 联合DOX 干预后,小鼠上述指标均有不同程度的改善,且LGZG 联合DOX 的改善作用更明显。然而,LGZG联合DOX化疗的增效减毒作用机制仍有待进一步探讨。
化疗药物可通过诱导细胞凋亡而杀伤肿瘤细胞,肿瘤细胞对化疗耐药的实质是药物不能活化其凋亡途径,因此,凋亡耐受的肿瘤细胞是多种化疗药物产生耐药性的主要原因[12]。研究发现,自噬介导的细胞死亡可增强NAFLD-HCC 化疗敏感性[13]。因此,自噬可能是LGZG增效减毒、逆转DOX肿瘤耐药性的重要靶点。
Beclin1 是自噬体形成启动复合物Class Ⅲ PI3K 的关键组分,在自噬的发生过程中发挥着重要作用[14]。LC3 是自噬过程的标志物,主要参与了自噬小体的形成,其合成后立即被自噬相关基因4剪切掉羧基端,形成胞浆型LC3 即LC3Ⅰ;随后LC3Ⅰ会酶解掉一小段多肽,偶联磷脂酰乙醇胺形成膜型LC3Ⅱ,因此,LC3Ⅱ/LC3Ⅰ比值在一定程度上反映了自噬的程度[15]。自噬体形成过程中,P62 作为链接LC3 和聚泛素化蛋白之间的桥梁,被选择性地包裹进自噬体,之后被自噬溶酶体中的蛋白水解酶降解,P62 蛋白的表达量与自噬活性呈负相关[16]。本研究发现,与DOX 组比较,DOX 联合LGZG干预可以显著诱导Beclin1蛋白表达上调和LC3Ⅱ/LC3Ⅰ比值升高,P62 蛋白表达下调,激活肝脏自噬发生。Beclin1 不仅参与自噬的起始阶段,还可与抗凋亡蛋白Bcl-2相互作用,抑制其抗凋亡作用,从而抑制肿瘤的增殖[17]。本研究发现,与DOX组比较,DOX联合LGZG干预可使小鼠肝脏组织中Bcl-2 蛋白表达水平明显降低,Bax 蛋白表达水平明显升高,促进肝癌细胞凋亡,增强NAFLD-HCC化疗敏感性。
综上所述,LGZG联合DOX能够协同促进肝脏肿瘤细胞的凋亡,增强NAFLD-HCC 化疗敏感性,有效减缓原发性HCC 的发生发展,其机制可能与调节肿瘤细胞自噬的发生有关。
