P54/cAMP/PKA信号调控在酒精依赖大鼠中的相关性研究
2023-10-16安子宜董泽嵩毕鹏翔刘洪凤耿艳萌薛继婷霍楠楠朱晓峰
李 齐 安子宜 董泽嵩 毕鹏翔 李 姝 刘洪凤 耿艳萌 岳 辉 薛继婷霍楠楠 朱晓峰▲
1.牡丹江医学院,黑龙江牡丹江 157011;2.开滦总医院,河北唐山 063001;3.浙江省丽水市中心医院,浙江丽水 323000
酒精依赖是现今最为常见的物质依赖疾病之一,患病人数仅次于尼古丁依赖综合征的人数,酒精已经成为全球第二大的成瘾物质,全球大约有4.9%(约2.4亿)的人群受到其影响[1-2]。我国的酒精依赖和滥用问题也在日益增多,而且增加的速度较快[3-4]。酒精依赖已经成为现今中国重大公共卫生问题之一,引起了极大的重视[5]。
P54蛋白是一种神经特异性蛋白,是一种广泛分布于大脑及外周组织的小分子神经肽[6]。近年来,关于P54对神经精神行为影响的相关研究引起了广泛关注[7-8]。P54与物质依赖的关系并不明确。Umut等[9]探讨了P54与酒精依赖之间的相关性,结果发现虽然该研究的结果无法证实酒精依赖、酒精戒断与P54水平之间的关系,但是P54的神经内分泌机制可能参与了酒精依赖或酒精戒断的神经生物学机制。还有研究发现[10],P54可能通过调控cAMP/PKA信号通路,参与了物质成瘾的发生和发展。
1 材料与方法
1.1 材料
1.1.1 实验动物 选取辽宁长生生物技术有限公司[SCXK(辽)2015-0001]SPF级SD雄性大鼠共50只,6周龄,体重170~200 g。动物模型的构建以及后续检测均在牡丹江医学院SPF级实验动物中心实验室[SYXK(黑)2019-006]内完成。全部SD大鼠的使用以及饲养符合牡丹江医学院实验动物管理条例并符合伦理要求。
1.1.2 主要试剂 无水乙醇(深圳迈瑞,18190511G902);总RNA提取试剂盒(Solarbio,R1200);逆转录试剂盒(Takara,RR037A);TB Green®Premix Ex TaqTM(Takara,RR420A);引物(上海生工);慢病毒试剂(武汉金思拓)。
1.1.3 主要仪器 NanoDrop2000 (Thermo);C1000TM Thermal Cycler PCR(美国伯乐);StepOne Real-Time PCR System(Applied Biosystems);脑立体定位仪(上海玉妍);Morris水迷宫视频分析系统(泰盟公司)。
1.2 方法
1.2.1 实验分组与10%双瓶自由连续性饮酒模型组建立 SD大鼠单笼适应性喂养1周后,随机数表法分成五组:对照组(control组)、10%双瓶自由连续性饮酒模型组(10% ethanol组)、慢病毒阴性对照组(JL-control组)、慢病毒空载组(JL-NC组)和P54过表达组(JL-P54组),每组各10只。开始建模喂养,实验过程中饮食正常,饮水则是每个笼内放置两个饮水瓶。control组两个水瓶均是蒸馏水,其余组两个水瓶分别是10%酒精溶液和蒸馏水,建模期间,每天早上8∶00分别测量饮水量(ml/24 h)和饮酒量(ml/24 h),并记录。为了避免形成位置偏爱,每天必须要交替更换酒瓶和水瓶的位置。持续造模4周(28 d)。每周更换垫料,检测体重。测定酒精偏好后,control组和10% ethanol组麻醉后断头处死。取出双侧海马组织,称重后存放于-80℃冰箱中。
1.2.2 酒精偏好的测定[7]构建模型成功后,计算模型组的酒精偏好,主要是掌握SD大鼠每天消耗的酒精量占了总液体(酒精+蒸馏水)的消耗量百分比,酒精偏好(%)=酒精总消耗量(ml)/(酒精+水)总消耗量(ml)×100%。
1.2.3 P54过表达组的建立与cAMP/PKA信号通路成分的变化 ①慢病毒提前从-80℃冰箱中取出,置于冰上缓慢融化。②JL-control组、JL-NC组、JL-P54组七氟烷吸入麻醉后,脑立体定位仪在大鼠头部的右侧半球前囟外侧1.5 mm和骨头后1.0 mm相交处钻一个小孔,微量进样器分别吸取生理盐水(JL-control组)、阴性对照试剂(JL-NC组)和慢病毒(JL-P54组)5 μl后,缓慢通过此小孔进入右侧脑室,注入后静止1 min,然后缓慢移除微量进样器,封闭该孔。操作完毕后,将三组大鼠送回笼中,注意保温,密切观察状态。三组大鼠饲养条件同前。③转染5 d后,麻醉后断头处死。取出双侧海马组织,称重后存放于-80℃冰箱中。
1.2.4 Western Blot检测 海马组织称重后,加入裂解缓冲液(PMSF∶RIPA裂解液=1∶100),研磨裂解,冰上摇床30 min,低温离心机4℃,13 000 r/min,离心12 min,取上清液,浓度在20~40 mg/ml。充分混匀后,100℃水浴煮沸10 min,每个孔道加入蛋白样品和Marker,每孔上样量为10 μl(总量10~20 μg),Marker上样4 μl,80 V电泳50 min,120 V电泳2 h。转膜,5%脱脂奶粉作为封闭液封闭1 h后,一抗孵育过夜,二抗孵育60 min,洗膜显色,Imgel J灰度值分析,所测蛋白的相对表达水平=所测目的蛋白条带的灰度值/内参蛋白条带的灰度值。
1.3 统计学方法
运用SPSS 25.0统计学软件进行数据处理,计量资料用均数±标准差()表示,两组间比较使用独立样本t检验,多组间比较选采用单因素方差分析(ANOVA),P< 0.05为差异有统计学意义,P< 0.01为差异有显著统计学意义。绘制统计图运用Graphpad Prism 9.0软件。
2 结果
2.1 建模期内10% ethanol组的饮酒量、饮水量和酒精偏好情况
10% ethanol组经历了连续28 d双瓶自由饮酒,在造模最后7 d,其酒精摄入量(16.80±0.63)ml/24 h保持稳定,饮水量(11.90±0.39)ml/24 h保持稳定,酒精偏好稳定在(57.74±1.83)%,其差异无统计学意义(P> 0.05)。见图1。

图1 建模期内10% ethanol组的饮酒量、饮水量和酒精偏好情况
2.2 P54、AC、PKA、CREB蛋白在酒精依赖SD大鼠海马组织的表达情况
与control组比较,10% ethanol组P54、AC、PKA、CREB蛋白表达量显著降低,差异有统计学意义(P< 0.05),见图2。说明酒精依赖大鼠蛋白的表达变化可能与长时间的酒精摄入有关。

图2 P54、AC、PKA、CREB蛋白在酒精依赖SD大鼠海马组织的表达情况
2.3 P54、AC、PKA、CREB蛋白在三组大鼠海马组织的表达情况
JL-P54组P54蛋白的表达较JL-control组及JL-NC组明显增高,差异有统计学意义(P< 0.05),提示JL-P54组造模成功。与JL-control组、JL-NC组比较,JL-P54组P54、AC、PKA蛋白表达量增高,差异有显著统计学意义(P< 0.01),CREB蛋白表达量增高,差异有统计学意义(P< 0.05);JL-control组、JL-NC组P54、AC、PKA、CREB蛋白表达量差异无统计学意义(P> 0.05)。见图3。结果说明,P54可能参与介导酒精依赖大鼠海马组织内cAMP/PKA信号通路的调控。
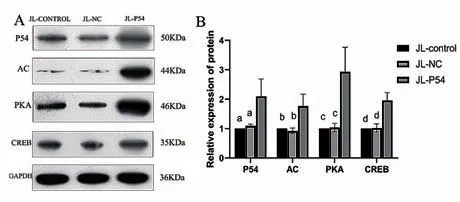
图3 P54、AC、PKA、CREB蛋白在三组大鼠海马组织的表达情况
3 讨论
酒精依赖是当前全球范围内物质成瘾中最为复杂的一种,它所涉及的问题已经严重影响患者生存质量。酒精依赖是一种比较复杂的疾病,目前为止,其病因仍不明确,因此对于成瘾机制的探索有待新的突破,期望其能够为今后的治疗提供新的思路和精确的靶点。
成功构建实验动物模型是进行科学研究的第一个非常关键的步骤。本研究选用SD大鼠来制备10%双瓶自由连续性饮酒模型。结果表明,10%双瓶自由连续性饮酒模型组通过28 d连续性饮酒造模,其酒精摄入量在逐步增多,最后到达平台期,该实验的结果和Deal等[11-12]构建动物自由饮酒模型的结果相类似,即当大鼠连续性摄入酒精的时候,酒精的消耗开始逐渐增加。
近年来研究发现酒精调控细胞内信号级联功能,特别是长期练习饮酒之后导致信号级联神经适应性变化,可能是长时间饮酒的细胞内分子基础[13]。根据研究[14-16],cAMP/PKA信号通路参与介导了物质成瘾(酒精、吗啡、尼古丁等)相关的机制,cAMP/PKA信号通路的多种组成成分,例如AC、CREB、PKA等均发生了适应性的变化。有学者研究认为,P54在大脑中与动机、情感和强化相关的区域(如海马区等)表达量低,可以通过AC降低cAMP水平,抑制神经元活动[10]。本研究结果发现,在酒精依赖SD大鼠的海马区组织中,P54、AC、CREB、PKA的表达水平明显下降,认为其表达量下降与长时间的酒精摄入相关;当P54过表达时,AC、PKA、CREB的表达水平也明显升高,说明P54可能通过参与调控cAMP/PKA信号通路,继而来参与酒精依赖的发生。
综上所述,本研究探讨并证明了P54/cAMP/PKA表达变化与长期酒精摄入相关,它可能通过P54参与调节cAMP/PKA信号通路,在酒精依赖发生过程中起着重要的作用,这一研究为酒精依赖神经生物学机制的探讨提供新的思路。本研究也有缺陷,如未研究P54和cAMP/PKA信号通路之间是如何调控的,因此下一步将研究其调控机制。
