CD73:肿瘤免疫治疗的新靶点
2023-10-13司德豹王丽非洪斌
司德豹,王丽非,洪斌
·综述·
CD73:肿瘤免疫治疗的新靶点
司德豹,王丽非,洪斌
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所国家卫生健康委员会抗生素生物工程重点实验室/中国医学科学院药物合成生物学重点实验室
肿瘤免疫治疗是缓解甚至治愈某些类型肿瘤的有效策略,例如针对程序性细胞死亡蛋白-1(programmed death-1,PD-1)的纳武利尤单抗对非小细胞肺癌和霍奇金淋巴瘤等实体癌有治疗效果[1],以细胞毒性 T 淋巴细胞相关蛋白-4(cytotoxic T-lymphocyte-associated protein-4,CTLA-4)为靶点的伊匹木单抗也在黑色素瘤、前列腺癌患者的临床试验中显示了较好的疗效[2]。然而,这些药物仅在少数患者中有效,且在相当一部分患者中观察到对免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)的耐药性[3]。这种现象的产生是因为肿瘤细胞可以通过多种免疫抑制途径发生免疫逃逸[4]。因此,对肿瘤免疫逃逸机制更深入和全面的研究将有利于人们应用肿瘤免疫疗法来对抗癌症。
胞外-5'-核苷酸酶(ecto-5'-nucleotidase,CD73,NT5E),能够催化磷酸腺苷(adenosine monophosphate,AMP)转化为具有免疫抑制作用的腺苷(adenosine,Ado)。近年的研究表明 CD73 在促进癌症进展中发挥重要作用,能通过上调腺苷信号抑制肿瘤免疫监视,并增强调节性 T 细胞(regulatory cells,Tregs)和髓源性抑制细胞(myeloid derived suppressive cells,MDSCs)的免疫抑制效应[5]。因此,靶向 CD73 以及 Ado 通路的治疗策略能够减弱免疫抑制,可作为抗肿瘤免疫疗法的新方向。目前已经有许多 CD73 抑制剂进入了临床阶段,如 BMS-986179、MEDI9447、NZV930 等,本综述旨在介绍 CD73 所介导的腺苷代谢通路对肿瘤微环境的免疫抑制作用,以及目前临床中针对 CD73 的肿瘤免疫治疗药物和策略,为抗 CD73 药物的后续临床研究和开发提供基础。
1 CD73 与腺苷代谢通路
CD73 是由 548 个氨基酸残基组成的核苷酸酶,分子量为 61 kD。CD73 具有两种类型,除了以糖基磷脂酰肌醇(glycosylphosphatidy-1-inositol,GPI)锚定于细胞表面的膜结合型,在细胞外液和血液中也存在具有酶活性的可溶型 CD73。该蛋白具有三个结构域(图1)[6]:一个含金属结合位点的 N 端结构域;一个含有催化位点的 C 末端结构域;一个连接 N 和 C 末端结构域的短 α 螺旋。
腺苷代谢通路是由多种酶、转运蛋白和受体组成的复杂系统,能调节细胞外 ATP 转化为免疫抑制的 Ado[7]。细胞外 ATP 是机体的重要信号分子,ATP 能与相应受体结合促进树突状细胞(dendritic cells,DCs)成熟、激活 T 细胞、抑制肿瘤细胞的增殖,并促进癌细胞的凋亡[8]。在肿瘤微环境(tumor microenvironment,TME)中,大量 ATP 被释放到胞外并由三磷酸外核苷二磷酸水解酶-1(CD39)和 CD73催化降解为 Ado,Ado 随后可与肿瘤细胞以及肿瘤微环境中的免疫细胞表面的腺苷受体(A1R、A2aR、A2bR 和 A3R)结合,引起下游受调控细胞的变化,如增加肿瘤细胞的存活和转移,促进血管生成,抑制淋巴细胞效应器功能,防止记忆 T 细胞分化为效应细胞等,最终促进肿瘤的逃逸。免疫细胞表面表达有不同的腺苷受体,A2aR 主要在 T 细胞、自然杀伤细胞(natural killer cells,NKs)、巨噬细胞等免疫细胞上广泛表达,A2bR 主要在髓系细胞(包括 DCs、巨噬细胞和 MDSCs)上表达(图2)。

图1 二聚体 CD73 三维结构示意图[6][黄色棒代表二硫键,紫色球状结构代表潜在的 N-糖基化位点(Asn),青蓝色球体代表锌离子]
2 CD73 对肿瘤微环境的影响
2.1 CD73 在肿瘤细胞中的表达
在bioGPS mRNA 表达数据库搜索 NT5E,数据显示呼吸道上皮细胞、平滑肌细胞、心肌细胞、子宫等组织中均可检测到 CD73 的显著表达。根据人类蛋白质图谱(human protein atlas,HPA)数据[9]在癌症患者中的报告,甲状腺癌、结直肠癌和肝癌是 CD73 阳性表达的三大组织,其次是胶质瘤、胰腺癌、宫颈癌和子宫内膜癌。癌症基因组图谱(the cancer genome atlas,TCGA)显示,CD73 在甲状腺癌、胶质母细胞瘤、肉瘤中的表达最为丰富,然而,宫颈鳞状细胞癌和宫颈腺癌、卵巢浆液性囊腺癌、睾丸生殖细胞肿瘤、子宫体子宫内膜癌、子宫癌肉瘤、膀胱尿路上皮癌和前列腺腺癌中 CD73 并没有明显表达上调[10]。
现有的证据表明 CD73 参与了肿瘤细胞的增殖、血管生成以及侵袭等过程[11],还可以作为细胞表面重要的黏附信号分子[12]。有研究通过单细胞测序和算法评分发现,CD73 的表达与免疫细胞在肿瘤微环境中的浸润和迁移有关。同时还观察到 CD73 参与了癌症中多种免疫相关途径的激活,如 BLCA、BRCA、LUAD、LUSC、OV 和 PRAD[13]。有趣的是,这些途径中许多都与肿瘤相关细胞(如 T 细胞、巨噬细胞和成纤维细胞)的激活和增殖有关,表明 CD73 可通过调节这些细胞的免疫活性从而协助肿瘤进行免疫逃逸。
多种因素参与调节肿瘤内 CD73 的表达。缺氧诱导因子-1、某些细胞因子(IL-6、TGF-β 等)和一些信号通路(WNT、TP53)可以上调 CD73,而 miR-30a ~ e、miR-200c 和雌激素受体都能够负调控 CD73 的表达[14]。
2.2 CD73 与肿瘤微环境的免疫抑制
肿瘤微环境是一个高度复杂的系统,主要由肿瘤细胞、浸润性免疫细胞(如巨噬细胞、DCs 和淋巴细胞)、癌相关基质细胞与细胞外基质和多种信号分子等成分组成[15]。据报道,TME 内的免疫细胞在肿瘤发生发展中起着重要作用,能产生肿瘤拮抗或肿瘤促进功能[16],并且 TME 与肿瘤患者的临床预后密切相关[17]。
CD73 在 TME 中多种免疫细胞表面表达,包括单核细胞、DCs 等[18]。CD73 产生的Ado 通过免疫细胞上的 A1R、A2aR 和 A2bR 介导多种抗炎和免疫抑制作用,影响免疫细胞的正常功能而导致免疫逃逸。因此,更好地了解 TME 中的免疫细胞以及明确 CD73 在各类免疫细胞中的作用对于破译免疫治疗的机制和确定新的免疫治疗靶点至关重要。下面将概述 CD73 对 TME 中 CD8+T 细胞、NKs、DCs、肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)、MDSCs 的影响。
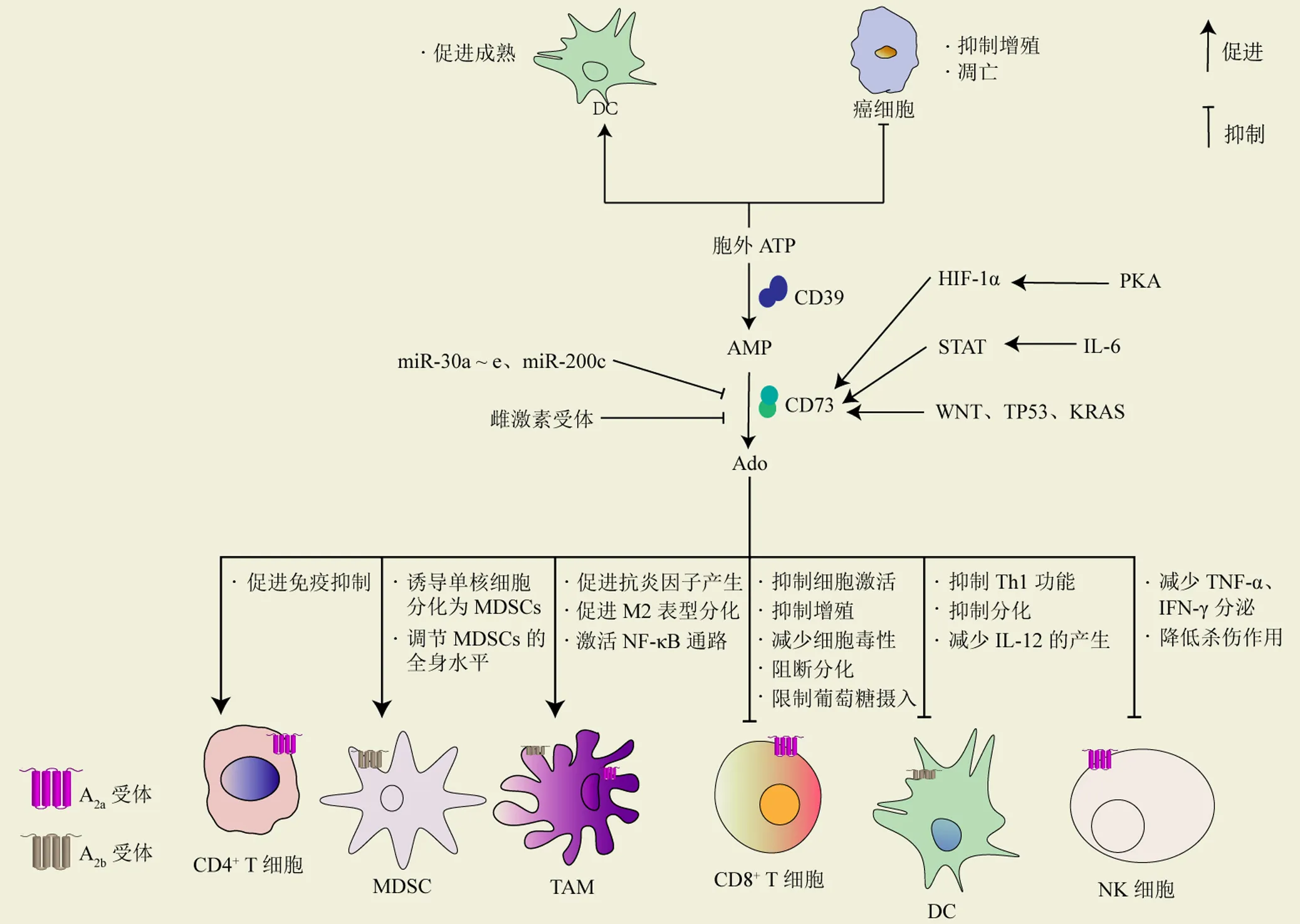
图2 腺苷代谢通路
2.2.1 CD8+T 细胞 CD8+T 细胞被认为是淋巴细胞的主要亚群。CD73 调控 CD8+T 细胞的机制,已有的研究报道证实 Ado 通过结合 CD8+T 细胞上的 A2aR,干扰 mTORC1 激活并损害 CD8+T 细胞代谢而抑制 T 细胞的激活[19],以及通过下调磷酸肌醇 3 激酶-Akt 通路增强记忆型 CD8+T 细胞的增殖与存活,降低其向细胞毒性表型转变的潜力[20]。此外,研究发现 CD73 敲除小鼠的 CD8+T 细胞摄取葡萄糖和分泌 T 细胞毒性蛋白-颗粒酶 B 能力显著升高,表明 CD73 能降低 T 细胞毒性而抑制抗肿瘤反应[21]。因此,靶向 CD73 可以成为逆转 Ado 对于抗肿瘤T 细胞免疫抑制作用、延缓肿瘤进展的新策略。
2.2.2 NKs NKs 也是一类介导肿瘤免疫监视的抗肿瘤免疫细胞,研究表明肿瘤浸润性NKs 的杀伤功能会受到 CD73 的调控。有研究发现,肿瘤浸润性 NKs 细胞表面的 CD73 表达上调,CD73+NKs 的数量与乳腺癌患者肿瘤大小相关。上调的 CD73 会产生高浓度的 Ado,减弱 NKs 产生 TNF-α 和 IFN-γ 的能力,并且通过 A2aR 抑制 NKs 的细胞杀伤作用[22]。另一研究也证实了 NKs 表面 CD73 的表达程度与癌症特异性和肿瘤微环境相关,并在缺氧时增强[23]。这些结果表明了 CD73 能通过调节 NKs 的活性来介导免疫逃逸,促进肿瘤进展。
2.2.3 DCs DCs 细胞是启动免疫反应的主要抗原递呈细胞,抗肿瘤免疫反应中它们可以呈递抗原并为 T 细胞活化提供共刺激信号[24]。TME 中,CD73 介导产生的 Ado 降低了 DCs 激活和放大 1 型辅助性 T 细胞(Th1)免疫反应的能力[25]。CD73 阻断增强了 DCs 对受辐射肿瘤的抑制作用,诱导全身抗肿瘤 T 细胞反应,证明放疗与 CD73 阻断具有协同作用[26]。此外,Ado 一方面与 DCs 表面的 A2bR 结合影响 DCs 的分化,表达高水平的促血管生成、免疫抑制及耐受分子(IL-8、IL-10 等);另一方面通过结合 DCs 上的 A2aR 抑制 IL-12 的生成,而 IL-12 是一个重要的抗肿瘤细胞因子[27]。这些发现明确了 CD73 对 DCs 的调控介导了免疫抑制,提示 CD73 在癌症治疗中有重要的应用。
2.2.4 TAM TAM是 TME 中一种重要的免疫细胞类型。TAM 分为 M1型和 M2型,其中 M2型 TAM 能够下调免疫应答,促进肿瘤进展和转移[28]。最近的研究发现,Ado 与骨髓来源细胞的巨噬细胞上 A2aR 结合后,诱导巨噬细胞的 M2极化,并通过 PPAR γ-p65 途径增加抗炎因子 IL-10 的表达,抑制抗肿瘤免疫反应[29]。同时,TAM 表达 CD39 和 CD73,进一步增加 MDSC 和 TAM 的浸润,从而形成一种自我放大机制,促进免疫逃逸。另一研究表明 CD73 通过头颈部鳞状细胞癌衍生的胞外囊泡重塑 TAM。胞外囊泡携带的 CD73 激活巨噬细胞中的 NF-κB 通路,促进了巨噬细胞中免疫抑制分子(LAG3、CD279 和 CD274)和相关细胞因子(IL-6、IL-10、TNFA 和 TGF-β)的表达,导致免疫逃逸和肿瘤进展[30]。这表明与正常巨噬细胞相比,CD73 水平较高的巨噬细胞具有更强的肿瘤促进作用。此外,CD73 介导的胞外 Ado 还能抑制 TAM 的抗菌反应,这可能会削弱巨噬细胞的先天免疫功能[31]。根据以上结果,CD73 可通过产生腺苷影响 TME 中巨噬细胞的免疫特性并促进肿瘤发生和发展。
2.2.5 MDSCs TME 中另一种主要的促肿瘤免疫细胞是MDSCs。许多研究证明 CD73 在各类肿瘤的 MDSCs 中表达,如头颈部鳞状细胞癌、口腔鳞状细胞癌、卵巢癌。CD73 对 MDSCs 的作用已有报道,CD73 产生的 Ado 诱导单核细胞在 TME 中分化为 MDSCs[32],CD73 通过粒细胞-巨噬细胞集落刺激因子上调 MDSCs 的活性与数量,加强对 T 细胞活化的抑制作用而介导免疫逃逸[33],CD73 抑制剂 5'-α,β-亚甲基二磷酸(APCP)降低了 MDSCs 对 T 细胞增殖的抑制作用。还有研究发现二甲双胍能够抑制卵巢癌患者 CD39/CD73 依赖性的 MDSCs 免疫抑制,提高抗肿瘤 T 细胞免疫功能[34]。
3 CD73 与肿瘤免疫治疗
由于靶向 CD73 以及 Ado 通路的治疗策略能够减弱肿瘤微环境中免疫抑制,有效抑制肿瘤生长,可作为抗肿瘤免疫疗法的新方向。下面将重点介绍以 CD73 为单靶点的药物、CD73 与其他药物联合治疗的研究现状以及最近的临床试验结果(表1)。
3.1 CD73 单靶点
3.1.1 CD73 单抗
3.1.1.1 Oleclumab Oleclumab(MEDI-9447)是通过噬菌体展示技术分离得到的一种人 IgG1 λ CD73 单抗[35],能够阻止或减少 Ado 的生成,并在体内抑制了小鼠肿瘤的生长。Oleclumab 通过抑制 CD73 二聚体交联和(或)空间位阻的双重机制拮抗 CD73。近期研究数据(NCT03736473)表明,oleclumab 在晚期实体瘤患者中安全性和耐受性都较好[36]。然而,oleclumab 对胞外小泡 CD73 的酶活性的阻断能力有限,并且传统的单特异性 CD73 抗体缺乏足够的亲和力和肿瘤选择性[37]。因此,目前大多数关于 oleclumab 的研究都是使用联合治疗的方法而不是单独用药。
3.1.1.2 IBI-325 另一种 CD73 抗体 IBI-325[38],其亲和力与 oleclumab 相似,但对 CD73 的抑制作用更强。在对 oleclumab 实验中,观察到了钩状效应(即高剂量 oleclumab 失去抑制 CD73 的活性),而高剂量的 IBI-325 则完全抑制了 CD73 的活性,并显著增强T 细胞增殖和细胞因子的释放。目前 IBI-325 在晚期实体瘤患者中的 I 期研究(NCT05119998)正在进行,该实验目的是检测 IBI-325 的安全性和初步抗肿瘤疗效。

表1 临床试验阶段的 CD73 抑制剂
3.1.1.3 BMS-986179 2018 年,美国癌症研究协会公布了在患有晚期实体瘤患者中进行的 BMS-986179 ± nivolumab(PD-1 单抗)人体 I/IIa 期研究(NCT02754141)的初步结果[39]。单药导入和联合治疗均耐受良好,无治疗相关死亡。BMS-986179 在所有剂量下有效地抑制肿瘤脉管系统和肿瘤细胞中的 CD73 活性,无剂量依赖性。总的来说,晚期实体瘤患者对 BMS-986179 单用或与 nivolumab 联用效果明显,耐受性好,为其未来在临床上应用提供了可靠的证据。
3.1.1.4 CPI-006 2019 年,美国临床肿瘤学会发布抗 CD73 抗体 CPI-006 在晚期癌症中I期临床试验的初步安全性和有效性评估[40]。CPI-006 是一种人源化 IgG1 Fc γ 受体缺陷型抗 CD73 抗体,可以抑制 CD73 活性。在12 mg/kg 剂量下,单一使用 CPI-006 是安全的。而与环磷腺苷联合使用时,安全剂量下降到 6 mg/kg。初步数据显示,加大剂量或联合 CPI-444(一种 A2aR 拮抗剂)治疗可提高疗效。目前 CPI-006 有一项I期临床试验(NCT03454451)正在进行。
3.1.1.5 Sym-024 Sym-024[41]是一种 Fc 减毒的人单克隆抗体,能与 CD73 催化中心相对侧酶上的独特表位结合,有效抑制可溶性 CD73 以及癌细胞、淋巴细胞上表达的 CD73 活性。重要的是,Sym-024 对 CD73 的抑制减轻了 AMP 介导的对 T 细胞增殖和活化的抑制。在临床前体内肿瘤模型中,Sym-024 有效抑制 CD73 活性和肿瘤生长。Sym-024 具有良好的耐受性,在猴子中以高达 100 mg/kg 的剂量水平进行的重复给药研究中未观察到毒性。目前 Sym-024 正在临床研究中(NCT04672434)。
3.1.2 小分子抑制剂 单抗在实体肿瘤中的渗透性通常很低,而小分子抑制剂可能具有更好地穿透各种组织和膜屏障的潜力。因此小分子抑制剂有望成为具有新作用机制的抗肿瘤药物[42]。目前在临床研究的 CD73 小分子抑制剂有 AB-680、ORIC-533、ATG-037。AB-680 有两项 I 期临床试验已经完成,结果显示有良好耐受性。ORIC-533 和 ATG-037 目前各有一项 I 期临床试验正在进行中。
3.1.2.1 AB-680 AB-680 是第一个进入临床的 CD73 核苷类小分子抑制剂[43]。它拥有优异的活性(对 CD73 的 IC50< 1 nmol/L,i= 5 pmol/L)和高选择性(对 CD39、NTPDase2、NTPDase3、NTPDase8 活性 IC50均大于10 μmol/L)。AB-680 的另一个特点是清除率非常低,在临床前物种中的半衰期(67 ~ 74 h)很长,因此适合长效肠胃外给药。AB-680 目前有 4 项临床试验(NCT04104672、NCT04660812、NCT04381832、NCT05688215)正在进行,有两项 I 期临床试验(NCT03677973、NCT04575311)已经完成,初始数据显示 AB-680 具有良好的耐受性。
3.1.2.2 ORIC-533 ORIC-533 是另一种口服有效的 AMP 竞争性 CD73 小分子抑制剂[44]。在体外试验中,与 oleclumab 相比,ORIC-533 在恢复被抑制的 CD8+T 细胞增殖和活化方面表现出更强的效力,并且与已有的 CD73 和 Ado 受体的小分子抑制剂相比也表现出更强的效力。这些结果表明 ORIC-533 有效抑制腺苷代谢通路,从而恢复抗肿瘤免疫力,并且目前正在进行一项针对多发性骨髓瘤患者的 I 期临床试验(NCT05227144)。
3.1.2.3 ATG-037 ATG-037 是中国及亚太地区首个进入临床阶段的口服型 CD73 小分子抑制剂。2022 年 11 月3 日,国家药品监督管理局批准 ATG-037 用于治疗局部晚期及转移性实体瘤患者的 I 期临床试验(NCT05205109)。在临床前研究中,与临床抗 CD73 抗体相比,ATG-037 显示出有效且完全的 CD73 酶抑制作用,以及在高水平 AMP 的抑制作用中恢复 T 细胞功能的能力[45]。
3.2 联合疗法
3.2.1 腺苷代谢通路双重阻断
3.2.1.1 CD73 与 CD39 临床前研究已经证明了同时阻断 CD73 和 CD39 治疗肿瘤的潜力。抗 CD39 单抗 IPH5201 与抗 CD73 单抗 IPH5301 联用抑制了 Ado 的生成,并通过刺激 DCs、TAM 以及通过激活癌症患者分离的 T 细胞来促进抗肿瘤免疫[46]。尽管目前并没有相关的临床联用数据,但是从理论上来说,这种策略是可行的。因此,我们可以期待未来抗 CD73 与 CD39 的药物联用策略出现在临床上。
3.2.1.2 CD73 与 A2aR Young 等[47]在 2016 年报道了 CD73 和 A2aR 缺陷的基因靶向小鼠比单基因敲除小鼠对癌症的抵抗力更强。这项研究首次揭示了宿主 A2aR 和CD73 在肿瘤免疫中的协同作用。抗 CD73 单抗和 A2aR 拮抗剂(SCH58261)的双重治疗也显示出比任何一种单一药物更强的抗肿瘤活性。目前该联用策略有两项进入临床阶段(NCT04237649 和 NCT04989387)。此外,该研究发现 A2aR 拮抗剂与 CD73 抑制剂 APCP 的联合并没有增加治疗效果,这反映了 CD73 在胞外核苷酸酶活性之外的多功能性。
3.2.2 CD73 阻断联合免疫检查点阻断 目前,已经有大量的临床前研究证实了CD73 抑制剂与 ICIs 联合可以提高抗肿瘤疗效[48-50]。在一项已经完成的 II 期临床试验(NCT03822351)中[51],与抗 PD-L1 的 durvalumab 单一疗法相比,durvalumab 和 CD73 单抗 oleclumab 的联合疗法使不能切除的 III 期非小细胞肺癌(nonsmall-cell lung cancer,NSCLC)患者的客观反应率增加了一倍,并显著改善了临床结果,没有任何新的不良反应。另一项 oleclumab ± duvalumab(NCT02503774)试验也显示总体应答率有改善[52]。CD73 单抗 uliledlimab 联合 PD-1 单抗 toripalimab 也在 NSCLC 患者中显示出显著的抗肿瘤活性(NCT04322006)[53]。
3.2.3 其他 根据目前的临床前研究和进入临床的CD73 抑制剂,我们不难发现CD73 能与许多类型的治疗方法进行组合,包括单抗、放疗、化疗、过继细胞治疗等。例如,oleclumab 加 osimertinib(EGFR 抗体)治疗局部晚期(转移性)NSCLC 的安全性和有效性(NCT03381274)良好[54],CD73 受体阻滞剂与放射治疗协同作用可增强对肿瘤的控制,吉西他滨和抗 CD73 抗体联合治疗后,原位植入 KPC1245 细胞的小鼠存活率显著提高,肿瘤生长率显著降低[55]。
4 总结与展望
CD73 能够降解 AMP 而产生 Ado,随后 Ado 与肿瘤微环境中的肿瘤细胞以及免疫细胞表面的腺苷受体结合,产生一系列的生理作用抑制抗肿瘤免疫反应。由此,CD73 被认为是癌症免疫治疗的有效靶点,多种靶向 CD73 的抗体和小分子抑制剂已经进入临床研究阶段。然而,针对 CD73 的研究和治疗策略仍面临一些问题。首先,CD73 抑制剂通过减少 Ado 生成而产生抗肿瘤免疫作用,但是 Ado 仍有其他补偿机制来供应;其次,尽管目前已经出现了腺苷通路多靶点阻断策略,但进入临床试验的并不多;另外,CD73 的非酶作用也对肿瘤有影响,如有研究发现,CD73 在胰腺导管腺癌细胞的细胞质中过表达,以不依赖核苷酸酶的方式促进肿瘤转移,表明 CD73 在肿瘤进展中的作用机制比预期的更复杂[56]。
此外,CD73 具有作为癌症治疗和预后效果的生物标志物的潜力。有研究利用肿瘤免疫功能障碍与排斥(TIDE)算法,评估 CD73 作为 ICIs 预测因子的潜力,发现 CD73 与其他常见生物标志物(如 IFNR、CD8)相比,能够更加有效和准确预测头颈部肿瘤抗 PD-1 治疗的敏感性,因此将来有望通过识别 CD73 来为患者定制个体化靶向治疗方案[57]。
[1] Yi M, Zheng X, Niu M, et al. Combination strategies with PD-I/PD-L1 blockade: current advances and future directions. Mol Cancer, 2022, 21(1):28.
[2] Rowshanravan B, Halliday N, Sansom DM. CTLA-4: a moving target in immunotherapy. Blood, 2018, 131(1):58-67.
[3] Maleki Vareki S, Garrigós C, Duran I. Biomarkers of response to PD-1/PD-L1 inhibition. Crit Rev Oncol Hematol, 2017, 116:116-124.
[4] Khalil DN, Smith EL, Brentjens RJ, et al. The future of cancer treatment: immunomodulation, CARs and combination immunotherapy. Nat Rev Clin Oncol, 2016, 13(5):273-290.
[5] Jeffrey JL, Lawson KV, Powers JP. Targeting metabolism of extracellular nucleotides via inhibition of ectonucleotidases CD73 and CD39. J Med Chem, 2020, 63(22):13444-13465.
[6] Scortichini M, Idris RM, Moschütz S, et al. Structure-activity relationship of 3-methylcytidine-5'-α, β-methylenediphosphates as CD73 inhibitors. J Med Chem, 2022, 65(3):2409-2433.
[7] de Andrade Mello P, Coutinho-Silva R, Savio LEB. Multifaceted effects of extracellular adenosine triphosphate and adenosine in the tumor-host interaction and therapeutic perspectives. Front Immunol, 2017, 8:1526.
[8] Zhou JZ, Riquelme MA, Gao X, et al. Differential impact of adenosine nucleotides released by osteocytes on breast cancer growth and bone metastasis. Oncogene, 2015, 34(14):1831-1842.
[9] Uhlén M, Fagerberg L, Hallström BM, et al. Proteomics. Tissue-based map of the human proteome. Science, 2015, 347(6220):1260419.
[10] Yang H, Yao F, Davis PF, et al. CD73, tumor plasticity and immune evasion in solid cancers. Cancers, 2021, 13(2):177.
[11] Hajizadeh F, Masjedi A, Heydarzedeh Asl S, et al. Adenosine and adenosine receptors in colorectal cancer. Int Immunopharmacol, 2020, 87:106853.
[12] Bhattarai S, Pippel J, Scaletti E, et al. 2-Substituted α,β-methylene- ADP derivatives: potent competitive ecto-5'-nucleotidase (CD73) inhibitors with variable binding modes. J Med Chem, 2020, 63(6): 2941-2957.
[13] Tang K, Zhang J, Cao H, et al. Identification of CD73 as a novel biomarker encompassing the tumor microenvironment, prognosis, and therapeutic responses in various cancers. Cancers (Basel), 2022, 14(22):5663.
[14] Kordaß T, Osen W, Eichmüller SB. Controlling the immune suppressor: transcription factors and microRNAs regulating CD73/NT5E. Front Immunol, 2018, 9:813.
[15] Giraldo NA, Sanchez-Salas R, Peske JD, et al. The clinical role of the TME in solid cancer. Br J Cancer, 2019, 120(1):45-53.
[16] Lei X, Lei Y, Li JK, et al. Immune cells within the tumor microenvironment: biological functions and roles in cancer immunotherapy. Cancer Lett, 2020, 470:126-133.
[17] Chen Z, Zhou L, Liu L, et al. Single-cell RNA sequencing highlights the role of inflammatory cancer-associated fibroblasts in bladder urothelial carcinoma. Nat Commun, 2020, 11(1):5077.
[18] Bono MR, Fernández D, Flores-Santibáñez F, et al. CD73 and CD39 ectonucleotidases in T cell differentiation: beyond immunosuppression. FEBS Lett, 2015, 589(22):3454-3460.
[19] Mastelic-Gavillet B, Navarro Rodrigo B, Décombaz L, et al. Adenosine mediates functional and metabolic suppression of peripheral and tumor-infiltrating CD8+ T cells. J Immunother Cancer, 2019, 7(1):257.
[20] Flores-Santibáñez F, Fernández D, Meza D, et al. CD 73-mediated adenosine production promotes stem cell-like properties in mouse Tc17 cells. Immunology, 2015, 146(4):582-594.
[21] Briceño P, Rivas-Yañez E, Rosemblatt MV, et al. CD73 ectonucleotidase restrains CD8+ T cell metabolic fitness and anti-tumoral activity. Front Cell Dev Biol, 2021, 9:638037.
[22] Neo SY, Yang Y, Record J, et al. CD73 immune checkpoint defines regulatory NK cells within the tumor microenvironment. J Clin Invest, 2020, 130(3):1185-1198.
[23] Chambers AM, Wang J, Dao TN, et al. Functional expression of CD73 on human natural killer cells. Cancer Immunol Immunother, 2022, 71(12):3043-3056.
[24] Wculek SK, Cueto FJ, Mujal AM, et al. Dendritic cells in cancer immunology and immunotherapy. Nat Rev Immunol, 2020, 20(1): 7-24.
[25] Ko MK, Shao H, Kaplan HJ, et al. CD73+ dendritic cells in cascading Th17 responses of experimental autoimmune uveitis-induced mice. Front Immunol, 2020, 11:601272.
[26] Wennerberg E, Spada S, Rudqvist NP, et al. CD73 Blockade promotes dendritic cell infiltration of irradiated tumors and tumor rejection. Cancer Immunol Res, 2020, 8(4):465-478.
[27] Borodovsky A, Barbon CM, Wang Y, et al. Small molecule AZD4635 inhibitor of A2AR signaling rescues immune cell function including CD103+ dendritic cells enhancing anti-tumor immunity. J Immunother Cancer, 2020, 8(2):e000417.
[28] Sumitomo R, Hirai T, Fujita M, et al. M2 tumor‑associated macrophages promote tumor progression in non‑small‑cell lung cancer. Exp The Med, 2019, 18(6):4490-4498.
[29] Mou KJ, Shen KF, Li YL, et al. Adenosine A2A receptor in bone marrow-derived cells mediated macrophages M2 polarization via PPARγ-P65 pathway in chronic hypoperfusion situation. Front Aging Neurosci, 2022, 13:792733.
[30] Lu T, Zhang Z, Zhang J, et al. CD73 in small extracellular vesicles derived from HNSCC defines tumour-associated immunosuppression mediated by macrophages in the microenvironment. J Extracell Vesicles, 2022, 11(5):e12218.
[31] Costales MG, Alam MS, Cavanaugh C, et al. Extracellular adenosine produced by ecto-5'-nucleotidase (CD73) regulates macrophage pro-inflammatory responses, nitric oxide production, and favors Salmonella persistence. Nitric Oxide, 2018, 72:7-15.
[32] Cui H, Lan Z, Zou KL, et al. STAT3 promotes differentiation of monocytes to MDSCs via CD39/CD73-adenosine signal pathway in oral squamous cell carcinoma. Cancer Immunol Immunother, 2023, 72(5):1315-1326.
[33] King RJ, Shukla SK, He C, et al. CD73 induces GM-CSF/MDSC-mediated suppression of T cells to accelerate pancreatic cancer pathogenesis. Oncogene, 2022, 41(7):971-982.
[34] He J, Zhou M, Chen X, et al. Inhibition of SALL4 reduces tumorigenicity involving epithelial-mesenchymal transition via Wnt/β-catenin pathway in esophageal squamous cell carcinoma. J Exp Clin Cancer Res, 2016, 35(1):98.
[35] Hay CM, Sult E, Huang Q, et al. Targeting CD73 in the tumor microenvironment with MEDI9447. Oncoimmunology, 2016, 5(8): e1208875.
[36] Kondo S, Iwasa S, Koyama T, et al. Safety, tolerability, pharmacokinetics, and antitumour activity of oleclumab in Japanese patients with advanced solid malignancies: a phase I, open-label study. Int J Clin Oncol, 2022, 27:1795-1804.
[37] Ploeg EM, Ke X, Britsch I, et al. Bispecific antibody CD73xEpCAM selectively inhibits the adenosine-mediated immunosuppressive activity of carcinoma-derived extracellular vesicles. Cancer Lett, 2021, 521:109-118.
[38] Zhou Y, Shen H, Wu M, et al. Pharmacology, pharmacokinetics, and toxicity characterization of a novel anti-CD73 therapeutic antibody IBI325 for cancer immunotherapy. Int J Biol Macromol, 2023, 229: 158-167.
[39] Siu LL, Burris H, Le DT, et al. Abstract CT180: Preliminary phase 1 profile of BMS-986179, an anti-CD73 antibody, in combination with nivolumab in patients with advanced solid tumors. Cancer Res, 2018, 78(13 Suppl):CT180.
[40] Luke JJ, Powderly JD, Merchan JR, et al. Immunobiology, preliminary safety, and efficacy of CPI-006, an anti-CD73 antibody with immune modulating activity, in a phase 1 trial in advanced cancers. J Clin Oncol, 2019, 37(15 Suppl):2505.
[41] Jakobsen JS, Riva M, Melander MC, et al. Abstract 1797: Preclinical characterization of Sym024, a novel anti-CD73 antibody. Cancer Res, 2021, 81(13 Suppl):1797.
[42] Baqi Y. Ecto-nucleotidase inhibitors: recent developments in drug discovery. Mini Rev Med Chem, 2015, 15(1):21-33.
[43] Lawson KV, Kalisiak J, Lindsey EA, et al. Discovery of AB680: a potent and selective inhibitor of CD73. J Med Chem, 2020, 63(20): 11448-11468.
[44] Junttila MR, Ray A, Warne R, et al. Abstract 2074: ORIC-533, a small molecule CD73 inhibitor with best-in-class properties, reversesimmunosuppression and has potential as an immunomodulatory therapy in patients with multiple myeloma. Cancer Res, 2022, 82(12 Suppl):2074.
[45] Bian G, Hua J, Tian L, et al. Abstract 2576: ATG-037, a highly potent small molecule CD73 inhibitor has superior activity of reversing immunosuppression in higher-AMP environments compared with anti-CD73 antibodies. Cancer Res, 2022, 82(12 Suppl):2576.
[46] Perrot I, Michaud HA, Giraudon-Paoli M, et al. Blocking antibodies targeting the CD39/CD73 immunosuppressive pathway unleash immune responses in combination cancer therapies. Cell Rep, 2019, 27(8):2411-2425, e9.
[47] Young A, Ngiow SF, Barkauskas DS, et al. Co-inhibition of CD73 and A2AR adenosine signaling improves anti-tumor immune responses. Cancer Cell, 2016, 30(3):391-403.
[48] Tu E, McGlinchey K, Wang J, et al. Anti-PD-L1 and anti-CD73 combination therapy promotes T cell response to EGFR-mutated NSCLC. JCI Insight, 2022, 7(3):e142843.
[49] Kim M, Min YK, Jang J, et al. Single-cell RNA sequencing reveals distinct cellular factors for response to immunotherapy targeting CD73 and PD-1 in colorectal cancer. J Immunother Cancer, 2021, 9(7):e002503.
[50] Goswami S, Walle T, Cornish AE, et al. Immune profiling of human tumors identifies CD73 as a combinatorial target in glioblastoma. Nat Med, 2020, 26(1):39-46.
[51] Herbst RS, Majem M, Barlesi F, et al. COAST: An open-label, phase II, multidrug platform study of durvalumab alone or in combination with oleclumab or monalizumab in patients with unresectable, stage III non-small-cell lung cancer. J Clin Oncol, 2022, 40(29):3383-3393.
[52] Bendell JC, LoRusso P, Overman MJ, et al. Safety and efficacy of the anti-CD73 monoclonal antibody (mAb) oleclumab ± durvalumab in patients (pts) with advanced colorectal cancer (CRC), pancreatic ductal adenocarcinoma (PDAC), or EGFR-mutant non-small cell lung cancer (EGFRm NSCLC). J Clin Oncol, 2021, 39(15 Suppl):9047.
[53] Zhou Q, Wu L, Cui J, et al. Safety, efficacy, pharmacokinetics of uliledlimab alone or combined with toripalimab in advanced solid tumor: Initial results of a phase I/II study. J Clin Oncol, 2022,40(16 Suppl):e21123.
[54] Kim DW, Kim SW, Camidge DR, et al. Abstract CT163: CD73 inhibitor oleclumab plus osimertinib for advanced EGFRm NSCLC: first report of a phase 1b/2 study. Cancer Res, 2021, 81(13 Suppl): CT163.
[55] Wennerberg E, Spada S, Rudqvist NP, et al. CD73 blockade promotes dendritic cell infiltration of irradiated tumors and tumor rejection. Cancer Immunol Res, 2020, 8(4):465-478.
[56] Liu W, Yu X, Yuan Y, et al. CD73, a promising therapeutic target of diclofenac, promotes metastasis of pancreatic cancer through a nucleotidase independent mechanism. Adv Sci (Weinh), 2023, 10(6): e2206335.
[57] Lu T, Zhang Z, Zhang J, et al. CD73 in small extracellular vesicles derived from HNSCC defines tumour-associated immunosuppression mediated by macrophages in the microenvironment. J Extracell Vesicles, 2022, 11(5):e12218.
10.3969/j.issn.1673-713X.2023.05.008
中国医学科学院医学与健康科技创新工程(2022-I2M-2-002)
王丽非,Email:lifeiwang2002@hotmail.com;洪斌,Email:binhong69@hotmail.com
2023-05-05
