FDA胃肠道局部作用复杂仿制药的等效性评价
2023-10-13魏赫李晓锋李雪梅
魏赫,李晓锋,李雪梅
(国家药品监督管理局药品审评中心,北京 100022)
仿制药(generic drugs)是指具有与参比药物(reference listed drugs,RLD)相同的活性成分、剂型、规格、适应证、给药途径和用法用量,并证明质量和疗效与RLD相同的药品[1-2]。仿制药需要进行药学等效性评价(pharmaceutical equivalence,PE)和生物等效性(bioequivalence,BE)评价,用以证明与参比药物的治疗等效性(therapeutic equivalence,TE)。
复杂仿制药一般包括具有复杂活性成分的产品,具有复杂剂型或给药途径的产品,复杂的药械组合产品等[3-4]。一般来说,结构相对简单的小分子药物比较容易通过药学质量研究和人体生物等效性试验进行PE和BE评价,而复杂仿制药的研发和评价难度较大。对于具有复杂活性成分的一类仿制药,如合成肽、复杂混合物等,由于其分子结构的复杂性需要进行充分的研究来证明仿制药与RLD活性成分(active pharmaceutical ingredient,API)的相同性,从而确证PE[5]。
BE是评价药物是否具有可替换性的重要指标。BE研究方法包括药代动力学研究、药效动力学研究、临床研究和体外研究。以药代动力学参数为终点的BE研究最为常用,但部分胃肠道局部作用的药品,未进入血液循环,无法通过药代动力学终点指标进行BE评价,而以药效学参数为终点的BE研究和以临床疗效为终点的BE研究则具有较大的变异和较低的灵敏度。近年来随着监管理念的提升和药物评价的发展,对于胃肠道局部作用药物,可根据产品特点、作用机制、体内外相关性等以体外方法来评价BE[6]。
国家卫生健康委联合国家药监局和国家知识产权局等部门制定了两批鼓励仿制药品目录清单,2019年发布的第一批目录中包括格拉替雷、盐酸考来维仑复杂仿制药,但截至目前尚无批准。表1汇总了部分复杂仿制药中美获批情况对比,可以看出我国此类药品的获批情况与美国有一定的差距,上市时间较早的硫糖铝则出现了过度仿制的情况[7]。

表1 中美部分复杂仿制药获批情况对比
本文主要以胃肠道局部作用的具有复杂活性成分的仿制药为例,汇总了近年美国食品药品监督管理局(FDA)发布的具体产品指南,以期为该类药物的研发和等效性评价提供参考。
1 硫糖铝
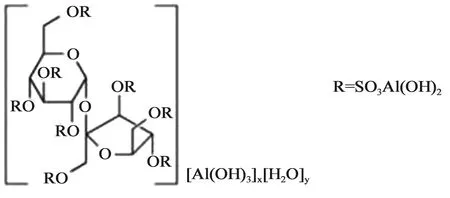
硫糖铝为抗酸药(结构示意图见图1),用于治疗胃、十二指肠溃疡及胃炎。在酸性环境下,解离出硫酸蔗糖复合离子,复合离子聚合成不溶性的带负电荷的胶体,能与溃疡面带正电荷的蛋白质渗出物相结合,形成一层保护膜覆盖于溃疡面,促进溃疡愈合。还具有吸附胃蛋白酶和胆汁酸的作用。FDA 硫糖铝口服混悬剂生物等效性研究指南首次发布于2014年,目前现行有效的版本为2023年2月发布[8]。推荐的研究内容包括1项API相同性研究,1项理化特性对比研究和4项生物学测定研究。受试制剂和RLD的Q1和Q2应相同(具有相同的非活性成分,且用量差异在±5%以内),BE应建立在API相同性评估基础上,并且受试制剂和RLD体外研究具有可比性。
Al8(OH)16(C12H14O35S8)[Al(OH)3]x[H2O]y x=8 to 10,y=22 to 31
1.1 API相同性研究硫糖铝结构式和分子式如图1所示。仿制药申请人应该对受试制剂的API进行表征,并且要证明其组成和分子式与RLD标签中的结构信息是一致的。结构表征至少采用3批受试制剂,推荐的结构表征包括但不限于:①API的组成:辛硫酸蔗糖和铝的含量;②元素分析测定 C、H、S、Al的数据,以及C/S比和C/Al比;③酸中和能力;④光谱学表征,例如傅立叶变换红外光谱(FT-IR)、紫外光谱(UV)、固态27Al核磁共振、差式扫描量热法(DSC)、热重量分析法(TGA)、粉末X射线衍射法(PXRD)。
1.2 受试制剂和RLD的理化特性对比理化特性对比包括以下内容:pH,比重,未处理制剂的黏度分布,表观黏度随酸度的变化情况,再分散性(再分散的时间、沉降时间和体积),酸中和能力,铝在pH 1.2介质中的释放情况。
1.3 受试制剂和RLD的生物学测定在进行生物学测定之前受试制剂和RLD均用酸预处理,如果可能,在与体内生理条件相关的条件下进行试验。应提供生物学测定的方法开发和方法学验证资料。
1.3.1 体外胆盐平衡结合研究该项研究是评估生物等效性的关键性研究。应在至少8种不同浓度的胆盐中进行孵育,浓度应分布合理直到达到最大结合。每项结合研究应至少重复12次。此外,研究数据应该表明选择的孵育时间长度可以产生最大的结合。生物等效性评价指标为 Langmuir结合常数k2的90%置信区间。
1.3.2 体外胆盐动力学结合研究该项研究用以支持关键性的平衡结合研究。应在2种不同浓度的胆盐溶液中孵育至少8个不同的时间长度,时间长度应分布合理直到达到最大结合。每项结合研究应至少重复12次。生物等效性评价指标是受试制剂和RLD硫糖铝与胆盐结合率的比较。
1.3.3 体外人血白蛋白(HSA)或牛血清白蛋白(BSA)平衡结合研究该项研究试验设计和数据分析可参考体外胆盐平衡研究。
1.3.4 体外酶(胃蛋白酶)活性研究该项研究应采用至少5种不同浓度的受试制剂和RLD进行。生物等效性评价指标是受试制剂和RLD关于胃蛋白酶活性降低百分比的比较。
1.4 讨论表2为FDA对硫糖铝产品指南的修订情况,可以看出近年来FDA对该药的BE评价观念逐渐转变,由体外评价方法替代以临床终点为指标的评价方法,更加体现科学性,同时也降低了仿制药企业的研发成本和时间成本。根据硫糖铝作用机制,设计4种体外研究方法,随着监管能力的提升,对体外BE研究的要求也越来越趋于完善。

表2 FDA硫糖铝产品指南修订情况
2 碳酸司维拉姆
碳酸司维拉姆(结构示意图见图2)是丙烯胺化合物的交联聚合体,用于治疗控制正在接受透析治疗的慢性肾病成人患者的高磷血症。口服后在胃肠道内水合膨胀成数倍于原体积的凝胶,胺根以质子化的形式存在,通过离子键和氢键与磷酸分子相互作用结合消化道中的磷酸根,降低血清中的磷酸根浓度,被聚合物结合的磷酸盐不能吸收入体内,以粪便方式排出[9]。FDA碳酸司维拉姆片生物等效性研究指南首次发布于2008年,目前现行有效的版本为2015年9月发布[10]。推荐的研究内容包括1项API相同性研究,2项体外研究。
2.1 API相同性研究碳酸司维拉姆结构如图2所示。API相同性研究通过合成路线以及理化性质对比研究建立。FDA鼓励申请人采用与参比API相同的合成路线,即聚丙烯胺盐酸盐与环氧氯丙烷交联来生产碳酸司维拉姆,如果采用不同的合成路线,则需要联系仿制药办公室取得同意,并且可能需要指南以外的特性研究来证明API的相同性。申请人应该向监管机构提供生产工艺和工艺过程控制信息。应将至少3批仿制API与至少3批从RLD中提取的API进行背对背比较研究,用以评价API的相同性和生产工艺的稳定性。RLD中API的提取方法应该在申报资料中递交。推荐的理化性质对比研究内容包括:①交联度(即交联氨基与总氨基的比例):建议采用C13固态核磁共振光谱(13C SSNMR),通过定量峰面积分析API的交联度;②质子化程度(碳酸盐含量):建议采用TGA;③总可滴定胺:建议采用滴定法;④粒径分布;⑤元素分析:结果应该包括C、H、N元素;⑥溶胀指数;⑦鼓励申请人进行更多的理化性质表征研究,包括但不限于FT-IR、拉曼光谱、PXRD和DSC等。
2.2 体外研究
2.2.1 体外平衡结合研究该项研究是评估生物等效性的关键性研究。应将受试制剂和RLD整片样品,在pH 4和pH 7条件下采用酸预处理或不处理的方式,于至少8种不同浓度的磷酸盐溶液中进行孵育,每种磷酸盐溶液中应包含80 mmol·L-1的氯化钠和100 mmol·L-1的N,N-双(羟乙基)-2-氨基乙磺酸(BES)。磷酸盐浓度应分布合理直到达到最大结合。试验应该在37 ℃条件下进行。每一项结合试验应重复至少12次。此外应提供数据,表明选择的孵育时间长度可使磷酸盐产生最大结合。
2.2.2 体外动力学结合研究该项研究用以支持关键性的平衡结合研究。应将受试制剂和RLD整片样品,在pH 4和pH 7条件下采用酸预处理或不处理的方式,于2种不同浓度的磷酸盐溶液中孵育至少8个不同的时间长度。磷酸盐的浓度应选择相应平衡结合研究中的最高和最低浓度。时间长度应分布合理直到达到最大结合。试验应该在37 ℃条件下进行。每一项结合试验应重复至少12次。
2.2.3 数据分析检测滤液中未结合的磷酸盐,间接计算出与碳酸司维拉姆结合的磷酸盐量。在体外平衡结合研究中,计算Langmuir结合常数k1和k2,受试制剂与RLD k1比值、k2的90%置信区间。体外动力学结合研究中,比较不同时间受试制剂与RLD的磷酸盐结合率,但可不计算90%置信区间。生物等效性的评价指标为平衡结合研究中k2的90%置信区间应在80%~120%范围内。
2.3 讨论仿制药与RLD具有相同的活性成分是研发的第一步,也是能够发挥相同治疗作用的重要前提。碳酸司维拉姆是高度交联的聚合物,不是单一分子,证明仿制药与RLD API的相同性较为复杂,不仅需要进行API理化特性对比,更需要从合成路线、工艺控制等方面入手,利用质量源于设计的理念使API的质量从源头得到保证。体外研究方面,根据随餐服用的特点,建议在pH 4和pH 7条件下进行磷结合试验,能够反映体内生理条件。对于选用的磷酸盐浓度,孵育时间长度等应进行合理优化,提供确定依据。采用的检测方法应具有较高的专属性和灵敏度,并开展完整的方法学验证[11]。
3 盐酸考来维仑
盐酸考来维仑(结构示意图见图3)是一种胆汁酸螯合剂,用于治疗原发性高脂血症。非吸收性的聚合物盐酸考来维仑在肠道中能与胆汁酸结合,阻滞胆汁酸的重吸收,从而加速肝内胆固醇经7-α-羟化酶向胆汁酸的转化。肝细胞对胆固醇的需求增加,使胆固醇生物合成酶羟甲基戊二酰辅酶A还原酶(HMG-CoA)的转录和活性增加,肝脏低密度脂蛋白受体数量增加。这些代偿作用导致血液中的低密度脂蛋白胆固醇(LDL-C)清除率增加,从而降低血清LDL-C水平[12]。FDA盐酸考来维仑口服混悬剂生物等效性研究指南首次发布于2010年,目前现行有效的版本为2021年9月发布[13]。推荐的研究内容包括1项API相同性研究,4项体外研究。

A+a′=2;b=1;c+c′=7;d+d′=6;m=聚合物网状结构的数量;基本聚合物单元的分子式为(C3H8NCl)2(C9H20N2OCl2)1(C13H28NCl)7(C12H28N2Cl2)6
3.1 API相同性研究盐酸考来维仑结构如图3所示。API相同性研究可以通过基本反应方案的相同性、化学结构和组成的相同性、理化性质相同性3方面进行确证。应将至少3批仿制API与至少3批从RLD中提取的API进行背对背比较研究,用以评价API的相同性和生产工艺的稳定性。RLD中API的提取方法应该在申报资料中递交。
3.1.1 基本反应方案相同性研究FDA建议仿制药申请人根据RLD标签信息,采用聚丙烯胺盐酸盐与环氧氯丙烷交联,与1-溴癸烷和(6-溴己基)-三甲基溴化铵烷基化的工艺生产盐酸考来维仑。如果采用替代合成工艺,应该联系FDA取得同意,并且可能需要指南以外的表征来证明API的相同性。
3.1.2 化学结构和组成相同性研究仿制药申请人应定义API的结构,如a + a′,b,c + c′,d + d′的数值等,受试API和参比API应具有相同的化学结构和组成。仅从理化性质表征可能不足以确证API的化学组成,因此建议仿制药申请人对交联中间体进行表征,推荐的研究包括13C SSNMR和玻璃化转变温度(Tg),具体可参照司维拉姆产品指南;此外,应对烷基化试剂随反应进行的消耗程度进行研究。
3.1.3 理化性质相同性研究API理化性质相同性研究包括以下内容:①13C SSNMR;②元素分析测定C、H、N、Cl和Br含量;③滴定法测定氯含量,确定质子化程度;④滴定法测定总可滴定胺;⑤滴定法测定溴含量;⑥粒径分布;⑦溶胀指数;⑧FT-IR和拉曼光谱;⑨DSC法测定玻璃化转变温度;⑩TGA。
3.2 体外研究
3.2.1 体外平衡结合研究该项研究是评估生物等效性的关键性研究。应将受试制剂和RLD在pH 6.8条件下采用酸预处理或不处理的方式,于至少8种不同浓度的总胆盐溶液中进行孵育,孵育介质总胆盐中应含有甘氨胆酸(GCA)、甘氨鹅去氧胆酸(GCDA)和牛磺脱氧胆酸(TDCA)。总胆盐浓度应分布合理直到达到最大结合。试验应该在37 ℃条件下进行。每一项结合试验应重复至少12次。此外应提供数据表明选择的孵育时间长度可使总胆盐产生最大结合。
3.2.2 体外动力学结合研究该项研究用以支持关键性的平衡结合研究。应将不经酸预处理的受试制剂和RLD,于2种不同浓度(0.3 mmol·L-1和3.0 mmol·L-1)的总胆盐溶液中孵育至少8个不同的时间长度。时间长度应分布合理直到达到最大结合。试验应该在37 ℃条件下进行。每一项结合试验应重复至少12次。
3.2.3 水和饮料条件下的体外平衡结合研究在37 ℃条件下将样品采用水、3种无糖软饮、3种弱酸性或中性果汁(葡萄柚汁除外)处理后,离心弃去上清液,然后对样品酸预处理或不处理,进行平衡结合研究,试验设计与“3.2.1”项下一致。
3.2.4 水和饮料条件下的体外动力学结合研究在37 ℃条件下将样品采用水、3种无糖软饮、3种弱酸性或中性果汁(葡萄柚汁除外)处理后,离心弃去上清液,进行动力学结合研究,试验设计与“3.2.2”项下一致。
3.2.5 数据分析检测滤液中未结合的胆盐,间接计算出与盐酸考来维仑结合的胆盐量。体外平衡结合研究及体外动力学结合研究需要进行数据分析的内容,以及生物等效性评价指标与碳酸司维拉姆相同(见“2.2.3”项下)。
3.3 讨论FDA盐酸考来维仑产品指南在2016年以后增加了API相同性研究要求,此前仅有体外结合研究要求。与碳酸司维拉姆类似,需要与从RLD中提取出来的API进行理化特性对比研究,除此之外还建议对交联中间体进行研究,从工艺过程控制方面对API相同性研究提出了更高的要求,同时也更能保证物质基础的一致性。盐酸考来维仑混悬剂可以水、果汁或无糖软饮送服,因此体外研究较片剂增加了水、3种无糖软饮、3种弱酸性或中性果汁(葡萄柚汁除外)前处理条件下的体外平衡结合研究和体外动力学研究。模拟临床应用条件,使得体外研究更加充分。
4 环硅酸锆钠
环硅酸锆钠(结构示意图见图4)用于治疗成人高钾血症。环硅酸锆钠是一种不可吸收的非聚合物无机粉末,具有均匀的微孔结构,优先捕获钾,置换出氢和钠。体外试验中,即便存在钙和镁等其他阳离子,环硅酸锆钠仍对钾离子具有高度选择性。环硅酸锆钠可在整个胃肠道中捕获钾离子,并降低胃肠腔中游离钾的浓度,从而降低血清钾浓度并促进粪便钾排泄以缓解高钾血症[14]。FDA 环硅酸锆钠口服混悬剂生物等效性指南首次发布于2020年,目前现行有效的版本为2021年8月发布[15]。推荐的研究内容包括一项API相同性研究,两项体外研究。
分子式:Na~1.5H~0.5ZrSi3O9·2-3H2O
4.1 API相同性研究环硅酸锆钠的结构如图4所示。API表征应包括范不限于化学组成、晶体结构、孔径、粒径分布、FT-IR、密度、TGA、DSC、钾交换能力。仿制药申请人应采用至少3批受试制剂与3批对照药进行背对背比较研究。
4.2 体外研究
4.2.1 体外平衡结合研究该项研究是评估生物等效性的关键性研究。应将受试制剂和RLD在pH 1.2、pH 4.5、pH 6.8条件下,于至少8种不同浓度的钾盐溶液中进行孵育。每个研究中应选择合适的钾盐浓度,以描绘吸附曲线,包括最大结合(即达到吸附平台)。试验应该在37 ℃条件下进行。每一项结合试验应重复至少12次。此外应提供数据表明选择的孵育时间长度能够满足吸附平衡条件。
4.2.2 体外动力学结合研究该项研究用以支持关键性的平衡结合研究。应将受试制剂和RLD在pH 1.2、pH 4.5、pH 6.8条件下,于至少3种浓度的钾盐溶液中孵育,包括平衡结合研究中的最高浓度、最低浓度、中间浓度(约50%最高浓度),每种条件下应该选择8个时间点直至24 h,包括达到结合平衡的时间,以充分描绘结合率曲线。试验应该在37 ℃条件下进行,并持续轻微振摇。每一项结合试验应重复至少12次。
4.2.3 数据分析检测滤液中未结合的钾盐,间接计算出与环硅酸锆钠结合的钾盐量。体外平衡结合研究及体外动力学结合研究需要进行数据分析的内容,以及生物等效性评价指标与碳酸司维拉姆相同(见“2.2.3”项下)。
4.3 讨论环硅酸锆钠通过与胃肠道中的钾结合而局部发挥其作用,不被全身吸收,从而使全身毒性的风险最小化或消除。采用离子阱技术,与现有高钾血症治疗方案相比,提高了捕获过量钾离子的能力、选择性和速度[16]。具有较明显的临床优势。环硅酸锆钠口服混悬剂为2018年FDA批准的新药,虽然上市时间较短,但推荐的体外BE研究方法已在多种药物指南中应用,FDA对于此类研究的评价具有较为丰富的经验。由于数据保护问题,国内外尚无仿制药上市。
5 总结
不同于一般小分子化合物,复杂仿制药需要进行API相同性研究,只有在满足API一致的前提下进行的BE研究才有意义。FDA硫糖铝产品指南在2019年修订时增加了API相同性要求,盐酸考来维仑产品指南在2016年修订时增加了API相同性要求,2022年发布了仿制药API相同性评估指南,FDA对API相同性研究的要求越来越明确。国内在此类药品研发和评价时也应给予足够重视。不同复杂仿制药对于API相同性评估的要求不同,根据复杂程度和结构特点等,可能需要从工艺路线和过程控制入手,并采用不同的结构确证分析手段与RLD进行多批次对比研究,使API的相同性得到保证。
对于胃肠道局部作用的药物,例如表3列举的11种药物,与磷酸盐、钾盐、胆盐等结合形成不溶性复合物随粪便排出以产生治疗效果,体外结合研究可以反映作用机制,已成为FDA比较成熟的体外BE研究方法。本文提及的胃肠道局部作用制剂硫糖铝,国内仿制药批准时间均约在2005年以前,推测未采用体外BE研究获得批准。2020年以后,国内已有采用体外BE试验获批的碳酸司维拉姆片,目前仍有多家仿制药在审。尽管如此,国内制药企业和监管机构对于此类体外BE研究和评价的经验仍有限,需要进行更深入的探讨,具体案例具体分析,科学地进行更多的探索和实践。
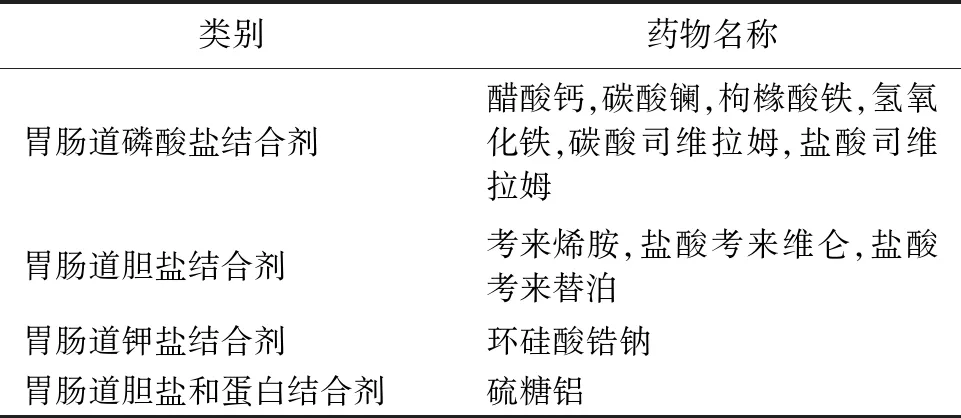
表3 FDA推荐采用体外结合研究的胃肠道局部作用药物[17]
复杂仿制药的研发面临较大的挑战,一方面由于仿制药企业缺乏相关经验,另一方面我国药品监管机构对复杂仿制药的研发缺少激励政策,且相关的技术要求和法规文件等发布滞后,使得国产复杂仿制药的可及性处于比较被动的状态。建议相关部门及时发布具有较大临床价值或专利即将到期等复杂仿制药清单,并制定和发布与之相应的特定产品指南,加强行业指导,体现科学监管理念;完善注册申请人与药品监管机构的沟通交流机制。另外,仿制药企业应结合市场需求制定合理的开发策略,及时跟进国内外监管机构发布的指南和法规文件,高质量研发,满足广大人民群众的用药需求。
