肿瘤中干细胞样T细胞的调控研究进展
2023-10-13陈玉梅杨勇
陈玉梅,杨勇
(1.中国药科大学药物科学研究院,江苏 南京 211198;2.中国药科大学基础医学与临床药学学院,江苏 南京 211198)
T细胞参与并维持机体免疫反应和免疫记忆的建立,是适应性免疫应答系统中抵御感染和维持内稳态的关键成分。T细胞起源于骨髓中的造血干细胞(HSCs),并在胸腺中发育成熟,随后输出到外周淋巴器官定居[1-2]。外周中的T细胞由不同发育阶段和功能的亚群组成,主要包括初始T细胞(TN)、细胞毒T细胞(CTL)、γδT细胞、辅助T细胞(Th)、调节T细胞(Treg)、效应T细胞(TEFF)和记忆T细胞(TM)等,它们在不断变化的生理或疾病过程中发挥着不同的作用[3]。近年来,在慢性感染[4]、肿瘤[5]、糖尿病[6]等疾病中报道了一类新型的T细胞亚群——干细胞样记忆T细胞(stem cell like memory T cells,TSCM),并发现了它在维持T细胞持续应答中的关键作用。
TSCM细胞是记忆T细胞早期分化阶段的一群异质性细胞亚群,兼有记忆性细胞和干细胞的特点。以往研究发现记忆T细胞自我更新的转录本特征与造血干细胞相似[7],从而提出了“记忆干细胞”这一概念。记忆干细胞(即TSCM细胞)首次被发现是在小鼠移植物抗宿主病(GVHD)的研究中[8]。然而,TSCM细胞产生的机制和分化途径仍有待完全阐明。
TSCM细胞在外周血中的比例很低。Gattinoni等[9]首次通过多色流式细胞术标记出健康人体外周血中的TSCM细胞亚群,约占所有循环CD8+和CD4+T淋巴细胞的2%~3%。而在慢性病毒感染的情况下,TSCMCD8+T细胞仅在淋巴组织中发现,在淋巴结中频率最高,脾脏中数目最多[4]。近期的一项研究发现,肾癌和其他泌尿系统癌症患者的肿瘤组织内也检测到了TSCM细胞,并且这群细胞大多位于肿瘤内抗原提呈细胞生态位(APC niche)中,说明肿瘤内形成的特定生态位可作为免疫生发中心,这对维持TSCM细胞产生持久的免疫治疗反应至关重要[5]。
本文综述了TSCM亚群的分化来源和功能特征,同时关注人体不同生态位中TSCM的作用以及维持T细胞干性的潜在调控机制。基于TSCM细胞自身的自我更新能力、增殖能力和长久的持续性等,有望在癌症免疫治疗中发挥临床应用价值。
1 TSCM的分化与表型
血液、淋巴和肿瘤组织中存在的记忆T细胞在肿瘤免疫中发挥了重要作用[10]。记忆T细胞群体具有异质性,分为中央记忆(TCM)、效应记忆(TEM)、组织驻留记忆(TRM)和干细胞样记忆T(TSCM)细胞4个亚群[11]。在抗原依赖途经下人记忆T细胞的发育路径为TN→TSCM→TCM→TEM。TSCM细胞是TCM细胞和TEM细胞的前体细胞,具有很强的扩增和自我更新能力,并能在体内长时间存活[12]。当机体遇到抗原再次刺激时,TSCM可以迅速分化为TCM和TEM,TEM细胞进一步分化为效应细胞,从而对抗原做出免疫应答。TSCM和TN细胞共有一些表型如CD45RA和CCR7,但它又具有CD95和IL-2Rβ等区别于TN的一些表面标志物。同时它们还高表达趋化因子受体CXCR3和淋巴细胞功能相关抗原LFA-1[9]。随着记忆T细胞分化程度的增加,与TSCM和TN不同的是,TCM和TEM细胞逐渐丢失CD45RA这一表征幼稚T细胞的标记物,而上调CD45RO分子[13]。TCM与TN细胞相似,仍表达CCR7和CD62L,而分化程度更高的TEM则丢失了这两个分子[14]。以上几种记忆T细胞的表型详见表1。
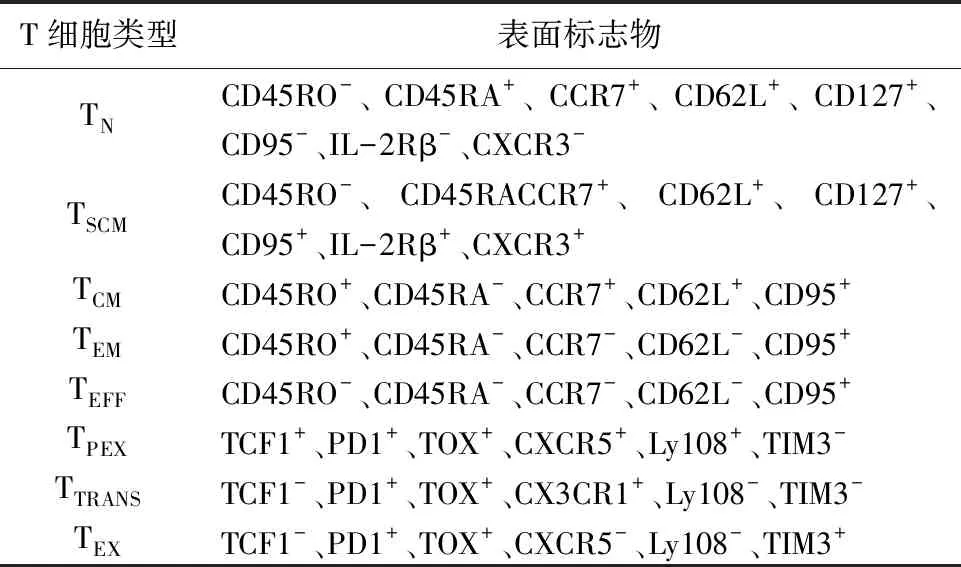
表1 几种不同的人T细胞亚群及其特征性表面标志物
总之,TSCM是唯一一群具有干细胞特性的记忆细胞,位于T细胞分化层次树的顶端。研究人员纵向追踪了接受单倍型造血干细胞移植(HSCT)患者的TSCM动态,检测到供体来源的TSCM在HSCT后早期高度富集。在抗原特异性、克隆水平和TCR测序多个层面中发现,TSCM细胞可以直接由移植细胞的前体分化而来,并且能够重建HSCT后的免疫记忆多样化的分化景观[15-16]。不仅如此,TSCM细胞还高表达Wnt信号通路相关的基因如Prickl1、Kit、Sox4、Lef1[4],这些基因已知与细胞的自我更新和造血干细胞的维持有关。这些证据共同表明TSCM是直接由TN细胞产生,具有长期的自我更新能力和多能性的干细胞样T细胞。
然而,在慢性病毒感染以及恶性肿瘤情形下,由于抑制性免疫微环境和持续的抗原刺激,激活后的T细胞通常被认为丢失了记忆分化的潜力,它们只能先分化为耗竭程度较低的耗竭前体细胞(progenitor of exhausted T cells,TPEX)[17]。这些耗竭前体T细胞具有和TSCM细胞类似的增殖和分化潜能,但又与典型的循环TSCM有所不同[18]。TSCM细胞在转录因子TOX参与的表观遗传调控下分化成为TPEX,继而分化成短暂性耗竭T细胞(TTRANS),最终产生终末耗竭T细胞(TEX)[17,19]。以上这些发现揭示了TSCM与耗竭T细胞之间的关系,TSCM与几种耗竭T细胞的表型总结见表1。
2 TSCM群体存在于特定的生态位中
2.1 淋巴结中的TSCM干细胞生态位在调节干细胞命运和组织稳态中起着重要作用。TSCM细胞显示出对淋巴组织的趋向性,但TSCM细胞生态位的完整解剖特征仍有待解决。生理条件下,骨髓中的生态位能够维持记忆性T细胞再循环[20],但目前还不清楚骨髓是否起到了支持TSCM细胞的作用。而机体在感染时产生的抗原特异性记忆T细胞大多定居在外周淋巴组织如脾脏和淋巴结中。2016年研究者们相继发现并鉴定出慢性病毒感染中位于淋巴组织内的具有干细胞潜能的耗竭前体T细胞[17,21]。这群CXCR5+CD8+TSCM细胞主要位于淋巴结的内皮层区(也被称为T细胞区),而非富含滤泡辅助性T(TFH )细胞和B细胞的外皮层区[4]。同时,内皮层中存在许多基质细胞,如成纤维细胞网状细胞(FRCs)以及树突状细胞(DCs)与TSCM相互作用来维持淋巴结的稳态[22]。肿瘤引流淋巴结(TDLN)是肿瘤特异性T细胞的储存库,能够驱动T细胞不断浸润到原发肿瘤中。在多种肿瘤模型中检测到了TDLN中存在着一群干细胞样的肿瘤引流淋巴结抗原特异性记忆CD8+T细胞(TDLN-TTSM),这群细胞在肿瘤进展过程中是稳定存在的[23]。研究者通过一系列肿瘤移植实验和淋巴结切除实验发现,TDLN-TTSM细胞呈现出显著优于TPEX及TEX的响应ICB疗法和抑制肿瘤的能力[24]。表明TDLN是TSCM细胞的生发中心,在肿瘤发展过程中维持了抗肿瘤T细胞反应持续存在。
2.2 肿瘤微环境中的TSCM近年来,许多研究表明TSCM细胞存在于肿瘤中的三级淋巴结构(tertiary lymphoid structures,TLSs)当中。TLSs是指个体出生后体内形成的位于非淋巴组织的组织性免疫细胞聚集结构。TLSs已在乳腺癌、结肠直肠癌、肺癌、肝细胞癌和胰腺癌等多种癌症中被发现[25]。在具有丰富TLSs的转移性黑色素瘤中检测到了更多的TCF1+T细胞,并与肿瘤的高生存率成正相关[26]。这提示我们肿瘤TLSs的存在与免疫治疗后更好的预后相关,可能是其中存在的TCF1+TSCM细胞做出了突出贡献,但TLSs以及TSCM形成的驱动因素仍不完全清楚。最近有研究发现了肾细胞癌患者中的肿瘤内密集的APC生态位。与TLS不同的是,APC生态位是含有超过5个MHCII+APC细胞的密集小区域。这些区域中同样分布着肿瘤反应性TCF-1+TSCM细胞,以保留TSCM细胞广泛浸润肿瘤的能力[5]。APC生态位结构的存在在控制肿瘤进展方面发挥着关键作用,但关于APC生态位构造是否是TLSs形成的早期阶段仍然有待研究。
3 TSCM具有强大而持久的抗肿瘤作用
在慢性病毒感染或癌症中抗原的持续性刺激下,CD8+T细胞会进入一种“耗竭”状态从而不能有效清除病原体[27]。TEX细胞表面持续表达免疫抑制性分子如PD-1[28],靶向免疫抑制性分子的抗体或小分子抑制剂在治疗多种类型的癌症中取得了成功[29]。遗憾的是,并非所有的肿瘤类型都对PD-1治疗敏感,甚至敏感肿瘤类型的患者临床响应率也不高[30]。因此,提高PD-1阻断疗法的响应人群及临床治愈潜力亟须对T细胞响应作用机制的更深入理解。
许多研究已经证实,肿瘤中的TEX群体具有异质性,这可能是导致PD-1治疗复杂化的一个因素。TEX并不是由末端效应T细胞分化而来,而是由耗竭前体祖细胞(TPEX)分化形成[31]。在持续的激活信号之下,TPEX进一步形成终末耗竭T细胞[32]。终末耗竭T细胞处于功能严重失调状态,并不能对PD-1治疗产生应答[33]。相反,TPEX才是响应ICB疗法而产生抗肿瘤作用的主要细胞群体[34]。TPEX细胞表现出自我更新以及干细胞样特性[17],能够提供长久的免疫应答增强T细胞抗肿瘤效应。然而,TPEX细胞在肿瘤组织中的浸润数目极低[4],在慢性感染后期其记忆潜能受到很大损害[31]。最新研究表明,响应PD-1免疫检查点治疗的细胞主要来源于肿瘤组织外部新补充的CD8+T细胞克隆[35],受到PD-1阻断抗体作用而产生爆发增殖的T细胞可能是一种系统性的作用,而不是TME局部性的CD8+T细胞应答[36]。总之,以上研究充分证明了TSCM细胞所具有的强大的抗肿瘤功能,也提示我们靶向、动员肿瘤或引流淋巴结中的TSCM细胞可以充分发挥PD-1疗法的抗肿瘤作用。
4 诱导与维持TSCM的调控策略
4.1 细胞因子调控细胞因子作为T细胞功能的重要参与者,在TSCM细胞的维持中发挥着重要作用。细胞因子IL-2 是T细胞的生长因子,对T细胞的增殖至关重要。然而,高水平的IL-2降低了TCM细胞的产生,适当减少IL-2浓度是促进早期记忆T细胞分化的一种方法[37]。研究发现,IL-15可以维持T细胞的记忆特征而抑制分化,使用IL-15和IL-7结合CD3/CD28抗体培养的TN细胞可以分化形成TSCM细胞[38]。在IL-15存在的情况下,T细胞显示出糖酵解酶表达降低和线粒体适应性增强的干性表型,这是由IL-15介导的mTORC1活性降低造成的[39]。此外,IL-21也能促进TSCM细胞的生成,IL-21诱导产生的TSCM在保留Tcf7、Lef1和CD62L表达的同时能够维持IL-2。通过激活JAK信号和STAT3磷酸化,从而促进了T-bet的表达同时抑制Eomes和GATA3的表达[40]。IL-10-IL-21-STAT3信号通路对于急性LCMV感染后的记忆性T细胞的发育至关重要[41]。综上,细胞因子对TSCM细胞的产生具有重要作用,采用恰当的重组细胞因子或抗体组合,可以在一定程度上阻滞T细胞的终末分化从而保证干性细胞的产生,这在T细胞过继免疫治疗中具有实际意义。
4.2 转录因子调控TCF1不仅是TSCM细胞的干性标志物,同时是调控T细胞干性的一个关键转录因子。在慢性病毒感染期间,TCF1缺失导致TPEX细胞的产生缺失[17]。在急性感染期间,抗原特异性CD8+T细胞分化为IL-7RaloKLRG1hi的末端效应细胞和IL-7RahiKLRG1lo的记忆前体细胞。TCF1缺陷小鼠能够产生正常的效应T细胞反应,但在急性感染高峰时CD8+TM细胞缺失[42];这表明TCF1调控CD8+TM细胞的干性和命运。在机制上,TCF1抑制Blimp1、Tim3同时诱导转录抑制因子Bcl6的表达,从而促进了祖细胞的命运。Bcl6在CD4+和CD8+T细胞分化、存活和长期记忆形成中发挥着重要作用[43],TCF1-Bcl6轴的相互作用维持了肿瘤中TSCM细胞的存在[44]。
BACH2是bZip TF家族的一个转录抑制因子,参与了病毒感染后CD8+TM细胞的分化。BACH2通过与AP-1蛋白的增强子位点结合,调节AP-1对Jun家族参与的信号调控,从而在一定程度上阻止了TCR信号驱动的终末分化基因的表达,使病毒感染后能够产生长寿的记忆细胞[45]。单细胞转录组学和表观基因组学分析显示,BACH2抑制了驱动耗竭的分子程序,建立了TSCM细胞独特的转录和表观遗传程序[46]。通过过表达BACH2,促使CD8+T细胞向干细胞命运的分化,从而维持了TSCM细胞强大的抗肿瘤效应。
转录因子MYB对TPEX细胞的发育和维持至关重要。在LCMV-Cl13感染小鼠中检测到,Myb基因在一群CD62L+PD-1+TIM-3loCD8+TPEX细胞中特异性富集,并且PD-1检查点抑制引起的T细胞增殖爆发几乎全部来自这群TPEX细胞并依赖于MYB[47]。在机制上,MYB作为Tcf7的转录激活因子来增强记忆发育,同时MYB也是Zeb2的抑制因子来阻碍效应器的分化[48]。以上研究充分说明了MYB可能是调控T细胞干性的关键性转录因子。
综上,随着对肿瘤中T细胞分化及耗竭的深入研究,许多参与调控T细胞命运的关键转录因子逐渐被揭示。抑制T细胞耗竭并维持其干性,对于CD8+T细胞的持续抗肿瘤应答至关重要。通过增强TSCM相关转录因子将TEX转化为再生的TSCM细胞,从而抑制T细胞耗竭,这可能是增强T细胞功能的一条开创性途径。
4.3 信号通路和代谢调控干细胞需要在自我更新和分化二者之间维持平衡。在这一过程中,许多信号通路参与促进了TSCM细胞的自我更新和分化。STAT3信号在记忆T细胞形成和维持中发挥作用,可能是通过诱导KLF促进细胞静止和淋巴归巢分子的表达来限制T细胞分化[49]。近期的许多研究发现了STAT3信号通路可以由一些细胞因子包括IL-6、IL-10和IL-21诱导激活,从而抑制TEFF的分化和衰竭,促进TSCM细胞的生成[41]。YAP是AKT和Hippo通路负调控的转录共激活因子,可以通过增强ID蛋白表达促进干细胞的自我更新[50],并通过与转录因子TEA结构域的结合,诱导LIF下游的YES-YAP-TEAD2信号响应[51]。YAP亚型的异位表达维持了IL-7Rα+KLRG1-记忆前体T细胞的形成[52],但YAP是否能够增强干细胞转录调控因子的表达还有待进一步研究。
Wnt-β-catenin通路是促进造血干细胞自我更新和多能性的一条信号途径。Wnt信号通路激活后,下游的β-catenin降解被抑制从而在细胞质中积累,随后转移到细胞核中TCF-1/LEF1转录因子结合,从而促进TCF-1的表达。研究发现,Wnt-β-catenin通路对记忆CD8+T细胞的形成和长期维持至关重要[53]。使用GSK3β抑制剂触发Wnt-β-catenin信号激活可以抑制TN向TEFF细胞的分化,同时促进TSCM细胞的产生[54]。
越来越多的证据表明,代谢调控对T细胞分化有着重要影响。与TN、TM细胞类似,TSCM细胞主要依靠脂肪酸氧化(FAO)来满足其相对较低的能量供应[55]。降低的ATP/AMP比值会激活AMPK并抑制mTOR信号传导[56]。在TCR活化信号和细胞因子的作用下,PI3K-AKT-mTOR信号通路调控T细胞向有氧糖酵解转化以支持其增殖和效应功能[57]。使用PI3K、AKT或mTOR的抑制剂都可以增强肿瘤特异性记忆T细胞的扩张,使T细胞向TSCM细胞分化[55,58]。此外,在T细胞激活过程中使用糖酵解抑制剂可以增强TM细胞的生成;体外短暂抑制乳酸脱氢酶(LDH)联合IL-21促进了TSCM细胞的形成,在过继细胞治疗中产生了更强的抗肿瘤反应[59]。
4.4 表观遗传调控在免疫应答过程中,T细胞经历了显著的表观遗传重编程[60]。DNA甲基化和组蛋白翻译后修饰这两种主要的表观遗传机制对调节干性CD8+T细胞的分化至关重要。在CD8+T细胞分化过程中,组蛋白修饰的分布和积累发生了渐进式的变化[61]。CD8+TM中记忆相关基因的表达呈现出与H3K4me3水平正相关,与H3K27me3水平负相关的普遍联系。在小鼠和人类中进行的多项研究中发现,组蛋白修饰参与调控许多干性相关基因(如Tcf7、Sell和Ccr7)的染色质开放性与转录活性[60]。组蛋白甲基转移酶SUV39H1参与H3K9me3的发生,研究发现Suv39h1基因缺失的CD8+T细胞H3K9me3受损,在终末效应细胞分化过程中不能沉默干性基因,从而增强了T细胞干性和记忆重编程能力[62]。PRC2是H3K27甲基化的调控因子,PRC2的一个关键催化亚基是EZH2。研究发现在病毒感染期间CD8+T细胞向效应分化过程中,H3K27me3在许多干性和记忆基因上富集。Ezh2的缺失损害了终末效应细胞的分化[63]。
DNA甲基化通常会抑制细胞中的基因表达。通过分析正常和自身免疫反应中的全基因组DNA甲基化,Abdelsamed等[64]建立了人CD8+T细胞分化的全基因组甲基化图谱,并观察到DNA甲基化CpG岛总数与细胞分化状态呈负相关:TN>TSCM> TCM>TEM。在记忆CD8+T细胞向效应转换的过程中,DNA甲基化的重塑在新生效应细胞中不断活跃发生。具体体现在,TSCM细胞增殖产生TCM和TEM过程中,Ccr7和Tcf7启动子位点的DNA甲基化增加,同时伴随着TCF1蛋白表达水平的下降。在1型糖尿病(T1D)患者中,研究人员建立了基于DNA甲基化的T细胞“多能指数”,并发现β细胞特异性CD8+T细胞保留了类似干细胞的表观遗传多能性。这项研究开拓了基于甲基化的新型多能性指数在研究CD8+T细胞分化中的应用[65]。
5 靶向TSCM在肿瘤免疫治疗中的应用
TSCM细胞因其强大的自我更新、增殖潜力和抗肿瘤能力,已经成为肿瘤免疫治疗领域的研究热点,靶向TSCM为肿瘤免疫治疗提供了全新的策略和方案。目前已经有许多TSCM细胞的研究应用到过继细胞疗法(ACT)当中,显示出长期持久的抗肿瘤治疗作用。研究检测到体外培养的基因编辑TSCM可在体内存活长达12年并具有良好的安全性[66]。在恶性B细胞瘤患者中,CD8+CD45RA+CCR7+TSCM细胞的频率与CD19+CAR-T细胞回输后的持续扩增相关[67]。但TSCM细胞在循环血液中的频率很低,需要通过各种方法诱导其产生以更好地应用于临床。采用IL-7和IL-15培养人外周血中的TN细胞是产生TSCM细胞的一种方法,可以结合嵌合抗原受体(CAR)编辑、TCR基因编辑来产生病毒特异性或肿瘤特异性的TSCM细胞[68]。一项有关B细胞淋巴瘤的CART临床试验(NCT02652910)数据表明,IL-7和IL-15能够选择性地扩增出具有不同记忆表型的TSCM细胞。使用CD3/CD28抗体短期激活(2 h)CD30-CAR T细胞后添加IL-7、IL-15和IL-21培养能够产生更多的CD30-CAR TSCM细胞;接受高比例TSCM细胞治疗的小鼠具有显著的生存优势[69]。此外,体外重塑CART细胞的代谢表型也是维持TSCM细胞持久性的一条途径。使用GSK-3β抑制剂TWS119联合IL-7、IL-21处理CD19 CART细胞,可以将CD8+CD62L+CD45RA+TN细胞诱导为TSCM细胞,这群细胞具有典型的低糖酵解和高备用呼吸能力的代谢特征,在体内表现出强大的代谢适应性和优越的抗肿瘤反应[70],目前相关产品正在进行针对淋巴瘤的临床Ⅰ期试验(NCT01087294)。在实体瘤的治疗上,使用环磷酰胺结合IL-21诱导TSCM细胞过继回输治疗黑色素瘤患者初步表现出良好的临床效果(NCT01106235),但仍需进一步的数据支持。靶向实体瘤的TSCM-CAR-T疗法能否成功增加T细胞向肿瘤部位的运输和浸润,促进肿瘤中T细胞的增殖,是未来研究领域内极具挑战性的方向。
6 总结与展望
TSCM细胞具有自我更新和多重分化潜能,同时具有记忆样特征,以TSCM细胞为主体的免疫治疗将是未来癌症临床治疗的一个新方向。然而,关于TSCM细胞维持其干性表型的分子调控机制仍未完全明晰。TSCM细胞在经过抗PD-1抗体治疗后产生的“爆发性”增殖极大程度上促进了T细胞的免疫反应,对ICB疗法具有重要意义。因此利用TSCM细胞放大免疫检查点抑制剂的作用从而增强疗效是未来优化ICB疗法可行的策略;此外,通过体外诱导和培养以获得临床适用的TSCM细胞进行过继转移也是未来临床应用的一个方向,但是如何获得足够数量级的TSCM细胞用于患者的治疗,同时产生稳定、安全的抗肿瘤作用是一个亟须突破的技术问题。因此,还需要更多的研究来阐明肿瘤微环境及生态位对TSCM细胞的影响,以助于TSCM细胞更好地靶向肿瘤部位来发挥抗肿瘤作用。相信随着对T细胞分化的深入了解,以及细胞培养、测序技术和基因编辑技术的发展,未来对TSCM细胞的研究将进一步深化。
