加味三黄膏治疗大鼠肛门溃疡和肿胀的药效机制研究 Δ
2023-10-09张馨月李胜楠杨亦柳李文杰严铭铭长春中医药大学人参科学研究院长春中医药大学药学院长春307吉林省中药保健食品科技创新中心长春307
张馨月 ,于 倩 ,李胜楠 ,杨亦柳 ,李文杰 ,陈 越 ,严铭铭 , (.长春中医药大学人参科学研究院/长春中医药大学药学院,长春 307;.吉林省中药保健食品科技创新中心,长春 307)
痔疮是临床常见的肛肠科疾病,病灶位于肛门部位,其常见症状包括肛门溃疡、直肠肿胀等,具有较高的发病率,任何年龄段均可发生,严重影响患者的生活质量[1]。有研究认为,痔疮的发病原因包括肛管下黏膜静脉曲张、肛管部位静脉瓣因压迫导致静脉回流障碍等[2]。临床常用的治疗方法有药物治疗、门诊手术治疗和外科手术治疗,但手术治疗容易损伤肛门周围括约肌,而致患者大便失禁,术后肛门口疤痕挛缩,严重者可致肛门狭窄、排便困难[3—4]。
三黄膏始载于《医心方》,原方由大黄、黄连、黄芩3味药材组成,本研究在此基础上加入地榆、冰片2 味药材,其中地榆具有凉血止血、清热解毒、培清养阴、消肿敛疮的功效,冰片用于治疗疮疡肿痛、溃后不敛。5味药材均有清热燥湿、泻火解毒的功效,共奏清热凉血、解毒消肿之功。临床研究表明,三黄膏能有效减轻患者的痔疮水肿,缓解疼痛,同时对患者术后肛门疼痛、出血、瘢痕形成等有明显的改善和预防作用[5],但其作用机制尚不明确。本研究利用冰醋酸和巴豆油建立大鼠肛门溃疡和肿胀模型,对加味三黄膏治疗模型大鼠的药效机制进行研究,旨在为阐明加味三黄膏治疗痔疮的作用机制提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括AB265-S 型十万分之一分析天平(瑞士Mettler Toledo 公司)、CP223C 型电子天平(美国OHAUS 公司)、INFINITE M200PRO 型多功能酶标仪[美谷分子仪器(上海)有限公司]、CX23型光学显微镜(日本Olympus 公司)、DT5-2B 型低速台式离心机(北京时代北利离心机有限公司)等。
1.2 主要药品与试剂
黄连、大黄、黄芩、地榆、冰片饮片均购自长春宏检大药房,经长春中医药大学药学院姜大成教授鉴定均为真品;兔瞬时受体电位通道V1(transient receptor potential channel V1,TRPV1)抗体、兔P 物质抗体、辣根过氧化物酶标记的山羊抗兔IgG(H&L)抗体、免疫组化试剂盒(批号分别为bs-23926R、bs-0065R、bs-40295G-HRP、IHC001)和苏木精-伊红(HE)染液均购自北京博奥森生物技术有限公司;马应龙麝香痔疮膏(批号210235,规格10 g/支)和复方角菜酸酯乳膏(批号LCJ9275,规格20 g/支)均购自长春宏检大药房;白细胞介素2(interleukin-2,IL-2)、IL-4、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)酶联免疫吸附试验(ELISA)检测试剂盒均购自上海优选生物科技有限公司;伊文思蓝购自上海麦克林生化科技股份有限公司;其余试剂均为分析纯。
1.3 动物
健康成年SD雌性大鼠,8~10周龄,体重(210±10)g,购自宏达生物科技有限公司,生产许可证号为SCXK(辽)2020-0001。所有大鼠于温度(24±2)℃、相对湿度(60±10)%的环境下适应性喂养1周后进行实验。动物实验通过长春中医药大学实验动物伦理委员会批准,批准号为2021218。
2 方法
2.1 不同剂量加味三黄膏的制备
按照相关文献方法[6]和前期预实验结果进行制备:取大黄、黄芩、黄连各5.0 g,酌予断碎,加入米醋没过药材,浸泡过夜;锅中加入80 g猪油预热,将上述药材同置锅中炸枯,去渣,滤过得药油;取1.0 g 冰片与2.5 g 地榆粉末(过120目筛),置于药油中,加入适量蜂蜡混匀,冷却至室温,即得药膏50 g,作为中剂量加味三黄膏。同法制备低、高剂量加味三黄膏(5味药材的取样量分别为中剂量的1/2和2倍)。
2.2 大鼠肛门溃疡实验
2.2.1 分组、建模与给药
取大鼠70只,随机取10只作为空白组,其余大鼠按照相关文献方法[7]建立肛门溃疡模型:将经99%冰醋酸溶液充分浸泡的滤纸片(直径6 mm)置于大鼠肛门,使滤纸片紧密接触肛周皮肤及黏膜,并于40 s 时更换1 次滤纸片,80 s时取下滤纸片。根据前期预实验结果,为了防止模型大鼠死亡,将造模成功且体重排名前10位的大鼠作为模型组,其余造模成功的大鼠随机分为中药阳性对照组(马应龙麝香痔疮膏1 g/kg)[8]、西药阳性对照组(复方角菜酸酯乳膏,按照人鼠体表面积换算药物剂量为1 g/kg)[9]和加味三黄膏低、中、高剂量组(185、370、740 mg/kg),每组10 只。各给药组大鼠每天在肛门内2 cm处涂抹相应药物1次,连续给药15 d。
2.2.2 指标考察
分别于给药前(第0 天)及给药第6、9、11、13、15 天称量各组大鼠体重,计算体重增加量;观察肛门溃疡情况,测量肛门溃疡的最大直径,并计算溃疡面积:溃疡面积(mm2)=π×(溃疡面最大直径/2)2;同时参考相关文献方法[10],根据溃疡面积大小、炎症液体渗出情况和肛周肿胀情况对给药第15 天的大鼠进行肛门溃疡等级评价:+++表示有大量炎症液体渗出,溃疡面积大于35 mm2,肛门边缘为暗红色,红肿隆起大于1.3 mm;++表示有较多炎症液体渗出,溃疡面积为25~35 mm2,肛门边缘为红色;+表示有少量炎症液体渗出,溃疡面积为15~<25 mm2,肛门边缘为淡粉色。
2.3 大鼠直肠肿胀实验
2.3.1 分组、建模与给药
取大鼠70只,随机取10只作为空白组,其余大鼠按照相关文献方法于肛门内注入巴豆油混合液(蒸馏水、吡啶、乙醚、6%巴豆油按体积比1∶4∶5∶10 混合[11])造成大鼠直肠黏膜水肿,以建立直肠肿胀模型,直肠在接触巴豆油6 h 后达到肿胀峰值[12]。根据前期预实验结果,为了防止模型组大鼠死亡,将建模成功且体重排名前10 位的大鼠分为模型组,剩余大鼠随机分为中药阳性对照组(马应龙麝香痔疮膏1 g/kg)[8]、西药阳性对照组(复方角菜酸酯乳膏,按照人鼠体表面积换算药物剂量为1 g/kg)[9]和加味三黄膏低、中、高剂量组(185、370、740 mg/kg),每组10只。各给药组大鼠在直肠接触巴豆油6 h时,在肛门内2 cm处涂抹相应药物1次,4 h后第2次涂抹相应药物。
2.3.2 大鼠血清中炎症因子含量和直肠肛门肿胀率的检测
取大鼠70 只,按“2.3.1”项下方法分组、建模、给药。第2次给药后2 h取血,根据试剂盒说明书操作,使用酶标仪检测各组大鼠血清中IL-2、IL-4、TNF-α 含量;然后处死大鼠,从肛门起取向上15 mm 长的直肠,即从肛门皮毛边缘起剪切,修剪肛门皮毛及直肠周围结缔组织后称重,即得直肠湿重;将取出的直肠置于80 ℃恒温干燥箱中干燥16 h,再次称重,即得直肠干重,按下式计算大鼠直肠肛门肿胀率:直肠肛门肿胀率=(直肠湿重-直肠干重)/直肠湿重×100%。
2.3.3 大鼠直肠组织病理形态观察
另取大鼠70 只,按“2.3.1”项下方法分组、建模、给药。第2次给药后2 h处死大鼠,从肛门起取向上15 mm长的直肠,剔除直肠周围结缔组织,用生理盐水漂洗、滤纸吸干水分。将大鼠直肠组织固定于多聚甲醛中,用HE 染色,在光学显微镜下观察各组大鼠直肠组织病理形态变化。
2.3.4 大鼠直肠组织中TRPV1和P物质表达的检测
另取大鼠70 只,按“2.3.1”项下方法分组、建模、给药,按“2.3.3”项下方法取直肠组织,并固定于多聚甲醛中,然后切片、脱蜡、水化、热修复处理,并用磷酸盐缓冲溶液(PBS)清洗后,加入兔TRPV1 抗体、兔P 物质抗体(稀释比例均为1∶200),孵育1 h,再用PBS清洗,加入二抗(稀释比例为1∶500),孵育20 min,最后用PBS 清洗,加入二甲基联苯胺染色及苏木精复染,经乙醇脱水至透明后,用中性树胶封片,即得。用显微镜观察并采集图片,每张切片各选5 个不同视野,采用Image J 软件分析阳性表达(棕黄色)的平均光密度(optical density,OD)值。
2.3.5 大鼠直肠血管通透性的检测
取250 mg 伊文思蓝,置于10 mL 容量瓶中,用甲酰胺完全溶解均匀,得伊文思蓝标准品溶液。取上述伊文思蓝标准品溶液,用甲酰胺稀释至不同浓度,使用酶标仪于620 nm 波长处测定OD 值。以浓度为横坐标(x)、平均OD值为纵坐标(y)绘制标准曲线,求得伊文思蓝的回归方程y=0.125 5x+0.033 4(R2=0.999 7)。
另取大鼠70 只,按“2.3.1”项下方法分组、建模、给药。在直肠水肿达到肿胀峰值前30 min(即直肠接触巴豆油后5.5 h),按20 mg/kg剂量尾静脉注射含1%伊文思蓝的生理盐水,4.5 h 后(即第2 次给药后)处死大鼠,于肛门皮毛边缘取15 mm长的直肠,置于0.5 mL甲酰胺溶液中,于45 ℃恒温水浴72 h 后称重,并使用酶标仪在620 nm 波长处测定样本浸泡的甲酰胺溶液的OD 值。根据伊文思蓝回归方程计算各样本中所含伊文思蓝的质量,再按下式计算各组大鼠直肠血管通透性:血管通透性=伊文思蓝质量(µg)/直肠质量(g)。
2.4 统计学方法
3 结果
3.1 大鼠肛门溃疡实验结果
3.1.1 大鼠体重变化
与空白组同时间点比较,模型组大鼠从给药第6 天起体重增加量均显著降低(P<0.01);与模型组同时间点比较,各给药组大鼠体重增加量整体呈现升高趋势,其中,加味三黄膏低剂量组从给药第13天起,加味三黄膏中、高剂量组从给药第9天起,中、西药阳性对照组从给药第15 天起体重增加量升高趋势显著(P<0.05 或P<0.01)。结果见图1。
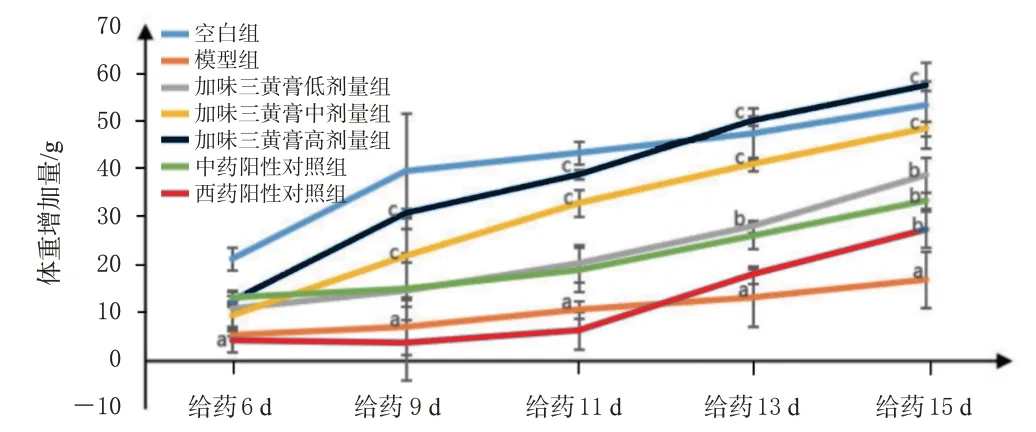
图1 加味三黄膏对肛门溃疡模型大鼠体重的影响(±s,n=10)
3.1.2 大鼠肛门溃疡面积变化
与空白组比较,模型组不同时间点大鼠的肛门溃疡面积均显著增加(P<0.01);与模型组比较,各给药组不同时间点大鼠的肛门溃疡面积均减小(除加味三黄膏高剂量组0 d外),其中加味三黄膏各剂量组大鼠从给药第6 天起、西药阳性对照组大鼠从给药第13 天起、中药阳性对照组大鼠从给药第15 天起肛门溃疡面积均显著减小(P<0.05或P<0.01)。结果见表1。
表1 加味三黄膏对肛门溃疡模型大鼠肛门溃疡面积的影响(±s,n=10,mm2)

表1 加味三黄膏对肛门溃疡模型大鼠肛门溃疡面积的影响(±s,n=10,mm2)
-:无溃疡;a:与空白组比较,P<0.01;b:与模型组比较,P<0.05;c:与模型组比较,P<0.01。
组别空白组模型组加味三黄膏低剂量组加味三黄膏中剂量组加味三黄膏高剂量组西药阳性对照组中药阳性对照组给药0 d-62.20±6.24a 56.19±4.45 59.93±2.65 63.11±6.35 60.28±4.54 61.39±4.77给药6 d-58.13±6.77a 47.51±5.28b 47.22±4.58b 46.18±6.06c 51.67±5.68 53.14±5.05给药9 d-50.18±4.58a 41.41±3.22b 42.16±5.26b 37.69±4.72c 46.87±5.32 46.78±4.84给药11 d-46.31±5.86a 38.14±4.74b 36.14±2.64b 30.46±3.28c 40.45±5.01 41.64±3.93给药13 d-43.43±5.56a 35.24±4.16b 28.54±4.53c 22.65±6.65c 35.23±2.53b 36.11±2.53给药15 d-39.61±8.43a 30.53±5.23c 21.75±3.86c 15.64±3.75c 28.45±5.32c 30.56±5.87b
3.1.3 大鼠肛门溃疡等级变化
与模型组比较,各给药组大鼠肛门溃疡等级均降低,其中加味三黄膏各剂量组改善效果优于西药阳性对照组和中药阳性对照组。结果见表2。

表2 加味三黄膏对肛门溃疡模型大鼠肛门溃疡等级的影响(n=10)
3.2 大鼠直肠肿胀实验结果
3.2.1 大鼠血清中IL-2、IL-4和TNF-α含量变化
与空白组比较,模型组大鼠血清中IL-2、IL-4 和TNF-α 含量均显著升高(P<0.01)。与模型组比较,西药阳性对照组、中药阳性对照组和加味三黄膏各剂量组大鼠血清中IL-2、IL-4 和TNF-α 含量均显著降低(P<0.05或P<0.01)。结果见图2。
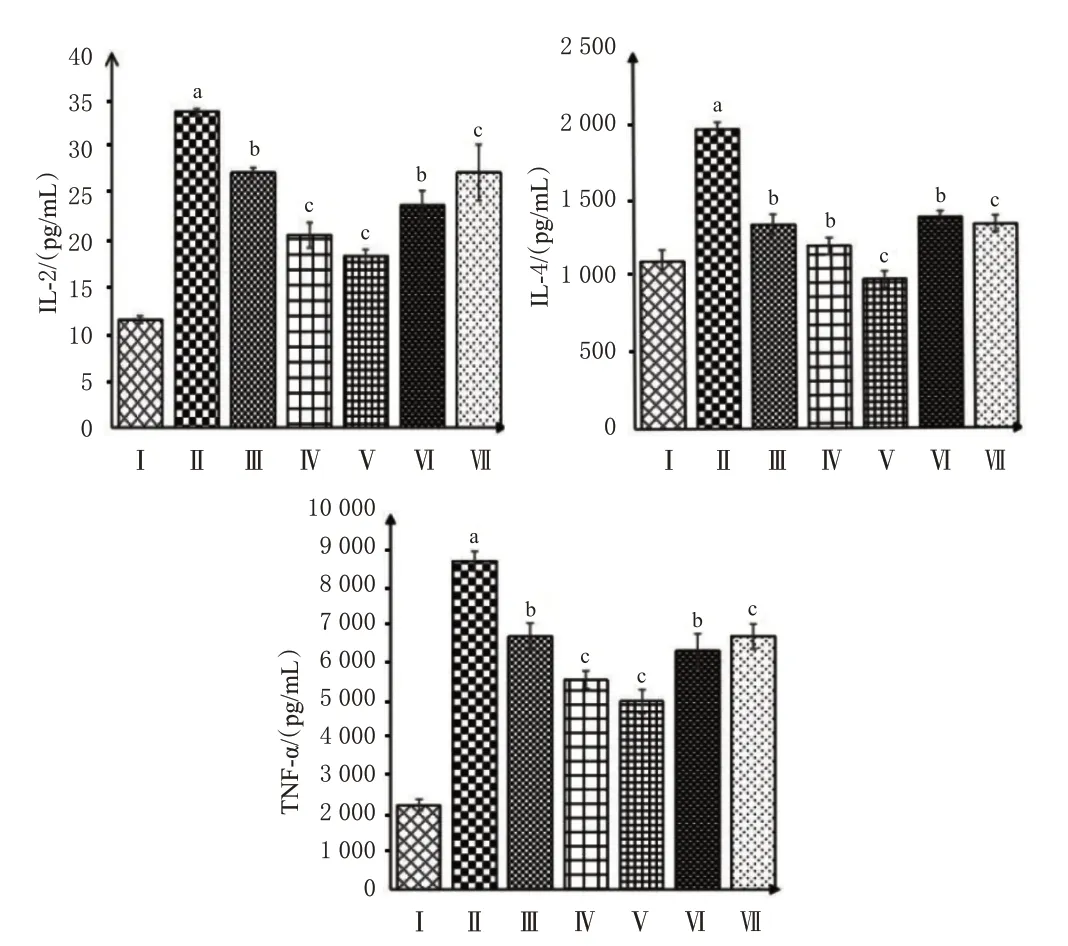
图2 加味三黄膏对直肠肿胀模型大鼠血清中IL-2、IL-4和TNF-α含量的影响(n=10)
3.2.2 直肠肛门肿胀率变化
空白组大鼠直肠肛门无肿胀。模型组大鼠直肠肛门肿胀率为(82.12±4.13)%,表明造模成功。西药阳性对照组、中药阳性对照组和加味三黄膏低、中、高剂量组大鼠直肠肛门肿胀率分别为(71.32±4.76)%、(75.12±6.13)%、(70.42±13.00)%、(66.12±3.76)%、(52.32±1.32)%,均显著低于模型组(P<0.05或P<0.01)。
3.2.3 大鼠直肠组织病理形态变化
空白组大鼠直肠黏膜上皮组织完整,结构正常。模型组大鼠直肠黏膜上皮组织出现局部坏死,炎症细胞浸润明显,黏膜下层水肿,静脉血管扩张;与模型组比较,西药阳性对照组、中药阳性对照组和加味三黄膏各剂量组大鼠的直肠黏膜组织损伤均有不同程度改善,腺体排列较为整齐,边界较清,炎症明显改善。结果见图3。
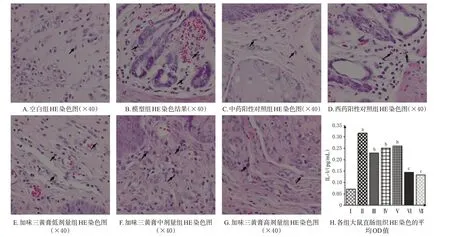
图3 各组大鼠直肠组织HE染色结果
3.2.4 加味三黄膏对大鼠直肠组织中TRPV1 及P 物质表达的影响
TRPV1和P物质染色阳性均呈棕黄色或褐色,二者主要分布在胞浆或间质中。免疫组化结果显示,与空白组比较,模型组大鼠直肠组织中TRPV1及P物质表达均显著升高(P<0.01);与模型组比较,西药阳性对照组、中药阳性对照组和加味三黄膏各剂量组大鼠直肠组织中TRPV1 及P 物质表达均显著降低(P<0.05 或P<0.01)。结果见图4、图5。
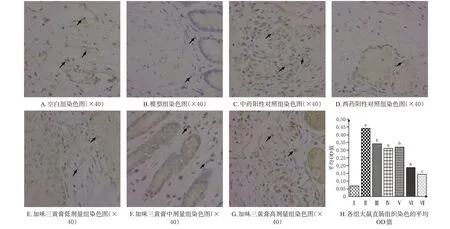
图4 加味三黄膏对大鼠直肠组织中TRPV1表达的影响
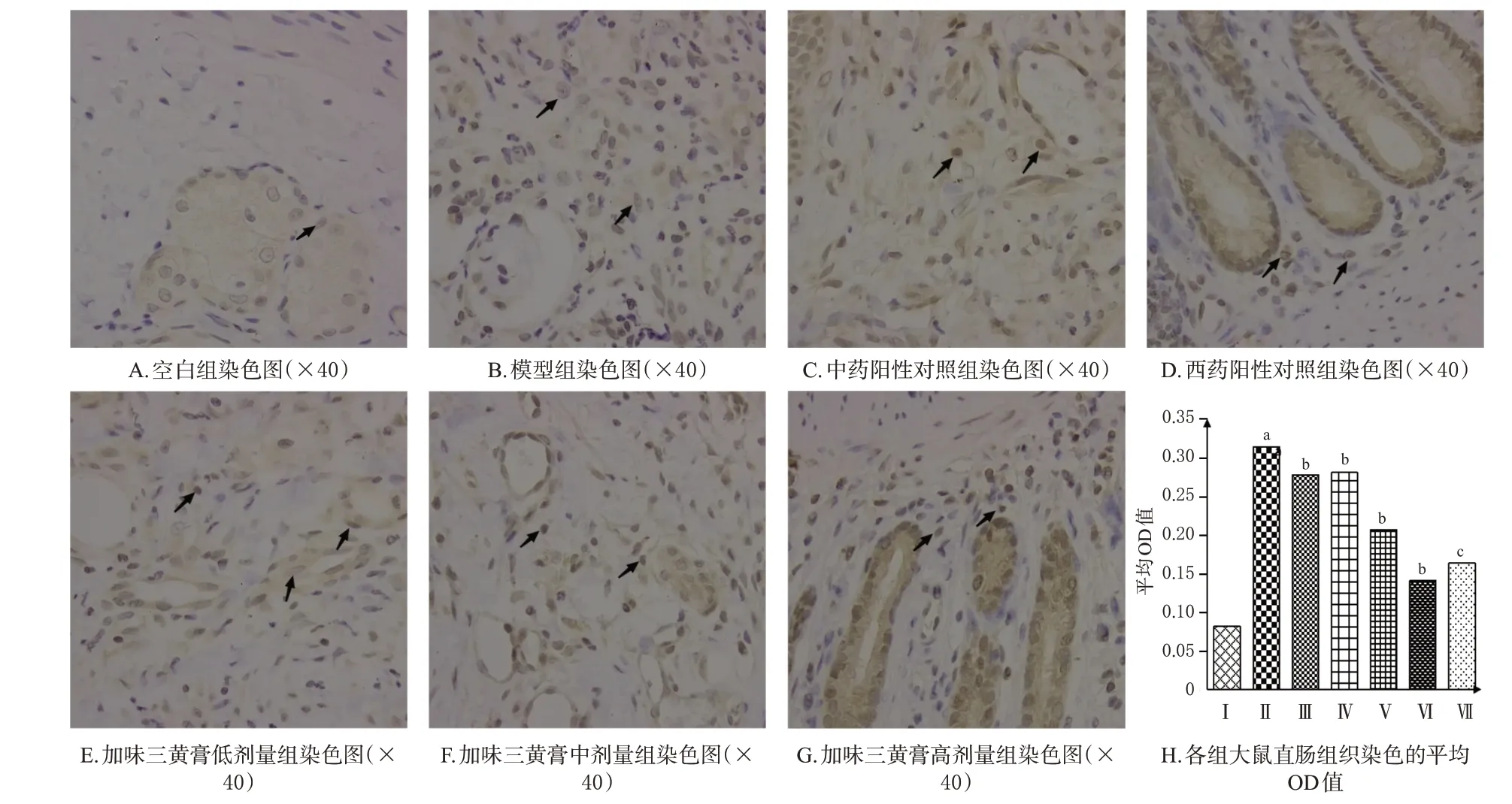
图5 加味三黄膏对大鼠直肠组织中P物质表达的影响
3.2.5 大鼠直肠血管通透性变化
与空白组比较,模型组大鼠直肠血管通透性显著升高(P<0.05);与模型组比较,西药阳性对照组、中药阳性对照组和加味三黄膏各剂量组大鼠直肠血管通透性均显著降低(P<0.05或P<0.01)。结果见表3。
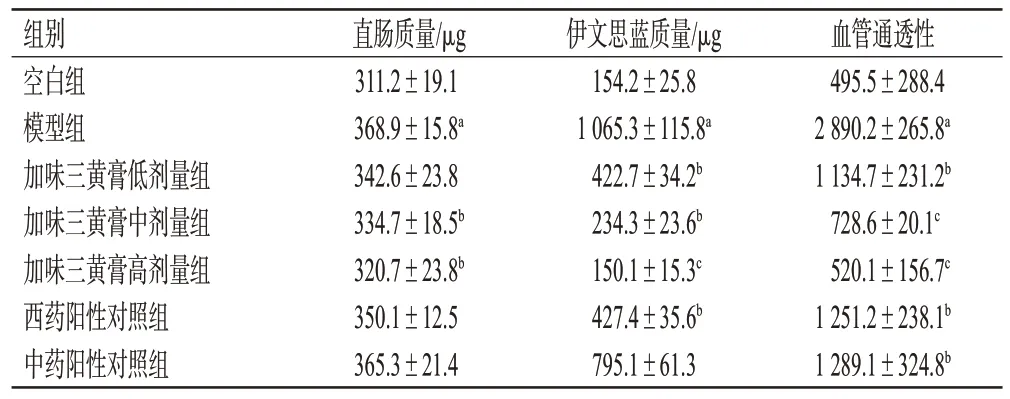
表3 各组大鼠直肠血管通透性测定结果(n=10)
4 讨论
痔疮是临床上较常见的疾病之一。患者因患处感染、出血等,而促使肛门直肠底部及肛门处的静脉丛与黏膜发生病变,最终导致肛门直肠肿胀和疼痛的同时,引发炎症及溃疡等症状。本研究结果显示,加味三黄膏可有效改善大鼠肛门溃疡及肛门肿胀,降低直肠血管通透性,其作用机制可能与抑制IL-2、IL-4 和TNF-α 的释放,减轻直肠组织病理损伤有关。HE染色结果也显示,模型组大鼠直肠黏膜上皮组织出现局部坏死,炎症细胞浸润明显,黏膜下层水肿,静脉血管扩张;经加味三黄膏干预后,大鼠直肠组织病理损伤有效改善,炎症反应得到缓解。
肛门不仅是一个身体器官,也是一个感受器。肛门直肠中的TRPV1主要分布于肛管黏膜下层的结缔组织中,组织损伤后的炎症反应能引起炎症区域中H+浓度上升,H+能直接激活TRPV1,向中枢传递伤害性神经信号,直接引起伤害性疼痛感受[13]。TRPV1 作为痛觉产生的关键性离子通道,当其被激活时,可诱发大量Ca2+内流,引起IL-2、IL-4、TNF-α、前列腺素等炎症因子大量释放,进一步引起炎症,产生痛感[14]。P 物质作为炎症反应产生的一种小分子神经肽,主要参与创伤修复中细胞增殖、分化的调节,还可通过扩张血管,增加血管通透性及相关蛋白渗出,并与淋巴细胞、单核巨噬细胞、中性粒细胞、肥大细胞等胞膜上受体结合,诱导释放大量炎症因子,如IL-2、IL-4和TNF-α,从而导致炎症加剧[15]。因此,TRPV1、P 物质与创面炎症及疼痛密切相关。免疫组化结果显示,模型组大鼠直肠组织中TRPV1及P物质表达均较空白组显著增强,经加味三黄膏干预后,各给药组大鼠直肠组织中TRPV1 及P 物质表达均较模型组显著降低,表明加味三黄膏可以通过抑制TRPV1及P物质的表达来改善炎症,缓解疼痛。
综上所述,加味三黄膏可通过降低炎症因子释放、抑制TRPV1及P物质表达来改善大鼠肛门溃疡和肿胀,进而达到改善大鼠实验性痔疮的作用。
