抑乳调经颗粒对奥氮平在大鼠体内药动学的影响 Δ
2023-10-09郑晖晖周龙玥赵博欣王春霞南方医科大学南方医院药学部广州510080
郑晖晖,周龙玥,赵博欣,王春霞 (南方医科大学南方医院药学部,广州 510080)
精神分裂症是一种慢性精神障碍,属于重性精神疾病,严重影响患者的正常生活。精神障碍的发病机制较为复杂,且病程较长,患者需要长期服药控制病情[1]。然而长期服用抗精神病药物,会导致患者出现糖脂代谢异常、体重增加、泌乳素异常升高等副作用,进而给患者带来更大的危害[2]。
奥氮平(olanzapine,OLZ)是一种二苯丁基哌啶类药物,该药不仅对精神分裂症有较好的治疗效果,还能改善患者认知功能[3]。临床实践发现,服用OLZ后,患者的泌乳素水平在1~2 周内迅速上升,并达到峰值,而长期服药后泌乳素水平会逐渐稳定甚至出现下降,但仍明显高于正常值,最终导致高泌乳素血症[4—5]。抑乳调经颗粒(Yiru tiaojing granules,YRTJ)是南方医科大学南方医院的院内制剂(粤药制字Z07022807),经过近20年临床研究证实,其治疗高泌乳素血症疗效较好[6]。该方以张仲景《伤寒论》的芍药甘草汤(白芍、甘草)为基础,加用巴戟天和仙茅而成。方中巴戟天归肾、肝二经,可补肾壮阳,兼养精血,为君药;仙茅补肾脾之阳,强肝健筋散寒,助巴戟天温补肾肝,为臣药;白芍入肝、脾二经,甘草味甘性平、调和诸药,两者共为佐使药。本课题组前期研究发现,YRTJ可以治疗由OLZ引起的高泌乳素血症,但YRTJ 是否会影响OLZ 的药动学过程尚不清楚。为此,本研究采用液相色谱-质谱(liquid chromatographymass spectroscopy,LC-MS)技术测定了大鼠血浆中OLZ浓度,考察了YRTJ对OLZ在大鼠体内药动学的影响,旨在为临床合理用药提供依据。
1 材料
1.1 主要仪器
本研究所用主要仪器包括Agilent 1260 液相色谱-G6460 三重四极杆质谱联用仪(美国Agilent 公司)、XW-80A 型旋涡混合器(海门市其林贝尔仪器制造有限公司)、Milli-Q 超纯水纯化系统(美国Millipore 公司)、5810R型高速冷冻离心机(德国Eppendorf公司)。
1.2 主要药品与试剂
OLZ 对照品(批号O830525,纯度≥98%)购自上海麦克林生化科技股份有限公司;奥氮平-d3 对照品(内标,批号B71387,纯度≥98%)购自上海源叶生物科技有限公司;YRTJ(批号20220413,规格10 g/袋)由南方医科大学南方医院药学部提供;肝素钠溶液(批号M052787)购自北京迈瑞达科技有限公司。
1.3 动物
SD大鼠24只,雌性,6~8周龄,体重180~200 g,购自珠海百试通生物科技有限公司[动物质量合格证明号:44822700014688;实验动物生产许可证号:SCXK(粤)2020-0051]。所有大鼠于标准环境下适应性饲养1周。动物实验符合南方医科大学南方医院实验动物伦理委员会的有关规定及要求(伦理证号:NFYY-2022-0316)。
2 方法与结果
2.1 色谱与质谱条件
2.1.1 色谱条件
以Agilent Poroshell EC-C18(50 mm×3.0 mm,2.7 μm)为色谱柱;以0.1%甲酸的乙腈溶液(A)-5 mmol/L甲酸铵溶液(B)为流动相进行梯度洗脱(0~0.5 min,95%B;0.5~1.7 min,50%B;1.7~2.5 min,5%B;2.5~5 min,95%B);流速为0.5 mL/min;进样量为5 μL。
2.1.2 质谱条件
采用电喷雾正离子源,扫描方式为多反应监测(multiple reaction monitoring,MRM);毛细管电压为4 000 V;喷雾气压力为40 psi;干燥气体流速为10 L/min;干燥气体温度为340 ℃。用于定量分析的离子对(m/z)分别为313→256.1(OLZ)、316.1→87.2(内标)。
2.2 溶液的制备
2.2.1 对照品溶液的制备
精密称取OLZ 对照品2.5 mg,加入甲醇溶解,并定容至25 mL 容量瓶中,制成质量浓度为0.1 mg/mL 的OLZ 溶液。取上述OLZ 溶液,加入甲醇稀释,制成质量浓度为500 μg/mL 的OLZ 储备液;临用时,用甲醇稀释成所需质量浓度的对照品溶液。
2.2.2 内标溶液的制备
精密称取内标对照品2.5 mg,加入乙腈溶解,并定容至25 mL容量瓶中,制成质量浓度为0.1 mg/mL 的内标储备液。取上述内标储备液,加入甲醇稀释,制成质量浓度为250 ng/mL的内标溶液。
2.3 血浆样品的处理
取血浆样品50 μL,置于1.5 mL 的EP 管内,加入“2.2.2”项下内标溶液100 μL,快速旋涡振荡1 min,以14 000 r/min离心15 min,取5 μL上清液进样分析。
2.4 方法学考察
2.4.1 专属性考察
分别取不同来源的大鼠空白血浆、空白血浆+OLZ(质量浓度为500 ng/mL)、大鼠单次给药后1 h的血浆样品各50 μL,分别按“2.3”项下方法处理(其中空白血浆不加内标溶液),再按“2.1”项下条件进样分析,记录色谱图。如图1所示,OLZ及内标在分析物保留时间处均无杂质干扰,空白血浆中的内源性物质不干扰OLZ及内标的测定,表明本方法专属性较好。

图1 空白血浆、空白血浆+OLZ、大鼠给药后血浆样品的MRM色谱图
2.4.2 线性关系及定量下限考察
取大鼠空白血浆,加入“2.2.1”项下对照品溶液,制成OLZ 质量浓度分别为5、50、150、300、500、750、1 000 ng/mL 的质控样品,按“2.3”项下方法处理后,再按“2.1”项下条件进样分析,记录峰面积。以OLZ质量浓度为横坐标(x)、OLZ 与内标峰面积比值为纵坐标(y),采用加权最小二乘法作回归分析。结果显示,OLZ的回归方程为y=0.006x(R2=0.993 2),表明OLZ在5~1 000 ng/mL范围内呈良好的线性关系。定量下限为5 ng/mL。
2.4.3 基质效应与提取回收率考察
将不同来源的大鼠空白血浆,按“2.3”项下方法处理后,加入“2.2.1”项下对照品溶液,制成低、中、高质量浓度(10、500、750 ng/mL)的样品,每个质量浓度样品平行制备6 份,再按“2.1”项下条件进样分析,记录峰面积为A。分别制备OLZ和内标质量浓度与前者一致的标准溶液,按“2.1”项下条件进样分析,记录峰面积为B。按“2.4.2”项下方法制备OLZ 质量浓度与前者一致的质控样品,每个质量浓度样品平行制备6 份,按“2.3”项下方法处理后,再按“2.1”项下条件进样分析,记录峰面积为C。按以下公式计算基质效应和提取回收率:基质效应(%)=A/B×100%,提取回收率(%)=C/A×100%。结果见表1。由表1 可知,低、中、高质量浓度样品的基质效应为70.56%~82.43%,RSD 不超过3.52%(n=6);OLZ 的平均提取回收率为86.71%~93.65%、RSD 不超过2.79%(n=6),内标的平均回收率为91.56%、RSD 为1.57%(n=6),均符合生物样品定量分析方法要求。
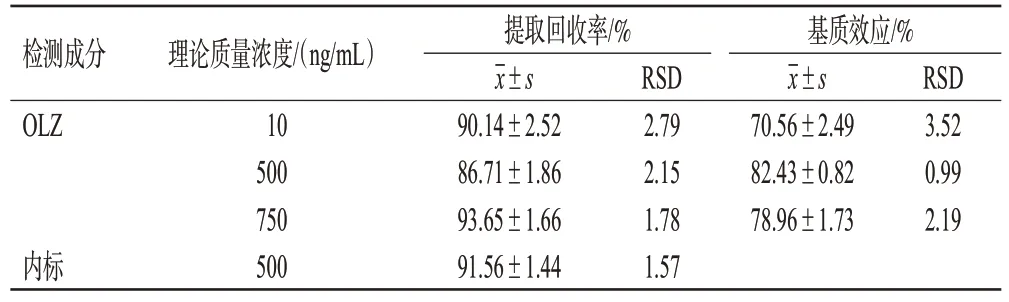
表1 基质效应与提取回收率结果
2.4.4 精密度与准确度考察
按“2.4.3”项下方法制备OLZ 质量浓度分别为5、10、500、750 ng/mL(定量下限及低、中、高质量浓度)的质控样品,按“2.3”项下方法处理后,再按“2.1”项下条件进样分析。每个分析批平行操作5 个样品,连续操作3个分析批,再根据同批随行回归方程计算OLZ的实际质量浓度,考察批内、批间精密度。将实际质量浓度与理论质量浓度进行比较,以相对误差(relative error,RE)考察准确度,结果见表2。由表2 可见,OLZ 的批内、批间RSD 均不超过7.69%,RE 为-3.11%~3.05%,均符合生物样品定量分析方法要求。
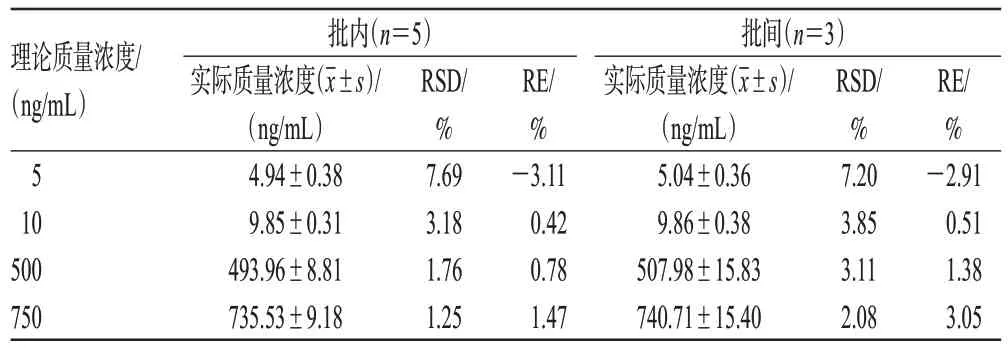
表2 精密度与准确度考察结果
2.4.5 稳定性考察
按“2.4.3”项下方法制备OLZ 质量浓度分别为10、500、750 ng/mL(低、中、高质量浓度)的质控样品,每个质量浓度样品平行制备6份,考察室温(25 ℃)放置8 h、冻融(-80 ℃~室温)循环3 次、4 ℃冰箱中存放24 h、-80 ℃冷冻1个月的稳定性。结果显示,各样品在上述条件下的RSD均不超过8.62%(n=6),表明样品稳定性良好。
2.5 药动学实验
2.5.1 给药剂量的确定
根据现有的研究及美国FDA药量转换原则,大鼠灌胃OLZ 剂量一般为2~20 mg/kg,但由于10 mg/kg 以上的剂量会使大鼠出现明显的镇静效果,且根据本课题组前期研究结果,故将大鼠灌胃OLZ 的剂量设定为5 mg/kg[7]。YRTJ 临床使用中按每人每天2 次、每次1 袋、每袋10 g 计,参照FDA 药量转换原则及本课题组前期药理毒理学研究结果,将大鼠灌胃YRTJ 的剂量设定为0.972 g/kg。
2.5.2 单剂量给药实验
将SD 大鼠随机分为A 组和B 组,每组6 只,给药前所有大鼠禁食12 h,自由饮水。A 组大鼠灌胃OLZ(5 mg/kg);B 组大鼠先灌胃OLZ(5 mg/kg),1 min 后再灌胃YRTJ(0.972 g/kg)。分别在给药前及给药后5、15、30 min和1、2、3、6、8、12、24 h于大鼠眼眶静脉丛采血约0.2 mL,置于肝素化的EP管中,于4 ℃、3 000 r/min离心10 min,取上层血浆,保存于-20 ℃冰箱中,待测。
2.5.3 多剂量给药实验
将SD大鼠随机分为C组和D组,每组6只。C组大鼠灌胃OLZ(5 mg/kg);D组大鼠先灌胃OLZ(5 mg/kg),1 min 后再灌胃YRTJ(0.972 g/kg)。两组均每天给药1次,连续给药14 d。其余操作同“2.5.2”,给药后采血时间为末次给药后。
2.5.4 数据处理
取不同时间点的血浆样品,按“2.3”项下方法处理后,再按“2.1”项下条件进样分析,记录峰面积,根据随行的回归方程计算OLZ浓度。采用GraphPad Prism 9.0软件进行数据分析并作图,数据以±s表示,以独立样本t检验进行组间比较,检验水准α=0.05。采用DAS 2.0软件,选择合适的数学模型拟合,计算药动学参数。药-时曲线见图2,药动学参数见表3。由表3 可知,在单剂量给药中,与A 组比较,B 组大鼠24 h 内的药-时曲线下面积(area under the concentration-time curve within 24 h,AUC0-24h)、AUC0-∞、峰浓度(maximum concentration,cmax)均显著降低(P<0.05),24 h 内的平均滞留时间(mean resident time within 24 h,MRT0-24h)、MRT0-∞、表观清除率(apparent clearance,CLz/F)均显著延长(P<0.05);在多剂量给药中,C 组与D 组大鼠的药动学参数比较,差异均无统计学意义(P>0.05)。
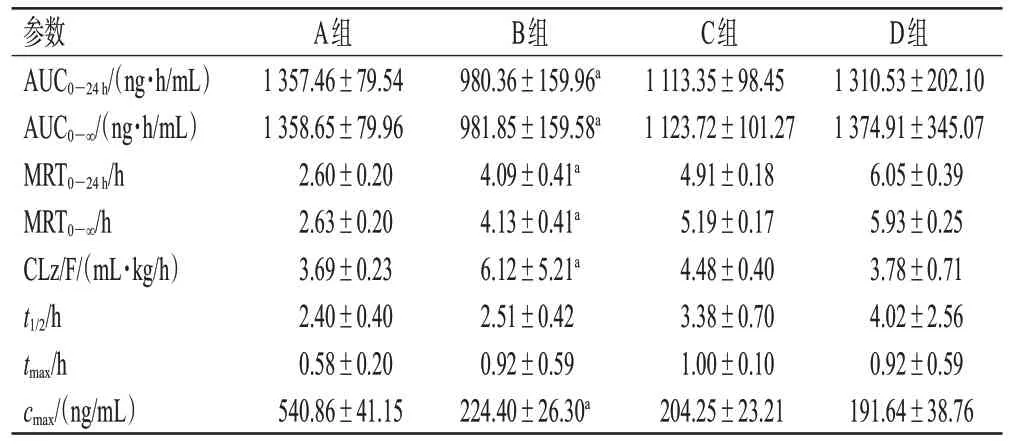
表3 大鼠体内OLA的药动学参数(n=6)
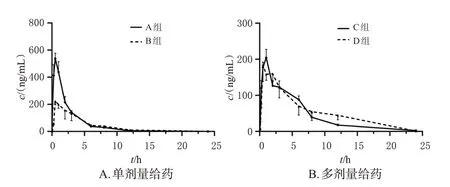
图2 各组大鼠的药-时曲线图(n=6)
3 讨论
人们在日常生活中通常会同时或先后序贯服用两种及以上药物。一方面是出于治疗需要,另一方面是为了增加疗效,减少药物毒副作用。但是服用两种及以上药物容易引起药物之间的相互作用,而导致其中一种或多种药物的药效或毒性发生改变[8]。其中,体内药动学的改变是最常见的原因,药物之间通过影响其体内的吸收、分布、代谢、排泄,从而导致血药浓度发生改变,进而影响药物疗效,甚至产生毒副作用[9—10]。近年来,中西药联用已经成为一种常见的疾病治疗手段。合理的中西药联用可以增强药物疗效、减少药物不良反应,反之则会影响药物疗效。由于中药成分复杂,可能存在多种相互反应,从而影响化学药的疗效。因此,药动学研究成为了探讨中西药相互作用的一个重要手段。
本研究初步探讨了YRTJ对OLZ在大鼠体内药动学的影响,结果显示,各组大鼠OLZ的tmax均小于2 h,这与文献报道一致[11]。在单剂量给药中,与单用OLZ 比较,OLZ 与YRTJ 联用后OLZ 的AUC0-24h、AUC0-∞、cmax均显著降低,MRT0-24h、MRT0-∞、CLz/F 均显著延长,说明YRTJ 可能会降低OLZ 的吸收;但在多剂量给药中,YRTJ对OLZ在大鼠体内的药动学参数无明显影响。
单剂量给药与多剂量给药的药动学参数结果存在差异,其原因可能是中药含有多种成分。中药复方制剂的化学成分复杂,在与其他化学药联用时,可能其中的有效单体成分会影响化学药在体内的吸收、分布、代谢和排泄。当单剂量给药时,YRTJ 对OLZ 的药动学过程可能产生了直接作用,从而导致了较大的药动学差异;而多剂量给药时,YRTJ 对OLZ 的药动学过程可能是一个长期多方面的调节,从而导致药动学参数差异不大。
对于OLZ 来说,单次给药的大鼠模型存在许多缺陷,一是仅单次给药容易造成体内血药浓度的大幅度波动[12];二是对于精神病患者来说,需要长期服用抗精神病药物治疗,单次给药无法模拟临床上的稳态浓度[13]。以上结果提示,多剂量给药更为合理。
综上所述,单次联用YRTJ 会抑制OLZ 在大鼠体内的吸收,长期联用YRTJ 对OLZ 的药动学过程无明显影响。
