卡培他滨联合同步放化疗治疗中晚期食管癌的临床有效性及安全性探讨
2023-10-09孙长侠刘玲贾海燕
孙长侠 刘玲 贾海燕
临床消化道恶性肿瘤疾病中, 食管癌属于常见类型, 不仅发生率较高, 而且死亡率较高, 对患者的生命安全产生了严重威胁[1-3]。相关统计结果提示, 近年来随着人们生活方式的改变, 食管癌的发病率逐年增高, 然而在食管癌的发生早期多无显著独特的临床症状表现, 极易被患者所忽视, 而随着病情的持续发展,往往已经进入中晚期, 进而对其生命安全构成严重威胁[4-6]。手术属于食管癌的重要治疗措施, 而为提升治疗效果, 积极实施放化疗具有十分重要的价值[7-10]。鉴于此, 本研究于2021 年1 月~2022 年12 月选取50 例中晚期食管癌患者分析卡培他滨联合同步放化疗治疗方案的临床效果和安全性。
1 资料与方法
1.1 一般资料 选取本院2021 年1 月~2022 年12 月收治的50 例中晚期食管癌患者, 使用随机数字表法分为观察组及对照组, 每组25 例。对照组中男13 例,女12 例;年龄32~68 岁, 平均年龄(48.35±6.56)岁;病程4~10 个月, 平均病程(7.32±1.98)个月。观察组中男14 例, 女11 例;年龄30~67 岁, 平均年龄(47.63±6.46) 岁;病程4~9 个月, 平均病程(7.38±1.93)个月。两组一般资料比较, 差异均无统计学意义(P>0.05), 具有可比性。
1.2 纳入及排除标准 纳入标准:①TNM 分期<Ⅲ期[11];②预估患者的生存时间>3 个月;③通过食道镜获得病变组织, 经病理诊断确认为食管癌, 同时患者为首次接受根治性手术;④均签署知情同意书。排除标准:①合并存在肠梗阻等对肠内营养干预和日常饮食产生影响的患者;②不具备完整的临床资料;③有肠内营养禁忌证者;④智力障碍或认知障碍者。
1.3 方法 对照组予以后程加速超分割三维适形放疗, 固定体位, 在立体定位架下进行标记, 定位标志为移位性较小的骨性标志。在患者平静状态下展开CT增强扫描, 重建图像后按照相关标准以患者肿瘤位置作为靶区。三维适形放射治疗, 应用6~1SM 的高能X 线作为放射源, 选择5~7 个非共面野照射靶区, 前3 周1 次/d, 180~200 cGy/次, 5 次/周, 照射剂量为3000 cGy/3 周;第4 周调整量为2 次/d, 150 cGy/次,间隔6 h, 5 次/周, 照射剂量为3000 cGy/2 周;总照射剂量为6000 cGy/5 周。
观察组予以卡培他滨联合同步放化疗治疗, 完成放疗后应用卡培他滨, 2 次/d, 剂量为1250 mg/m2, 3 周为1 个疗程。患者出现不良反应时应及时调整剂量。
1.4 观察指标及判定标准 比较两组患者治疗效果、不良反应(血小板下降、白细胞下降、胃肠道反应、放射性肺炎、放射性食管炎)发生情况、满意度以及治疗前后的生存质量评分、T 细胞亚群指标(CD3+、CD4+、CD8+、CD4+/CD8+)水平。①疗效判定标准:完全缓解指经治疗后肿瘤病灶体积消失且持续>4 周;部分缓解指肿瘤体积直径缩小>50%;疾病稳定指肿瘤体积缩小≤50%;疾病进展指肿瘤体积增加, 甚至出现新病灶。总有效率=(完全缓解+部分缓解)/总例数×100%[12]。②患者生存质量改善情况应用简明健康状况调查表(SF-36)进行评价, 评价指标包括躯体疼痛、健康状况、精神状态以及生理功能, 评分越高提示患者生存质量越好[13]。③分别在治疗前和治疗后评价两组患者T 细胞亚群变化情况,包括CD3+、CD4+、CD8+、CD4+/CD8+, 采集肘静脉血2 ml, 经乙二胺四乙酸抗凝, 4℃冰箱内保存, 应用免疫荧光法检测[14]。④不良反应包括血小板下降、白细胞下降、胃肠道反应、放射性肺炎、放射性食管炎[15]。⑤以自制满意度评价量表评估患者满意度, 总分100 分, 评分80~100 分表示非常满意;评分60~79 分表示满意;评分<60 分表示不满意。满意度=(非常满意+满意)/总例数×100%。
1.5 统计学方法 采用SPSS20.0 统计学软件处理数据。计量资料以均数±标准差(±s)表示, 采用t 检验;计数资料以率(%)表示, 采用χ2检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 两组患者治疗效果比较 观察组临床总有效率92.00%高于对照组的68.00%, 差异具有统计学意义(P<0.05)。见表1。

表1 两组患者治疗效果比较[n(%)]
2.2 两组患者治疗前后生存质量比较 治疗前, 两组患者躯体疼痛、健康状况、精神状态、生理功能评分比较, 差异均无统计学意义(P>0.05)。治疗后, 对照组患者躯体疼痛、健康状况、精神状态、生理功能评分与治疗前比较, 差异无统计学意义(P>0.05);观察组患者躯体疼痛、健康状况、精神状态、生理功能评分均高于治疗前, 且躯体疼痛评分(64.38±5.35)分、健康状况评分(57.67±3.83)分、精神状态评分(59.72±6.66)分、生理功能评分(58.36±7.42)分均高于对照组的(60.86±4.59)、(54.56±5.70)、(55.40±6.26)、(52.88±6.85)分, 差异均具有统计学意义(P<0.05)。见表2。
表2 两组患者治疗前后生存质量比较( ±s, 分)

表2 两组患者治疗前后生存质量比较( ±s, 分)
注:与本组治疗前比较, aP<0.05;与对照组治疗后比较, bP<0.05
组别例数躯体疼痛健康状况治疗前治疗后治疗前治疗后对照组2558.77±5.2960.86±4.5951.99±5.3054.56±5.70观察组2558.15±5.46 64.38±5.35ab50.32±5.58 57.67±3.83ab t 0.4082.4971.0852.264 P 0.6850.0160.2830.028组别例数精神状态生理功能治疗前治疗后治疗前治疗后对照组2552.75±5.3555.40±6.2650.27±6.1852.88±6.85观察组2552.26±5.40 59.72±6.66ab50.14±6.36 58.36±7.42ab t 0.3222.3630.0732.713 P 0.7490.0220.9420.009
2.3 两组患者治疗前后T 细胞亚群指标水平比较 治疗前, 两组患者CD3+、CD4+、CD8+、CD4+/CD8+水平比较, 差异均无统计学意义(P>0.05)。治疗后, 对照组患者CD3+、CD4+、CD8+、CD4+/CD8+水平与治疗前比较,差异无统计学意义(P>0.05);观察组患者CD3+、CD4+、CD4+/CD8+水平高于治疗前, CD8+水平低于治疗前, 且CD3+(60.45±7.54)%、CD4+(37.51±7.82)%、CD4+/CD8+(1.60±0.75)均高于对照组的(54.62±7.55)%、(23.45±6.77)%、(1.03±0.48), CD8+(21.24±1.86)%低于对照组的(35.35±1.64)%, 差异均具有统计学意义(P<0.05)。见表3。
表3 两组患者治疗前后T 细胞亚群指标水平比较( ±s)

表3 两组患者治疗前后T 细胞亚群指标水平比较( ±s)
组别例数CD3+(%)CD4+(%)治疗前治疗后治疗前治疗后对照组2553.72±7.1654.62±7.5523.66±6.3723.45±6.77观察组2555.12±8.82 60.45±7.54ab23.28±7.57 37.51±7.82ab t 0.6162.7320.1926.797 P 0.5410.0090.8490.000
续表3
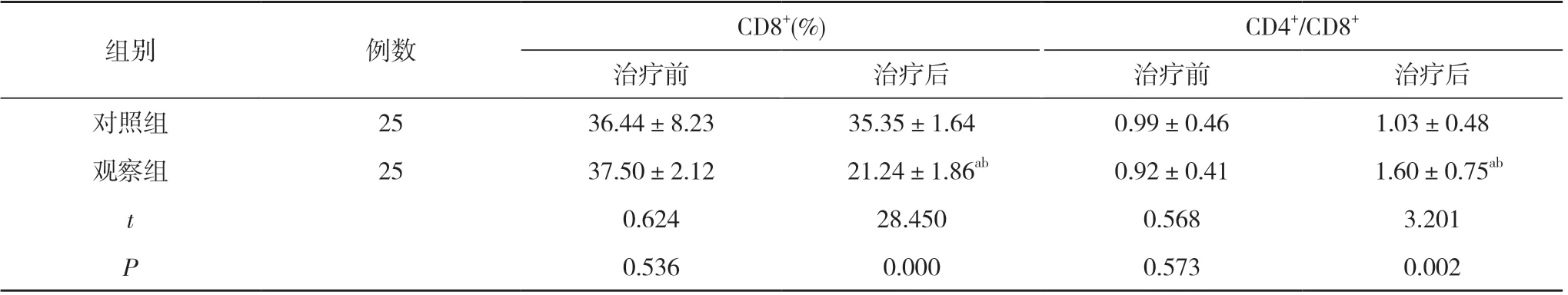
表3 两组患者治疗前后T 细胞亚群指标水平比较( ±s)
注:与本组治疗前比较, aP<0.05;与对照组治疗后比较, bP<0.05
组别例数CD8+(%)CD4+/CD8+治疗前治疗后治疗前治疗后对照组2536.44±8.2335.35±1.640.99±0.461.03±0.48观察组2537.50±2.12 21.24±1.86ab0.92±0.41 1.60±0.75ab t 0.62428.4500.5683.201 P 0.5360.0000.5730.002
2.4 两组患者不良反应发生情况比较 观察组不良反应发生率8.00%低于对照组的32.00%, 差异具有统计学意义(P<0.05)。见表4。

表4 两组患者不良反应发生情况比较[n(%)]
2.5 两组患者满意度比较 观察组患者满意度96.00%高于对照组的72.00%, 差异具有统计学意义(P<0.05)。见表5。
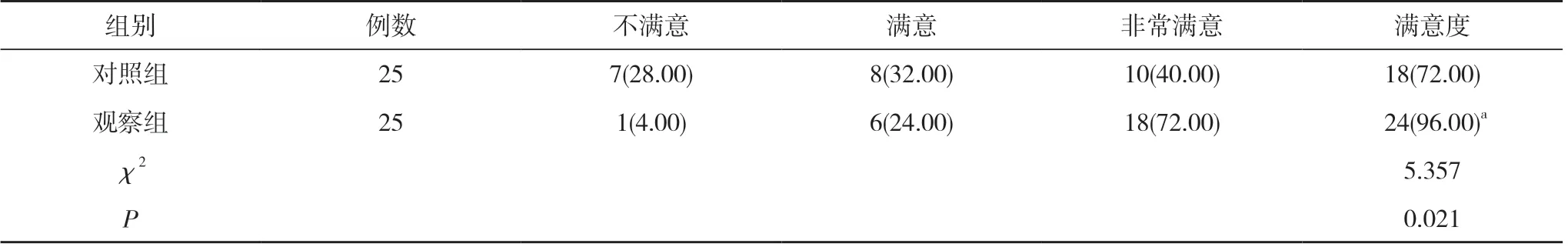
表5 两组患者满意度比较[n(%)]
3 讨论
临床消化系统疾病中, 食管癌属于一种十分常见的恶性肿瘤疾病类型, 往往会对患者的营养状态产生严重影响, 诱发营养不良[16]。有关研究提示, 我国食管癌发病率在世界范围内的占比约为40%, 而发生营养不良的几率约为55%[17]。有研究提示, 恶性肿瘤属于消耗性疾病之一, 在出现营养不良时, 会导致患者身体素质降低, 影响其免疫功能, 继而导致患者耐受治疗的能力降低, 比如放化疗, 大大增加了并发症的发生率,不仅会影响治疗效果, 还会加重患者的痛苦程度。对于多数食管癌患者而言, 不仅需承受疾病本身造成的痛苦, 而且会严重影响患者的心理健康。手术为当前治疗食管癌的主要方法, 对癌细胞扩散具有良好的抑制作用, 但是手术具有创伤性, 会导致胃肠激素或神经调节出现紊乱, 同时手术治疗效果有限, 术后积极实施有效的放化疗措施具有十分重要的价值[18]。
本研究结果提示, 观察组临床总有效率92.00%高于对照组的68.00%, 差异具有统计学意义(P<0.05)。治疗后, 对照组患者躯体疼痛、健康状况、精神状态、生理功能评分与治疗前比较, 差异无统计学意义(P>0.05);观察组患者躯体疼痛、健康状况、精神状态、生理功能评分均高于治疗前, 且躯体疼痛评分(64.38±5.35)分、健康状况评分(57.67±3.83)分、精神状态评分(59.72±6.66)分、生理功能评分(58.36±7.42)分均高于对照组的(60.86±4.59)、(54.56±5.70)、(55.40±6.26)、(52.88±6.85)分, 差异均具有统计学意义(P<0.05)。治疗后, 对照组患者CD3+、CD4+、CD8+、CD4+/CD8+水平与治疗前比较, 差异无统计学意义(P>0.05);观察组患者CD3+、CD4+、CD4+/CD8+水平高于治疗前, CD8+水平低于治疗前, 且CD3+(60.45±7.54)%、CD4+(37.51±7.82)%、CD4+/CD8+(1.60±0.75)均高于对照组的(54.62±7.55)%、(23.45±6.77)%、(1.03±0.48), CD8+(21.24±1.86)%低于对照组的(35.35±1.64)%, 差异均具有统计学意义(P<0.05)。观察组不良反应发生率8.00%低于对照组的32.00%,差异具有统计学意义(P<0.05)。观察组患者满意度96.00%高于对照组的72.00%, 差异具有统计学意义(P<0.05)。由此可知, 中晚期食管癌患者联合应用卡培他滨、同步放化疗治疗的临床效果突出, 能够改善患者生存质量和T 细胞亚群, 同时安全性较高, 分析原因:卡培他滨属于针对肿瘤细胞可发挥选择性活性细胞毒性药物之一, 该药物本身不具备细胞毒性, 但是口服后能够于肿瘤所在部位转化成为细胞毒性的5-氟尿嘧啶(5-FU), 继而可最大程度降低5-FU 对正常细胞的损伤, 属于治疗消化道有关肿瘤的有效化疗药物[19]。相较于其他化疗药物, 其效果更突出, 安全性更高, 且患者耐受性更好[20]。联合应用卡培他滨、同步放化疗治疗时, 可发挥协同作用, 提升治疗效果。
综上所述, 中晚期食管癌患者应用卡培他滨联合同步放化疗治疗的临床效果突出, 能够改善患者生存质量和T 细胞亚群, 同时安全性较高, 值得推广应用。
