基于广泛靶向代谢组学的‘品丽珠’葡萄转色中果皮差异代谢物分析
2023-09-21丁亭亭苏东平杜宜龙陈景辉赵红军孙磊王鹏飞
丁亭亭,苏东平,杜宜龙,陈景辉,赵红军,孙磊,王鹏飞,6*
(1. 山东省葡萄研究院,山东济南 250100;2. 烟台科技学院,山东烟台 265600;3. 蓬莱国宾葡萄酒庄有限公司,山东烟台 265600;4. 中粮长城葡萄酒(蓬莱)有限公司/山东省酿酒葡萄与葡萄酒技术创新中心,山东烟台 265600;5. 北京市农林科学院林业果树研究所,北京 100093;6. 农业农村部华东都市农业重点实验室,山东济南 250100)
葡萄果皮颜色的变化是成熟过程中的重要指标之一,花色苷随着果实的成熟进程逐渐积累并稳定在较高水平。而果皮颜色是由果皮中花色苷的种类和比例决定的[1]。同时,花色苷还具有重要的营养和药理作用,具有抗氧化、预防心血管疾病和抗肿瘤等多种保健功能[2-4]。葡萄中花色苷的生物合成可分为苯丙烷类代谢途径、类黄酮途径及花色苷合成途径3个阶段[5-6]。在苯丙烷类代谢途径中,在苯丙氨酸裂解酶、肉桂酸羟化酶和4-香豆酰CoA连接酶作用下合成花色苷前体物质——对香豆酰-CoA[7]。在类黄酮途径中,查尔酮合成酶、查尔酮异构酶和黄烷酮-3-羟化酶将对香豆酰-CoA转化为花色苷合成关键前体物质二氢黄酮醇。在花色苷合成途径中,二氢黄酮醇还原酶、无色花色素双加氧酶及花青素合成酶催化二氢黄酮醇转化为花白素,最后合成未修饰的花青素,再经过糖基化等修饰反应,形成不同结构的花色苷[8],这种二次修饰决定了葡萄果皮的颜色。通常葡萄果皮中的花色苷以锦葵素-3-葡萄糖苷、锦葵素-3-p-香豆酰葡萄糖苷、锦葵素-3-乙酰葡萄糖苷为主[9]。花色苷属于多酚物质,葡萄中的多酚物质还包括酚酸类、黄烷酮醇类、黄酮醇类、黄烷醇类(例如儿茶素、表儿茶素)、芪类化合物(例如白藜芦醇)等[10-11]。
在葡萄成熟过程中,果实中的其他成分也发生着复杂的变化,例如果实中的糖分不断积累[12],酸度不断减退。葡萄果实中积累的糖主要包括果糖、葡萄糖、蔗糖等[13];酸可分为有机酸和无机酸两种,有机酸以酒石酸、苹果酸及柠檬酸为主[12,14]。而糖、酸的种类和含量以及糖酸比决定着成熟葡萄的风味[15]。
虽然前人对葡萄成熟过程中的代谢产物含量变化做了大量研究,但是针对转色前到转色前期这一过程果皮的代谢产物变化没有细致的研究。尤其是针对葡萄膨大到转色这个阶段,果皮中花色苷种类和含量变化的研究鲜有报道。在转色前葡萄果皮的颜色为绿色,但是花色苷合成是否已经开始尚不明确。果皮中糖、酸、黄酮、芪类等营养物质的积累状况也鲜有报道。因此,本团队利用广泛靶向代谢组调查葡萄转色前约4周、转色前约1周和转色前期‘品丽珠’葡萄果皮中代谢产物的积累和变化,旨在明确葡萄果皮转色过程中产生不同代谢产物的分子机理,为深入研究葡萄果实成熟的分子机制奠定基础。
1 材料与方法
1.1 试验材料与处理
2019年在山东省葡萄研究院葡萄种质资源圃采集‘品丽珠’葡萄转色前约4周(S1)、转色前1周(S2)和转色前期(S3)形状、大小均一,无病虫害、无损伤的果实,每个时期分别采3穗果实样品(图1)。洗净擦干后,在液氮速冻状态下剥取果皮去果肉,-80 ℃下保存待用。每组样品3个生物学重复。

图1 不同发育阶段的‘品丽珠’葡萄果实Figure 1 'Cabernet Franc' fruit at different stages of development
1.2 试验方法
1.2.1 葡萄果皮前处理
取0.10 g葡萄果皮在冻干机(Scientz-100F)中进行真空冷冻干燥,随后用研磨仪(MM 400,Retsch)研磨振荡(30 Hz,1.5 min)成粉末。加入0.6 mL 70%甲醇提取液,涡旋振荡仪振荡混匀,溶解后的样品放在4 ℃冰箱静置过夜,中间涡旋振荡混匀6次,以提高提取效率。第2天,4 ℃离心机10 000 r·min-1高速离心10 min,吸取上清液,用0.22 μm孔径的微孔滤膜过滤,保存于棕色进样瓶中,用于后续UPLC-MS/MS分析。
1.2.2 色谱质谱方法
数据采集系统包括超高效液相色谱仪(UPLC)和串联质谱(MS/MS)。色谱柱是Waters ACQUITY UPLC HSS T3 C18 1.8 μm,2.1 mm×100 mm;流动相A是包含0.04%乙酸的超纯水,流动相B是加入0.04%乙酸的乙腈溶液。流速为0.35 mL·min-1;柱温为40 ℃;进样量添加4 μL。
质谱条件:使用三重四级杆串联质谱仪(Applied Biosystems 4500 QTRAP)测定;电喷雾离子源(ESI)温度设置为550 ℃,质谱电压设置为5500 V,帘气(CUR)设置为30 psi,碰撞诱导电离(CAD)参数设为高。
1.2.3 代谢物定性与定量分析
参照Yang等方法进行[16]。
1.3 数据处理与分析
基于武汉迈维科技有限公司自建数据库(Metawaredatabase,MWDB),依据二级谱信息数据库对代谢物质进行定性分析。采用多元统计分析方法,对3组样品进行主成分分析(Principal component analysis,PCA)和正交偏最小二乘判别分析(PLSDA)法预测模型的可靠性。选取其中Log2FC≥1和Log2FC≤-1、变量权重值(Variable important in projection,VIP)≥1、P(P value)≤0.05的代谢物被鉴定为差异代谢物。将其中的差异代谢物数据提交到KEGG数据库[17],进行相关注释和通路类型分类。使用KOBAS 2.0软件 (http://kobas.cbi.pku.edu.cn/home.do)进行KEGG富集分析。
2 结果与分析
2.1 代谢组成分总体分析
在3个取样期的果皮中,共鉴定出29类416种代谢物(表1),其中S1果皮的代谢组成分有29类394种,特有的化学物质有1类1种,即1-硬脂酰-sn-甘油-3-磷酰胆碱;S2果皮的代谢组成分有29类401种,特有的化学物质有2类2种,即丙氨酰亮氨酸和2-苯乙胺;S3果皮的代谢组成分有29类397种,特有的化学物质有4类14种,包括DL-多巴、矢车菊素半乳糖苷、3-O-葡萄糖苷氯化物、锦葵色素O-己糖苷、锦葵色素3-O-半乳糖苷、锦葵色素3-O-葡糖苷、甲基花青素-3,5-二葡糖糖苷、翠雀素-3-O-(6-O-乙酰)葡萄糖苷、矮牵牛-3-(乙酰基)葡糖苷、二甲花翠素-3-(乙酰基)葡糖苷、金圣草黄素、7-O-芸香糖苷麦黄酮、5-O-芸香糖苷和异鼠李素(表1)。
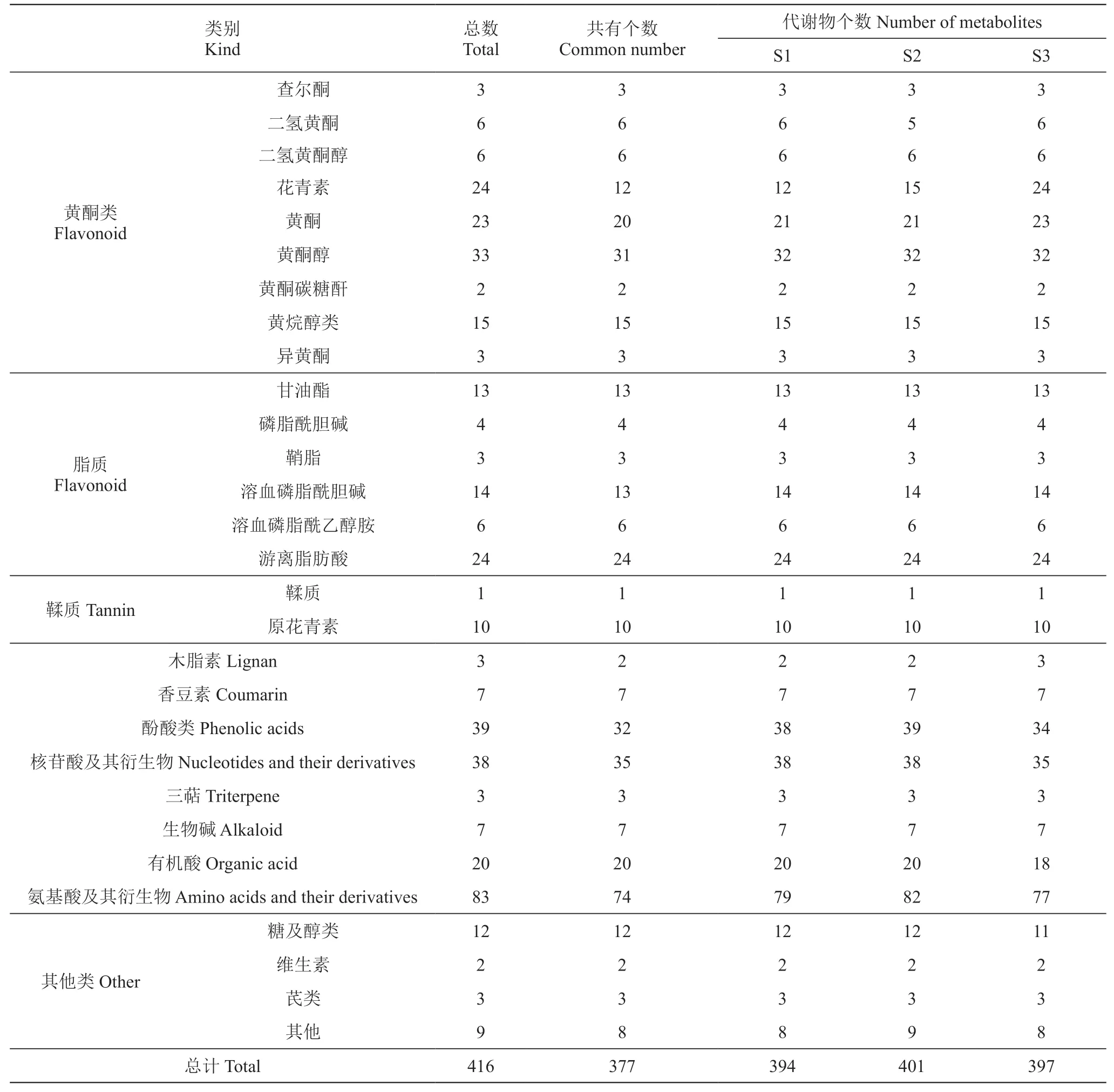
表1 三个取样期葡萄果皮中代谢物数量统计Table 1 Statistics of metabolites in grape pericarp in three sampling periods
2.2 不同着色期葡萄果皮代谢组主成分分析结果
通过对样品进行主成分分析(PCA),判断S1、S2和S3期葡萄果皮各组样品之间的总体代谢物差异和组内样品之间的变异度大小。其中PC1的贡献率为55.4%,PC2的贡献率为11.21%,且3组样本在二维图上表现出明显的分离趋势(图2),在PCA结果上能够从总体上反映出3组样品之间的代谢物差异。
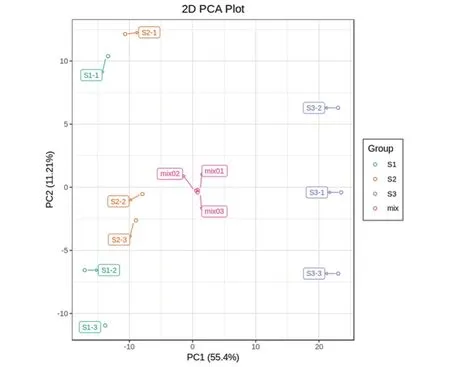
图2 三组样品及质控的PCA结果Figure 2 PCA plot for discrimination of three groups of samples and quality control
2.3 不同着色期果皮主要差异代谢成分分析
分别对S1、S2和S3期果皮样品中代谢成分定量信息发生的差异倍数变化进行两两比较,三个比较组果皮差异代谢物分别为32个(S1 vs S2)、195个(S1 vs S3)和186个(S2 vs S3);其中,S1 vs S2独有差异代谢物4个,S1 vs S3独有28个,S2 vs S3独有19个;3个比较组共有差异代谢物20个。对影响葡萄果实品质的代谢物质如花青素、糖及有机酸进行分析,其中花青素的变化个数分别为8个(S1 vs S2)、22个(S1 vs S3)和23个(S2 vs S3);糖类变化个数分别为1个(S1 vs S2)、9个(S1 vs S3)和7个(S2 vs S3);有机酸变化个数为1个(S1 vs S2)、7个(S1 vs S3)和7个(S2 vs S3)。
将差异倍数进行处理转化为log2FC,从中选出变化倍数最大的前10个上调和下调的差异表达代谢成分进行分析(图3)。与S1期果皮相比,S2期果皮中5种花青素(芍药素-3-葡萄糖苷、甲基花青素-3-(乙酰基)葡糖苷、二甲花翠素-3-O-(6-O-对香豆酰)-5-O-二葡萄糖苷、二甲花翠素-3-O-(6-对香豆酰)葡糖苷、甲基花青素-3-O-(6-对香豆酰)葡糖苷),3种氨基酸及其衍生物(丙氨酰亮氨酸、氨基乙酰基异亮氨酸、DL-高半胱氨酸),1种酚酸类(邻苯三酰-β-D-葡萄糖),1种其他类(2-苯乙胺)的相对含量显著增加;3种氨基酸及其衍生物(β-烟酰胺单核苷酸、烟草胺、L-胱硫醚),1种有机酸(L-(+)-酒石酸),1种黄烷醇类(没食子酸),1种黄酮(芹菜素O-己糖基-O-芸香糖苷),1种查耳酮(根皮素),1种糖及醇类(DL-阿拉伯糖),1种酚酸类(1-阿魏酰-sn-甘油)和1种磷脂酰胆碱(甘磷酸胆碱GPC)的相对含量显著降低。
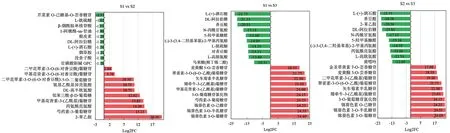
图3 三个比较组代谢物差异倍数柱状图(差异倍数最大)Figure 3 The most significant different metabolite multiples of three comparison groups
与S1期果皮相比,S3期果皮中9种花青素(锦葵色素3-O-半乳糖苷、锦葵色素3-O-葡糖苷、芍药素-3-葡萄糖苷、翠雀素-3-O-(6-O-乙酰)葡萄糖苷、矮牵牛-3-(乙酰基)葡糖苷、锦葵色素O-己糖苷、甲基花青素-3-(乙酰基)葡糖苷、3-O-葡萄糖苷氯化物、矢车菊素半乳糖苷)和1种黄酮(麦黄酮5-O-芸香糖苷)的相对含量显著增加;4种氨基酸及其衍生物(N-丙酰甘氨酸、(-)-3-(3,4-二羟基苯基)-2-甲基丙氨酸、L-胱硫醚、L-高胱氨酸)、3种酚酸类(对香豆酸、香豆酸、5-羟甲基糠醛)、2种有机酸(L-(+)-酒石酸、马来酸)和1种糖及醇类(DL-阿拉伯糖)的相对含量显著降低。
与S2期果皮相比,S3期果皮中8种花青素(矢车菊素半乳糖苷、3-O-葡萄糖苷氯化物、锦葵色素O-己糖苷、锦葵色素3-O-半乳糖苷、锦葵色素3-O-葡糖苷、翠雀素-3-O-(6-O-乙酰)葡萄糖苷、矮牵牛-3-(乙酰基)葡糖苷、二甲花翠素-3-(乙酰基)葡糖苷)和2种黄酮(金圣草黄素7-O-芸香糖苷、麦黄酮5-O-芸香糖苷)的相对含量显著增加;5种氨基酸及其衍生物(N-丙酰甘氨酸、丙氨酰亮氨酸、(-)-3-(3,4-二羟基苯基)-2-甲基丙氨酸、黄嘌呤、L-高胱氨酸),2种酚酸类(香豆酸、5-羟甲基糠醛),1种有机酸(L-(+)-酒石酸),1种糖及醇类(DL-阿拉伯糖),1种其它(2-苯乙胺)的相对含量显著降低。
2.4 不同着色期果皮差异代谢物通路富集分析
通过KEGG数据库对S1、S2和S3三个时期差异代谢物质进行通路富集分析。对S1 vs S2鉴定出的32种显著差异代谢物进行KEGG通路分析,根据p值大小排序,富集的KEGG通路中前17条主要涉及类黄酮的生物合成、次生代谢物的生物合成、二苯乙烯、二芳基庚酸类和姜酚合成、半胱氨酸和蛋氨酸代谢及异黄酮的生物合成。其中,次生代谢物和类黄酮生物合成途径富集差异代谢物较多,富集程度显著,表明转色前4周到转色前1周果皮中的差异代谢物主要参与次生代谢物和类黄酮的生物合成(图4)。

图4 差异代谢物的富集分析Figure 4 Enrichment analysis of differential metabolites
对S1 vs S3鉴定出195种显著差异代谢物进行KEGG通路分析,根据p值大小排序,富集的KEGG通路中前20条主要涉及代谢途径、次生代谢物的生物合成、花青素的生物合成和氨基酸的生物合成等(图4)。
对S2 vs S3鉴定出186种显著差异代谢成分进行KEGG通路分析,根据p值大小排序,富集的KEGG通路中前20条主要涉及代谢途径、异黄酮的生物合成、花青素的生物合成和氨基酸的生物合成等(图4)。
3 讨论与结论
果实成熟是葡萄最重要的生长发育过程之一。在此过程中,果实中的各种代谢产物会发生复杂的变化,其中糖、酸和多酚类物质等的种类和含量变化与葡萄品质有着密切的关联[13]。在葡萄成熟过程中,最明显的变化是果皮颜色。花色苷是重要的类黄酮物质,是葡萄各个组织重要的呈色物质。而在红色品种果实颜色逐渐加深过程中花色苷持续积累,到成熟时基本稳定在较高的含量水平[1]。本研究中,与转色前4周相比,转色前1周的‘品丽珠’葡萄果皮中氯化锦葵色素-3-葡糖苷、矮牵牛-3-葡萄糖苷、芍药素-3-葡萄糖苷、甲基花青素-3-(乙酰基)葡糖苷、二甲花翠素-3-O-(6-O-对香豆酰)-5-O-二葡萄糖苷、矮牵牛-3-O-(6-对香豆酰)葡糖苷、二甲花翠素-3-O-(6-对香豆酰)葡糖苷和甲基花青素-3-O-(6-对香豆酰)葡糖苷8种花青素的积累水平上升,说明在葡萄转色之前已经发生花色苷的积累。矢车菊素3-O-葡萄糖苷、矢车菊素O-丁香酸、花翠素3-O-葡萄糖苷和矢车菊素-3-O-(6-对香豆酰)葡糖苷在转色前4周和转色前1周有相似的含量,到转色前期含量上升。矢车菊素半乳糖苷、3-O-葡萄糖苷氯化物、锦葵色素O-己糖苷、锦葵色素3-O-半乳糖苷、锦葵色素3-O-葡糖苷、甲基花青素-3,5-二葡糖糖苷、翠雀素-3-O-(6-O-乙酰)葡萄糖苷、矮牵牛-3-(乙酰基)葡糖苷和二甲花翠素-3-(乙酰基)葡糖苷9种花青素在转色前4周和转色前1周并没有积累,在转色前期才发生积累。Fasoli等[18]研究发现,在‘赤霞珠’和‘黑比诺’果实中,锦葵色素3-O-葡糖苷含量从转色前期到成熟期显著上升。而本研究中‘品丽珠’果皮中锦葵色素3-O-葡糖苷的变化趋势不同,可能是组织部位或品种不同原因导致的。
在葡萄果实成熟过程中,叶片通过积累、运输、转化光合产物以及果实自身的光合同化作用和有机酸代谢等过程使得果实中的糖类物质不断积累[13]。葡萄果实中积累的可溶性糖类物质主要是葡萄糖和果糖,其次是蔗糖,后者含量不足总糖的4%。此外,还有少量的其他糖类,如:麦芽糖、半乳糖、水苏糖、棉籽糖及蜜二糖等,随着果实成熟含糖量逐渐增加[19-21]。此外,糖还可作为信号分子,与激素、N等信号形成网络,通过交互作用调控植物的生长发育过程[22-23]。本研究显示,与转色前4周相比,转色前期‘品丽珠’葡萄果皮中的蔗糖和葡萄糖相对含量上调,与转色前1周相比,转色前期‘品丽珠 ’葡萄果皮中的蔗糖含量上调。转色前4周、转色前1周和转色前期的‘品丽珠’葡萄果皮中可溶性糖类物质积累以葡萄糖为主,蔗糖为辅,而没有检测到果糖的积累。Fasoli等[18]研究发现,在‘赤霞珠’和‘黑比诺’果实中,果糖含量从转色前期到成熟期显著上调。而本研究中在‘品丽珠’葡萄果皮中并没有检测到果糖的积累,可能是由于组织或品种不同的原因。
葡萄果实中的酸包含无机酸和有机酸两大类[24]。无机酸是葡萄根系从土壤中吸收,主要有硫酸、盐酸、磷酸等。葡萄果实中有机酸的主要成分是酒石酸,还有苹果酸以及少量的柠檬酸,其中酒石酸和苹果酸占浆果总酸的90%左右,柠檬酸在葡萄果实中含量始终很低[13,15]。本研究中,与转色前1周相比,转色前4周‘品丽珠’葡萄的果皮中酒石酸的含量更高,后下降4~8倍,到转色前期未检测出酒石酸。苹果酸在转色前4周和转色前1周有相似的含量,到转色前期时含量下降2倍。而在3个采样期的‘品丽珠’葡萄果皮中始终没有检测出柠檬酸。这说明葡萄果皮在幼果期酸含量较高,而在转色期以后酸含量迅速降低。
