虎杖苷促进大鼠骨质疏松性骨折的作用及对SIRT1/FoxO1信号通路的影响
2023-09-12李明哲罗国厂张仲博岳宗进
李明哲 罗国厂 张仲博 岳宗进
1南阳医学高等专科学校,河南 南阳 473000
2河南省中医院,河南 郑州 450000
骨质疏松症是一种全身性骨骼疾病,其特点是骨量低、骨强度受损、骨折风险增加[1]。随着人口老龄化程度的不断加剧,骨质疏松症引发的骨折发生率日益升高[2]。沉默信息调节因子1(SIRT1)/叉头状转录因子O1(FoxO1)信号通路是与自噬密切相关的通路,也是机体调节炎症相关的信号通路之一[3]。据报道,SIRT1/FoxO1信号通路可调控炎症小体发挥对创伤性脑损伤小鼠的神经保护作用[4]。同时,手法治疗能够通过SIRT1/FoxO1信号通路抑制氧化应激和炎症,延缓大鼠椎间盘衰老[5]。有研究表明,大蒜素能够通过预防破骨细胞形成、提高抗氧化活性以及激活SIRT1/FoxO1信号通路对铅诱导的小鼠骨质流失发挥保护作用[6]。虎杖苷是植物虎杖的提取物,具有平喘、抗菌、调节激素、抗炎和抗肿瘤的功效[7]。Zhan等[8]研究报道,虎杖苷可促进骨髓间充质干细胞向神经元分化,从而治疗脊髓损伤。研究发现,虎杖苷对骨质疏松症有较好的治疗效果,可促进成骨细胞生成来改善骨质疏松[9]。目前关于虎杖苷对骨质疏松性骨折后愈合情况的效果还未见报道,因此本研究基于SIRT1/FoxO1信号通路,探究虎杖苷对骨质疏松性大鼠骨折愈合的疗效及机制。
1 材料与方法
1.1 材料
1.1.1动物:SPF级别雌性SD大鼠,8~10周龄,体重245~272 g,购自南京伟沃生物科技有限公司,生产许可证号:SCXK(苏)2022-0005,所有大鼠均饲养于温度为(22±2)℃、相对湿度为(60±5)%、自动光/暗交替(12 h/12 h)的饲养房中,自由饮食进水,本研究经南阳医学高等专科学校伦理委员会批准(LZS2022-03-04)。
1.1.2药物与试剂:虎杖苷(批号RKL1093,原料药,纯度≥98.5%)购自江苏齐氏生物科技有限公司;阿仑膦酸钠片(批号20220225)购自成都天台山制药有限公司;I型胶原交联羧基末端肽(CTX-Ⅰ)、骨钙素(OC)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)ELISA试剂盒、Trizol试剂、反转录试剂盒、蛋白裂解液(批号分别为MY-59849、MY-42628、MY-63114、MY-70257、MY-17584、MY-51584、MY-21449)均购自宁波迈跃生物科技有限公司;HE染色试剂盒、PCR试剂盒、BCA试剂盒、ECL发光液(批号分别为BH-10409、BH-12594、BH-15986、BH-24585)均购自济南博航生物技术有限公司;兔源SIRT1、FoxO1、β-肌动蛋白(β-actin)一抗、羊抗兔二抗(批号分别为BF-11482、BF-20700、BF-10652、BF-24729)均购自杭州比格飞序生物科技有限公司。
1.1.3仪器:双能X线骨密度仪(型号XYH-1000B)、酶标仪(型号M200Pro)、显微镜(型号LW200ET-A)均购自郑州邦泰生物科技有限公司;小动物X线片机(型号Posvet-100HF)、荧光定量PCR仪(型号ForeQuant F6)、凝胶成像系统(型号BOT-870)均购自山东绿都生物科技有限公司。
1.2 方法
1.2.1模型的建立及分组给药:参照文献[10]构建骨质疏松性大鼠骨折模型:大鼠适应性喂养一周,经腹腔注射2 %戊巴比妥钠(50 mg/kg)进行麻醉,在无菌条件下切开大鼠背部双侧,摘除双侧卵巢后缝合创口并消毒;另取12只大鼠作为对照组,仅暴露卵巢,不切除。3个月后通过双能X线骨密度仪检测大鼠股骨骨密度(bone mineral density, BMD),以去卵巢大鼠股骨BMD与对照组大鼠股骨BMD相比显著降低且有统计学意义视为骨质疏松模型大鼠构建成功,成功造模48只骨质疏松模型大鼠。用2 %戊巴比妥钠(50 mg/kg)麻醉所有大鼠,将其右侧股骨皮肤切开,暴露关节面,锯断股骨干中段,克氏针固定断肢,闭合伤口并消毒。将建模成功的48只骨质疏松性骨折大鼠随机分为模型组、虎杖苷低剂量组、虎杖苷高剂量组、阿仑膦酸钠组,每组12只。建模结束后,虎杖苷低、高剂量组大鼠分别给予30 mg/kg、60 mg/kg虎杖苷灌胃给药[11](将虎杖苷和生理盐水混溶成浓度分别为3、6 mg/mL的混悬液,灌胃体积10 mL/kg);阿仑膦酸钠组大鼠给予0.5 mg/kg阿仑膦酸钠灌胃给药[12](将阿仑膦酸钠片和生理盐水混溶成浓度为0.05 mg/mL的混悬液,灌胃体积10 mL/kg);对照组和模型组大鼠给予等体积生理盐水灌胃。各组给药每天1次,连续8周。
1.2.2大鼠骨折愈合程度评分及骨折处BMD的测定:末次给药结束后次日,给大鼠拍摄X光片,进行骨折愈合程度评分[13],标准如下:骨折线清晰,无骨膜为0分;骨折处模糊,轻度骨膜反应,无骨痂为1分;骨折处边缘模糊,骨膜反应浅,少量骨痂生成为2分;骨折处痕迹不明显,骨痂生成增多,密度增加,边缘较清晰为3分;骨折处痕迹不可见,骨痂填满缺损部位,且密度与正常骨组织基本相同为4分。由三位专业人士对X光片进行评判,取平均值为骨折愈合程度评分,评分越高代表骨折愈合程度越好。同时采用双能X线扫描仪对大鼠骨折处BMD进行测定。
1.2.3大鼠血清中OC、CTX-1、TNF-α、IL-1β水平的测定:用2 %戊巴比妥钠(50 mg/kg)麻醉大鼠,使用非抗凝管心脏取血3 mL,4 ℃、5 200 r/min条件下离心15 min,取上清于一支新的离心管中,根据ELISA试剂盒说明书中的方法检测大鼠血清中OC、CTX-1、TNF-α、IL-1β水平。
1.2.4大鼠骨组织病理学变化检测:取血后处死大鼠,骨折处取大鼠骨组织,分为两部分。一部分置于- 80 ℃冰箱中保存;另一部分用4 %多聚甲醛固定24 h,脱钙,石蜡包埋,切片,HE染色,观察骨组织病理学变化。
1.2.5大鼠骨组织中SIRT1、FoxO1信使RNA(mRNA)水平的测定:取1.2.4中大鼠骨组织,加入液氮充分研磨,Trizol法提取骨组织总RNA,逆转录为cDNA,运用荧光定量PCR法检测SIRT1、FoxO1 mRNA水平,内参为GAPDH。引物由杭州比格飞序生物科技有限公司设计合成,引物序列见表1。反应条件和环境参照PCR试剂盒进行配置,通过2-△△Ct法计算靶基因mRNA水平。

表1 引物序列
1.2.6大鼠骨组织中SIRT1、FoxO1蛋白水平的测定:取1.2.4中大鼠骨组织,加入液氮充分研磨后,加入蛋白裂解液裂解,BCA试剂盒定量总蛋白,电泳分离后转膜,脱脂牛奶(5 %)在室温下封膜1 h,加入兔源SIRT1(1∶1 200)、FoxO1(1∶1 500)、β-actin(1∶1 600)一抗4 ℃下孵育过夜,加入羊抗兔二抗(1∶2 400),室温孵育1 h,ECL试剂显影,Image J软件分析蛋白条带灰度值,以β-actin为内参,计算SIRT1、FoxO1蛋白水平。
1.3 统计学分析
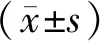
2 结果
2.1 虎杖苷对骨质疏松性骨折大鼠骨折愈合程度评分、骨折处BMD的影响
与对照组相比,模型组大鼠骨折愈合程度评分、骨折处BMD显著降低(P<0.05);与模型组相比,虎杖苷低、高剂量组,阿仑膦酸钠组大鼠骨折愈合程度评分、骨折处BMD显著升高(P<0.05);与虎杖苷低剂量组相比,虎杖苷高剂量组、阿仑膦酸钠组大鼠骨折愈合程度评分、骨折处BMD显著升高(P<0.05);阿仑膦酸钠组和虎杖苷高剂量组大鼠骨折愈合程度评分、骨折处BMD比较差异无统计学意义(P>0.05)。见表2。

表2 各组大鼠骨折愈合程度评分、骨折处BMD水平的比较
2.2 虎杖苷对骨质疏松性骨折大鼠血清中OC、CTX-1、TNF-α、IL-1β水平的影响
与对照组相比,模型组大鼠血清中OC水平显著降低,CTX-Ⅰ、TNF-α、IL-1β水平显著升高(P<0.05);与模型组相比,虎杖苷低、高剂量组,阿仑膦酸钠组大鼠血清中OC水平显著升高,CTX-Ⅰ、TNF-α、IL-1β水平显著降低(P<0.05);与虎杖苷低剂量组相比,虎杖苷高剂量组、阿仑膦酸钠组大鼠血清中OC水平显著升高,CTX-Ⅰ、TNF-α、IL-1β水平显著降低(P<0.05);阿仑膦酸钠组和虎杖苷高剂量组大鼠血清中OC、CTX-Ⅰ、TNF-α、IL-1β水平比较差异无统计学意义(P>0.05)。见表3。

表3 各组大鼠血清中OC、CTX-1、TNF-α、IL-1β水平的比较
2.3 虎杖苷对骨质疏松性骨折大鼠骨组织病理学变化的影响
对照组大鼠骨组织骨小梁结构正常;模型组大鼠骨组织的骨小梁变细、数量减少且连续性较差,同时骨小梁间距增宽;虎杖苷低、高剂量组大鼠上述病理学变化程度依次减轻,骨小梁明显增多且有序排列,有大量成骨细胞;阿仑膦酸钠组和虎杖苷高剂量组大鼠骨组织病理学变化无显著差异。见图1。

图1 各组大鼠骨组织病理学变化(HE染色,×200)
2.4 虎杖苷对骨质疏松性骨折大鼠骨组织中SIRT1、FoxO1 mRNA水平的影响
与对照组相比,模型组大鼠骨组织中SIRT1、FoxO1 mRNA水平显著降低(P<0.05);与模型组相比,虎杖苷低、高剂量组,阿仑膦酸钠组大鼠骨组织中SIRT1、FoxO1 mRNA水平显著升高(P<0.05);与虎杖苷低剂量组相比,虎杖苷高剂量组、阿仑膦酸钠组大鼠骨组织中SIRT1、FoxO1 mRNA水平显著升高(P<0.05);阿仑膦酸钠组和虎杖苷高剂量组大鼠骨组织中SIRT1、FoxO1 mRNA水平比较差异无统计学意义(P>0.05)。见表4。

表4 各组大鼠骨组织中SIRT1、FoxO1 mRNA水平的比较
2.5 虎杖苷对骨质疏松性骨折大鼠骨组织中SIRT1、FoxO1蛋白水平的影响
与对照组相比,模型组大鼠骨组织中SIRT1、FoxO1蛋白水平显著降低(P<0.05);与模型组相比,虎杖苷低、高剂量组,阿仑膦酸钠组大鼠骨组织中SIRT1、FoxO1蛋白水平显著升高(P<0.05);与虎杖苷低剂量组相比,虎杖苷高剂量组、阿仑膦酸钠组大鼠骨组织中SIRT1、FoxO1蛋白水平显著升高(P<0.05);阿仑膦酸钠组和虎杖苷高剂量组大鼠骨组织中SIRT1、FoxO1蛋白水平比较差异无统计学意义(P>0.05)。见图2、图3。

图2 各组大鼠骨组织中SIRT1、FoxO1蛋白印迹图

图3 各组大鼠骨组织中SIRT1、FoxO1蛋白水平的比较
3 讨论
引起机体骨质疏松的因素较复杂,且目前研究认为机体雌激素水平的失调是导致骨质疏松症的重要因素之一,当大鼠去掉卵巢后,常常伴随出现机体激素代谢紊乱、雌激素水平降低,增加骨质疏松的发生率[14]。骨质疏松症可诱发骨折,当机体成骨细胞功能正常时,骨细胞结构正常,并且排列整齐,由于各种因素引起机体产生骨质疏松时,机体成骨细胞结构和功能发生病理性变化,进而导致BMD的降低,增加骨折的风险[15]。CTX-Ⅰ是破骨细胞活性的标志物,OC是成骨细胞分泌的特异性蛋白,是成骨细胞功能敏感标志,OC和CTX-1水平可有效反应机体的成骨细胞和破骨细胞的活性[16]。TNF-α、IL-1β是反映机体炎症的常见指标,其水平越高代表炎症反应越剧烈[17]。本研究结果发现模型组大鼠骨折愈合程度评分、骨折处BMD、血清中OC水平较对照组显著降低,CTX-Ⅰ、TNF-α、IL-1β水平较对照组显著升高。病理学结果显示,对照组大鼠骨组织骨小梁结构正常,模型组大鼠骨组织的骨小梁变细、数量减少且连续性较差,同时骨小梁间距增宽,表明骨质疏松性骨折大鼠骨折愈合较差,BMD和成骨细胞活性降低,破骨细胞活性和炎症反应升高。
虎杖苷具有抗休克、保护神经、保护肝脏、免疫调节等方面的作用[18]。Zhan等[19]研究表明,虎杖苷能够调节涉及破骨细胞和成骨细胞分化和活性的基因,减轻氧化应激和基质金属蛋白酶活性,以及恢复Wnt/β-连环蛋白信号通路,保护患有慢性脊髓损伤小鼠的骨量流失。Yuan等[20]研究表明,虎杖苷通过促进成骨细胞分化对切除卵巢的小鼠表现出显著的抗骨质疏松作用。本研究发现使用虎杖苷处理的骨质疏松性骨折大鼠骨组织病理学变化程度减轻,骨小梁明显增多且有序排列,有大量成骨细胞,同时骨折愈合程度评分、骨折处BMD、血清中OC水平升高,CTX-Ⅰ、TNF-α、IL-1β水平降低,且呈现剂量依赖性,表明虎杖苷具有减轻骨质疏松性骨折大鼠炎症反应和促进骨折愈合的效果。
SIRT1/FoxO1信号通路是和细胞凋亡、炎症反应都相关的通路。Chen等[21]研究表明,积雪草酸可能通过激活SIRT1/FoxO1信号通路来减轻高脂肪饮食诱导的小鼠骨质疏松症,从而抑制氧化应激并促进成骨分化。Jiang等[22]研究表明,白藜芦醇能通过激活SIRT1/FoxO1信号通路,增强对氧化损伤的抵抗力,从而促进成骨细胞活性。本研究发现,模型组大鼠骨组织中SIRT1、FoxO1 mRNA和蛋白水平显著降低,虎杖苷处理的骨质疏松性骨折大鼠骨组织中SIRT1、FoxO1 mRNA和蛋白水平显著升高,结合Chen和Jiang等[21-22]的研究,本研究猜测虎杖苷可能通过激活SIRT1/FoxO1信号通路来促进骨质疏松性骨折大鼠的骨折愈合。
综上所述,虎杖苷可减轻骨质疏松性骨折大鼠炎症反应,具有促进骨折愈合的效果,其机制可能与激活SIRT1/FoxO1信号通路有关。但是,本研究仅从SIRT1/FoxO1信号通路的角度探究了虎杖苷对骨质疏松性骨折大鼠骨折愈合的效果,其能否通过其他信号通路对骨质疏松性骨折大鼠的骨折愈合产生影响,有待后续研究。
