DNA甲基化探讨中药干预骨质疏松症的研究进展
2023-09-12姚鹏程关永林马斌祥李振豪张洋邓梦常斌张思源
姚鹏程 关永林 马斌祥 李振豪 张洋 邓梦 常斌 张思源
1.甘肃中医药大学,甘肃 兰州 730000
2.甘肃省中医院,甘肃 兰州 730050
骨质疏松症(osteoporosis,OP)是一种以体内骨代谢平衡失调导致成骨细胞减少、破骨细胞增加而形成的一种骨小梁退化、骨结构脆性增加,易引发全身性骨折的中老年人常见疾病。骨质疏松的发生多由基因及生活环境、生活方式的影响,导致成骨细胞(osteoblast,OB)、破骨细胞(osteoclast,OC)活化和凋亡受到影响使骨骼重塑失调,造成骨稳态失衡[1]。全基因组关联研究(genome wide association studies,GWAS)研究发现骨质疏松及骨质疏松性骨折(osteoporotic fracture,OPF)的发病机制与DNA甲基化改变关系密切[2]。中医遵循人与自然相统一的观念,重视外部环境对人体的影响,通过药物调理使机体阴阳平衡,与表观遗传学关注的重点相似。中医认为骨质疏松属于“骨萎”的范畴,经临床实践及基础研究证实补益肝肾类中药治疗OP疗效显著[3]。笔者通过整理近期相关文献进行综述。
1 DNA甲基化介绍
DNA甲基化(DNA methylation)是目前研究最深入的表观遗传调控机制,作为一种对稳定的修饰状态,在特定DNA甲基转移酶的催化下,基因组CpG二核苷酸的胞嘧啶5号碳位通过共价键结合化学修饰获得甲基基团[4-5]。外环境对机体刺激,引起DNA甲基化修饰分子细胞调控基因表达,随DNA的复制遗传给子代[6],人体基因启动子区多数存在于富含双核苷酸“CG”周边区域,称其为“CPG岛”;CPG岛在染色质结构的组成及基因调控表达方面起着关键作用,DNA甲基化主要在CPG岛启动子区完成[7-8]。通过基础研究及实验发现[9]DNA甲基化异常可引发多种疾病,尤其是CPG岛启动子区的DNA甲基化,DNA的稳定性、不同染色质的构形改变调控基因的表达。目前,研究DNA甲基化对不同疾病的影响已成为全球生命科学探索的焦点,被称为研究后基因时代的引领者。
2 DNA甲基化在骨质疏松发生发展中的作用
DNA甲基化在研究OB和OC两方面,OB与OC代谢失调导致骨量减少,骨脆性增加、逐渐加重骨质疏松的发病进程。Delgado[10]在全基因组骨组织中分析骨质疏松和骨关节炎(osteoarthritis,OA)的甲基化区域差异,对23 367个CPG位点中13 463个基因进行甲基化分析,发现甲基化与基因表达在全基因组范围内呈负相关关系。DNA甲基化参与调节骨相关细胞的基因表达,如雌激素受体α(estrogen receptor alpha,EAα)、碱性磷酸酶(alkaline phosphatase,ALP)、骨保护素(osteoprotegerin,OPG)、核因子kB受体活化因子配体(receptor activator of NF-Kb ligand,RANKL)等[11]。OPG、RNAKL两细胞在调节骨吸收起到关键作用[12]。DNA甲基转移酶(DNA methyltransferase,DNMT)由DNMT3A和DNMT3B组成介导DNA甲基化抑制基因转录[13]。Nishikawa等[14]研究DNMT3A在骨稳态中占有重要地位、通过DNMT3A缺陷的OC前体细胞不能有效分化为OC,发现DNMT3A介导SAM介导的DNA甲基化通过表观遗传抑制OC生成基因来调节OC生成。Liu等[15]在研究胸苷磷酸化酶(thymidine phosphorylase,TP)对骨髓瘤骨吸收和骨形成的影响,发现在OB祖细胞中,TP上调RUNX2和osterix的甲基化,导致骨形成减少;在OC祖细胞中,TP上调IRF8甲基化,进而上调NFATc1(活化T细胞核因子,包浆1蛋白)表达,导致骨吸收增加。因此,在骨代谢过程中DNMT起到关键的调控作用。同时,研究发现DNA甲基化通过改变个体表观遗传及对骨稳态影响随DNA复制遗传给子代。Laurent等[16]研究人类分化过程中甲基组动态变化,证实DNA甲基化后DNA复制的基因组可以遗传给下代。因此,需更深入研究DNA甲基化对骨代谢的影响,阐明表观遗传机制,防治骨质疏松的发生发展。
2.1 DNA甲基化与成骨细胞
OB主要由骨膜和骨髓中的间充质干细胞(mesenchymal stem cells,MSCs)分化而来。Zhang等[17]研究多分化潜能骨髓(bone mesenchymal stem cells,BMSC)和脂肪组织(Adipose tissue,AT)人基质细胞中基因表达与过渡CPG甲基化的关系,发现BMSC中RUNX2及ATSC中PPARgamma2基因表达出现CPG的低甲基化和强表达,且MSCs向OB分化伴随基因启动子甲基化改变,得出OB在分化的过程中DNA甲基化起着重要的调控作用。在OB分化过程中RUNX2和OSX是必不可少的转录因子,且OSX也是RUNX2下游作用靶点[18]。同时,RUNX2和OSX相互作用参与骨细胞的分化与基因的相关表达[19-20]。
骨形态发生蛋白通过影像骨中多种细胞类型(MSCs、OB、OC等)具有骨形成和分解代谢的作用。其中BMP2具有骨诱导性,诱导RUNX2和OSX的表达促进OB分化、骨生长,已批准用于骨折愈合和脊柱手术等方面[21]。研究表明,DNA甲基化(上调)与BMP2子区甲基化(下调)对骨形成的表达起相反结果[22-23]。Raje等[23]发现OP患者骨密度与位于CpG岛甲基化程度相关,BMP2转录起于CpG位点,此位点的甲基化水平较高,造成BMP2转录活性、基因表达降低,得出BMP2在OB分化中具有重要的调控作用。
β-catenin信号分子在通过Wnt/β-catenin通路起着关键作用。Wnt可抑制细胞浆内β-catenin降解,调节基因转录,加速OB分化和成熟[24]。在对Wnt/β-catenin信号通路及MSCs研究,发现MSCs向OB转化中Wnt/β-catenin信号通路中甲基化分子发生相应改变[25]。García-Ibarbia等[26]从853例患者血液中提取DNA,对OPF和OA差异表达基因的24个单核苷酸多态性分析,得出OP患者的Wnt活性降低。以上研究表明,DNA甲基化可通过调控MSCs、BMP2、Wnt/β-catenin通路等分子的转录表达,参与OB的分化与成熟,影响骨质疏松的发生发展。
2.2 DNA甲基化与破骨细胞
核因子kB受体活化因子(receptor activator of NF-Kb,RANK)、配体(RANKL和OPG)位于OC表面,两配体由OB和骨髓基质细胞合成分泌[27-28]。RANK、OPG、RANKL在骨代谢过程中占据重要的地位,有效调控OC活性及分化[29]。研究ST2小鼠的MSCs发现,诱导分化后MSCs中的RANKL基因周围出现CPG甲基化,抑制RANKL表达,降低OB分化,表明诱导RANKL基因转录可调节CpG位点甲基化改变,影响OC分化[30]。Delgado-Calle等[31]探讨CPG甲基化对调节OC生成的RANKL和OPG转录水平的影响,发现DNA甲基化与RANKL和OPG表达抑制之间关联强烈,表明甲基化影响这些基因的转录,而其在OC生成中起关键作用。虽然Husain等[32]在人体研究中未发现OP患者与常人RANKL基因甲基化无明显差异。但Wang等[33]在对比非OP与OPF两组患者OPG与RANKL中CPG甲基化状态的差异,发现OP组RANKL基因的表达远高于非OP组,但RANKL基因甲基化水平却低于非OP组。分析得出,RANKL基因甲基化水平降低,促使RANKL和OPG降低可增加OC活性,加速骨量的丢失,促进骨质疏松的发生。因此,RANK、RANKL、OPG在骨稳态平衡过程中具有重要调控作用[34]。见图1。
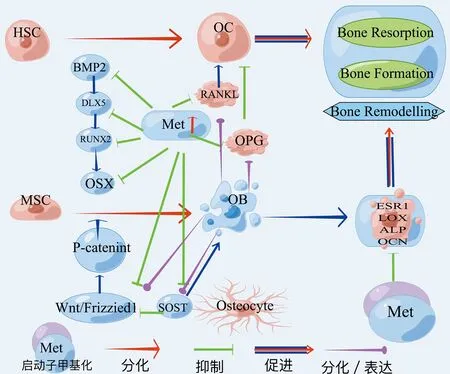
图1 DNA甲基化对成骨、破骨细胞平衡过程的调节作用
3 中医理论与DNA甲基化
祖国医学在诊疗时注重整体观念,强调人与自然相统一,通过改善患者饮食起居、舒畅情志配合药物调理使机体内阴阳平衡,促使疾病治愈;研究发现表观遗传学也将外界环境与自身遗传两因素相结合,使基因组具有较高的稳定性,更加适用于外界环境改变机体做出准确的反应[35]。因此,表观遗传学与中医整体观念、人与自然相统一的理念相符合。对于骨质疏松的发病进程,中医认为与脏腑功能密切相关,脾肾为先后天之本,可因外界环境、饮食结构的改变导致脾肾功能失调,诱发骨质疏松的发生[36]。现经表观遗传学研究发现,饮食结构改变通过影响宿主肠道菌群的稳态可参与骨质疏松的发病过程[37]。另有研究发现多种疾病都同时包含高、低不同的异常甲基化状态,这与中医对体内阴阳失衡而导致疾病的发生观点相一致[38]。因此,应用表观遗传学方式对骨质疏松的发病机制进行研究,具有深远的研究意义。
4 中药干预DNA甲基化防治骨质疏松
近年来,随着我国对中医药事业的大力发展、生命科学及人类疾病谱系的深入研究,认识到中药多靶点、多成分的特性,难以产生耐药性,且副作用较少,尤其在治疗OP方面具有独特优势[39]。目前中药调控DNA甲基化的研究集中在全基因组、单一化合物和中药复方的异常甲基化状态[40],发现补益肝肾类药物(如淫羊藿、骨碎补、补骨脂、续断等中药及复方)具有强筋健骨、促进骨量吸收、调节骨代谢等作用,对DNA甲基化有较强的调控作用[41],能够防治骨质疏松的发展。观察葛根素对骨质疏松的影响,发现能有效抑制雌激素受体α(estrogen receptor α,ERα)甲基化,增强ERα mRNA表达促进OB成熟分化[42]。赵刚等[43]通过CCK-8法验证葛根素和柚皮苷对小鼠OB增值效应的影响,发现葛根素与柚皮苷均刺激碱性磷酸酶的分泌促进OB的合成。中药在对疾病相关靶点进行干预时,具有多成分、多环节、多基因相互作用的特点,中药复方治疗疾病时更具有相互协同作用,增强临床疗效。王剑等[44]通过在骨质疏松大鼠上给予补肾健骨中药复方(鹿茸、续断、牡蛎等),观察对骨组织leptin启动子甲基化的影响,发现有效降低Runx2、Osterix启动子甲基化及下丘脑leptin蛋白水平,同时上调其骨组织蛋白的表达,有效防治骨质疏松的发生[45]。同实验观察鹿茸中药复方对骨质疏松大鼠疗效机制的研究,其复方可降低Runx2、Osterix启动子甲基化,防治骨质疏松发生[46],可见多成分的中药复方对基因甲基化的影响具有双向调节的作用。金匱肾气丸干预去势大鼠观察大鼠组织中ERα基因甲基化水平,发现去势大鼠其基因表达与雌激素受体甲基化水平呈负相关,表明金匱肾气丸对去势骨质疏松大鼠雌激素受体甲基化水平有抑制作用[47]。另有研究,补肾药方(左归丸、右归丸)在不同节点干预成骨、成脂不同诱导环境中的MSCs,通过检测PPARy、β-catenin甲基化及基因的表达,探讨补肾药物对表观遗传学机制的影响,发现补益肝肾类药可调节控制MSCs基因的表达,促进成骨抑制成脂分化,调控骨脂分化平衡[48]。由此可见,单味中药及复方治疗疾病可通过表观遗传学作用机制改变人体微环境、调控疾病DNA甲基化整体水平及疾病发展中关键基因的DNA甲基化状态,干预疾病的发展,从而实现对疾病的防治。
综上所述,补益肝肾类药物在防治OP的发展具有良好的临床疗效,其药物作用机制是通过影响OB、OC及MSCs等DNA甲基化转录表达,促进OB分化和抑制OC活性、增加骨量,进而防治骨质疏松的发病进程。
5 总结
骨质疏松是一种由多因素引发的骨代谢性疾病,其发病涉及多种机制,目前对其发病机制尚不清晰,因此,对于OP的治疗还未有根治的手段。随着表观遗传学对骨质疏松进行深入研究,人们对其发病机制的认知到达了微观层面,DNA甲基化可通过调控OB、OC、MSCs、BMP2、RANK、RANKL、OPG、Wnt/β-catenin通路等分子的转录与表达,参与到OB和OC的分化,影响骨质疏松的发病进程。通过网络药理学分析发现,中药治疗疾病具有多靶点、多途径等特点,与病变相关基因、蛋白进行多位点结合;通过DNA甲基化对关联基因转录表达影响骨质疏松的病理变化。目前对于中药干预骨质疏松基因变化还未进行深入研究,相关研究报道较少。从中医整体观来看,与表观遗传学关注重点相似,因此,可从DNA甲基化的角度来探讨OP的防治,更好地服务于骨质疏松患者。
目前对于骨质疏松中药干预其DNA甲基化的研究存在以下问题:骨质疏松是一个逐渐发展、演变的过程,中药对骨质疏松的干预机制未能明确阐述;且现有的基础实验研究笼统地阐述中药对引发骨质疏松相关基因、细胞、DNA甲基化的影响,未能明确点明对某一环节或途径产生影响、进而改变基因表达,研究深度不够;其次,中药干预临床观察研究纳入样本量较少,不能完成大样本量的随机对照观察和客观的系统评价。
