不同核酸提取程序及扩增仪组合检测呼吸道病毒的差异
2023-09-08钟福春陈甜张抒彧唐尧罗荟辰季文轩薛飞张爱芳薛恒
钟福春 陈甜 张抒彧 唐尧 罗荟辰 季文轩 薛飞 张爱芳 薛恒
急性呼吸道感染是引起门诊就诊和住院治疗的主要原因之一,其中80%以上由病毒所致[1]。传统的病毒分离培养方法操作烦琐,临床常规开展受限[2]。病毒抗原进行准确、快速检测,有助于早期诊断,指导临床精准选择用药,阻止疾病流行,并减少经验性检测敏感性较低,易受其他因素干扰的影响[2]。血清抗体检测具有滞后性,主要用于病毒流行病调查[3]。基于病毒核酸的实时荧光定量RT-PCR方法因其所具备的优势,是早期筛查和诊断呼吸道病毒感染的主要方法之一[4]。其中,对样本进行核酸提取和对提取物进行扩增是目前通用的病毒核酸检测步骤,然而核酸提取体系和扩增系统常常随机混搭组合,形成多套检测系统。这些不同的检测系统在核酸检测性能方面是否存在差别,须通过对比分析进行验证。达安基因核酸提取或纯化试剂(磁珠法)为常用的病毒核酸提取试剂,根据其说明书有常规核酸提取程序和快速核酸提取程序可供选择。本研究选用这两种核酸提取程序与不同的实时荧光定量PCR仪进行混搭组合,通过比较阳性检出率、Ct值和批内重复性来探索不同检测系统的性能差异,预期为实验室选择最适的检测方案提供参考。
1 资料与方法
1.1 试剂和仪器
核酸提取或纯化试剂(广州达安基因股份有限公司,粤穗械备20170583,32反应/盒);核酸检测试剂盒(广州达安基因股份有限公司,国械注准20203400749,96人份/盒);Smart32核酸提取仪(广州达安基因股份有限公司);ABI7500荧光定量PCR仪(美国应用生物系统公司);AGS8830-16实时荧光定量PCR仪(广州达安基因股份有限公司)。
ABI7500和AGS8830-16荧光定量PCR仪分别为普通和快速实时荧光定量PCR仪。将核酸提取试剂的常规核酸提取程和快速核酸提取程序分别和两种扩增系统进行混搭构建四种检测系统,A为常规核酸提取程序+ABI7500荧光定量PCR仪,B为快速核酸提取程序+ABI7500荧光定量PCR仪,C为常规核酸提取程序+AGS8830-16实时荧光定量PCR仪,D为快速核酸提取程序+AGS8830-16实时荧光定量PCR仪。
1.2 一般材料
假病毒第三方弱阳性室内质控品为从广州邦德盛生物科技有限公司购买的病毒核糖核酸液体室内质控品(批号 :2022201)平均浓度为5.1×102copies/mL,浓度参考范围:2.03×102~1.28×103copies/mL。将弱阳性室内质控品用去离子水按1∶2、1∶5、1∶10、1∶50、1∶100和1∶500进行稀释。分别采用A、B、C和D检测系统对每个浓度质控品进行20次重复检测。
1.3 方法
1.3.1 核酸提取
弱阳性室内质控品充分震荡混匀后,于核酸提取96深孔板第1、7列孔内加入200 μL样本或质控品、20200 μL蛋白酶K。将深孔板放入Smart32全自动核酸提取仪底座,磁棒套推入卡槽。按核酸提取试剂说明书设置57 min的常规核酸提取程序和18 min的快速核酸提取程序,分别对不同浓度的弱阳性室内质控品进行核酸提取,具体步骤见核酸提取仪和核酸提取试剂说明书。
1.3.2 核酸扩增
按扩增试剂说明书配置反应的体系、设置荧光定量PCR仪扩增反应的程序和荧光收集的通道。扩增反应结束后按扩增试剂说明书进行结果判定。具体步骤按仪器和扩增试剂说明书进行设置和操作。该扩增试剂可同时检测3个靶基因,靶基因1和靶基因2为病毒相关基因,靶基因3为人源性内标基因,用于监控采样质量。由于扩增试剂设置了扩增反应程序不采集前10个循环的荧光信号,因此,Ct值=原始Ct值+10。
1.4 统计学方法
使用SPSS 23.0统计学软件进行数据分析。计量资料运用(±s)表示,各组间靶基因Ct值选用单因素方差分析来比较,当方差齐性时两组间比表较选用LSD-t检验来比较,不齐时采用Tamhane's检验;计数资料采用n(%)表示。P<0.05为差异有统计学意义。
2 结果
2.1 4种检测系统在不同浓度假病毒弱阳性室内质控品中靶基因的检出率
在假病毒弱阳性室内质控品原浓度和1∶2稀释度时,4种组合均100%检出靶基因1及靶基因2。1∶5稀释度时,A、B检测系统均可100%检出靶基因1及靶基因2;C、D检测系统均可100%检出靶基因2,但靶基因1的检出率分别为90.00%和80.00%。随弱阳性室内质控品浓度的降低,4种检测系统靶基因的检出率均随之下降,其中靶基因检出率由高到低为A>B>C>D,见表1。

表1 4种检测系统在不同浓度假病毒弱阳性室内质控品中的靶基因检出率(%)
2.2 4种检测系统在不同浓度假病毒弱阳性室内质控品中的靶基因Ct值
4种检测系统在质控品原浓度和1:2稀释度时均可100%检出靶基因,故比较这两浓度扩增的Ct值。原浓度时,A、B、C和D系统扩增靶基因1的Ct值分别为(31.35±0.90)、(32.00±0.79)、(32.40±0.97)和(33.12±1.15),差异有统计学意义(F=11.286,P< 0.05);A系统靶基因1的Ct值小于B系统(LSD-t=-2.080,P<0.05)、小于C系统(LSD-t=-3.364,P=0.001)、小于D系统(LSD-t=-5.673,P<0.0001),B系统靶基因1的Ct值低于D系统(LSD-t=-3.593,P<0.001),C系统靶基因1的Ct值低于D系统(LSD-t=-2.309,P<0.05);A、B、C和D系统靶基因2的Ct值分别为(30.99±0.81)、(31.49±0.68)、(32.08±0.78)和(32.41±0.80),差异有统计学意义(F=12.749,P<0.05),A系统靶基因2的Ct值小于B系统(LSD-t=-2.017,P<0.05)、小于C系统(LSD-t=-4.378,P<0.0001)、小于D系统(LSD-t=-5.694,P<0.0001),B系统靶基因2的Ct值小于C系统(LSD-t=-2.361,P<0.05)、小于D系统(LSD-t=-3.677,P<0.001),见图1a。1∶2稀释度时,A、B、C和D系统靶基因1的Ct值分别为(32.88±0.47)、(33.07±0.62)、(33.62±0.55)和(34.32±0.70),差异有统计学意义(F=22.748,P<0.05),A系统靶基因1的Ct值小于C系统(LSD-t=-3.847,P<0.001)、小于D系统(LSD-t=-7.501,P<0.0001),B系统靶基因1的Ct值小于C系统(LSD-t=-2.889,P<0.01)、小于D系统(LSD-t=-6.543,P<0.0001),C系统靶基因1的Ct值低于D系统(LSD-t=-3.654,P<0.001);A、B、C和D系统靶基因2的Ct值分别为(32.70±0.52)、(32.97±0.62)、(33.19±0.62)和(34.12±0.81),差异有统计学意义(F=16.961,P<0.0001),A系统靶基因2的Ct值小于C系统(LSD-t=-2.338,P<0.05)、小于D系统(LSD-t=-6.713,P<0.0001),B系统靶基因2的Ct值低于D系统(LSD-t=-5.415,P<0.0001),C系统靶基因2的Ct值低于D系统(LSD-t=-4.375,P<0.0001),见图1b。
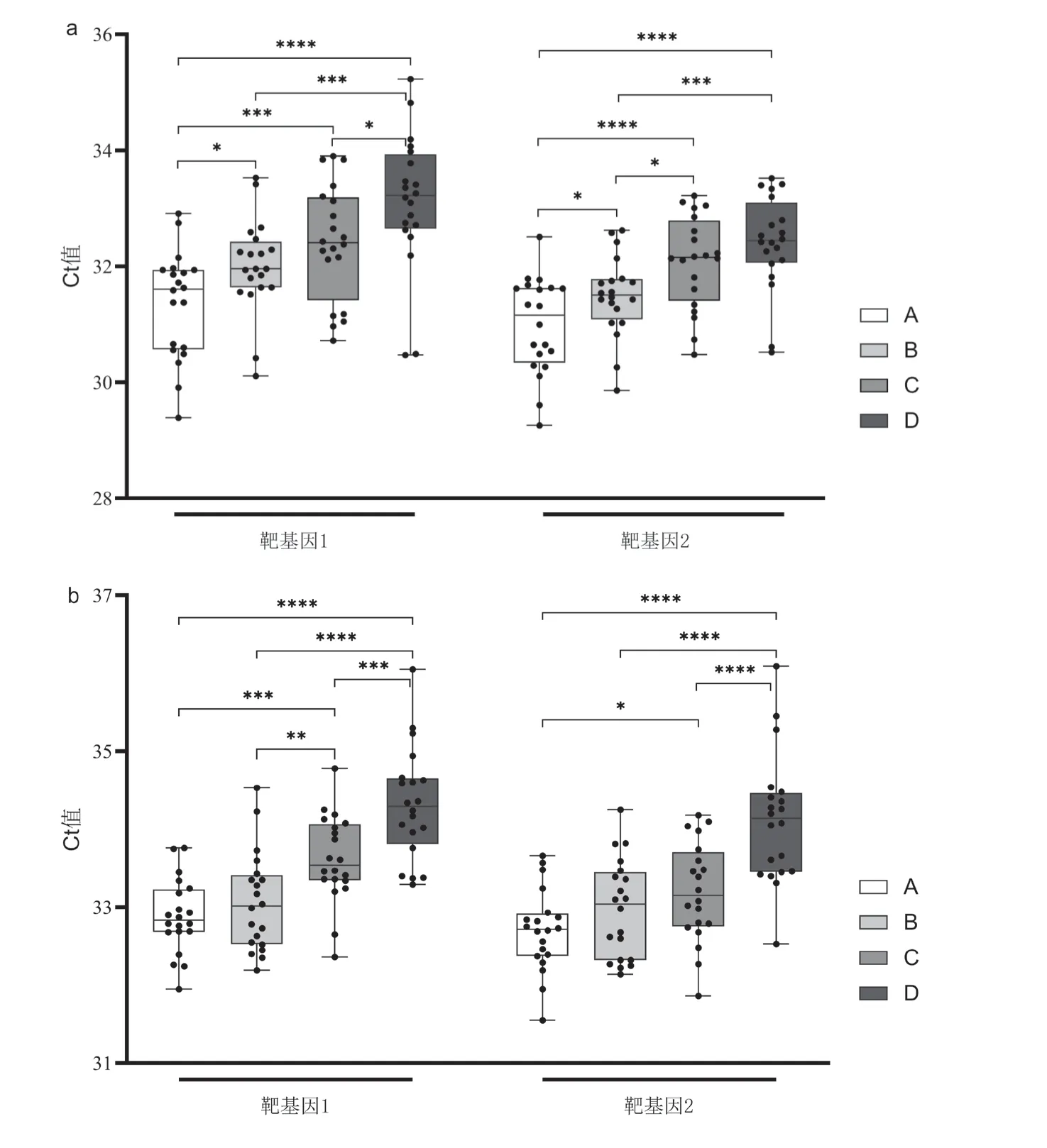
图1 4种检测系统在不同浓度假病毒弱阳性室内质控品中的靶基因Ct值
2.3 4种检测系统的检测耗时和批内重复性比较
常规核酸提取程序和快速核酸提取程序核酸提取耗时分别为57 min和18 min,ABI 7500荧光定量PCR仪和AGS8830-16实时荧光定量PCR仪扩增耗时分别为63 min和42 min。4种检测系统检测耗时由低到高为:D<C<B<A。A、B、C和D检测系统在弱阳性室内质控品原浓度和1∶2稀释度时检测靶基因1和靶基因2Ct值的变异系数(CV)均<5%,均符合核酸提取和扩增试剂说明书批内重复性≤5%的标准,见表2。
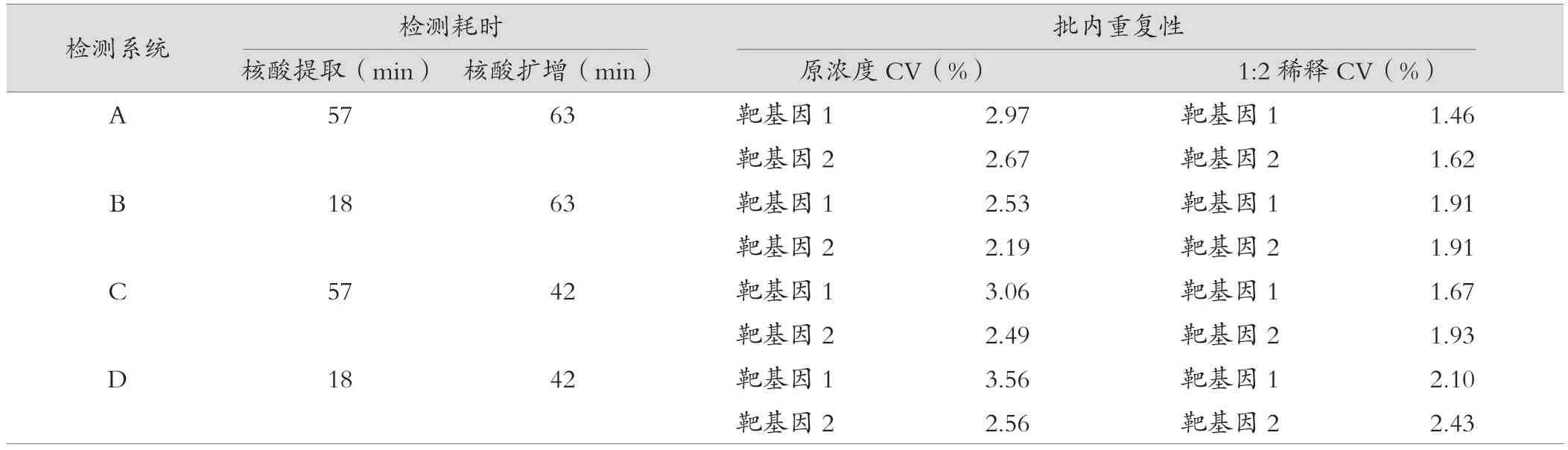
表2 4种检测系统的检测耗时和批内重复性比较
3 讨论
急性呼吸道病毒感染的常规检测方法包括基于病毒蛋白的抗原检测、基于人体免疫反应的抗体检测和基于病毒核酸的核酸检测。抗原和抗体检测无需专用分析仪器,通常30 min内即可判读[5-6]。但是,需体内病毒载量足够高时,才可得到准确结果,且存在交叉反应[5]。与其他检测方法不同,实时荧光RT-PCR的特异性几乎为100%,同时又具有较高的敏感性,病毒感染早期即能诊断[4]。这些特性使实时荧光RT-PCR成为病毒感染诊断的主要方法之一。在实际临床检测过程中,每个基因扩增实验室通常使用多种核酸提取系统、扩增试剂和扩增系统,不同品牌的试剂和设备多混搭组合建立起多种核酸检测系统。这些不同的检测系统在核酸检测性能方面是否存在差别,必须通过对比分析进行验证。
实时荧光RT-PCR检测病毒起始核酸模板质量,尤其当体内病毒载量十分低时能否顺利检出病毒核酸,直接关系到检测结果是否准确,是否导致漏检[7]。为了更好地体现4种检测系统在病毒核酸检测中性能差异,本研究选择了第三方弱阳性室内质控品作为研究材料,并对其进行了不同程度的稀释。对上述样本进行核酸提取和扩增,就可以更好地摸清不同检测系统的靶基因检出能力及假阴性差异。
本研究中在弱阳性室内质控品原浓度和1∶2稀释度时,A、B、C和D检测系统均可以100%检出靶基因;但检测系统C和D在1∶5稀释度时靶基因1的检出率分别为90%和80%,而靶基因2可100%检出,提示靶基因1和靶基因2的检测敏感性存在着差异。随着弱阳性室内质控品浓度的降低,A、B、C和D检测系统靶基因的检出率均随之下降,检出率由高到低为A>B>C>D,提示不同检出系统靶基因检出率存在着差别。进一步对靶基因的Ct值进行比较,结果发现在弱阳性室内质控品原浓度和1∶2稀释度时,A检测系统靶基因1和靶基因2的Ct值最低,D检出系统最高,差异有统计学意义(P<0.05)。因此,可认为A检测系统靶基因的Ct值越低,靶基因的检出率越高,在病毒载量十分低时,其检测优势就越发明显。由于4种检测系统在弱阳性室内质控品原浓度和1∶2稀释度时均可100%检出靶基因,因此对这两浓度质控品提取扩增后的C进行结果接近程度的评估,结果显示4种检测系统的批内重复性均在5%的范围内,检测结果均稳定,符合要求。在检测耗时方面,常规核酸提取程序耗时57 min、快速核酸提取程序耗时18 min,普通实时荧光定量PCR仪耗时63 min、快速实时荧光定量PCR仪耗时42 min;因此,D检测系统总体检测耗时最低,A检测系统最高,D检测系统可明显缩短全程检测耗时,在特殊原因需要尽快得到核酸检测结果的情形下具有明显优势。
既往研究发现,不同品牌核酸提取系统、扩增试剂和扩增系统的核酸检测结果可出现一些差异[8-12]。黄裕游等[8]采用4种品牌的核酸提取试剂对第3方质控品进行了核酸提取,扩增提取物后发现不同提取试剂在阳性率、靶基因Ct值有差异。本研究使用同一种核酸提取系统,选用不同核酸提取程序进行核酸提取,检测结果发现不同的核酸提取程序不仅在核酸提取耗时,而且在靶基因检出率和扩增Ct值上也存在不同程度的差异。黄玉兰等[9]选用3种普通扩增系统分别进行标本检测,发现不同品牌扩增仪的检测原理和使用维护状况不同可引起检测结果不同。本研究对普通实时荧光定量PCR仪和快速实时荧光定量PCR仪进行比较,也得出相似的结果。李卓敏等[10]采用不同的核酸提取仪与不同的扩增仪组合检测阴性样本和弱阳性室内质控品,发现不同系统组合在检测效能上存在差别。本研究选用同一核酸提取试剂不同核酸提取程序与不同的扩增系统进行组合建立4种检测系统,也发现这些不同试剂和仪器设备随机混搭组也可对检测结果产生影响,甚至出现漏诊的风险。
综上所述,本研究采用不同的核酸提取程序与不同的扩增系统组合建立了4种核酸检测系统,结果显示4种检测系统的检测性能存在差别。同时也显示,同一核酸提取系统不同的核酸提取程序也可对病毒核酸检测结果产生影响。因此,实验室应根据自身条件和检测需求选择最适的核酸检测体系。本研究的不足在于使用弱阳性室内质控品代替病毒感染患者样本来比较不同检测系统的性能,弱阳性室内质控品为假病毒,而且与患者样本在基质上存在着不同,可能影响检测的结果。
