m6A去甲基化酶FTO通过调控p53磷酸化抑制急性髓系白血病的发生发展
2023-09-07华春兰李海军喻静
华春兰,李海军,喻静
(郑州大学第一附属医院 河南省检验医学重点实验室,河南 郑州 450052)
急性髓系白血病(acute myeloid leukemia,AML)是血液系统的恶性肿瘤,发病率高,预后差。m6A甲基化是20世纪70年代被发现的一种RNA分子上的甲基化修饰,存在于各种RNA中,但主要在mRNA中出现[1]。它主要是通过影响mRNA与读取蛋白的结合,从而调控mRNA的可变剪接、翻译效率和稳定性等,进而改变基因表达[2]。在细胞癌变的过程中,m6A甲基化这一表观遗传修饰能通过调控癌基因、抑癌基因的mRNA分子的表达水平来影响肿瘤的发生发展。FTO是m6A的去甲基酶,其主要生理功能为调节机体的代谢速率、能量平衡、体重及体脂聚集。有研究报道FTO基因非编码区域的多个SNPS与乳腺癌、胰腺癌等恶性肿瘤的患病风险有关[3-4]。FTO通过对下游靶基因RNA m6A进行去甲基化修饰,调控下游靶基因的表达,从而促进AML、肺癌以及消化系统肿瘤的发生发展。此外,研究证明,在混合谱系白血病重排的AML细胞系中转染FTO基因后,AML细胞的生长及增殖能力增强,凋亡减少,同时细胞中mRNA m6A水平下降;而转染突变体FTO基因(去甲基化功能丧失)后,AML细胞则无上述改变,说明FTO在调控AML发生发展中起重要作用[5-7],但FTO通过何种机制调控AML的发生发展并不清楚。因此,进一步研究FTO调控AML发生发展的机制,突破常规,为AML的分子病理诊断和分子靶向治疗探寻新方向,才可能改变治疗现状,为患者提供更有效的治疗手段。
1 材料与方法
1.1 主要材料、试剂和仪器
293T细胞、K562细胞和HL60细胞为本实验室保存。临床材料取自郑州大学第一附属医院2018年1月至2019年1月的27例AML患者和15例健康对照者骨髓。本研究经医院伦理委员会讨论通过,编号为ZZU-LAC20230331[09]。所有患者均签署知情同意书。流式相关抗体CD45-Percp、p-p53-FITC(Alexa Fluor 488)购自e-Bioscience。凋亡相关试剂:Annexin Ⅴ-PE/7-AAD apoptosis Kit FITC、IntraSure kit均为美国BD公司产品。逆转录试剂盒购自美国Transgene公司。Fast Start Universal SYBR Green Master购自瑞士Roche公司。PBS、RPMI1640培养基、Gibico胎牛血清购自美国Gibico公司。普通PCR仪为美国ABI公司产品;LSRⅡ流式细胞仪为美国BD公司产品。
1.2 PCR检测白血病患者及健康对照者外周血中FTO表达情况
采用荧光定量PCR(real-time PCR,RT-PCR)法。利用Qiagen RNeasy Mini Kit试剂盒提取AML患者和健康对照者标本总RNA,利用全式金反转录试剂盒,用Oligo(dT)18,2×TS Reaction Mix,TransScript RT/RI Enzyme混合物以RNA为模板,逆转录合成cDNA。根据荧光定量PCR试剂盒说明书进行荧光定量PCR分析。PCR反应体系:10 μL SYBR Green,3 μL模板,10 μmol·L-1的上、下游引物各1 μL,去离子水5 μL。PCR反应条件:95 ℃、10 min;95 ℃、15 s),60 ℃、60 s,45个循环;每个标本3复孔,按照上述条件进行扩增,使用2-△△Ct法计算mRNA相对表达量。FTO引物序列:前向5’-ACTTGGCTCCCTTATCTGACC-3’,反向5’-TGTGCAGTGTGAGAAAGGCTT-3’。GAPDH引物序列:前向5’-GAAGGTGAAGGTCGGAGTC-3’,反向5’-GAAGATGGTGATGGGATTTC-3’。
1.3 细胞转染
FTO-siRNA购自Invitrogen公司,共2个FTO-siRNA(简称为hFTO-siRNA1、hFTO-siRNA2)、1个hFTO-siNC。按照慢病毒包装试剂盒说明书转染293T细胞并收集富含慢病毒颗粒的上清液。将细胞(每孔5×105)接种至6孔板中,保证细胞在孔中均匀分布。将慢病毒转染液和阴性对照分别加入相应培养孔中,置37 ℃、5% CO2、饱和湿度下继续进行培养。约6 h后去除转染混合液,更换为新鲜培养基,之后将培养板置于培养箱中培养48 h。
1.4 流式细胞仪检测细胞凋亡
细胞凋亡检测使用Anncxin V-PE/7-AAD试剂盒(BD公司)。每管样品(50 μL)细胞数为5×105个,依次加入Annexin V-PE(5 μL)及7-AAD(5 μL),混匀后室温避光孵育15 min。再加入400 μL的Binding buffer 重悬并过膜,1 h之内上机检测。
1.5 流式细胞仪检测细胞内磷酸化
细胞内磷酸化检测使用BD公司检测试剂盒,每管样品(50 μL)细胞数为1×107个。样品管按照检测项目分别加入相应的抗体,冰上孵育30 min。每管加入100 μL试剂A,混匀并室温避光放置5 min。每管加入1 mL固定裂红液,室温避光孵育10 min后2 000 r·min-1离心8 min并弃上清,留约50 μL液体。每管加入50 μL试剂B及p53s46抗体,室温孵育1 h,每管用1 mL PBS洗1遍,2 000 r·min-1离心(Eppendorf 5810离心机,半径30.5 cm)8 min并弃上清,重悬至300 μL,上机检测。
1.6 统计学分析
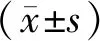
2 结果
2.1 FTO在AML中高表达
本研究对27例人AML骨髓标本和15例正常骨髓标本中FTO基因表达进行RT-PCR检测,结果显示在人AML骨髓细胞中,FTO的表达水平高于健康对照者(图1A)。利用生物信息学方法对TCGA数据库进行分析,结果显示在白血病中FTO表达水平与健康对照者相比升高(图1B);FTO高表达组总体生存率约为100个月,较FTO低表达组(总体生存率约为200个月)低(P<0.01)(图1C);Pearson相关性分析显示FTO与p53之间存在相关性(P<0.001)(图1D)。

A为FTO在人AML中的表达;B为TCGA数据库中FTO的表达水平;C为FTO的表达与生存率;D为FTO与p53之间的相关性;*为P<0.05;**为P<0.01。
2.2 FTO表达降低后促进白血病细胞的凋亡
为了检测FTO表达降低后HL60和K562细胞的细胞凋亡情况,首先用FTO的siRNA对FTO进行敲降,使FTO表达降低,敲降效率见表1;接着使用流式的方法通过Annexin V和7-AAD标记检测HL60和K562细胞的凋亡情况,其中Annexin V阳性细胞为凋亡细胞,Annexin V阴性细胞为活细胞,结果显示FTO表达降低后白血病细胞的凋亡增加,见图2、表2。
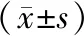
表1 FTO-siRNA的敲降效率

表2 不同处理组HL60和K562细胞发生凋亡比率
2.3 FTO表达降低后p53磷酸化水平升高
生物信息学分析显示FTO与p53存在相关性,并且在细胞系中FTO表达降低后白血病细胞凋亡增多,为了探讨白血病细胞凋亡是否与p53的磷酸化有关,采用流式方法检测p53的磷酸化水平,发现FTO表达降低后p53磷酸化水平升高,见图3、表3。
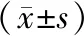
表3 p53磷酸化平均荧光强度

A为FTO表达降低后HL60细胞中p53磷酸化水平;B为FTO表达降低后K562细胞中p53磷酸化水平。
3 讨论
随着免疫学、细胞遗传学和分子生物学等技术的应用,有研究认为白血病的发生可能是细胞遗传学和表观遗传学共同作用的结果。人类AML细胞具有独特的基因表达谱,在AML细胞中的许多突变基因都编码具有表观遗传调控或修饰功能的蛋白质分子,如DNMT3A、TET2、IDH、EZH2、KMT2A和KDM5A等,提示表观遗传修饰的改变是AML发生的重要机制[8-9]。
RNA m6A甲基化于20世纪70年代被发现,是一种最常见的甲基化修饰,其由一系列甲基转移酶(METTL3/14、WTAP、RBM15/15B、KIAA1429,即m6A编码器)、去甲基酶(FTO和ALKBH5,即m6A消码器)和识别码(YTHDF1/2/3、YTHDC1、 HNRNPA2B1、 HNRNPC、eIF3、FMR1、LRPPRC,即m6A读码器)协调的动态可逆过程[10-11]。FTO是m6A的去甲基酶,属于AlkB家族高度同源蛋白,表达于细胞核[12]。2007年Frayling等[13]在研究与肥胖发生相关基因时首次命名,然后迅速成为各科研领域研究的热点。Pitman等[14]发现敲除FTO基因后神经母细胞瘤细胞株SH-SY5Y细胞中ATP水平显著增高,而磷酸化的AMP蛋白激酶和蛋白激酶B表达下降,这提示FTO基因敲除可导致肿瘤细胞内能量平衡的破坏。Zhang等[15]研究发现,雌激素可通过PI3K-Akt和丝裂素活化蛋白激酶信号通路对FTO基因进行调控,敲除FTO基因可明显抑制子宫内膜癌细胞株的增殖活性。Liu等[16]发现FTO蛋白可通过降低其靶基因ASB2、RARA等mRNA中m6A水平,促进这些基因表达,从而促进AML的发生,同时研究还发现FTO可抑制全反式维甲酸诱导的白血病细胞向粒细胞和单核细胞的分化。Su等[17]发现用羟戊二酸抑制FTO的去甲基化酶活性,可促进MYC和CEBPA转录本中m6A水平,抑制AML的发生发展。这些研究使FTO基因成为一种新兴的肿瘤治疗靶点。本研究显示在人AML细胞中,FTO的表达水平高于正常细胞。另外,通过基因生物信息学的方法比较白血病患者与健康者样本中FTO的表达水平,发现白血病患者中FTO表达水平升高;分析白血病患者总体生存率发现,FTO高表达组患者的总体生存率约为100个月,FTO低表达组患者的总体生存率约为200个月,FTO高表达组患者的总体生存率低于FTO低表达组。在细胞系HL60和K562中,利用FTO-siRNA将FTO进行敲降使其表达降低后,发现HL60和K562细胞的凋亡增加,表明FTO表达降低后可促进白血病细胞的凋亡。以上结果表明FTO在白血病发生发展过程中发挥着重要的作用。
p53是定位于细胞核的一种抑癌因子,在抑制肿瘤的发生进展和转移等方面起着重要的作用,其编码基因定位于人染色体17p13上,全长20 kb,共编码393个氨基酸[18]。p53蛋白从氨基端到羧基端包括2个转录激活结构域、1个富含脯氨酸的结构域、1个DNA结合结构域、1个四聚体寡聚化结构域和1个调节结构域[19]。当细胞接受DNA损伤、活性氧及缺氧等信号刺激时,p53蛋白会发生乙酰化、甲基化、磷酸化、泛素化等修饰,活化并激活下游信号通路,通过阻滞细胞周期、修复DNA损伤、激活细胞凋亡及自噬等多种机制抑制肿瘤形成[20]。有研究证实MDM2可以通过抑制p53与p300的结合,降低p53的乙酰化水平进而降低p53的转录活性,形成p53-MDM2负反馈调节通路,以此来调控肿瘤细胞的凋亡[21-22]。另外有研究显示,p53还在心血管疾病中起着重要的作用,p53失活后可以加速动脉粥样硬化的进展[23]。本研究首先利用生物信息学分析的方法,通过Pearson相关系数和P值发现FTO与p53之间存在相关性,并且FTO表达降低后白血病细胞的凋亡增加,为了验证FTO敲降后p53的变化,采用流式方法检测了p53的磷酸化水平,发现在细胞系HL60和K562中,FTO表达降低后p53磷酸化平均荧光强度增加,表明FTO表达降低后p53磷酸化水平升高。
4 结论
在AML中FTO表达升高,FTO表达降低可使p53磷酸化水平升高,FTO可以通过调控p53磷酸化,抑制AML的发生发展,这可以为AML的诊疗寻找新的靶点并提供理论依据。
