基于3A组装的多拷贝基因策略优化重组水蛭素变体Ⅲ的生产
2023-09-01王亚丽刘秀霞杨艳坤白仲虎
王亚丽,刘秀霞,杨艳坤,白仲虎*
1(江南大学,粮食发酵与食品生物制造国家工程研究中心,江苏 无锡,214122) 2(江南大学,工业生物技术教育部重点实验室,江苏 无锡,214122)3(江南大学 生物工程学院,江苏 无锡,214122)
水蛭素(Hirudin,H)是一种从水蛭唾液中提取的小分子多肽,具有3个分子内二硫键[1]。它能特异性结合凝血酶,是目前发现的最强凝血酶天然抑制剂[2]。水蛭素有3种主要亚型,分别为水蛭素变体(Hirudin varidant, Hv)Ⅰ、Ⅱ、Ⅲ(Hv1, Hv2, Hv3)[3],它们具有相似的N端核心结构域和对凝血酶的抑制活性。其中Hv3除了具有抗凝血作用外,在预防和治疗白内障方面也表现出巨大潜力[4]。目前,一些水蛭素变体已经在大肠杆菌(Escherichiacoli)、乳酸乳球菌、丝状真菌、转基因植物、酵母菌等[4-10]多种底盘细胞中成功表达。MENDOZA-VEGA等[11]利用酿酒酵母(Saccharomycescerevisiae) C13ABYS86表达Hv2时产量达到500 mg/L,但是其发酵周期长达60 h;KIM等[7]利用GAL1启动子在S.cerevisiae中表达水蛭素,发酵72 h产量才能达到62.1 mg/L;MATSUI等[12-13]通过构建猪腺苷酸激酶蛋白与重组水蛭素变体I(recombinant Hirudin varidant I, Rhv1)融合表达载体,实现了Rhv1在E.coli中的高水平表达,但是其以包涵体形式存在,产物没有活性。HUANG等[4]开发了一种稳定表达Rhv3的方法,并通过补料分批发酵使得Rhv3产量达到915 mg/L。然而S.cerevisiae、转基因植物、丝状真菌等发酵周期长;E.Coli具有内毒素、纯化工艺复杂,其大规模生产仍然具有不小的挑战。
谷氨酸棒杆菌(Corynebacteriumglutamicum)是一种高GC含量、无内毒素的革兰氏阳性细菌,常被用来生产氨基酸等小分子物质[14-15]。由于其胞外蛋白酶活性低、具有Sec、Tat两种强大的蛋白分泌体系,被认为是一种新型重组蛋白表达系统。利用C.glutamicum表达系统进行重组蛋白生产不仅能缩短发酵周期,而且可以规避E.coli表达系统内毒素、纯化难的问题,降低重组蛋白生产成本。
本研究利用实验室前期开发的3A组装系统,在C.glutamicun中构建以组成型启动子Ptac控制表达的1~7拷贝Rhv3重组菌株,并且每一个Rhv3基因的构建过程中将信号肽进行替换,以实现Rhv3的高效分泌。同时在Rhv3基因的C端添加6个组氨酸标签,最终仅需通过简单的Ni2+纯化即可获得高纯度Rhv3蛋白。
1 材料与方法
1.1 材料与试剂
1.1.1 主要试剂
TaqDNA聚合酶、pfuDNA聚合酶、质粒提取试剂盒、胶回收试剂盒、PCR产物回收试剂盒,CWBIO;限制性内切酶、Ligation Mix,TakaRa;牛纤维蛋白原、凝血酶,索莱宝;所有试剂和化学品均为分析纯试剂。
1.1.2 菌株、质粒
不同核糖体结合位点(ribosome binding site,RBS)-目标基因融合质粒所用引物见表1。引物合成和测序由苏州安升达完成。

表1 本实验所用引物
本研究中所构建菌株如表2所示。
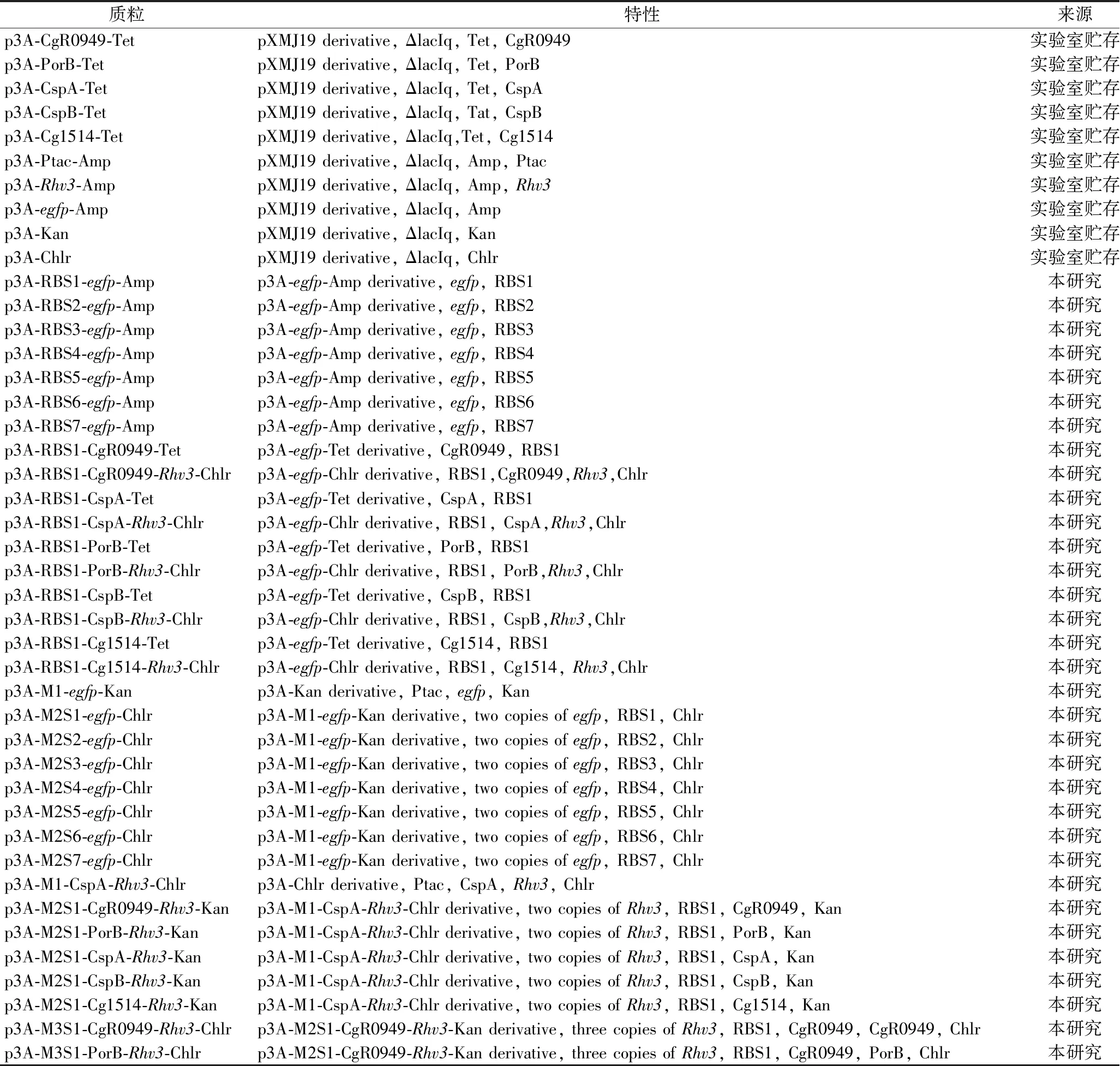
表2 本实验所用菌株
1.1.3 培养基
LB培养基(g/L):酵母提取物5,胰蛋白胨10,NaCl 10,用于培养E.coliDH5α。
LBB培养基(g/L):酵母提取物5,胰蛋白胨10,NaCl 10,脑心浸出液 10,用于C.glutamicumCGMCC1.15647重组菌株培养。
CGXⅡ培养基:葡萄糖 40 g/L;尿素 5 g/L;硫酸铵 20 g/L;K2HPO41 g/L;MgSO4·7H2O 0.25 g/L;CaCl210 mg/L;FeSO4·7H2O 10 mg/L;MnSO4·H2O 10 mg/L;ZnSO4·7H2O 1 mg/L;0.2 mg/L CuSO4;NiCl·6H2O 0.02 mg/L;原儿茶酸30 mg/L;3-吗啉丙磺酸(3-morpholinopropanesulfoinc acid,MOPs) 42 g/L,用于C.glutamicumCGMCC1.15647重组菌株培养。
BHI培养基:脑心浸出液 37 g/L,用于C.glutamicumCGMCC1.15647重组菌株培养。
1.1.4 仪器与设备
LongGene A 300 PCR仪,朗基科学仪器有限公司;DYCZ-24DN电泳仪,北京六一仪器厂;MicroPulser电击转化仪,Bio-Rad (USA)。
1.2 实验方法
1.2.1 单拷贝基因表达载体构建
课题组前期以BioBrick为基础,在C.glutamicum中构建了含不同抗性基因的3A组装系统[16]。克隆质粒p3A-Amp、p3A-Kan、p3A-Chlr上含有EcoR I、NheI、SpeI和PstI 4个限制性内切酶位点。NheI、SpeI为一组同尾酶,经酶切后产生相同的黏性末端。在组装时两个黏性末端连接,形成不被其中任何限制性内切酶识别的间隔序列(Scar)。
标准化组成型启动子Ptac采用EcoR I、NheI酶切,标准化egfp质粒使用SpeI、PstI酶切,标准化p3A-Kan质粒使用EcoR I、PstI酶切。经80 ℃灭活后,按照4∶4∶1比例连接,构建以Ptac控制表达的单拷贝egfp质粒。同样地,构建以Ptac启动子、CspA信号肽控制分泌表达的单拷贝Rhv3质粒。
1.2.2 多拷贝基因表达载体构建
RBS-egfp质粒构建:以p3A-egfp-Kan为模板,使用引物3A-RBS-F和p3A-R进行PCR扩增(图1-A),将不同RBS序列引入egfp基因ATG之前。获得的片段使用EcoR I、PstI酶切后,将目的片段连入经EcoR I、PstI酶切的p3A-Amp中,得到含不同RBS序列的p3A-RBS-egfp-Amp质粒。
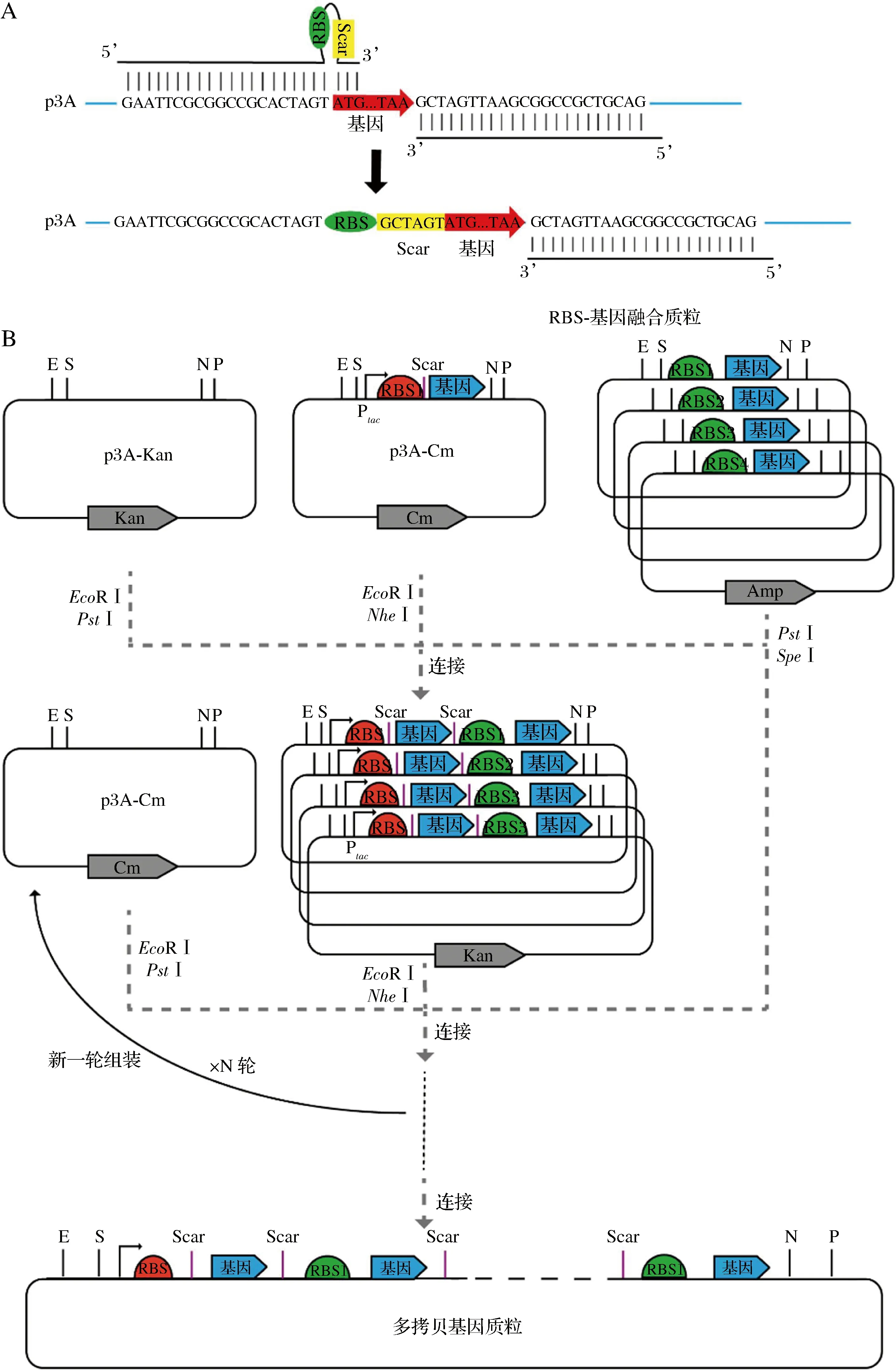
A-适用于3A组装系统的RBS通用引物示意图;B-基于3A组装的多拷贝质粒构建示意图
多拷贝egfp质粒构建:分别利用上述质粒与实验室前期构建的p3A-Ptac-egfp-Kan进行3A组装,获得含不同RBS序列的两拷贝egfp表达质粒(图1-B)。具体操作步骤参照图1-B。
RBS-CgR0949-Rhv3、RBS-PorB-Rhv3、RBS-CspA-Rhv3、RBS-CspB-Rhv3、RBS-Cg1514-Rhv3质粒构建:分别以p3A-CgR0949-Kan、p3A-PorB-Kan、p3A-CspA-Kan、p3A-CspB-Kan、p3A-Cg1514-Kan为模板,使用引物3A-SD1-F和p3A-R进行PCR扩增(图1-A),将RBS1序列引入信号肽基因CgR0949、PorB、CspA、CspB、Cg1514的ATG之前。得到的片段使用EcoR I、PstI酶切,连接到p3A-Amp中,得到p3A-RBS1-CspA-Amp、p3A-RBS1-CgR0949-Amp。上述质粒经EcoR I、NheI酶切,标准化Rhv3质粒经SpeI、PstI酶切,连接至经EcoR I、PstI酶切的p3A-Chlr中,获得p3A-RBS1-CgR0949-Rhv3-Chlr、p3A-RBS1-PorB-Rhv3-Chlr、p3A-RBS1-CspA-Rhv3-Chlr、p3A-RBS1-CspB-Rhv3-Chlr、p3A-RBS1-Cg1514-Rhv3-Chlr(图1-B)。
多拷贝Rhv3质粒构建:分别利用上述质粒与单拷贝p3A-Ptac-CspA-Rhv3-Chlr进行3A组装,获得含不同信号肽序列的两拷贝Rhv3表达质粒。接着选择最优表达菌株对应质粒按照上述步骤进行多轮(×N rounds)构建,获得多拷贝Rhv3表达质粒。具体操作步骤参照图1-B。
1.2.3 质粒转化
上述质粒采用电转化方法引入宿主细胞C.glutamicumCGMCC1.15647中[17]。
1.2.4egfp荧光强度分析
将含有不同RBS序列的两拷贝egfp重组菌株接种到24孔板中过夜培养。按2%接种比例转接到含新鲜LBB培养基的24孔板中发酵24 h。取待测菌液0.2 mL,使用培养基将OD600值调至0.5左右,使用荧光分光光度计测定菌体荧光值(激发波长和发射波长分别为488 nm和507 nm)。最后计算单位OD600值荧光强度以指示不同RBS翻译强度。
1.2.5 Rhv3表达、纯化分析
将重组菌接种至含相应抗生素的培养基中过夜培养,按2%接种比例转接到新鲜培养基中发酵24 h后,菌液经12 000 r/min离心5 min收集上清液进行SDS-PAGE分析。
Rhv3蛋白序列C端添加有6个His-tag,作为纯化标记。用AKTA中的HisTrap HP色谱柱纯化Rhv3-His,蛋白纯度用SDS-PAGE分析测定。
1.2.6 凝血酶滴定
蛋白浓度检测采用BSA定量法。分别取0.5 mg/L蛋白标准溶液0、1、2、4、8、12、16、20 μL加入到96孔酶标板中,用PBS溶液稀释上述蛋白标准品溶液至终体积为20 μL。同时取适量样品加入酶标板中,按需将终体积稀释至20 μL;按照说明书配制BCA标准溶液,并向上述各孔中加入200 μL,放置在37 ℃培养箱中反应30 min;结束后使用酶标仪测定A595;最后根据蛋白标准品浓度及A595得出标准曲线,并按此曲线计算样品蛋白浓度。
Rhv3活性分析采用凝血酶滴定法。试管中加入200 μL 0.5%(质量分数)牛纤维蛋白原及100 μL适量浓度发酵上清液;接着每隔1 min加入10 μL 50、25、12.5、6.25、3.125 NIH/mL凝血酶溶液,直至观察到溶液出现凝结,此时即为反应终点。按照水蛭素与凝血酶1∶1反应,加入凝血酶的量即为水蛭素抗凝血酶活性(ATU/mL),如公式(1)所示:
(1)
2 结果与分析
2.1 Rhv3在C.glutamicum中的表达及活性分析
将构建好的p3A-M1-CspA-Rhv3-Chlr质粒(图2-A)电转化入C.glutamicumCGMCC 1.15647中进行发酵培养,取发酵上清液进行SDS-PAGE分析。结果如图2-B所示,在15 kDa处出现明显的蛋白条带。与理论值(8 kDa)相比,目标条带大小接近理论值的2倍,猜测可能是因为2个蛋白质分子间较强的疏水作用力使Rhv3以二聚体形式分泌。为进一步优化产量,将重组菌株分别在LBB、BHI和CGXⅡ 3种培养基中培养。结果显示在CGXⅡ培养基中Rhv3几乎无表达。结合重组菌株生物量及凝血酶滴定活性分析(图2-C)可知,重组菌株在CGXⅡ培养基中生长最差,其OD600值仅为3.33,活性为0.42×103ATU/L。相反在BHI培养基中重组菌株具有最大的生物量(26.62)和最大活性(3.02×103ATU/L)。

A-单拷贝Rhv3质粒结构示意图;B-不同培养基中Rhv3表达分析(M为分子质量标准);C-不同培养基中Rhv3活性分析
2.2 RBS筛选
为了获得强RBS序列用于C.glutamicum中重组蛋白生产,本研究选取了7个不同强度的RBS序列,分别是AAAGGAGGA、AGAAGGAG、AGAAAGGAGG、GAAAGGAGG、GAAAGGA、GAAAGGCGA、GAAAGGAGA。按照图1-A方式进行PCR,构建含不同RBS序列的p3A-RBS-egfp-Amp质粒。接着得到的质粒分别与p3A-Ptac-egfp-Kan进行组装,构建两拷贝egfp质粒(图1-B)。将构建好的两拷贝egfp质粒转入C.glutamicum中,以单拷贝egfp(p3A-Ptac-egfp-Kan, POS)重组菌为对照(图3-A),通过egfp荧光强度差异比较不同RBS序列表达强度。

A-两拷贝egfp质粒结构示意图;B-不同RBS重组菌株单位荧光强度(RFU/OD600值)比较
如图3-B所示,两拷贝egfp重组菌株荧光强度均高于单拷贝egfp重组菌株(POS);含不同RBS序列的两拷贝egfp重组菌株中,RBS1荧光强度最高,达到POS的1.81倍;RBS2、RBS3次之;RBS5最弱,荧光强度与POS相比几乎无增长。因此,选用RBS1序列用于C.glutamicum中重组蛋白的表达。
2.3 多拷贝Rhv3菌株构建及信号肽、拷贝数的优化表达分析
为优化Rhv3分泌水平,选择C.glutamicum内源信号肽CgR0949、PorB、CspA、CspB、Cg1514进行Rhv3多拷贝重组菌株构建(图4-A)并通过SDS-PAGE验证其表达强度。以单拷贝Rhv3重组菌做对照,通过Image J进行灰度分析发现,两拷贝Rhv3重组菌株表达量明显得到改善,并且第二拷贝Rhv3使用CgR0949、PorB、CspA、CspB和Cg1514信号肽(M2S-Cg1514)时,分泌强度分别是单拷贝菌株(M1-CspA)的1.37、1.67、1.45、2.06、2.28倍。需要注意的是,当第二拷贝Rhv3使用信号肽CspA、CspB时,SDS-PAGE上显示为两条带,猜测可能是蛋白表达过程中Rhv3蛋白出现降解造成的。

A-多拷贝Rhv3质粒结构示意图;B~G-分别为二、三、四、五、六、七拷贝Rhv3表达分析(M-蛋白分子质量标准;CK-野生型C.glutamicum)
为进一步优化Rhv3的表达,选择最优表达菌株(M2S-Cg1514)构建三拷贝Rhv3重组菌,结果如图4-C所示,Rhv3最高表达强度(M3S-CspB)是M2S-Cg1514的1.45倍。当Rhv3拷贝数到六时,Rhv3表达量达到最高(M6S-PorB),是出发菌株的4.69倍(图4-F)。然而在随后的七拷贝Rhv3表达中发现,Rhv3表达量出现下降(图4-G),猜测可能是过多重复序列积累导致其在体内发生同源重组;也可能是因为过多Rhv3合成消耗了过量核糖体,或者造成宿主代谢负担加重,导致菌株生长不良。综上,经过多轮构建及筛选,获得了一株高产Rhv3重组菌株(M6S-PorB);并且发现,在一定程度上,Rhv3表达量随着基因拷贝数的增加而升高。
2.4 Rhv3重组菌发酵培养及纯化分析
将M6S-PorB重组菌在500 mL摇瓶中进行发酵培养并检测其凝血酶活性。结果如图5-A所示,菌株在4~20 h内生物量快速增长,20 h后进入稳定期,至40 h时生物量达到最高(OD600=23.08)。SDS-PAGE显示,在4 h时上清液中能检测到明显的Rhv3蛋白条带。并且随着时间的延长,条带越来越粗(图5-B)。凝血酶滴定结果证实在40 h时,上清液中Rhv3活性达到最高,为10.91×103ATU/L,比单拷贝Rhv3菌株提高3.61倍。经BCA蛋白定量检测分析可知,Rhv3含量达到1.89 g/L。AKTA纯化后,Rhv3纯度高于90%(图5-C)。
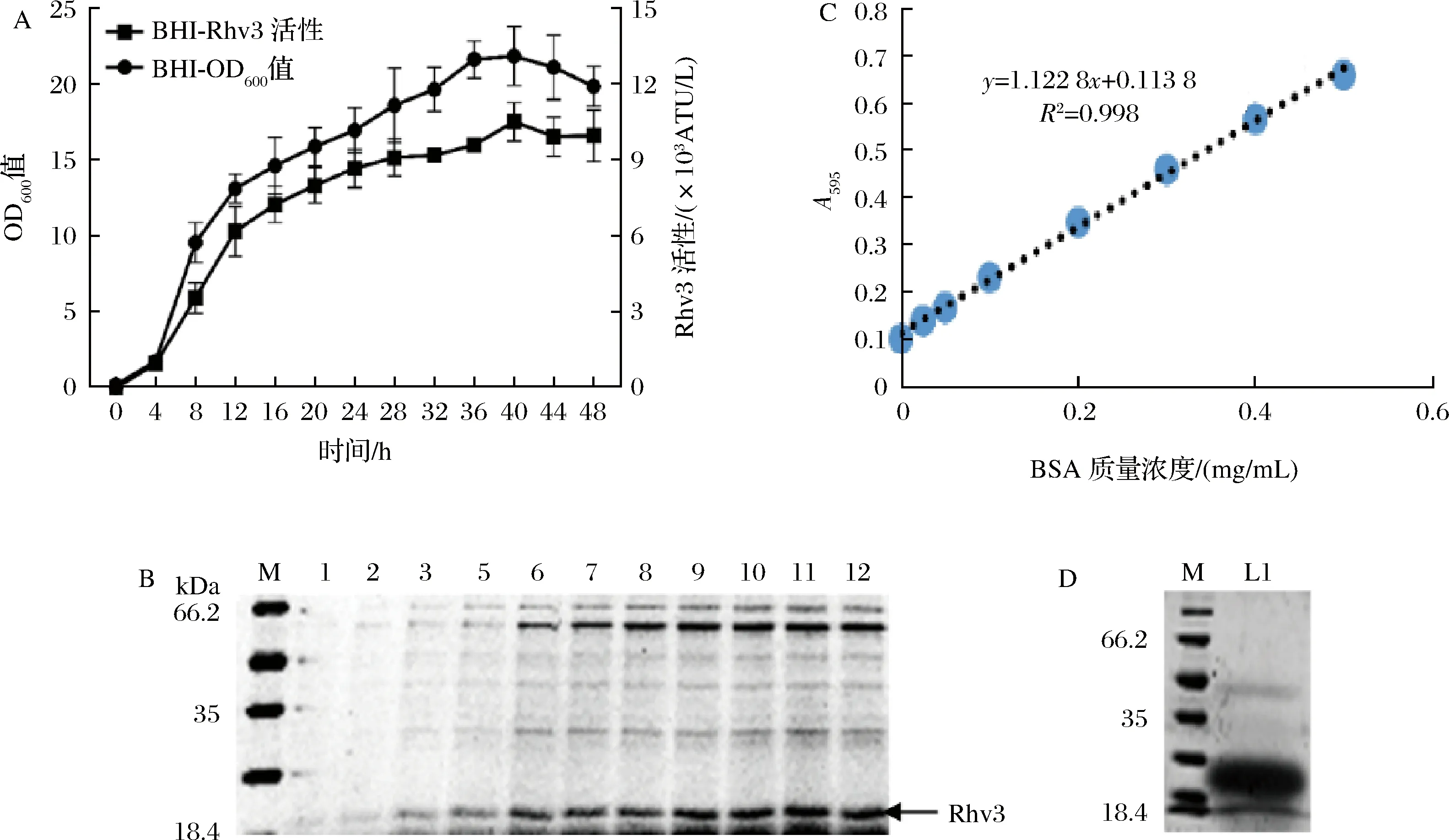
A-重组菌株在BHI培养基中发酵生长曲线及Rhv3活性分析;B-重组菌株Rhv3表达分析(每泳道上样3 μL,M为分子质量标准,1~12对应发酵4、8、12、16、20、24、28、32、36、40、44、48 h时Rhv3的表达情况);C-BSA标准曲线;D-经AKTA纯化后蛋白的SDS-PAGE分析(L1为目标蛋白纯化样品)
3 讨论
为了改善重组蛋白的合成,学者们尝试过很多方法,包括替换启动子和信号肽、共表达伴侣蛋白、优化发酵工艺、提高基因拷贝数等[13,16,18-19]。对于Rhv3这种小分子多肽的生产,多数采用多拷贝策略提高生产。LIN等[20]利用2A肽构建egfp基因多拷贝串联表达菌株,egfp表达量在三拷贝时达到最高。梁伟锋等[18]利用同尾酶的不可逆转连接方式在Pichiapastoria中构建人脑源性神经营养因子(human brain derived neurotrophic factor, hBDNF)的1~6拷贝重组表达载体,使得hBDNF产量达到20 mg/L。同年,ZHONG等[21]使用常规构建方法在E.coli中构建1、2、4、8个拷贝融合人β-防御素-2(humanβ-defensin-2, hBD2)重组表达菌株,最终融合蛋白产量占总可溶性蛋白的62.2%,是目前报道的最高产量。周伟杰等[22]利用BioBrick法在P.pastoria中构建以Pgap为启动子的五拷贝血管内表皮生长因子(vascular endothelial growth factor, VEGF)重组菌,获得VEGF165产量高达0.45 g/L。
理论上讲,重组蛋白的生产与基因拷贝数呈线性关系,基因拷贝数增加会直接提高重组蛋白的生产。尽管在实际应用生产中被证实两者并没有呈现出很好的线性关系,但是这一策略仍然是提高重组蛋白生产最高效、快捷的方法。本研究通过在C.glutamicum中分泌表达Rhv3并筛选RBS、信号肽和拷贝数,使得Rhv3产量达到1.89 g/L。然而需要注意的是,RBS序列、拷贝数只是影响重组蛋白表达的因素之一,后续仍然可以通过底盘细胞改造、发酵工艺优化等手段进一步改善Rhv3的表达。
4 结论
总之,本研究在C.glutamicum表达系统中开发了3A组装的多拷贝基因表达策略。利用该策略,优化Rhv3合成过程中的RBS、信号肽以及拷贝数等,在放大培养中Rhv3分泌活性达到10.91×103ATU/L,比之前报道的1.75×103ATU/L[16]提高523%。与通过Linker、2A肽等进行重组蛋白表达的多拷贝融合策略相比,本研究多拷贝基因策略旨在利用一条mRNA上进行多个核糖体结合位点的翻译,实现重组蛋白表达最大化。同时3A组装的开发,缩短了载体构建周期,极大加速了重组蛋白生产效率。这一策略的开发,增强了C.glutamicum作为重组蛋白生产宿主的核心竞争力,为进一步利用C.glutamicum进行重组蛋白工业化生产奠定了基础。
