芪玉三龙汤调节小鼠腹腔巨噬细胞M2/M1型极化及其对CD4+、CD8+T细胞的影响
2023-08-21范国栋李泽庚
兰 煜 ,范国栋,王 婷,吴 欢,李泽庚,李 平,陈 杨
(1.安徽中医药大学,安徽 合肥 230012;2.安徽医科大学第一附属医院中西医结合肿瘤科,安徽 合肥 230022;3.安徽中医药大学第一附属医院,安徽 合肥 230031)
巨噬细胞是单核吞噬系统中一类高度分化的成熟免疫细胞,在维持机体的免疫稳态中具有重要的作用[1]。近些年来,巨噬细胞极化备受关注,巨噬细胞可极化为抗肿瘤M1型(CD16/32+)和促肿瘤M2型(CD206+)巨噬细胞,其中M1型主要产生白细胞介素(interleukin, IL)-12、IL-1和诱导型一氧化氮合酶(inducible nitric oxide synthases,iNOS)等因子,M2型主要分泌精氨酸酶1(arginase,Arg1)、 FIZZ1、IL-10等因子[2]。研究[3]表明,若调控诱导条件,二者可相互逆转。巨噬细胞极化与肿瘤发生发展及肿瘤免疫治疗关系密切,因此,对巨噬细胞亚型诱导因素及功能的研究对于肿瘤免疫治疗的思路创新有着重要的意义,如何诱导巨噬细胞由M2型向M1型极化,从而发挥抗肿瘤效应已成为现今研究的热点之一。
芪玉三龙汤是治疗肺癌的有效验方,其应用于临床已有20余年,可改善肺癌患者生活质量,稳定瘤体[4]。既往研究显示,芪玉三龙汤能够平衡肺癌小鼠Th1/Th2漂移,抑制肿瘤细胞免疫逃逸[5],方中有21种与肺癌发病相关的潜在生物标志物,其中鞘脂代谢途径与Th1介导的抗肿瘤免疫显著相关[6]。然而,芪玉三龙汤对巨噬细胞极化及其对CD4+、CD8+T细胞的影响目前未见报道。本研究拟通过检测芪玉三龙汤处理的小鼠腹腔巨噬细胞膜表面分子、分泌的细胞因子及其对T细胞表面分子的作用,探讨芪玉三龙汤对巨噬细胞极化及其对CD4+、CD8+T细胞的影响,为该方通过免疫调节发挥抗肿瘤效应的机制提供实验依据。
1 材料
1.1 实验动物 6~8周龄的雄性SPF级C57BL/6小鼠10只,体质量(20±2)g,购自常州卡文斯实验动物有限公司[生产许可证号SCXK(苏)2011-0003],饲养于安徽中医药大学新安医学教育部重点实验室动物房,使用许可证号:SYXK(皖)2020-0060。本研究由安徽中医药大学动物伦理委员会批准,批准号:AHUCM-mouse-2019013。
1.2 主要试剂 DMEM培养基(批号分别为NAA1321)、胎牛血清(fetal bovine serum,FBS;NZJ5374):美国Hyclone公司;青霉素和链霉素(批号 68060600):Biosharp公司;胰酶(批号 F410BA0015):生工生物工程股份有限公司;三氯甲烷、异丙醇、无水乙醇和甲醇(批号 20180904、20150513、20190529、20190812):国药集团化学试剂有限公司;巯乙基淀粉肉汤(批号 70157100G):美国Sigma公司;Trizol(批号 87801):美国Invitrogen公司;Anti-mouse-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)-F4/80(批号 70AM048005)、Anti-mouse-藻红蛋白(phycoerythrin,PE)-CD11b(批号 B2018137)、Anti-mouse-别藻蓝蛋白(allophycocyanin,APC)-CD16/32(批号 70AM01601100)、Anti-mouse-APC-CD206(批号 SZB13607)、Anti-mouse-PE-PD-L1(批号 SZB18013)、Anti-mouse-PE-Cy7-Galectin-9(批号 BS2417)、Anti-mouse-FITC-CD4(批号 100405)、Anti-mouse-FITC-CD8(批号 100701)抗体:美国Biolegend公司;Anti-mouse-APC-CD155(批号 B335690)、Anti-mouse-APC-TIGIT(批号 B217242)抗体:美国eBioscience;IL-4(批号 E-21403):美国Peprotech公司。
1.3 主要实验仪器 倒置显微镜:日本Olympus公司;移液器:德国Eppendof公司;超净工作台:苏州净化公司;CO2恒温培养箱、低温高速离心机:美国Thermo Fisher公司;紫外可见分光光度计:美国METTLER TOLEDO UV5公司;流式细胞仪:美国Beckman公司;ABI 7500荧光实时定量PCR仪:美国ABI公司。
2 方法
2.1 小鼠腹腔巨噬细胞的分离培养及纯度鉴定 C57BL/6小鼠每天腹腔注射1次4%巯乙基淀粉肉汤,每次2 mL。3 d后,颈椎脱臼处死小鼠,置于75%乙醇中浸泡3~5 min,于无菌环境中向腹部注射含3% FBS和双抗(100 μg/mL链霉素和100 U/mL青霉素)的DMEM培养基5 mL,按摩腹部约3 min,静置5 min后,镊子拎起上腹部,剪开小口,抽出腹腔液于离心管中,1 300 r/min常温离心8 min,弃上清,用含双抗的DMEM洗涤1遍。用含10% FBS和双抗的DMEM培养基重悬细胞,取1×106个细胞进行FITC-F4/80和PE-CD11b染色,流式细胞仪鉴定细胞的纯度。剩余的细胞接种于培养瓶中,37 ℃、5% CO2培养箱中培养3 h后,弃上清,DMEM培养基洗涤2遍,再加入10% FBS和双抗的DMEM培养基培养。
2.2 芪玉三龙汤浓缩液的制备 将黄芪30 g,龙葵、白花蛇舌草、薏苡仁各20 g,玉竹、莪术、贝母各10 g,壁虎、地龙、泽漆各6 g加入10倍量的蒸馏水,浸泡1 h,武火煮沸后,文火慢煎90 min。将提取液过滤,残渣再加入1.07 L的蒸馏水,武火煮沸,文火慢煎40 min。过滤提取液。将两次提取液在50 ℃真空中混合浓缩至2 g/mL,制得芪玉三龙汤浓缩液[7]。
2.3 M2型巨噬细胞体外诱导及芪玉三龙汤处理 将上述分离鉴定的巨噬细胞,以每孔4×105个种植于6孔板中,3个重复孔,24 h后,采用20 ng/mL IL-4诱导其向M2型细胞极化[8],取细胞进行Anti-mouse-APC-CD206染色,流式细胞仪鉴定模型诱导是否成功。在此基础上,加入20 mg/mL芪玉三龙汤处理细胞[6],分别于0、8、16、24 h收集细胞(对照组细胞不加入芪玉三龙汤处理,在0 h检测),流式细胞术检测细胞表面膜分子CD16/32、CD206、CD155、PD-L1、Galectin-9的表达水平;qRT-PCR检测iNOS、IL-12 p40、IL-1β、Arg1、FIZZ1、IL-10 mRNA表达水平。
2.4 CD4+、CD8+T细胞的分离及与芪玉三龙汤处理的M2型巨噬细胞共培养 小鼠颈椎脱臼处死后,取脾脏组织经过研磨、过滤、裂解红细胞、洗涤等方式获得小鼠脾脏淋巴细胞悬液,再经过流式细胞分选的方法获得CD4+、CD8+T细胞。将经过芪玉三龙汤处理24 h的M2型巨噬细胞分别加入CD4+、CD8+T细胞与之共培养24 h后收集细胞悬浮液,流式细胞术检测TIGIT表达水平。

3 结果
3.1 小鼠腹腔巨噬细胞的纯度鉴定 分离获得C57BL/6小鼠腹腔冲洗细胞,流式细胞术检测小鼠腹腔巨噬细胞特异性表面分子CD11b和F4/80的表达水平,其纯度为89.8%,达到实验要求。见图1。

注:A.收集腹腔冲洗的细胞,流式细胞仪根据散射光设门,前向角散射和侧向角散射联合设门;B.同型对照通过PE/FITC标记的isotype流式抗体进行分析;C.细胞采用FITC-F4/80和PE-CD11b染色,检测双阳性细胞所占的比例
3.2 M2型巨噬细胞体外诱导的结果 流式细胞术检测结果发现,细胞表面特异性CD206分子的表达水平上升,对照组和IL-4处理组的CD206分子表达率分别为(0.53±0.02)%和(48.63±2.65)%,与对照组比较,IL-4处理组CD206分子表达率明显上升(P<0.05)。见图2。

注:A.对照组;B.IL-4处理组
3.3 芪玉三龙汤处理体外诱导的M2型巨噬细胞的结果 流式细胞术检测结果显示,随着时间的推移,细胞表面特异性分子CD16/32的表达水平不断升高,而CD206表达水平降低,见表1。qRT-PCR结果显示,处理24 h后芪玉三龙汤诱导的M1型巨噬细胞相关因子iNOS、IL-12 p40、IL-1β mRNA表达水平升高,而M2型相关因子Arg1、FIZZ1、IL-10 mRNA表达水平降低,见表2。结果提示,芪玉三龙汤能够诱导M2型巨噬细胞向M1型极化。在肿瘤发生的诸多因素中,各类型的免疫抑制分子及其配体使肿瘤局部成为免疫抑制区,作为肿瘤逃逸的机制之一。研究表明,芪玉三龙汤处理后,M2型巨噬细胞免疫抑制分子配体CD155、PD-L1、Galectin-9表达水平下降,见图3。
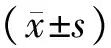
表1 芪玉三龙汤对IL-4诱导的小鼠腹腔巨噬细胞表面CD16/32和CD206分子表达的影响

表2 芪玉三龙汤对IL-4诱导的小鼠腹腔M1型和M2巨噬细胞相关因子mRNA相对表达水平的影响

注:A.对照组;B.芪玉三龙汤组;与对照组比较,*P<0.05
3.4 芪玉三龙汤处理的M2型巨噬细胞对CD4+、CD8+T细胞表面抑制分子表达的影响 流式细胞术检测发现,CD4+、CD8+T细胞表面与巨噬细胞CD155分子配对的免疫抑制受体TIGIT的表达水平明显下降。见图4。

注:Ⅰ.IL-4诱导的M2型巨噬细胞经芪玉三龙汤处理后,再与CD4+T细胞共培养24 h,收集悬液细胞,通过流式细胞术检测CD4+T细胞表面免疫抑制受体TIGIT的表达水平;Ⅱ.IL-4诱导的M2型巨噬细胞经芪玉三龙汤处理后,再与CD8+T细胞共培养24 h,收集悬液细胞,通过流式细胞术检测CD8+T细胞表面免疫抑制受体TIGIT的表达水平;A.对照组;B.共同培养组;与对照组比较,*P<0.05
4 讨论
肿瘤的发生和发展包括了一系列复杂的生物学过程。肿瘤相关巨噬细胞(tumor associated macrophage, TAM)在肿瘤微环境中具有重要作用。TAM根据不同功能表型,可以分为抗肿瘤作用的M1型和促肿瘤作用的M2型,巨噬细胞亚群M1/M2比例失衡能够影响肿瘤的进展[9-10]。
研究[11-12]表明,体外腹腔巨噬细胞经IL-4诱导可成为促肿瘤作用的M2型巨噬细胞,其表面高表达特异性甘露糖受体CD206,具有高度特异性,可作为多种恶性肿瘤诊断的潜在标志物。M2型巨噬细胞免疫抑制分子配体PD-L1与T细胞表面PD-1结合阻断T细胞介导的抗肿瘤免疫应答,促使肿瘤细胞免疫逃逸。而免疫抑制分子配体Galectin-9是TIM-3配体之一,TIM-3由其配体Galectin-9激活后,会抑制效应T细胞的活性,并引起外周耐受。CD4+、CD8+T细胞表面与巨噬细胞CD155分子配对的免疫抑制受体TIGIT是一种免疫调节分子,对肿瘤免疫周期产生抑制作用,保护肿瘤不被消除。TIGIT通过与巨噬细胞CD155分子配对结合,抑制T细胞和自然杀伤细胞的抗肿瘤反应,导致肿瘤细胞发生免疫逃逸。
“元气化生异常,正气亏虚,内生瘤毒,毒生病络,瘤毒阻络,瘤毒传络”是恶性肿瘤的病因病机,据此提出了“稳化生、扶正气、清瘤毒、调病络”的治疗大法,即通过“扶正解毒通络”稳定元气化生的环境,匡扶正气,增强机体的抗病能力,结合各种清除瘤毒的治疗手段,调节肿瘤患者络脉瘀滞或过度增殖的病理状态,以达到控制肿瘤的目的[13]。依据“扶正解毒通络”治法,形成了治疗肺癌的有效验方——芪玉三龙汤。方中黄芪补肺益气,龙葵解毒抗癌,共为君药;壁虎、地龙、泽漆解毒消积、通络散结,与黄芪相须为臣药;莪术破血行气、消积止痛,白花蛇舌草清热解毒,薏苡仁补益肺脾,玉竹养阴生津,共为佐药;贝母化痰润肺、消肿散结为使药。该方益气养阴以补正虚,解毒消积、化痰祛瘀以祛积聚,诸药合用,扶正与祛邪有机结合,共奏“扶正解毒、通络消积”之功。
本研究采用IL-4诱导的M2型巨噬细胞为研究对象,从体外细胞角度探究芪玉三龙汤对巨噬细胞极化及T细胞的影响。研究结果表明,芪玉三龙汤可以将体外IL-4诱导的M2型巨噬细胞向M1型极化,并且可以下调CD4+、CD8+T细胞免疫抑制受体的表达水平,这可能是其调节肿瘤微环境中免疫系统功能,发挥抗肿瘤作用的机制。
综上所述,芪玉三龙汤可以通过诱导M2/M1型极化,并进一步促进M1型巨噬细胞对T细胞产生调节作用。本研究结果表明,芪玉三龙汤在体外环境中对免疫细胞具有一定的调节作用,但其在体内肿瘤微环境中的作用及内在机制仍需要整体研究加以阐述与证实。
