鱼藤酮通过调控JAK/STAT3通路对口腔鳞状细胞癌细胞增殖、凋亡的影响
2023-08-02马文贤董振耀
马文贤,黄 琼,董振耀
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是口腔中最常见的恶性肿瘤之一,在全球癌症中排名第十,已成为世界日益严重的公共卫生问题[1]。尽管放化疗等治疗手段在OSCC治疗中取得极大的进步,但由于其高复发率及转移率,病人的预后仍不容乐观,因此了解其发生机制并开发新型治疗药物十分迫切[2]。鱼藤酮作为一种从豆科鱼藤属植物根中提取到的有毒黄酮类化合物,多作为植物性杀虫剂使用,但近期研究[3]表明其能够抑制肺癌、肝癌等癌细胞的增殖[3]。还有研究[4-5]表明鱼藤酮类化合物鱼藤素能抑制头颈部鳞状细胞癌细胞系的增殖。酪氨酸激酶/信号转导和转录活化因子3(Janus kinase/signal transducers and activators of transcription 3,JAK/STAT3)信号通路已被发现其参与癌细胞的增殖、侵袭及肿瘤血管生成,激活该途径可促进OSCC的恶性表型[6]。鱼藤酮已被发现在神经细胞中能够抑制JAK/STAT信号转导[7],但其是否可通过JAK/STAT3信号通路影响OSCC细胞的增殖和凋亡还未可知,因此本研究通过对其探究,以期为鱼藤酮在OSCC中治疗机制的研究提供参考。
1 材料与方法
1.1 试剂和仪器 鱼藤酮(货号:D2028)购自上海宝曼生物科技有限公司;SCC25细胞系(货号:DA-C5308)购自上海冠导生物工程有限公司;青霉素-链霉素(货号:LM1200K)购自上海联迈生物工程有限公司;胰酶溶液(货号:PYG0065)购自武汉博士德生物工程有限公司;胎牛血清(货号:164210-500)、DMEM培养基(货号:PM150210)购自武汉益普生物科技有限公司;AG490、MTT检测试剂盒、BCA蛋白检测试剂盒、HRP标记的山羊抗兔IgG二抗抗体(货号:M00132-EPI、BTN111105、K12862、WE0381-QAN)购自北京百奥莱博科技有限公司;蛋白提取试剂盒(货号:CD-13559-ML)购自武汉纯度生物科技有限公司;兔抗β-actin、caspase-3、Bax、JAK2、p-JAK2、p-STAT3、STAT3(货号:4970、9661、2772、3230、3771、9145、4904)购自Cell Signaling Technology;兔抗c-Myc、CyclinD1抗体(货号:ab32072、ab16663)购自abcam;Annexin V-FITC/PI Apoptosis Detection试剂盒(货号:A211-01/02)购自南京诺唯赞生物科技股份有限公司。iBright蛋白免疫印迹成像系统购自赛默飞世尔科技;CytoFLEX流式细胞仪购自美国贝克曼库尔特有限公司。
1.2 方法
1.2.1 细胞培养 OSCC SCC25细胞接种到含胎牛血清10%、100 U/mL青霉素-100 mg/mL链霉素DMEM培养基中后置于37 ℃、5%CO2恒温培养箱中培养,2 d更换一次培养基直至细胞融合至80%左右后通过胰酶消化进行传代。
1.2.2 MTT法检测SCC25细胞活力 将SCC25细胞分为对照组、低浓度鱼藤酮组(5 μmol/L)、中浓度鱼藤酮组(10 μmol/L)、高浓度鱼藤酮组(20 μmol/L)[8]、JAK2抑制剂AG490组(40 μmol/L AG490)[9],以5×103个/孔的密度(重复5孔,每孔100 μL)在96孔板中培养至对数生长期,分别添加相应剂量鱼藤酮和AG490培养48 h后添加MTT(5 mg/mL,20微升/孔),4 h后弃上清液培养液加入DMSO 100 μL,震荡直至MTT反应结晶充分溶解后在490 nm处测定吸光度(OD)值,计算SCC25细胞存活率(%)=[(OD处理组-OD空白对照组)/(OD对照组-OD空白对照组)]×100%。
1.2.3 克隆形成实验检测SCC25细胞的增殖 将各组SCC25细胞以5×102个/孔的密度(重复5孔)接种至6孔板中培养,贴壁后添加相应剂量鱼藤酮和AG490进行处理,直至培养到克隆细胞肉眼可见后弃上清,多聚甲醛(4%)进行15 min固定后1%结晶紫溶液染色10 min,流水冲洗、晾干并随机选取3个视野进行克隆细胞计数(细胞集落>50个)。
1.2.4 流式细胞术检测SCC25细胞凋亡情况 胰酶消化各组已处理培养48 h后的SCC25细胞,PBS洗涤后调整细胞浓度(5×105个/孔),添加Annexin V-FITC和PI各5 μL后混匀并避光孵育15 min,1 h内于流式仪观察SCC25细胞凋亡情况(n=5)。
1.2.5 Western blotting检测SCC25细胞蛋白表达情况 RIPA裂解液于冰上裂解各组SCC25细胞后,通过BCA蛋白试剂盒检测细胞总蛋白含量;SDS-PAGE凝胶电泳后低温转移蛋白至PVDF膜上,5%脱脂奶粉封闭2 h后,一抗4 ℃(兔抗β-actin、c-Myc、CyclinD1、caspase-3、Bax、JAK2、p-JAK2、p-STAT3、STAT3,1∶2 000)孵育过夜,PBS清洗、HRP标记的山羊抗兔IgG二抗(1∶1 000)孵育1 h后于蛋白凝胶成像仪定量分析各蛋白含量(n=5)。
1.3 统计学方法 采用t检验、单因素方差分析和 SNK-q检验。
2 结果
2.1 MTT法检测鱼藤酮对SCC25细胞活力的影响 与对照组比较,低浓度鱼藤酮组、中浓度鱼藤酮组、高浓度鱼藤酮组SCC25细胞存活率显著降低,且呈剂量依赖性(P<0.05);与高浓度鱼藤酮组相比,AG490组细胞存活率差异无统计学意义(P>0.05)(见表1)。

表1 不同浓度鱼藤酮及AG490对SCC25细胞活力的影响
2.2 克隆形成实验检测鱼藤酮对SCC25细胞增殖的影响 与对照组比较,低浓度鱼藤酮组、中浓度鱼藤酮组、高浓度鱼藤酮组SCC25克隆细胞数显著降低,且呈剂量依赖性(P<0.05~P<0.01);与高浓度鱼藤酮组相比,AG490组克隆细胞数差异无统计学意义(P>0.05)(见图1、表2)。

表2 不同浓度鱼藤酮及AG490对SCC25细胞增殖的影响
2.3 鱼藤酮对SCC25细胞凋亡的影响 与对照组比较,低浓度鱼藤酮组、中浓度鱼藤酮组、高浓度鱼藤酮组SCC25细胞早期和晚期凋亡率显著增加,且呈剂量依赖性(P<0.05~P<0.01);与高浓度鱼藤酮组相比,AG490组细胞早期和晚期凋亡率差异无统计学意义(P>0.05)(见表3、图2)。

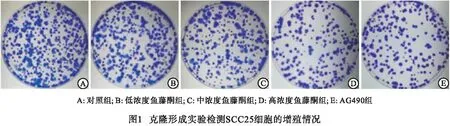

表3 不同浓度鱼藤酮及AG490对SCC25细胞凋亡的影响
2.4 鱼藤酮对SCC25细胞中增殖、凋亡相关蛋白表达的影响 与对照组比较,低浓度鱼藤酮组、中浓度鱼藤酮组、高浓度鱼藤酮组SCC25细胞内c-Myc、CyclinD1表达水平均显著降低,而caspase-3、Bax表达水平均显著增加,且呈剂量依赖性(P<0.05~P<0.01);与高浓度鱼藤酮组相比,AG490组细胞内c-Myc、CyclinD1、 caspase-3、Bax表达水平差异均无统计学意义(P>0.05)(见图3、表4)。
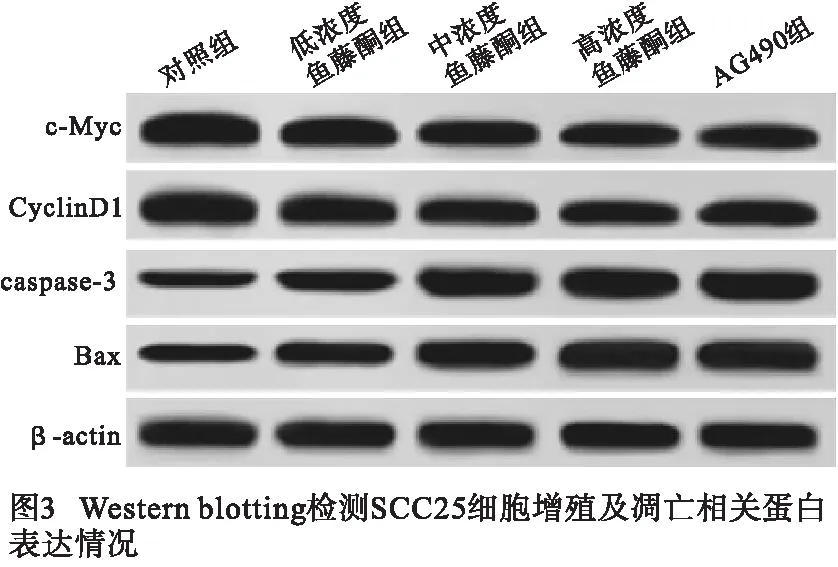

表4 不同浓度鱼藤酮及AG490对SCC25细胞中增殖、凋亡相关蛋白表达的影响
2.5 鱼藤酮对JAK2/STAT3通路相关蛋白表达的影响 与对照组比较,低浓度鱼藤酮组、中浓度鱼藤酮组、高浓度鱼藤酮组SCC25细胞内p-JAK2/JAK2、p-STAT3/STAT3水平呈剂量依赖性显著降低(P<0.05~P<0.01);与高浓度鱼藤酮组相比,AG490组细胞内p-JAK2/JAK2、p-STAT3/STAT3水平差异无统计学意义(P>0.05)(见图4、表5)。


表5 不同浓度鱼藤酮及AG490对JAK2/STAT3通路相关蛋白表达的影响
3 讨论
头颈部癌症在世界恶性肿瘤中排名第六,而OSCC占其中的95%以上,其最致命的原因是其从形成肿瘤开始,癌细胞就可远程转移至身体其他部位形成新肿瘤,最终导致病人5年预后生存率不足50%[10]。每年有近300万的OSCC新病人出现,其发生发展是原癌基因的激活和抑癌基因的丧失共同作用的结果。放化疗综合治疗已成为治疗癌症的主要手段,但由于化疗药物耐药性及药物不良反应的出现,导致OSCC病人仍出现五年预后生存不良现象,因此寻找新型治疗药物十分必要[11]。
鱼藤酮是从豆科植物中提取出的一种线粒体复合体Ⅰ抑制剂,其已显示出通过诱导肺癌[12]、乳腺癌[13]等癌细胞凋亡而具有抗癌活性。在肺癌A549细胞中,鱼藤酮通过促进活性氧生成促进细胞自噬及增加自噬通量[12-13]。鱼藤酮在结肠癌异体移植小鼠中通过抑制PI3K/AKT途径来抑制肿瘤增长及上皮间质转化[14]。神经酰胺水平增加可激活AMP依赖的蛋白激酶,以此磷酸化Ulk1,导致细胞自噬的发生,而鱼藤酮类化合物鱼藤素可通过诱导神经酰胺生成来促进HNSCC细胞凋亡[15]。c-Myc、CyclinD1作为常见的促增殖相关蛋白,而caspase-3、Bax作为促凋亡相关蛋白,在癌细胞的增殖、凋亡过程中发挥有重要作用。本研究发现,鱼藤酮可呈剂量依赖性降低SCC25细胞存活率、克隆细胞数、c-Myc、CyclinD1表达水平,而增加细胞凋亡率、caspase-3、Bax表达水平。该结果表明鱼藤酮在OSCC中能够通过抑制癌细胞增殖、促进细胞凋亡,从而起到抗癌作用。
细胞增殖、凋亡及转移的紊乱是导致肿瘤发生发展的主要引发因素[16]。JAK/STAT3信号通路在肿瘤中参与细胞增殖、侵袭及血管生成已被多项研究所证明[6,17]。JAK作为一种酪氨酸激酶可通过信号转导激活STAT,而STAT3是STAT家族成员之一,可在细胞质中被JAK1/2所磷酸化,并转移至细胞核发挥转录因子的作用[6,18]。JAK/STAT3激活可通过促进结直肠癌上皮间质转化增加癌症的发生、化学抗性及癌症干细胞转化的能力[19]。甘草查尔酮H通过抑制JAK/STAT3信号通路来诱导OSCC凋亡,抑制细胞生长[20]。有研究[21]发现,鱼藤酮在神经细胞中可抑制干扰素-γ介导的JAK/STAT1的激活。本研究发现,鱼藤酮能够显著降低p-JAK2/JAK2、p-STAT3/STAT3表达。该结果表明,在OSCC中,鱼藤酮可能通过抑制JAK2及STAT3的磷酸化来抑制JAK/STAT3信号通路的激活。本研究还发现,与高浓度鱼藤酮组相比,AG490组细胞存活率、克隆细胞数、c-Myc、CyclinD1、p-JAK2/JAK2、p-STAT3/STAT3表达水平、细胞凋亡率、caspase-3、Bax表达水平差异无统计学意义。该结果表明,鱼藤酮与AG490作用效果相同,鱼藤酮对SCC25细胞增殖的抑制和凋亡的促进可能与其抑制JAK/STAT3信号通路有关。
综上所述,鱼藤酮可能通过抑制JAK/STAT3信号通路来抑制OSCC细胞的增殖和促进细胞凋亡,以此在OSCC中起到抑癌作用。本研究不仅对鱼藤酮在OSCC中的治疗机制研究具有重要意义,还对疾病新型治疗药物的寻找具有一定参考价值,但关于鱼藤酮在OSCC中对该通路下游机制的影响还需进一步研究。
