瑞马唑仑对脑缺血再灌注损伤模型大鼠脑神经的保护作用及其机制
2023-08-01段梅刘佳张静孙晓丽王士雷
段梅 刘佳 张静 孙晓丽 王士雷
(青岛大学附属医院麻醉科,山东 青岛 266555)
缺血性脑卒中是全球人群残疾和死亡的主要原因之一[1],早期恢复缺血性脑卒中患者脑血流供应是其最有效治疗方法[2]。然而血流恢复过程会导致进一步的再灌注损伤,称之为脑缺血再灌注(I/R)损伤[3]。核因子κ-活化B细胞轻链增强子(NF-κB)是一种关键的核转录因子,在脑I/R损伤中被激活,通过增加促炎细胞因子白细胞介素-6(IL-6)、IL-1β以及肿瘤坏死因子-α(TNF-α)的产生而放大炎症反应[4]。NF-κB p65是NF-κB家族的主要成员[5],其磷酸化以及核易位是NF-κB途径激活的最直接的证据[6]。蛋白激酶B(PKB,也称AKT)是磷脂酰肌醇3-激酶(PI3K)的主要的下游靶标,磷酸化的AKT(p-AKT)是AKT的活性形式。研究表明,甘氨酸通过激活AKT抑制NF-κB p65/Hif-1α信号通路,从而减轻脑缺血诱导的炎症反应[7]。瑞马唑仑是一种新型苯二氮类γ-氨基丁酸A受体激动剂,适用于诱导和维持成人的程序性镇静。研究表明在神经性疼痛的发作过程中,瑞马唑仑可以抑制NF-κB核易位,并减少促炎细胞因子的表达[8]。此外,瑞马唑仑可抑制NOD样受体热蛋白结构域相关蛋白3炎性小体介导的炎症级联反应,减少神经元损伤,从而减轻脑I/R损伤[9]。然而,瑞马唑仑对脑I/R损伤的保护机制十分复杂且有待深入研究。本研究旨在观察瑞马唑仑对脑I/R损伤的保护作用,并探究AKT/NF-κB信号通路是否参与该过程。现将结果报告如下。
1 材料和方法
1.1 材料与试剂
雄性SD大鼠(体质量230~260 g)购自济南朋悦实验动物繁育有限公司,PI3K抑制剂LY294002购买于美国MedChemExpress公司,AKT、p-AKT、NF-κB p65及磷酸化NF-κB p65(p-NF-κB p65)抗体均购买于美国Cell Signaling Technology公司,IL-6、IL-1β和TNF-α酶联免疫吸附试验(ELISA)试剂盒均购自上海劲马生物科技有限公司。
1.2 分组及处理
所有大鼠在恒温25 ℃室内,12-12 h昼夜条件下适应性饲养1周。将大鼠随机分为5组(每组10只),分别为①假手术(Sham)组:使用异氟烷麻醉大鼠,但不阻塞其大脑中动脉;②I/R组:使用异氟烷麻醉大鼠,阻塞其大脑中动脉2 h致脑缺血后再恢复大脑中动脉血流灌注24 h,完成大鼠脑I/R损伤模型制备;③I/R+瑞马唑仑(I/R+RE)组:经大鼠腹腔注射16 mg/kg瑞马唑仑以后,立即制备大鼠脑I/R损伤模型;④I/R+RE+LY294002(LY)组:经大鼠侧脑室注射50 mmol/L LY294002 10 μL,30 min后经腹腔注射16 mg/kg瑞马唑仑,立即制备大鼠脑I/R损伤模型;⑤I/R+LY组:经大鼠侧脑室注射50 mmol/L LY294002 10 μL,于30 min后制备大鼠脑I/R损伤模型。
1.3 各组大鼠血清IL-6、IL-1β和TNF-α水平分析
在大鼠脑I/R损伤模型制备完成以后,从各组大鼠当中分别取3只,每只于心脏左心室采血5~10 mL,将血液室温静置2 h以后离心取上清液,使用ELISA试剂盒测定各组大鼠血清中IL-6、IL-1β和TNF-α水平。
1.4 各组大鼠神经功能缺损评分及脑梗死体积比的计算
从每组大鼠中随机选取3只大鼠,使用神经功能缺损评分量表[10]评估神经功能缺损情况。继而使用异氟烷麻醉大鼠,并迅速取出其大脑置于直径6 cm小皿中,-20 ℃冰箱冷冻30 min。再将大脑组织行2 mm厚冠状切片,共切割5片,使用20 g/L的2,3,5-三苯基四氮唑氯化物溶液染色。染色组织拍照后使用Image J软件分析缺血(白色)和正常(红色)区域,然后计算脑梗死体积比。脑梗死体积比=脑梗死总体积/脑组织总体积×100%。
1.5 免疫印迹实验检测各组大鼠脑组织中AKT、p-AKT、NF-κB p65、p-NF-κB p65相对表达量
从每组大鼠中随机选取3只大鼠,使用含磷酸酶抑制剂和蛋白酶抑制剂的组织裂解液裂解其梗死脑组织,提取脑组织梗死区域总蛋白,测定总蛋白浓度。然后上样30 μg蛋白到100 g/L的聚丙烯酰胺凝胶上进行电泳分离,通过湿法转移到PVDF膜上,并在室温下使用50 g/L的脱脂奶粉密封PVDF膜1.5 h。之后向PVDF膜分别添加NF-κB p65、p-NF-κB p65、AKT一抗(1∶1 000)和p-AKT一抗(1∶2 000)、内参β-actin(1∶1 000),4 ℃下孵育过夜,再添加二抗室温孵育1 h,滴加增强化学发光试剂,显影仪曝光各蛋白条带。以β-actin蛋白为内参照,并使用Image J软件分析AKT、p-AKT、NF-κB p65、p-NF-κB p65相对表达量;同时计算p-AKT/AKT和p-NF-κB p65/NF-κB p65比值,分别表示AKT和NF-κB p65蛋白的活化程度。
1.6 免疫荧光法检测各组大鼠脑组织细胞核内、外p-NF-κB p65表达
从每组大鼠中随机选取3只大鼠,常规麻醉后处死,取整个脑组织以40 g/L多聚甲醛固定,切下纹状体切面脑组织,并以石蜡包埋制成25 μm厚冠状切片。切片以体积分数0.005曲拉通X-100渗透10 min,再用体积分数0.05的山羊血清封闭1 h,4 ℃下以稀释的一抗p-NF-κB p65(1∶50)孵育过夜。随后使用磷酸盐溶液洗涤并添加二抗,室温下避光孵育2 h,以4′,6-二脒基-2-苯基吲哚染色细胞核并封片,最后使用共聚焦激光显微镜观察并拍照。
1.7 统计学方法
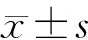
2 结 果
2.1 5组大鼠脑梗死体积比及神经功能缺损评分比较
5组大鼠的脑梗死体积比分别为0、(24.58±0.52)%、(6.22±0.70)%、(22.23±1.52)%和(26.28±0.96)%,各组间比较差异具有显著性(F=537.30,P<0.05);5组大鼠的神经功能缺损评分则分别为0、(3.73±0.25)、(1.77±0.25)、(3.37±0.15)以及(4.10±0.10)分,各组间比较差异具有显著性(F=271.30,P<0.05)。其中与Sham组相比,I/R组大鼠的脑梗死体积比及神经功能缺损评分显著增高(P<0.05);与I/R组相比,I/R+RE组大鼠脑梗死体积比和神经功能缺损评分显著下降(P<0.05);与I/R+RE组相比,I/R+RE+LY组和I/R+LY组大鼠脑梗死体积比和神经功能缺损评分均显著增高(P<0.05)。
2.2 5组大鼠血清促炎细胞因子IL-6、IL-1β、TNF-α水平比较
ELISA检测结果显示,5组大鼠血清IL-6、IL-1β、TNF-α水平比较差异均有显著性(F=72.41~209.30,P<0.05),其中与Sham组比较,I/R组大鼠血清IL-6、IL-1β、TNF-α的水平均显著增高(P<0.05);与I/R组比较,I/R+RE组大鼠血清IL-6、IL-1β、TNF-α水平均显著下降(P<0.05);与I/R+RE组比较,I/R+RE+LY组、I/R+LY组大鼠血清IL-6、IL-1β、TNF-α水平均显著增高(P<0.05)。见表1。

表1 各组大鼠的血清中IL-6、IL-1β、TNF-α水平比较
2.3 5组大鼠脑组织AKT、p-AKT、NF-κB p65和p-NF-κB p65相对表达量比较
免疫印迹实验的结果表明,各组大鼠脑组织中p-AKT、p-NF-κB p65相对表达量和p-AKT/AKT、p-NF-κB p65/NF-κB p65比值均有显著差异(F=313.30~654.90,P<0.05),其中与Sham组相比较,I/R组大鼠p-AKT相对表达量和p-AKT/AKT比值显著降低(P<0.05),p-NF-κB p65相对表达量以及p-NF-κB p65/NF-κB p65比值则显著性增高(P<0.05)。与I/R组、I/R+RE+LY组和I/R+LY组相比,I/R+RE组大鼠p-AKT相对表达量和p-AKT/AKT比值均显著增高(P<0.05),p-NF-κB p65相对表达量和p-NF-κB p65/NF-κB p65比值均显著降低(P<0.05)。见图1、表2。

A~E依次为Sham组、I/R组、I/R+RE组、I/R+RE+LY组、I/R+LY组

表2 各组大鼠脑组织AKT、p-AKT、NF-κB p65、p-NF-κB p65相对表达量及p-AKT/AKT、p-NF-κB p65/NF-κB p65比值比较
2.4 5组大鼠脑组织细胞核内、外p-NF-κB p65的表达比较
免疫荧光实验结果显示,Sham组大鼠p-NF-κB p65主要表达于细胞质,并且荧光强度较低。与Sham组相比,I/R组大鼠p-NF-κB p65从细胞质转移到细胞核,荧光强度增高;与I/R组相比,I/R+RE组大鼠p-NF-κB p65从细胞核转移到细胞质,荧光强度降低;与I/R+RE组相比,I/R+RE+LY组、I/R+LY组大鼠p-NF-κB p65均主要表达于细胞核,且荧光强度增高。见图2。

A~E依次为Sham组、I/R组、I/R+RE组、I/R+RE+LY组、I/R+LY组,60倍
3 讨 论
脑I/R损伤涉及机体一系列复杂的病理生理变化,如兴奋毒性、氧化应激、能量代谢紊乱、炎症反应和细胞凋亡等[11]。其中炎症反应在脑I/R损伤过程中起重要作用[12]。因此,抑制炎症反应是开发新的脑I/R损伤治疗方法的关键[13]。瑞马唑仑是一种新型苯二氮类短效镇静剂,已经被证明在脑I/R损伤中具有抗炎作用[9],但其确切的抗炎机制尚未完全明了。本研究使用脑I/R损伤大鼠模型研究瑞马唑仑产生脑神经保护作用的机制,结果表明瑞马唑仑通过减轻炎症反应保护脑I/R损伤,其抗炎作用很大程度上是由AKT/NF-κB信号通路介导的。
本研究首先评估了瑞马唑仑的脑神经保护作用。在实验动物的脑I/R损伤模型中,脑梗死体积比和神经功能缺损评分是评估脑I/R损伤进展的主要参数,且神经功能缺损评分与脑梗死体积比相关[14]。因此,本研究通过测量脑梗死体积比和神经功能缺损评分评估瑞马唑仑的体内疗效,结果表明瑞马唑仑能够显著降低脑梗死体积比和神经功能缺损评分,对脑I/R损伤具有保护作用。
其次,本研究观察到瑞马唑仑在脑I/R损伤中具有抗炎作用。炎症细胞因子是脑I/R损伤后炎症反应和神经元损伤的关键驱动因素[15]。在I/R损伤期间,大脑皮质免疫细胞激活,产生并释放过量促炎细胞因子TNF-α、IL-1β和IL-6[16]。I/R中各种复杂因素导致血脑屏障被破坏,上述促炎细胞因子进入血液循环,血清和脑脊液中TNF-α和IL-1β水平升高,使得小胶质细胞活化,促进巨噬细胞和中性粒细胞聚集并向大脑缺血区域浸润,从而进一步破坏脑组织和加速神经元丢失[17]。据报道,血清及脑脊液中IL-6水平升高与I/R损伤所致的神经系统恶化相关[18-19]。本研究使用ELISA试剂盒,测定各组大鼠血清促炎细胞因子TNF-α、IL-1β和IL-6水平,结果显示与I/R组相比,I/R+RE组促炎细胞因子水平显著降低,表明瑞马唑仑通过减轻脑I/R时炎症反应发挥脑神经保护作用。
最后,本研究探讨了瑞马唑仑在脑I/R损伤中的抗炎机制。NF-κB是炎症中重要的二聚转录因子家族,p65-p50异二聚体是NF-κB最常见的种类,而具有多功能结构域的p65是NF-κB最重要的亚基[20]。脑I/R期间,缺氧、过量活性氧和炎症介质诱导p65磷酸化,使其从细胞质易位进入细胞核,并特异性结合炎性细胞因子的启动子,从而诱导IL-1β、IL-6和TNF-α的表达,导致神经元死亡[21]。既往研究表明,PI3K/AKT的激活对脑I/R具有脑神经保护作用,且PI3K/AKT激活可抑制NF-κB通路活化[22]。根据报道,咪达唑仑(化合物结构与瑞马唑仑类似)能够上调神经元细胞中P-AKT的表达[23],瑞马唑仑能够下调神经性疼痛和胶质瘤中NF-κB的表达[8,24]。本研究通过免疫印迹检测了各组大鼠脑组织中AKT、p-AKT、NF-κB p65和p-NF-κB p65的表达水平,并使用免疫荧光法检测了各组大鼠脑组织细胞核内、外p-NF-κB p65的表达,结果表明,脑I/R损伤以后,瑞马唑仑上调了脑组织中p-AKT表达水平,下调了p-NF-κB p65表达水平,并使得p-NF-κB p65从细胞核转移到细胞质,减少了其细胞核内的表达。为了阐明AKT/NF-κB信号通路是否参与瑞马唑仑在脑I/R损伤中的抗炎作用,本研究使用LY294002抑制PI3K/AKT的功能,结果显示,LY294002能够下调脑组织中p-AKT表达水平,上调p-NF-κB p65表达水平,增加了p-NF-κB p65的细核内表达,并逆转了瑞马唑仑的脑神经保护作用和抗炎作用。这些结果表明,AKT/NF-κB信号通路在瑞马唑仑对脑I/R损伤的脑神经保护和抗炎作用中起着重要作用。
综上所述,瑞马唑仑对脑I/R损伤具有保护作用,其保护机制可能与AKT/NF-κB信号通路介导的抗炎作用相关。
伦理批准和动物权利声明:本研究涉及的所有动物实验均已通过青岛大学医学部伦理委员会的审核批准(文件号AHQU-MAL2021-1105)。所有实验过程均遵照美国国立卫生院出版的《实验动物合理和使用指南》的条例进行。
作者声明:段梅、刘佳、王士雷参与了研究设计;段梅、刘佳、张静、孙晓丽、王士雷参与了论文的写作和修改。所有作者均阅读并同意发表该论文,且均声明不存在利益冲突。
