普罗布考对ApoE-/-小鼠动脉粥样硬化的影响及其机制
2023-08-01李栋安毅
李栋 安毅
(1 青岛大学附属医院心内科,山东 青岛 266003; 2 临沂市人民医院急诊内科)
动脉粥样硬化(atherosclerosis,AS)是由多种因素参与的动脉血管的慢性炎症性疾病[1]。巨噬细胞在AS发生、发展和转归中发挥重要作用。斑块中的巨噬细胞可根据局部微环境的变化呈现不同的表型,其中M1型巨噬细胞分泌促炎因子,加速斑块进展,并使斑块不稳定性增高;M2型巨噬细胞分泌抗炎因子,可抑制AS进展[2]。因此,如何抑制巨噬细胞M1极化或促进巨噬细胞M2极化,对于减轻斑块炎症反应、促进斑块稳定意义重大。
普罗布考具有抗氧化和调血脂的作用,临床上主要用于高脂血症和AS治疗[3]。另外普罗布考还具有减轻同型半胱氨酸引起氧化应激和炎症反应、抑制血管弹性纤维降解、抑制白细胞黏附、抑制树突状细胞活化以及改善内皮功能等作用[4-8]。但普罗布考能否调控动脉中巨噬细胞极化尚无研究报道。本研究通过构建AS小鼠模型和体外细胞实验,旨在揭示普罗布考对AS进展的影响,并从巨噬细胞极化角度探讨普罗布考影响AS进展的分子机制。
1 材料与方法
1.1 材料与试剂
清洁级健康雄性ApoE-/-小鼠20只,8周龄,品系背景为C57BL/6J,健康雄性C57BL/6J小鼠10只,8周龄,均购自北京维通利华实验动物技术有限公司,均于恒温恒湿及昼夜交替环境中饲养。普罗布考购自美国Sigma公司,ELISA试剂盒购自美国RD公司,一抗α-SMA、CD86购自美国CST公司,MOMA-2购自美国Bio-Rad公司,iNOS、IL-1β购自美国Abcam公司。
1.2 方法
1.2.1动物分组与处理 20只ApoE-/-小鼠随机分为对照组和普罗布考组,每组10只。两组小鼠均以高脂饲料喂养12周后,普罗布考组小鼠隔日1次灌胃普罗布考(30 mg/kg),对照组隔日1次灌胃等剂量的生理盐水,均灌胃12周。
1.2.2两组小鼠各项指标检测 灌胃12周后,腹腔注射10 g/L戊巴比妥钠(50 mg/kg)麻醉两组小鼠,心尖取血,离心以后采用全自动生化检测仪检测血清中三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白(LDL-C)、肌酐(CRE)、尿素(UREA)、尿酸(UA)含量及丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)的水平,采用ELISA法检测血清中炎性因子白细胞介素1β(IL-1β)、IL-6、肿瘤坏死因子α(TNF-α)的水平,检测步骤严格按照试剂盒说明书进行。颈椎脱臼法处死小鼠后开胸取主动脉血管(包括主动脉弓及分支部分),置于40 g/L多聚甲醛溶液中固定。随机取每组5只小鼠的主动脉血管,进行油红O染色,检测斑块面积,计算斑块面积占血管壁总面积百分比。取每组另外5只小鼠的动脉血管,OCT包埋,制备5~6 μm厚冷冻切片,使用油红O染色检测主动脉根部切片中斑块面积大小,以Masson染色法检测斑块稳定性,采用组织免疫荧光方法检测两组小鼠动脉斑块中的巨噬细胞、平滑肌细胞、胶原纤维以及巨噬细胞M1极化情况,采用实时荧光定量PCR(RT-qPCR)方法检测两组小鼠主动脉斑块中IL-1β、IL-6和TNF-α mRNA的水平,检测步骤严格按照试剂盒说明书要求进行。
1.2.3小鼠腹腔原代巨噬细胞提取和分组 8周龄雄性C57BL/6J小鼠10只,颈椎脱臼法处死后,立即浸于含体积分数0.75乙醇中2 min。然后在小鼠腹部剪一小口,充分暴露腹膜,使用无菌注射器向腹腔注入约10 mL预冷的无菌PBS,使腹腔内充满PBS;反复抽打腹腔PBS后,以无菌注射器将腹腔悬液移至另一无菌管中,以800 r/min离心5 min;弃掉PBS,并使用含有体积分数0.10胎牛血清的DMEM培养基重悬细胞;置于37 ℃培养箱中进行培养,待细胞贴壁生长融合度约75%时,PBS清洗1次,更换新鲜含体积分数0.10胎牛血清的DMEM培养基后继续培养,获得小鼠腹腔原代巨噬细胞。
将小鼠腹腔原代巨噬细胞分为两组,每组设置3个复孔,结果取平均值,其中对照组的巨噬细胞以LPS(100 μg/L)+INF-γ(20 μg/L)处理24 h;普罗布考组的巨噬细胞以普罗布考(10 μmol/L)+LPS(100 μg/L)+IFN-γ(20 μg/L)处理24 h。然后采用ELISA方法检测两组巨噬细胞中的炎性因子IL-1β、IL-6、TNF-α水平,检测严格按照试剂盒说明书进行。
1.2.4RT-qPCR方法检测各组细胞中IL-1β、IL-6、TNF-α、CD86和iNOSmRNA的相对表达水平分别取对照组、普罗布考组小鼠主动脉根部血管和巨噬细胞,后分别加入1 mL TRIzol试剂,根据试剂盒说明书要求提取总RNA,根据反转录试剂盒说明书的要求进行逆转录,条件为42 ℃ 30 min,95 ℃ 2 min。根据 SYBR GREEN 染料试剂盒说明书要求,以cDNA模板为底物进行扩增,反应体系的总体积为 15 μL,其中引物1 μL,cDNA 模板1 μL,SYBR GREEN染料5.5 μL和去离子水7.5 μL。以β-actin为内参照,根据2-△△CT法计算目的基因的相对表达水平。引物由上海博尚生物技术有限公司提供,引物名称及其序列见表1。

表1 引物名称及其序列
1.3 统计学处理
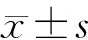
2 结 果
2.1 普罗布考对ApoE-/-小鼠血脂和肝肾功能的影响
与对照组小鼠相比较,普罗布考组小鼠血清中的TG、TC及LDL-C水平均明显下降(t=2.445~4.024,P<0.05),其他指标比较差异均无显著意义(P>0.05)。见表2。
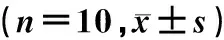
表2 两组小鼠血清血脂和肝肾功能指标比较
2.2 普罗布考对ApoE-/-小鼠AS斑块面积和稳定性的影响
主动脉血管油红O染色显示,对照组和普罗布考组小鼠的斑块面积与血管壁总面积比值分别为(27.40±0.02)%和(17.40±0.02)%,两组比较差异有显著性(t=3.599,P<0.05)。主动脉根部切片油红O染色显示,对照组和普罗布考组小鼠斑块面积分别为(35.40±4.18)、(21.80±1.93)mm2,两组比较差异具有显著性(t=2.954,P<0.05);与对照组相比,普罗布考组小鼠主动脉根部斑块中脂质明显减少(图1A、B)。Masson染色结果显示,与对照组进行比较,普罗布考组小鼠的主动脉根部斑块中胶原纤维明显增多(图1C、D)。免疫荧光染色显示,与对照组相比,普罗布考组小鼠的主动脉根部斑块中巨噬细胞(MAMO-2)明显减少,斑块纤维帽处平滑肌细胞(α-SMA)和胶原纤维均明显增多(图2),图中红色为巨噬细胞,绿色为平滑肌细胞以及胶原纤维。
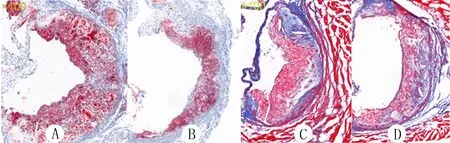
A、B:主动脉根部切片油红O染色(红色表示脂质含量),C、D:主动脉根部切片Masson染色(蓝色表示胶原纤维含量),100倍
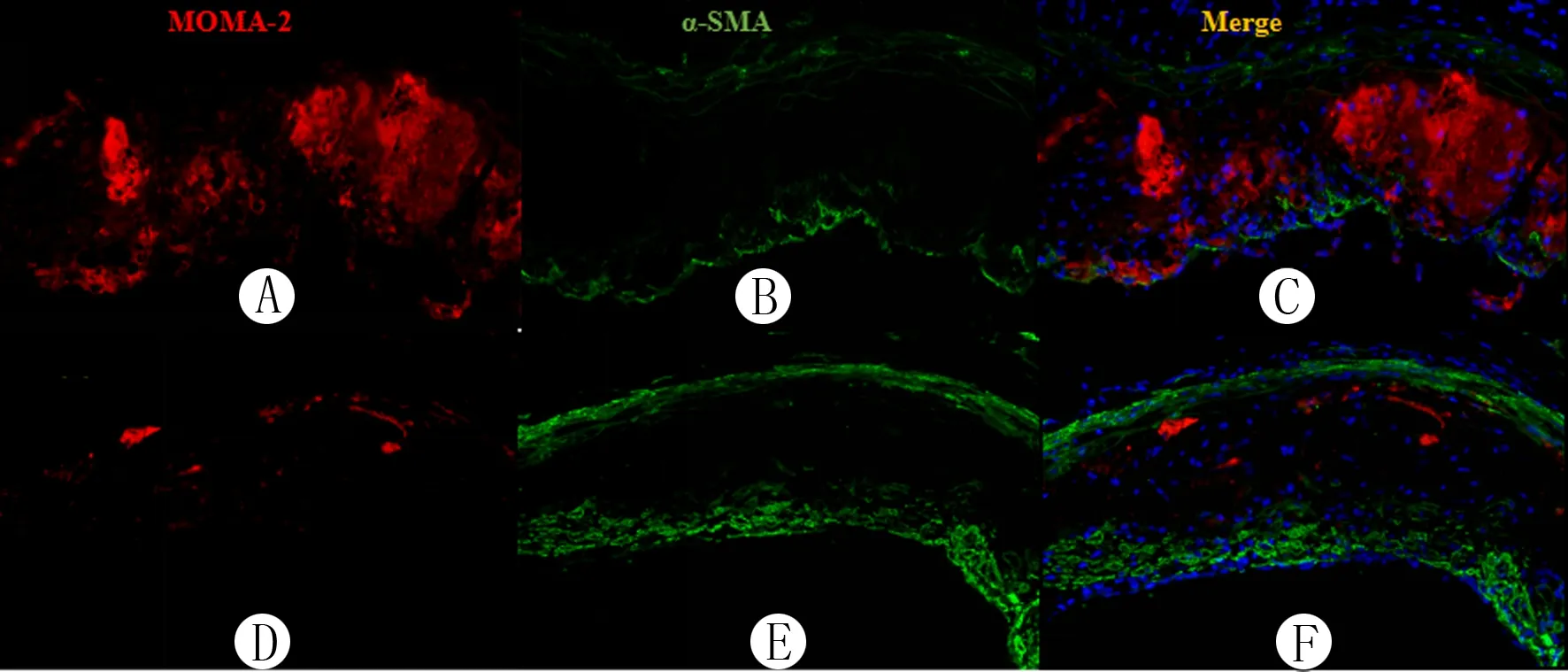
A、B:对照组,C:对照组融合图,D、E:普罗布考组,F:普罗布考组融合图;组织免疫荧光法,200倍
2.3 普罗布考对ApoE-/-小鼠血清和动脉斑块中炎性因子的影响
与对照组相比,普罗布考组小鼠血清中炎性因子IL-1β、IL-6和TNF-α水平明显降低(t=2.388~4.891,P<0.05);主动脉斑块中IL-1β、IL-6以及TNF-α mRNA的表达水平亦明显降低,差异具有显著性(t=3.060~4.507,P<0.05)。见表3。
表3 两组小鼠动脉斑块和血清炎性因子水平变化比较
2.4 普罗布考对小鼠巨噬细胞M1极化的影响
与对照组相比较,普罗布考组中MOMA-2+和iNOS+细胞数量及其比例明显减少,见图3。图中绿色为MOMA-2,红色为巨噬细胞M1极化标志物iNOS。
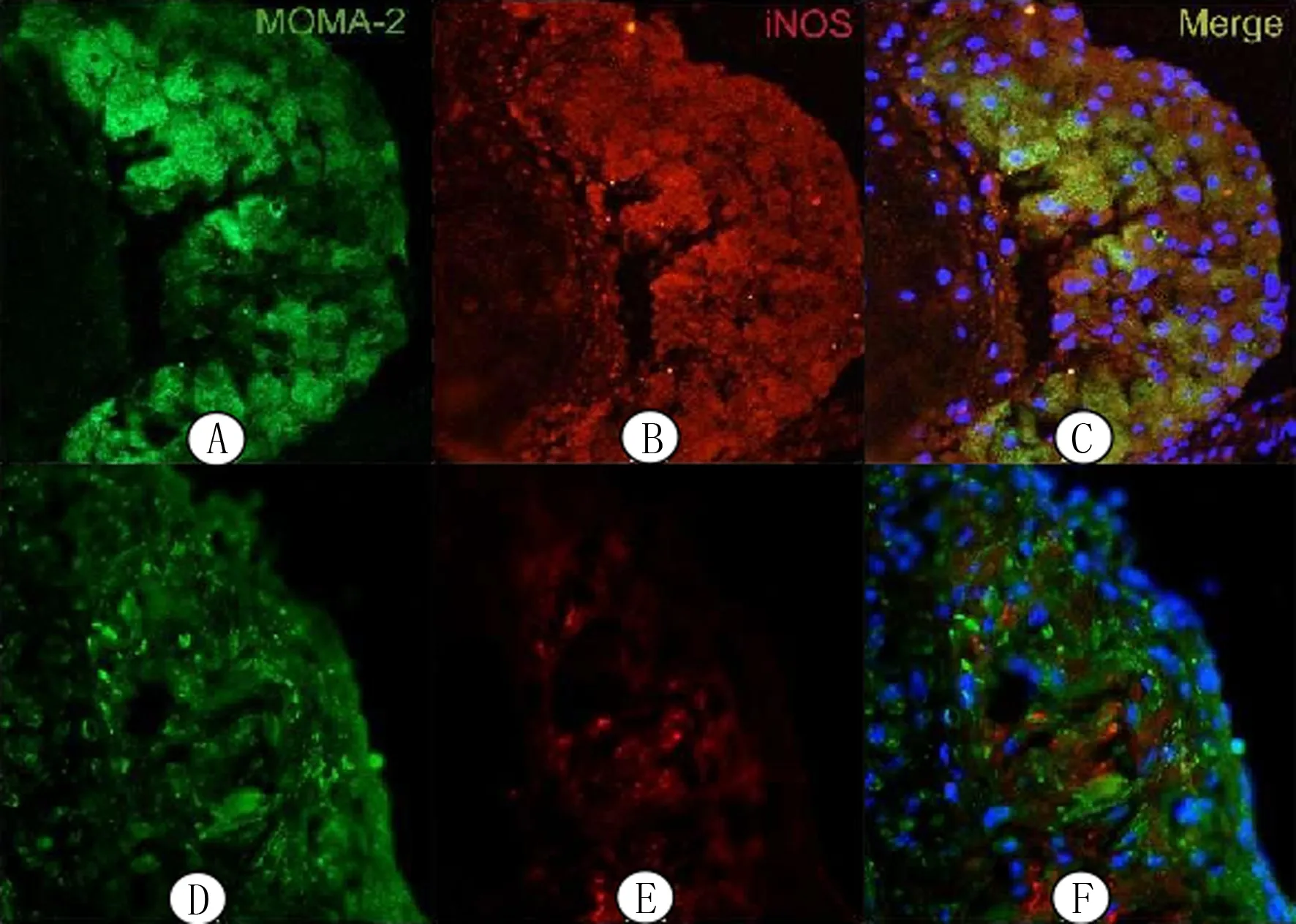
A、B:对照组,C:对照组融合图;D、E:普罗布考组,F:普罗布考组融合图;组织免疫荧光法,400倍
ELISA检测结果显示,与对照组比较,普罗布考组细胞中IL-1β、IL-6、TNF-α含量明显减低(t=4.238~9.580,P<0.05);RT-qPCR检测结果也显示,巨噬细胞的M1极化标志物CD86、iNOS和炎性因子IL-1β、IL-6、TNF-α mRNA的水平亦均明显降低(t=3.251~36.190,P<0.05)。见表4。
表4 小鼠腹腔原代巨噬细胞M1极化标志物及上清炎性因子水平变化比较
3 讨 论
AS是一种涉及多种细胞和多种生物学过程的复杂病变。当各种因素诱导血管发生AS时,血管内皮细胞受损,白细胞黏附到受损处,进而通过内皮间隙浸润至血管内膜。内膜中的单核细胞进一步分化为巨噬细胞,可吞噬修饰的低密度脂蛋白及凋亡细胞等,变成泡沫细胞[9]。泡沫细胞是AS的特征性细胞[10]。泡沫细胞后期发生凋亡坏死,释放脂质和各种抗原,构成了斑块的坏死核心,加剧斑块的炎症反应。巨噬细胞或泡沫细胞可分泌大量的炎性因子、趋化因子和基质金属酶,一方面会招募更多的白细胞浸润,另一方面会导致内皮细胞和平滑肌细胞发生形态和功能学改变,如内皮细胞凋亡、平滑肌细胞表型转换,此外基质金属酶会直接降解胶原纤维,导致斑块纤维帽变薄,易于破裂。
巨噬细胞极化与AS发生关系密切。斑块中的多种成分比如胆固醇结晶、氧化LDL-C、TNF-α以及微修饰LDL-C均可诱导巨噬细胞M1极化[9-11]。M1型巨噬细胞与斑块发生、发展及不稳定有关。M1 型巨噬细胞分泌的TNF-α、IL-6和IL-1β一方面增加LDL跨内皮进入内膜中,促进了AS的进展[11];另一方面导致内皮细胞活化,内皮细胞凋亡增加,内皮一氧化氮合酶表达降低,引起内皮功能紊乱,加速AS的进展[11]。其次,M1 型巨噬细可引起平滑肌细胞凋亡,使动脉中膜变薄,血管重构。最后,M1 型巨噬细胞大量分泌基质金属蛋白酶,降解胶原纤维,使纤维帽变薄,易于发生斑块破裂[12]。
普罗布考具有多重药理学效应,包括调脂、抗炎、抗氧化及改善血管内皮功能等,在临床上多用于AS性心血管疾病的防治[13-16]。近年来研究还发现了普罗布考的多种生物学作用,如普罗布考可逆转同型半胱氨酸诱导的单核细胞分化和氧化应激[4],抑制链脲霉素诱导的糖尿病小鼠CD11c+树突状细胞的免疫成熟[7],抑制脂多糖诱导的白细胞黏附[6],抑制血管弹性纤维降解等[5]。但是,普罗布考能否调控巨噬细胞极化尚不清楚。
本研究探讨了普罗布考对高脂饮食诱导的小鼠AS的影响及对斑块中巨噬细胞极化的影响。通过以上实验结果显示该浓度的普罗布考干预未对小鼠的肝肾功造成损害,经普罗布考治疗能降低小鼠血脂水平,减小AS斑块面积,使得斑块更加稳定,降低全身和斑块中炎性因子水平;更重要的是,普罗布考抑制了斑块中巨噬细胞M1极化,表现为多种M1极化标志物例如CD86、iNOS、IL-1β的mRNA水平均明显降低。本研究在体外实验中,进一步验证了普罗布考对巨噬细胞M1极化的调控作用。由此,我们揭示了普罗布考通过调控巨噬细胞极化和炎症反应从而抑制AS的新机制。
本课题尚有一些局限性。首先,本研究虽然发现了普罗布考可抑制巨噬细胞M1极化,但没有阐明普罗布考调控M1极化的分子机制。其次,普罗布考能否调控巨噬细胞M2极化尚不清楚。再者,普罗布考调控的巨噬细胞M1极化在多大程度上影响AS仍需研究。最后,在临床上服用普罗布考能否减轻AS患者斑块中巨噬细胞M1极化亦需要进一步研究。
综上所述,本研究探讨了普罗布考对ApoE-/-小鼠AS的影响,结果显示普罗布考可延缓小鼠AS进展并促进斑块稳定,其机制可能与抑制巨噬细胞M1极化、减轻斑块炎症反应有关。
伦理批准和动物权利声明:本研究涉及的所有实验均已通过青岛大学附属医院实验动物福利伦理委员会的审核批准(文件号AHQU-MAL20190510)。所有实验过程均遵照《实验动物福利伦理原则》的条例进行。
作者声明:李栋、安毅参与了研究设计和论文的写作和修改。所有作者均阅读并同意发表该论文,且均声明不存在利益冲突。
