金边鲤肌球蛋白结合蛋白C3基因的克隆与表达分析
2023-07-22韦玲静吕业坚甘宝江滕忠作莫飞龙叶香尘
韦玲静,吕业坚,甘宝江,黄 杰,刘 康,张 盛,滕忠作,莫飞龙,叶香尘
( 1.广西壮族自治区水产引育种中心,广西 南宁 530031; 2.柳州市渔业技术推广站,广西 柳州 545006 )
皮肤是鱼类的重要组织器官,具有多种不同的颜色。鱼的肤色和着色模式与其交配、信息传递和生理调节等生物学活动息息相关,同时肤色也是水产养殖中重要的经济表型特征。遗传条件是影响鱼类肤色的主要因素[1]。已有研究人员提出了鱼类皮肤着色遗传基础的初步见解[2-4]。真黑素主要产生黑色和棕色皮肤表型,而褐黑素主要产生黄色和红色皮肤表型[5],这2种色素均通过黑色素合成途径产生。目前已发现的与皮肤色素沉着相关的遗传信号通路有黑色素合成通路、细胞外因子/β-连环蛋白信号通路、丝裂原活化蛋白激酶信号通路等,其中涉及的体色调控相关基因包括酪氨酸酶(TYR)、酪氨酸酶相关蛋白1(TYRP1)、酪氨酸酶相关蛋白2(TYRP2)和黑素皮质激素受体1(MC-1R)、灰鼠信号蛋白、小眼畸形相关转录因子和黑色素浓集素等[6-8]。然而鱼类皮肤颜色调控分子机制尚不十分清楚,各色素沉着相关基因及其调节网络还需要进一步研究。
金边鲤(Cypinuscarpio)是针对稻田养殖而选育出的鲤鱼新品系。金边鲤的原始选育群体中有黑色和金边2种肤色个体,其中金边个体数约占30%,其背部金色皮肤面积较小,呈断续状未连成条带。而经选育后的金边鲤,其背部金色条带面积增大呈连续状,并且能够稳定遗传[9]。在前期的研究工作中,笔者主要对金边鲤的皮肤颜色差异、群体遗传结构、肌肉营养成分、肠道菌群等方面进行了系统分析[10-14]。在金边鲤皮肤转录组和蛋白质组差异表达分析中,2个组学分析均富集到了肌球蛋白结合蛋白C3(MyBPC3),且金色皮肤中的MyBPC3 mRNA和蛋白表达量显著低于黑色皮肤,认为肌球蛋白结合蛋白C3可能与金边鲤皮肤颜色变异调控机制有关,这与前人对鱼类皮肤色素沉着相关研究结果多有不同。
肌球蛋白结合蛋白C(MyBPC)是一种胞内多膜结构蛋白,属于免疫球蛋白和纤维连接蛋白超家族[15]。MyBPC位于肌小节A带C区中粗肌丝两端肌球蛋白头部的连接处,连接原肌球蛋白、肌联蛋白和肌动蛋白,是粗肌丝的重要组成部分,具有维护肌小节的完整性和结构的稳定性功能,并通过磷酸化作用参与肌小节的收缩和舒张功能调节[16-19]。MyBPC基因具有3种不同的亚型:慢骨骼肌型MyBPC1、快骨骼肌型MyBPC2和心肌型MyBPC3。通常认为2种骨骼肌型MyBPC1/2基因只特异性表达于骨骼肌中,而MyBPC3基因特异性表达于心肌细胞[20]。人MyBPC3基因发生突变已被证实与心脏疾病的风险有关,是肥厚性心肌病发生的主要因素,因此该基因成为心血管疾病相关研究的热点[21-22]。
目前国内外关于MyBPC3基因的研究主要集中在哺乳动物上,尚未有关于鲤MyBPC3基因克隆和表达分析的相关报道。笔者克隆金边鲤心脏组织中MyBPC3基因,分析其结构和组织表达特性,并探索该基因与黑色素合成相关基因TYR、TYRP1、TYRP2和MC-1R的关系,为初步研究金边鲤皮肤色素沉着差异分子调控机制提供参考。
1 材料与方法
1.1 试验材料
试验所用金边鲤取自广西壮族自治区水产引育种中心武鸣基地。试验鱼有金边鲤和无金边鲤 (3月龄)均为同一池塘养殖,体质量(74.74±0.92) g。试验分别采集8尾有金边鲤和8尾无金边鲤的大脑、心脏、皮肤、肌肉、肝脏、脾脏、肾脏和肠道共8种组织样品于2 mL冻存管中(图1)。样品用液氮速冻后转入—80 ℃冰箱保存备用。

图1 不同皮肤颜色金边鲤个体Fig.1 Jinbian carp with different skin coloursa.有金边鲤;b.无金边鲤.a.common carp with yellow skin; b.common carp with black skin.
1.2 总RNA提取和cDNA合成
各组织总RNA采用Trizol法提取,电泳和超微量分光光度计检测RNA完整性、浓度和纯度。采用TransScript Fly First-Strand cDNA Synthesis SuperMix试剂盒(北京全式金)合成cDNA第1链,用于中间片段扩增;采用TransScript All-in-One First-Stand cDNA Synthesis SuperMix for qPCR试剂盒(北京全式金)合成cDNA用于qPCR。
1.3 中间片段扩增
根据GenBank中鲤(XM_019108924)、鲫(Carassiusauratus)(XM026215405)和斑马鱼(Daniorerio)(NM_001044349)预测的MyBPC3基因序列,设计3对引物(MyBPC3-F1、R1、F2、R2、F3、R3)(表1)用于扩增MyBPC3基因中间片段。PCR反应体系(20.0 μL):cDNA 1.0 μL,引物F和R各0.5 μL(10 μmol/L),PCR Mix 10.0 μL,双蒸水 8.0 μL;反应条件:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,32个循环;72 ℃ 5 min。PCR产物电泳检测后测序。

表1 MyBPC3基因扩增引物序列Tab.1 Primer sequences of MyBPC3 gene amplification
1.4 5′ RACE和3′ RACE扩增
根据中间片段测序结果,采用Oligo 7.0软件设计RACE引物MyBPC3 5′-GSP1、MyBPC3 5′-GSP2、MyBPC3 3′-GSP1、MyBPC3 3′-GSP2。UPM-long用于RACE第1轮PCR的通用引物,UPM-short用于RACE巢式PCR的通用引物(表1)。采用SMART RACE 5′/3′ Kit试剂盒(Clontech)进行RACE cDNA合成及PCR扩增。第1轮RACE PCR模板为cDNA,反应条件:94 ℃ 5 min;94 ℃ 30 s,72 ℃ 30 s,72 ℃ 2 min,5个循环;94 ℃ 5 min;94 ℃ 30 s,70 ℃ 30 s,72 ℃ 2 min,5个循环;94 ℃ 5 min;94 ℃ 30 s,68 ℃ 30 s,72 ℃ 2 min,25个循环;72 ℃ 10 min。以第1轮PCR反应产物(稀释50倍)为模板,采用TransStart GoldPfu PCR Mix(北京全式金)进行第2轮反应,反应条件:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min,25个循环;72 ℃ 10 min。扩增产物经纯化克隆后测序,测序结果采用SeqMan软件进行拼接,获得完整的cDNA序列。
1.5 MyBPC3基因表达分析
根据扩增获得的cDNA序列设计合成定量引物MyBPC3-DF和MyBPC3-DR,以β-actin为内参基因(表1)。以稀释20倍的cDNA为模板,以TransStart Top Green qPCR SuperMix为反应试剂进行定量扩增。反应体系(20.0 μL):cDNA 2.0 μL,primer F 和R各0.5 μL(10.0 μmol/L),PCR Mix 10.0 μL,双蒸水 7.0 μL。反应条件:94 ℃ 5 min,94 ℃ 15 s,60 ℃ 30 s,41个循环。每个样品设置3个平行。同时利用本课题组前期研究已发表的金边鲤皮肤黑色素合成相关基因(TYR、TYRP1、TYRP2和MC-1R)的相对表达量数据[23]与MyBPC3基因表达量数据结果进行相关性分析。
1.6 序列分析及数据处理
利用在线分析软件(https://www.ncbi.nlm.nih.gov/orffinder/)查找MyBPC3基因开放阅读框及其对应编码氨基酸序列;利用在线工具ExPASY ProtPAram Tool (https://web.expasy.org/protparam/)预测蛋白质的理化特性;利用NetPhos 3.0 server、TMHMM和SignalP 5.1等在线软件预测蛋白磷酸化位点、跨膜结构和信号肽区域;利用Clustal X2和MEGA 7.1软件进行氨基酸序列多重比对和系统进化树构建(邻接法,自展值为1000);利用WISS-MOEDL在线软件预测蛋白三级结构;利用2-ΔΔCt法计算基因的相对表达量并利用Sigma Plot 12.5软件作图。
2 结 果
2.1 MyBPC3序列特征
金边鲤MyBPC3基因cDNA全长为4253 bp,ORF为3783 bp,编码1260个氨基酸。其5′非编码区(5′UTR)为44 bp,3′非编码区(3′UTR)为427 bp,末端含有AATAAA的加尾识别信号和28个碱基的poly(A)结构(图2)。在线软件预测可知,MyBPC3蛋白分子式为C6288H9961N1709O1908S48,分子质量为141.57 ku,理论等电点为6.42,半衰期为30 h,不稳定指数为38.80,总平均疏水性指数为-0.505,为亲水性酸性蛋白,无信号肽和跨膜结构。MyBPC3共有119个潜在的蛋白磷酸化位点,其中PKC磷酸化位点21个,PKA磷酸化位点5个,属于高度磷酸化蛋白(图2)。MyBPC3蛋白的三级结构呈现环状三角结构(图3a、b)。

图2 金边鲤MyBPC3基因的cDNA全长序列及对应氨基酸序列Fig.2 The nucleotide and amino acid sequences of the cDNA of MyBPC3 in Jinbian carp C. carpio黑色方框标示起始密码子(ATG)和终止密码子(TAA);圆圈表示PKC磷酸化位点,六边形表示PKA磷酸化位点;粗体下划线表示3′-UTR端AATAAA序列;粗体表示为poly(A).The AA corresponding to start codon (ATG) and termination codon (TAA) is shown in the black box; circles represent PKC phosphorylation sites, hexagon represent PKA phosphorylation sites; the nucleotides corresponding to the polyadenylation signal in the 3′-untranslated region (AATAAA) are marked with bold and underlined; the poly (A) is marked with bold.

图3 金边鲤MyBPC3蛋白二级和三级结构预测Fig.3 Prediction of the second structure and tertiary structure of MyBPC3 protein in Jinbian carp C. carpioa.MyBPC3三级结构卡通模型; b.MyBPC3三级结构空间立体球模型.a.Cartoon model of tertiary structure of MyBPC3; b.Space fill model of tertiary structure of MyBPC3.
2.2 MyBPC3同源性比较与进化树分析

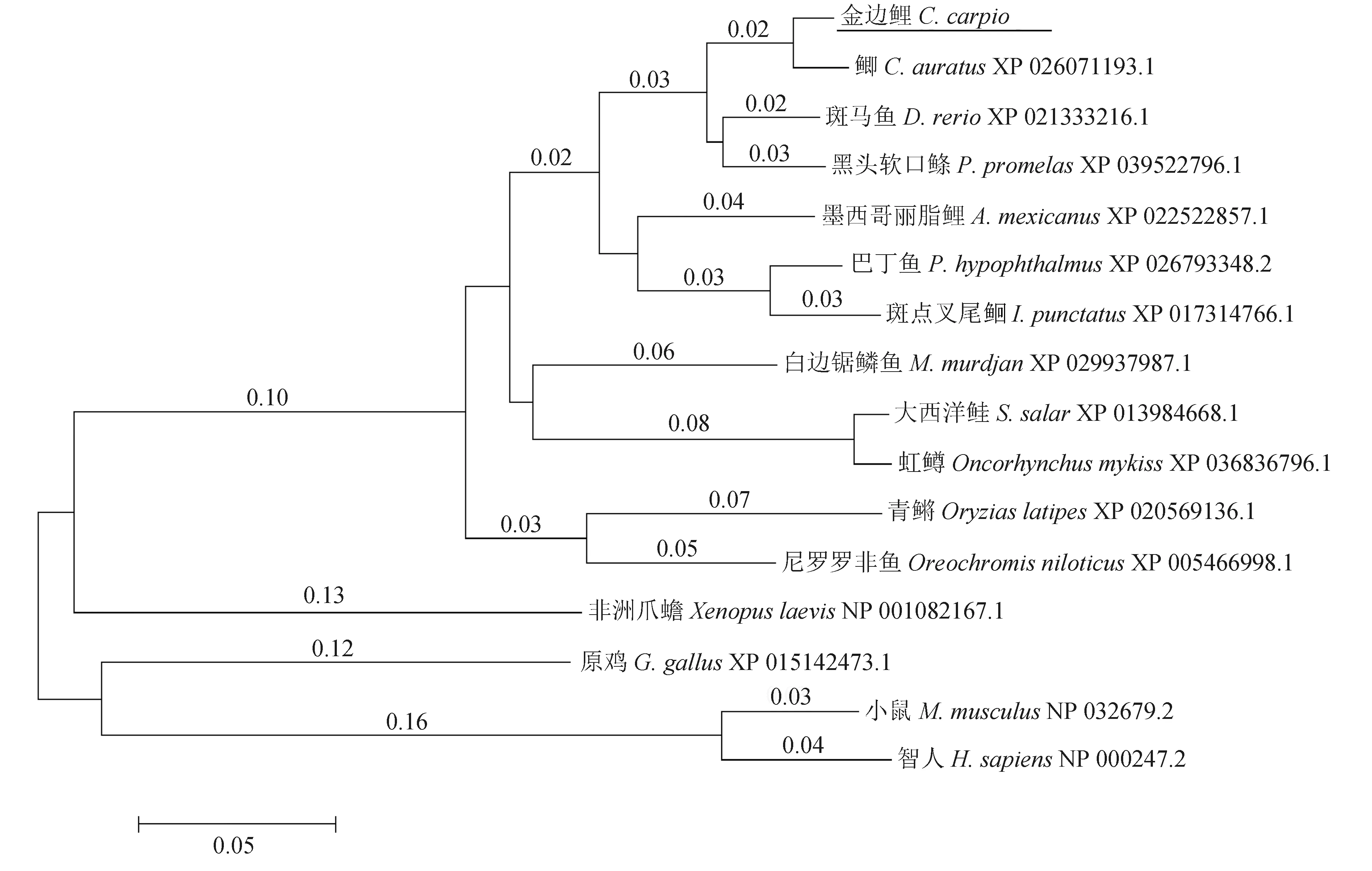
图4 基于MyBPC3氨基酸序列的邻接系统发育树Fig.4 Phylogenetic tree of MyBPC3 based on Neighbor-Joining method of species amino acid sequence
2.3 MyBPC3基因的组织表达特性
以肾脏组织为参考,qRT-PCR检测MyBPC3基因mRNA在金边鲤不同组织中的相对表达量。结果显示:MyBPC3在检测的8个组织中均有表达,其中在心脏中的表达量最高,显著高于大脑、皮肤、肌肉、脾脏、肝脏、肠道和肾脏组织(P<0.05)(图5);同时MyBPC3基因在金边个体的心脏和皮肤中的表达量显著低于黑色个体(P<0.05)。

图5 MyBPC3基因在不同组织中的相对表达量Fig.5 Expression levels of MyBPC3 gene in difference tissuesHe.心脏;Br. 脑;Sk. 皮肤;Mu. 肌肉;Sp. 脾脏;Li. 肝脏;Gu. 肠道;Ki. 肾脏.图中不同大写字母表示不同组织表达差异显著(P<0.05),小写字母表示同种组织表达差异显著(P<0.05).He. heart; Br. brain; Sk. skin; Mu. muscle; Sp. spleen; Li. liver; Gu. gut; Ki. kidney; different capital letters indicate significant difference in different tissues (P<0.05), different letters indicate significant difference in the same tissues (P<0.05).
2.4 MyBPC3与黑色素合成相关基因的相关性分析
MyBPC3基因与黑色素合成相关基因表达水平的相关性分析结果显示,MyBPC3与TYR、TYRP1、TYRP2及MC-1R均呈正相关,其中与TYR、TYRP2及MC-1R基因相关性显著(P<0.05)(图6)。
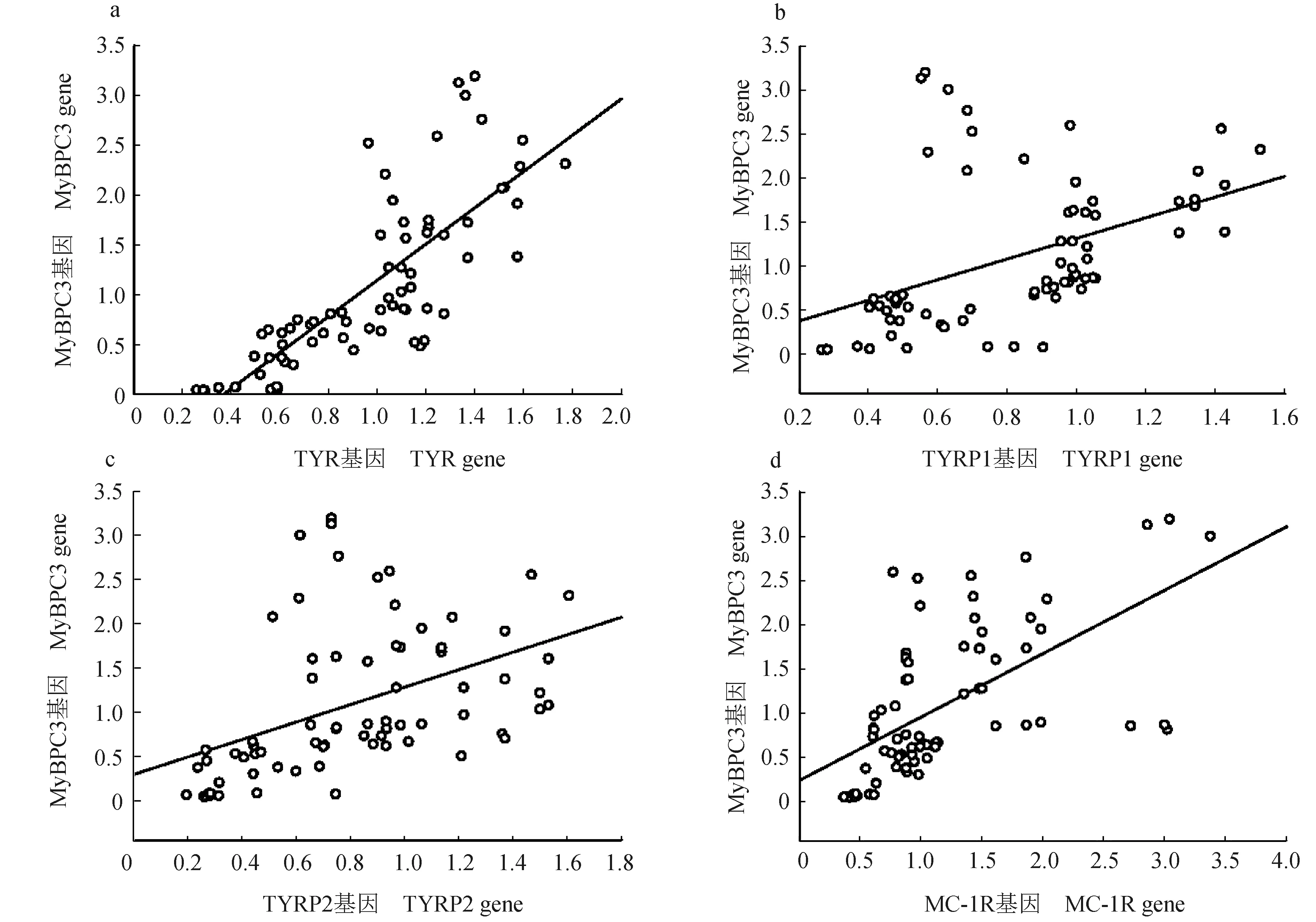
图6 MyBPC3基因与黑色素合成相关基因TYR(a)、TYRP1(b)、TYRP2(c)和MC-1R(d)的相关性分析Fig.6 Correlation analysis of MyBPC3 and related genes TYR(a), TYRP1(b), TYRP2(c) and MC-1R(d) of melanin synthesis
3 讨 论
3.1 MyBPC3基因序列及结构特点
目前已有文献报道了多个物种的MyBPC3序列和功能信息,其中研究较为深入的主要集中在小鼠和人类等哺乳动物上,关于鱼类的相关研究甚少[24-26]。笔者从金边鲤心脏组织中克隆获得了MyBPC3的cDNA序列全长,其开放阅读框长3783 bp,编码1260个氨基酸。MyBPC3无信号肽和跨膜结构,为胞内蛋白。同源性比较和系统进化树分析显示,MyBPC3与鲫和斑马鱼的亲缘关系较近,与原鸡、小鼠和智人等禽类和哺乳类的进化距离分别为0.12、0.16和0.16,表明MyBPC3在各物种进化过程中相对保守。
3.2 MyBPC3基因组织表达特点
不同MyBPC亚型在心肌和骨骼肌中都有不同的调控,在MyBPC3缺失的情况下,骨骼亚型可以在心脏发生转补体[20]。Dhoot等[27]认为骨骼肌和心肌MyBPC通常主要表达于相应的组织中,但是MyBPC1和MyBPC2在心脏组织中也有表达,同样MyBPC3在骨骼组织中也可表达。Ward等[28]发现MyBPC3在鸟类和两栖类动物的骨骼肌发育中均有表达。本试验中MyBPC3基因在金边鲤心脏、脑、皮肤和肌肉等组织中均有表达,其中在心脏中的表达量最高,为主要效应组织,这与已有研究的人MyBPC3基因组织表达的结果基本一致[29]。同时笔者还发现,MyBPC3基因在金边个体的心脏和皮肤中的表达量均显著低于黑色个体,推测其表达差异可能与其皮肤颜色变异有关。
3.3 MyBPC3功能与金边鲤体色变异的关系
MyBPC3通常以磷酸化形式存在于血清中。肾上腺素能受体激活、胆碱能受体激活、内皮素、Ca2+等均可引起MyBPC3磷酸化,且主要通过蛋白激酶和钙/磷脂依赖性蛋白激酶途径进行[30-31]。在受到β-肾上腺素刺激时,MyBPC3通过磷酸化作用于肌联蛋白、肌动蛋白和肌球蛋白,加速横桥与肌动蛋白结合,调节肌丝运动[32-33]。笔者预测得到MyBPC3的多个PKA和PKC磷酸化位点,推测这些磷酸化位点在调节肌丝的收缩和舒张功能上发挥重要作用。黑色素是存在于脊椎动物体内的主要色素,其生物合成由多种酶类参与,并受多基因调控[34-35]。大量研究已证实,黑素皮质激素受体1、酪氨酸酶、酪氨酸相关蛋白1、酪氨酸相关蛋白2是调控黑色素合成途径中的主要基因[5,36-38]。细胞骨架和肌丝微管相关蛋白参与黑色素在角质形成细胞内的分布和运动,肌动蛋白可作为黑素体的运输马达,与肌球蛋白一同为黑素体转运提供动力[39]。笔者在前期的金边鲤皮肤转录组研究中富集到了与细胞骨架和肌丝蛋白的相关基因,包括心肌肌球蛋白结合蛋白基因(MyBPC2和MyBPC3)、肌动蛋白基因(ACTC1和ACT3)、肌球蛋白基因(MYH1、MYH2、MYH6和MYH7)、肌浆球蛋白基因(TPM1、TPM2和TPM3),这些基因均在金边个体皮肤中表达下调,并发现,除了MyBPC2和MyBPC3基因,其余的均为心肌肾上腺素信号通路中的基因[10]。有研究显示,β2肾上腺素能受体通过G蛋白-腺苷酸环化酶-蛋白激酶A(GS-AC-PKA)途径调节酪氨酸酶活性及其相关基因,从而影响黑色素的合成[40]。本研究中,金边鲤皮肤中MyBPC3基因表达量与黑色素合成相关基因TYR、TYRP2及MC-1R基因均为显著正相关,且金边个体皮肤中的MyBPC3表达量下调,推测MyBPC3可能通过心肌肾上腺素信号通路间接参与黑色素合成以及调节黑色素在角质形成细胞的分布和运动,从而形成了金边鲤皮肤色素沉着差异。
4 结 论
笔者从金边鲤的心脏组织中克隆获得了MyBPC3基因序列,其开放阅读框为3783 bp,编码1260个氨基酸。金边鲤MyBPC3与鲫的进化地位最为接近。组织表达分析和相关性分析结果显示,MyBPC3基因与黑色素合成相关基因TYR、TYRP2及MC-1R基因均为显著正相关,且其在金边个体的心脏和皮肤中表达量显著低于金边个体(P<0.05)。结果表明,MyBPC3基因可能影响金边鲤皮肤黑色素的合成,其基因表达差异可能是金边鲤皮肤颜色差异形成的原因。该结果可为研究金边鲤皮肤色素沉着差异调控机制提供参考。
