仿刺参腐皮综合征病原灿烂弧菌RPA-Cas13a检测方法的建立
2023-07-22陈艳茹侯竹美徐冬雪谷元雪宋文琦宋宜泽
刘 骥,陈艳茹,侯竹美,徐冬雪,谷元雪,宋文琦,宋宜泽,夏 斌
( 青岛农业大学,海洋科学与工程学院,山东 青岛 266109 )
仿刺参(Apostichopusjaponicus),属棘皮动物门海参纲经济物种,具有较高的营养和药用价值。截至2020年底,我国仿刺参年产量1.97×106t,总产值超300亿元[1]。随着仿刺参养殖规模的扩大,其病害问题也日益凸显,给广大养殖从业者带来了严重的经济损失,其中以腐皮综合征的危害最为严重,发病死亡率超过90%[2]。
灿烂弧菌(Vibriosplendidus),属弧菌科弧菌属细菌,革兰氏阴性菌,可引发仿刺参、大西洋鲑(Salmosalar)和菲律宾蛤仔(Ruditapesphilippinarum)等水产养殖动物患细菌性疾病[3-4]。目前已知仿刺参腐皮综合征的主要病原为灿烂弧菌[5-8],其感染后可经仿刺参体内MyD88依赖的TLR信号通路进行信号转导并引发免疫应答[9],改变仿刺参体内免疫相关酶的活性[10]。为有效预防和控制灿烂弧菌引发的相关疾病,开发快速灵敏、特异可靠的灿烂弧菌检测技术十分必要。另外,水产动物弧菌病的发生也与病原丰度直接相关[11],因此建立灿烂弧菌的定量检测方法有着重要意义。目前已有的灿烂弧菌检测方法包括细菌分离培养-生理生化试验、基于蛋白质检测的免疫学技术[双抗原夹心酶联免疫吸附测定(ELISA)法、斑点酶联免疫吸附试验(Dot-ELISA)等]和基于核酸检测的分子生物学技术(PCR法、核酸探针法)等[12-15]。然而,生理生化试验灵敏度低、特异性差;分离培养法和免疫学检测周期长、通量低;以PCR和核酸探针为代表的分子生物学检测方法所需的仪器设备和人员培训投入高、核酸探针设计复杂且昂贵,无法适用于基层单位和养殖现场等场所。
成簇的规律间隔短回文重复序列(CRISPR)及其相关蛋白(Cas)是原核生物中广泛存在的一种通过切割核酸来抵御病毒和外源核酸入侵的天然免疫防御系统[16]。近年,科学家们发现,Cas13a在激活后具有核酸附属切割活性,Gootenberg等[17]提出了基于CRISPR-Cas13a的核酸检测方法:Cas13a可通过其内部的CRISPR RNA(crRNA)识别并结合靶标RNA,从而激活Cas13a的附属切割活性,非特异地切割RNA探针以检测靶标RNA的存在。此后,他们进一步结合重组酶介导的聚合酶扩增(RPA)技术,建立了SHERLOCK分子检测平台[18],并将其成功应用于病毒核酸分子(如寨卡病毒、埃博拉病毒、A型禽流感病毒等)和其他分子(如miRNA和N1-甲基腺苷等)的检测[19-23]。
笔者设计针对灿烂弧菌gyrB基因的靶标特异性RPA引物和crRNA,利用CRISPR-Cas13a,建立1种CRISPR-Cas13a辅助的RPA检测技术(图1),旨在实现对灿烂弧菌快捷、灵敏、特异的定量检测,为该病原引发的水产动物相关弧菌病的早期诊断和有效防控提供新的分子工具。

图1 灿烂弧菌RPA-Cas13a快速检测技术原理Fig.1 Schematic of RPA-Cas13a rapid detection of V. splendidus
1 材料与方法
1.1 试验材料及仪器
1.1.1 菌株及样本
试验所用灿烂弧菌由中国水产科学研究院黄海水产研究所赠与,创伤弧菌(V.vulnificus)、哈维氏弧菌(V.harveyi)、鳗弧菌(V.anguillarum)、副溶血弧菌(V.parahaemolyticus)、美人鱼发光杆菌(Photobacteriumdamselae)、产黑假交替单胞菌(Pseudoalteromonasnigrifaciens)、嗜水气单胞菌(Aeromonashydrophlia)和迟缓爱德华氏菌(Edwardsiellatarda)为实验室前期自养殖环境中分离,以上菌株均已在本实验室保存。32份健康和疑似患腐皮综合征的仿刺参皮肤黏液样品、15份养殖水体样本和10份表层沉积物样品采集自山东青岛、烟台和威海的6个仿刺参养殖池塘。
1.1.2试剂与仪器
质粒pC013-Twinstrep-SUMO-huLwCas13a购自武汉淼灵生物科技有限公司;细菌基因组核酸提取使用E.Z.N.A.®Bacterial DNA Kit(美国Omega Bio-tek公司);沉积物样品DNA提取使用FastDNA®Spin Kit for Soil(MP bio);RPA使用TwistAmp®Basic kit(TwistDx);T7 RNA聚合酶、NTPs、柱形RNA纯化试剂盒和RNase抑制剂均购于纽英伦生物技术(北京)有限公司;ABI 7500实时荧光定量PCR仪购于美国赛默飞公司;SpectraMax iD5多功能酶标仪购于美谷分子仪器(上海)有限公司。
1.2 试验方法
1.2.1 LwCas13a的表达与纯化
将质粒pC013-Twinstrep-SUMO-huLwCas13a转化至RosettaTM (DE3) pLysS Singles感受态细胞(美国Millipore公司)后,进行Cas13a的表达,调整异丙基硫代半乳糖苷(IPTG)浓度、诱导温度和诱导时间等以优化蛋白表达条件,利用重组蛋白N末端的His标签进行镍柱纯化,同时利用类泛素蛋白修饰分子(SUMO)标签促溶促表达,经酶切后过离子柱去除标签,获得纯净目的蛋白后透析并于-80 ℃保存于蛋白储存缓冲液(600 mmol/L NaCl、20 mmol/L Tris-HCl、5%甘油、1 mmol/L二硫苏糖醇,pH 8.0)中。
1.2.2 RPA引物设计
灿烂弧菌的保守基因包括gyrB、16S rRNA、toxR、hsp60、vhhp2等,在GenBank中下载相关基因序列并在MegAlign中比对分析,最终选定在细菌中广泛存在,在基因组中呈单拷贝、进化速度相对更快、碱基替换率高、无频繁的基因水平转移、特别适合亲缘关系较近菌种的区别和鉴定的gyrB基因作为检测灿烂弧菌的靶标基因[24-26]。选取50株灿烂弧菌和17株非灿烂弧菌(包括鳗弧菌、哈维氏弧菌、副溶血弧菌、创伤弧菌和迟缓爱德华氏菌等)的gyrB基因,寻找灿烂弧菌gyrB基因特异的保守区序列,并据此设计其RPA引物,在反向引物5′端添加T7 RNA聚合酶启动子序列(表1)。
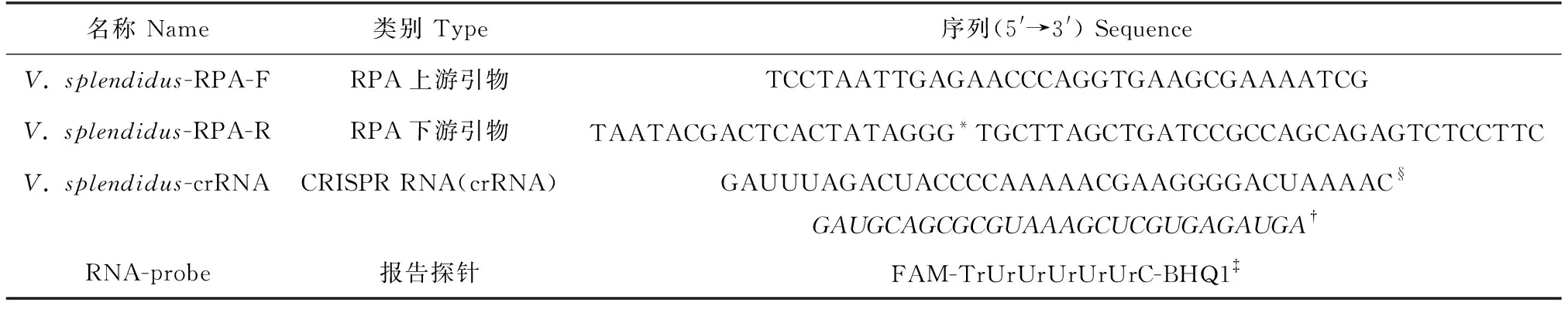
表1 灿烂弧菌RPA引物、crRNA和RNA报告探针序列Tab.1 Sequences of Vibrio splendidus RPA primers, crRNA and RNA-probe
1.2.3 crRNA的制备
根据设计的灿烂弧菌crRNA序列(表1),合成用于体外转录crRNA的模板(5′-TCATCTCAC GAGCTTTACGCGCTGCATCGTTTTAGTCCCC TTCGTTTTTGGGGTAGTCTAAATCCCCTAT AGTGAGTCGTATTA-3′,下划线部分为T7 RNA聚合酶的启动子序列)及其互补链,通过双链退火反应和T7 RNA聚合酶[纽英伦生物技术(北京)有限公司]体外转录制备crRNA。
1.2.4 RPA强化的CRISPR-Cas13a检测
参照TwistAmp®Basic kit(TwistDx)说明书配置灿烂弧菌RPA反应体系(50 μL):将基础缓冲液29.5 μL,10 μmol/L上、下游引物(表1)各2.4 μL,双蒸水 12.2 μL,1.0 μL DNA模板加入到TwistdxAmp基础单元中,混匀后加入2.5 μL 乙酸镁溶液(280 mmol/L),37 ℃孵育20 min进行RPA反应。
CRISPR-Cas13a检测反应体系如下(50 μL):5 μL RPA 扩增产物,22.5 nmol/L crRNA,45 nmol/L Cas13a,2 μL RNase inhibitor[纽英伦生物技术(北京)有限公司],125 nmol/L RNA-probe(青岛友虹生物化学科技有限公司),0.6 μL T7 RNA Polymerase Mix,2.5 μL NTP Buffer Mix[纽英伦生物技术(北京)有限公司],最后用Cas13a检测缓冲液(60 mmol/L NaCl、40 mmol/L Tris-HCl、6 mmol/L MgCl2,pH 7.3)补齐至50 μL。通过SpectraMaxiD5多功能酶标仪在37 ℃下孵育2 h,并于485 nm的激发光和520 nm的发射光下每5 min收集1次荧光信号。
1.2.5 RPA-Cas13a检测的灵敏度和特异性试验
根据质粒质量浓度和长度计算稀释前人工合成含有gyrB基因的质粒(擎科生物)的拷贝数,并进行梯度稀释,最终获得5.5×101~5.5×108拷贝/μL共8个gyrB基因的密度梯度,作为DNA模板对灿烂弧菌的CRISPR-Cas13a结合RPA检测方法进行灵敏性评价。按同样梯度稀释方法制备灿烂弧菌荧光定量PCR检测的DNA模板标准品并进行荧光定量PCR检测[反应体系:10 μL 2×SYBR®Green Pro Taq HS Premix(艾科瑞生物),1 μL DNA模板,10 μmol/L上、下游引物(同RPA引物,见表1),0.4 μL ROX reference dye(艾科瑞生物),ddH2O补齐至20 μL。反应条件:95 ℃ 5 min;95 ℃ 10 s;60 ℃ 30 s,共40个循环。得到其对应循环阈值并以循环阈值≤35为阳性判别标准]。比较RPA-Cas13a和荧光定量PCR的检测敏感性差异。
选取灿烂弧菌,与灿烂弧菌同属不同种的创伤弧菌、哈维氏弧菌、鳗弧菌、副溶血弧菌,与弧菌亲缘关系相近的美人鱼发光杆菌,仿刺参的常见致病菌产黑假交替单胞菌、嗜水气单胞菌和水产动物常见致病菌迟缓爱德华氏菌及其混合培养物(9种菌株混合培养及无灿烂弧菌8种菌株的混合培养)作为对照,提取其基因组DNA,利用灿烂弧菌的RPA引物(表1)对提取获得的DNA进行RPA反应和后续CRISPR-Cas13a检测,判断该检测方法的特异性。
1.2.6 养殖环境样本验证
采集青岛、烟台和威海养殖池塘32份仿刺参的皮肤黏液样本、15份养殖水体样本和10份表层沉积物样品,通过十二烷基苯磺酸钠-苯酚-氯仿法进行皮肤黏液样本和养殖水体样品DNA提取,利用试剂盒提取表层沉积物样品DNA,以RPA-Cas13a和荧光定量PCR(qRT-PCR)法进行同步检测,比较两种方法对检测实际养殖环境样本的效果一致性。
1.2.7 统计分析
采用R软件进行统计学分析,计量资料采用学生t检验,计数资料采用配对卡方检验,分析不同荧光信号强度的差别以及不同方法检测实际养殖环境样品中灿烂弧菌检出率的结果差异,双尾P<0.05认为有统计学差异。
2 结果与分析
2.1 LwCas13a的表达及纯化
对LwCas13a目的基因进行克隆,并对蛋白表达条件进行优化,最终选定500 μmol/L IPTG,18 ℃诱导表达16 h,经镍柱纯化、SUMO蛋白酶切割、离子柱纯化和透析后,通过SDS-PAGE电泳检测产物,结果显示获得了高纯LwCas13a(图2)。
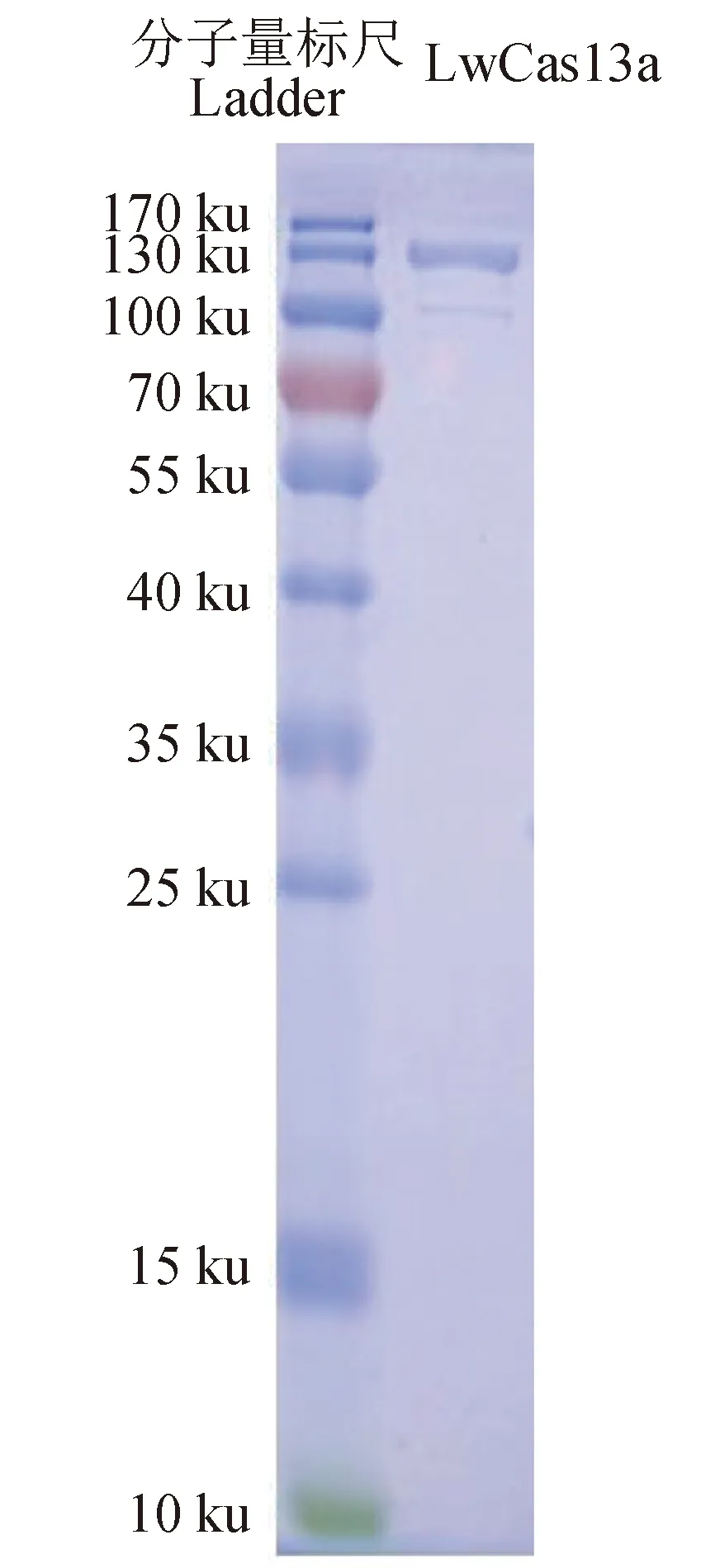
图2 纯化LwCas13a蛋白的SDS-PAGE检测Fig.2 SDS-PAGE detection of purified LwCas13a protein
2.2 灿烂弧菌CRISPR-Cas13a结合RPA检测的灵敏度
以梯度稀释的DNA质粒标准品(5.5×101~5.5×108拷贝/μL,gyrB)作模板进行检测,发现RPA-Cas13a的检测灵敏度为550拷贝/μL(gyrB)(图3)。荧光定量PCR和RPA-Cas13a具有相同的检测灵敏度,亦为550拷贝/μL(gyrB DNA分子的密度低于550拷贝/μL时,PCR扩增的循环阈值大于35,图4)。
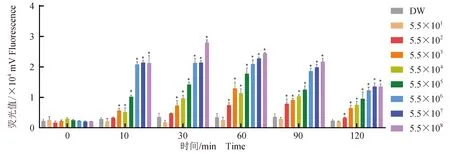
图3 RPA-Cas13a检测灿烂弧菌gyrB基因的灵敏度测试Fig.3 Sensitivity test for RPA-Cas13a detection of V. splendidus gyrB geneDW.双蒸水;5.5×101~5.5×108. 5.5×101~5.5×108拷贝/μL(gyrB);*.与DW组比较有显著性差异(P<0.05).DW. ddH2O; 5.5×101—5.5×108. 5.5×101—5.5×108 copies/μL(gyrB); *.compared with DW group, significant differences were observed(P<0.05).
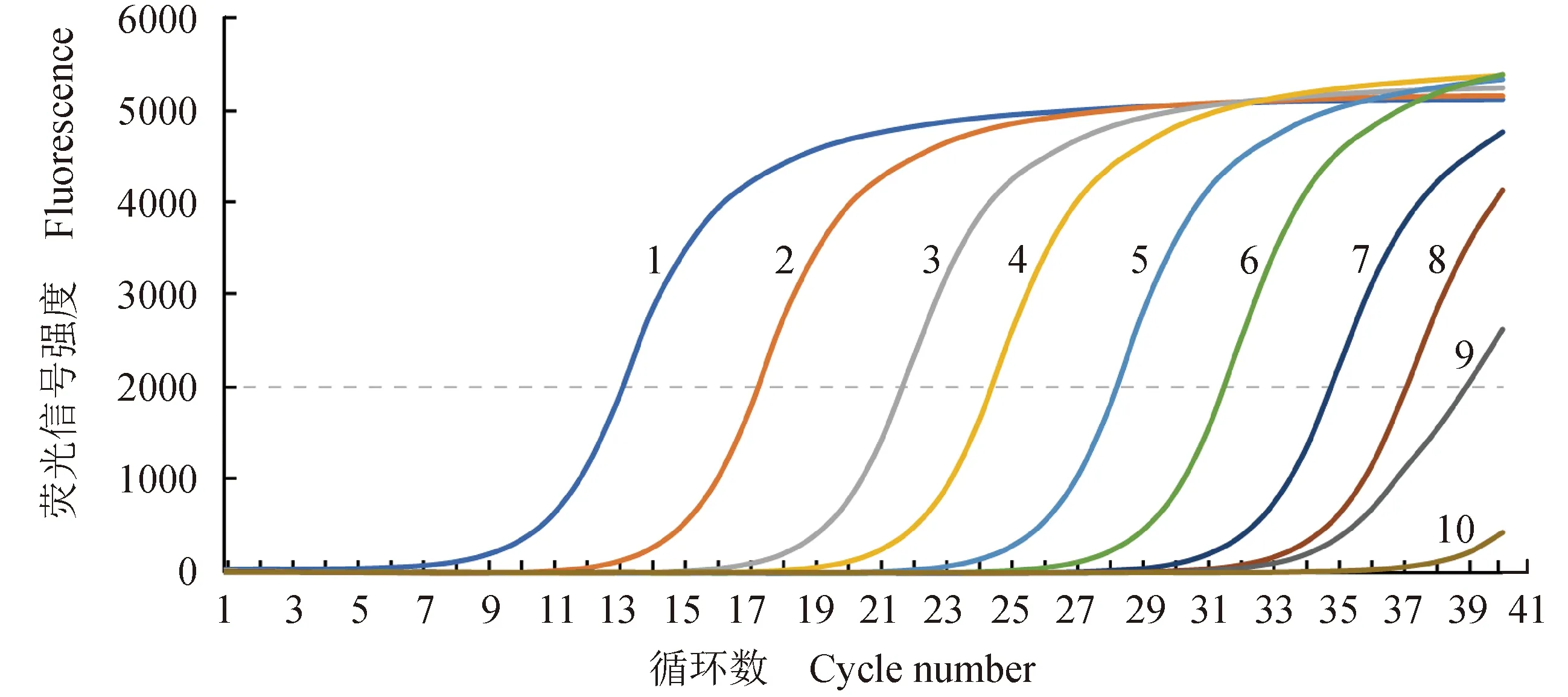
图4 荧光定量PCR法检测不同拷贝数浓度灿烂弧菌gyrB基因的扩增曲线Fig.4 Amplification curves of V. splendidus gyrB gene with different concentrations detected by fluorescence quantitative PCR1~9.5.5×108~5.5×100拷贝/μL(gyrB);10.阴性对照(ddH2O);虚线表示设置的用于获得循环阈值的荧光信号强度阈值.1-9. 5.5×108—5.5×100 copies gyrB/μL; 10. negative control (ddH2O); the dashed line indicates the fluorescence intensity threshold set to obtain the CT values.
2.3 灿烂弧菌CRISPR-Cas13a结合RPA检测的特异性
特异性试验结果显示,仅具有灿烂弧菌DNA的样本经RPA-Cas13a检测有荧光信号产生,而对照菌株及无灿烂弧菌的菌株混合培养物均未出现明显荧光信号(图5),表明建立的方法用于检测灿烂弧菌具有较高的特异性。
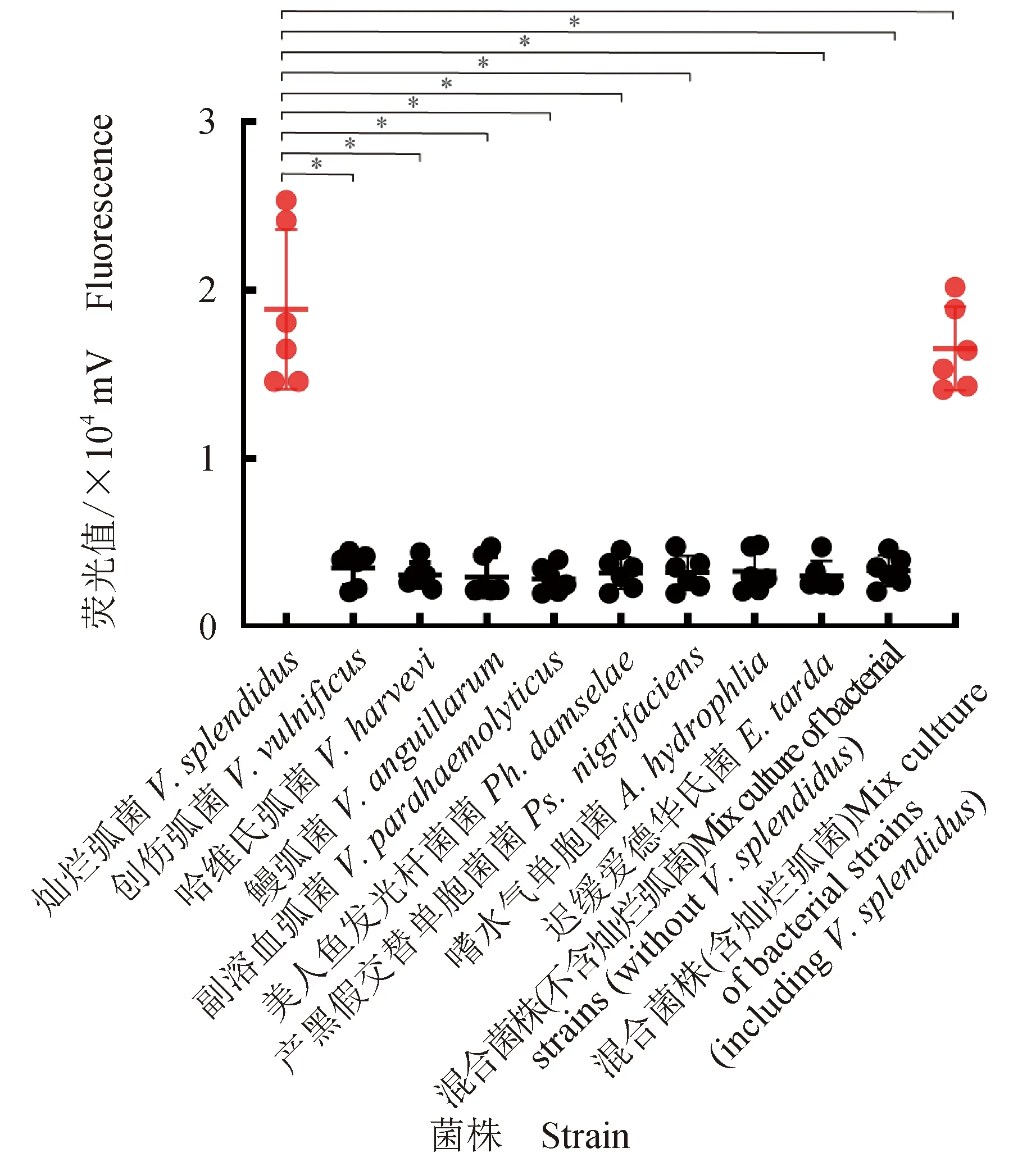
图5 RPA-Cas13a检测灿烂弧菌gyrB基因的特异性测试Fig.5 Specificity test for RPA-Cas13a detection of V. splendidus gyrB gene*.与其他组比较有显著性差异(P<0.05);红色表示检测结果为阳性,黑色表示检测结果为阴性.*.compared with other groups, significant differences were observed(P<0.05); red color indicates positive test results, while black indicates negative test results.
2.4 养殖环境样本检测效果评价
提取32份养殖环境仿刺参皮肤黏液样本、15份养殖水体样本和10份表层沉积物样本的DNA,分别采用RPA-Cas13a和荧光定量PCR法检测样本中的灿烂弧菌。结果显示:RPA-Cas13a法共检出阳性标本5份(阳性率8.77%);荧光定量PCR法共检出阳性标本5份(阳性率8.77%),两种检测方法的实际应用效果无统计学差异(P>0.05)、一致性高(Kappa=1.00)(表2)。
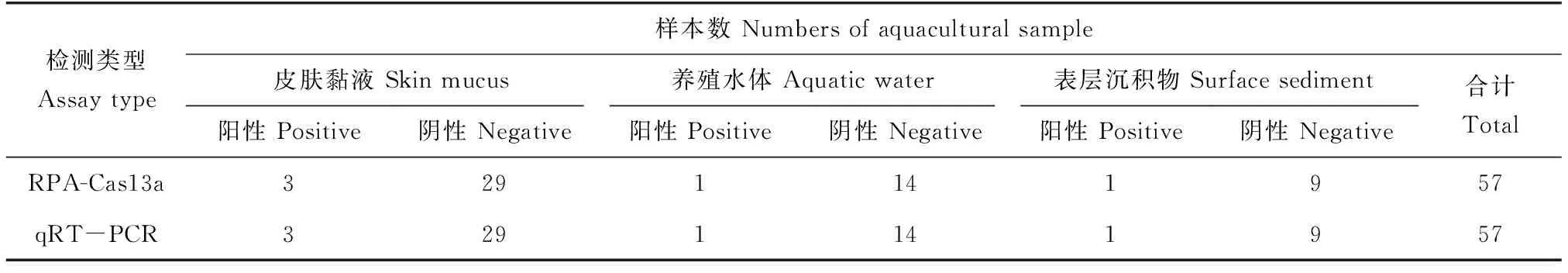
表2 RPA-Cas13a和荧光定量PCR检测养殖环境样本的效果比较Tab.2 Comparison of the detection effects between RPA-Cas13a and quantitative PCR on aquacultural samples
3 讨 论
随着仿刺参养殖规模的扩大和养殖密度的增加,其病害问题日益凸显,其中以腐皮综合征危害最为严重,每年因该传染性疾病造成的经济损失可达数十亿元[27-28]。灿烂弧菌是引发仿刺参腐皮综合征的主要病原之一[5-8],它可以快速感染仿刺参的体壁黏膜、肌肉和内脏组织,发病后几天内便可导致大规模死亡。该菌也是其他多种水产养殖动物的重要致病菌,可引发鱼类皮肤溃疡、内脏糜烂,引起虾、蟹、牡蛎和贻贝大量死亡,严重影响海水养殖业的可持续发展。因此,对养殖环境中灿烂弧菌进行快速定量检测以便对相关水产动物弧菌病进行早期预警是水产病原微生物研究领域亟待解决的问题之一。
3.1 RPA-Cas13a检测灿烂弧菌的原理分析
目前,针对灿烂弧菌已有的检测手段均存在某些局限性,如:常规细菌分离纯化和生理生化鉴定过程繁琐、通量低;免疫学检测特异性不强,易造成假阳性或假阴性结果;分子生物学检测方法中的PCR技术所需仪器昂贵且不便携,核酸等温扩增技术中的环介导等温扩增技术引物设计难度较大且常出现非特异性扩增,核酸序列依赖扩增技术需要在变温条件下才能完成引物结合且只能依赖RNA无法利用DNA作为模板;而RPA技术引物设计相对简单、反应温度低且恒定,近年来已得到普及,但该技术也存在产物检测繁琐、荧光探针设计复杂等问题。近年研究发现,Cas9可与DNA靶序列的特异性位点结合并激活切割活性,自此开启了利用CRISPR/Cas系统进行基因编辑的新时代[16]。除基因编辑功能外,Cas13a在特异性crRNA的引导下可结合靶标RNA并激活其附属切割活力,对临近RNA进行无选择性非特异切割。基于此,可选择在Cas13a+crRNA+靶标RNA的反应体系中添加非特异RNA报告探针,便可对靶标核酸分子开展特异性检测[29-30]。Kellner等[18,31]进一步将RPA技术与CRISPR/Cas系统相结合,建立了SHERLOCK(应用Cas13a)和DETECTR(应用Cas12a)核酸检测系统,以上两种检测方法利用RPA技术对样本中的靶标DNA分子进行信号预放大后再利用Cas识别并切割,使得检测更加快速灵敏、特异性更强。
3.2 RPA-Cas13a检测灿烂弧菌的灵敏性及特异性分析
经灿烂弧菌靶标基因gyrB的RPA处理、T7 RNA聚合酶转录后,产生的靶标RNA分子在特异性crRNA的引导下结合Cas13a并激活其附属切割活性,切割体系中添加的非特异RNA探针释放荧光信号,以检测样品中灿烂弧菌的数量。本检测方法无需设计和合成复杂的荧光探针,降低了检测难度和成本。另外,T7 RNA聚合酶转录和Cas13a的附属切割均可进行信号放大,使得RPA-Cas13a法相较单纯RPA的检测灵敏度更高,达到了DNA分子102个/μL量级,与本研究中荧光定量PCR的检测灵敏度水平一致,与Chang等[32]通过RPA-Cas13a法检测猪繁殖与呼吸综合征病毒的灵敏度在同一数量级,但低于于永翔等[33]通过荧光定量PCR检测的灿烂弧菌灵敏度(20拷贝/μL gyrB)。从不同稀释梯度灿烂弧菌gyrB基因产生的荧光信号来看,其强度与gyrB基因密度呈正相关关系,因此荧光信号强度可用于初步定量养殖环境中灿烂弧菌的丰度或水产动物的灿烂弧菌携带量。
特异性crRNA的引导决定了该检测过程是一种序列特异的识别过程,非灿烂弧菌gyrB基因的RPA产物因无法结合特异性crRNA而不能激活Cas13a的附属切割活力。与单纯RPA荧光检测法相比,无需探针的双荧光标记和引物四氢呋喃取代及末端封闭修饰等复杂设计,便可保证检测方法的高度特异性,试验成本和难度更低。目前已知灿烂弧菌可分为两种生物型——生物Ⅰ型与Ⅱ型,均具有致病性[34],本方法对检测以上两种类型的灿烂弧菌在敏感性和特异性方面是否存在差异,尚待进一步研究。对仿刺参养殖环境样品的检测结果显示,本方法与荧光定量PCR法的检测结果无统计学差异,检出一致性高,表明该方法应用于实际环境样本的特异性和准确性是可靠的。由于RPA-Cas13a的整个检测过程均可在37 ℃恒温下进行,现场实际操作中只需1台便携式恒温荧光检测仪,且整个检测过程耗时较短,在1 h内便可以进行结果判读,因此适合在基层单位和养殖场使用。
3.3 RPA-Cas13a检测灿烂弧菌的优化方向
由于本方法需要先单独完成RPA处理,获得产物进行纯化后,再加入到CRISPR-Cas13a检测体系中,所以实际操作中较易引发阴性对照污染以及样本间的交叉污染。在后续研究中,一方面可在RPA体系表面滴加油脂封住液面,防止污染;另一方面,也可对扩增和检测体系进行优化,实现单管一步法反应。若将荧光探针中的荧光淬灭基团改为生物素,便可与侧向流动试纸相结合实现可视化定性检测,最大程度减少对仪器设备的依赖,进一步降低应用成本。另外,如何简化环境样品中核酸提取的操作,甚至开发一套无需进行核酸提取的检测方法,也是今后需要继续探讨的问题。
关于靶标基因的选择,gyrB是DNA促旋酶B亚单位的编码基因,具有在细菌基因组中广泛存在、序列相对保守、单拷贝,相对16S rRNA基因进化速度更快、碱基替换率更高、无频繁基因水平转移等特征,特别适用于区别和鉴定亲缘关系较近的菌种[24-26]。弧菌属由于较为庞大、细菌种较多,种间亲缘关系较近,因此选择该基因作为靶标恰好可满足检测需求,但其他具有类似遗传和进化特征的管家基因,如rpoB、gapA、pyrH和recA等[35],均可在今后的试验中考虑作为靶标建立有关检测方法。
4 结 论
笔者将CRISPR-Cas13a系统与RPA技术相结合,建立了RPA-Cas13a检测方法,应用于仿刺参腐皮综合征主要病原体——灿烂弧菌的快速定量检测。该方法简单、灵敏、特异、高效,为预警和防控由灿烂弧菌引发的水产动物病害,实现水产动物健康养殖提供了有力的分子工具,也为建立其他水产病原体的快速分子检测方法提供了思路。
