宰后初期不同温度处理对鸭肉肌原纤维蛋白氧化及凝胶品质的影响
2023-07-17朱学伸齐高俊丁正峰
朱学伸 齐高俊 丁正峰


摘 要:研究不同温度处理对宰后初期鸭肉肌原纤维蛋白氧化及凝胶特性的影响。分别将鸭胸肉在不同温度处理(0、40 ℃分别孵育1 h),之后提取肌原纤维蛋白,测定蛋白氧化特征变化(羰基含量、巯基含量)以及对其凝胶特性(流变特性、质构和微观结构)的影响,并对蛋白特征使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electropheresis,SDS-PAGE)进行分析。结果表明:与对照组(0 ℃)肌原纤维蛋白相比,热处理组(40 ℃)肌原纤维蛋白中的羰基含量升高,而巯基含量降低52.7%,蛋白凝胶的保水性降低14.1%,凝胶强度降低45.5%,三者均显著降低(P<0.05);两组间蛋白流变特性差异不明显,而SDS-PAGE分析发现,40 ℃处理组中部分肌浆蛋白附着于肌原纤维蛋白上,且凝胶网格结构整体较松散,说明在热处理过程中会伴随鸭肉肌原纤维蛋白发生氧化,从而使其凝胶特性受到影响。
关键词:鸭肉;宰后温度;肌原纤维蛋白;氧化特性;凝胶特性
Effects of Different Temperature Treatments during the Early Postmortem Period on the Oxidation Characteristics and Gel Properties of Duck Myofibrillar Protein
Zhu Xueshen, Qi Gaojun, Ding Zhengfeng*
(Key Laboratory of Development and Utilization of Biologically Active Substances for Food and Medicine,
College of Life Science and Chemistry, Jiangsu Second Normal University, Nanjing 211200, China)
Abstract: The effects of different temperature treatments during the early postmortem period on the oxidation and gel properties of duck myofibrillar protein (MP) were studied. After postmortem aging for 1 h at different temperatures (0 and 40 ℃), MP was extracted from duck breast meat to measure changes in its oxidation characteristics (including carbonyl content and sulfhydryl content) and the effects thereof on its gel properties (including rheological properties, texture, and microstructure). Meanwhile, changes in MP composition were analyzed by sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE). The results showed that compared with the control group (0 ℃), the carbonyl content of MP in the heat-treated group (40 ℃) significantly increased, while the free sulfhydryl content decreased by 52.7%, the water-holding capacity (WHC) of MP gel decreased by 14.1% and the gel strength decreased by 45.5%; all these decreases were significant (P < 0.05). There was no significant difference in protein rheological properties between the two groups; however, SDS-PAGE analysis indicated that sarcoplasmic proteins were partially attached to myofibrils in the 40 ℃ treatment group and the gel network structure was loose overall. These results indicated that the oxidation of duck MP can occur during heat treatment, which will affect its gel-forming capacity.
Keywords: duck meat; postmortem temperature; myofibrillar protein; oxidation properties; gel properties
DOI:10.7506/rlyj1001-8123-20230220-016
中圖分类号:TS251.5 文献标志码:A 文章编号:1001-8123(2023)06-0001-07
引文格式:
朱学伸, 齐高俊, 丁正峰. 宰后初期不同温度处理对鸭肉肌原纤维蛋白氧化及凝胶品质的影响[J]. 肉类研究, 2023, 37(6): 1-7. DOI:10.7506/rlyj1001-8123-20230220-016. http://www.rlyj.net.cn
ZHU Xueshen, QI Gaojun, DING Zhengfeng. Effects of different temperature treatments during the early postmortem period on the oxidation characteristics and gel properties of duck myofibrillar protein[J]. Meat Research, 2023, 37(6): 1-7.
(in Chinese with English abstract) DOI:10.7506/rlyj1001-8123-20230220-016. http://www.rlyj.net.cn
我國鸭肉产量世界排名前列,且鸭肉由于其丰富的蛋白质含量、低廉的价格,深受广大消费者的青睐[1]。肌肉中的蛋白质根据其在肌肉组织中的溶解度主要可分为肌原纤维蛋白(myofibrillar protein,MP)和肌浆蛋白两大类[2],其中MP是动物肌肉蛋白的主要成分,占肌肉蛋白总量的50%~60%,主要由肌球蛋白、肌动蛋白和肌动球蛋白等构成[3]。在肉制品加工过程中,环境中的氧、温度等以及肉类本身所存在的铁离子等因素均可诱发MP发生氧化反应,改变MP的结构,使得分子结构展开,暴露出氨基酸侧链基团,从而发生一系列的反应,如羰基衍生物、二硫键等的生成,进而引起其理化性质及功能性质的改变。
同时,MP具有良好的凝胶和水结合能力,经加热诱导可形成凝胶。在热凝胶化过程中涉及蛋白受热变性展开,包括蛋白的构象变化、疏水相互作用以及氢键、二硫键等相互作用,随后蛋白之间发生聚集,形成有序的三维网状结构[4-5],因此,温度是影响MP凝胶特性的最重要因素之一。而MP的凝胶特性是肉糜类制品加工的基础,直接影响肉制品的质量,并对产品的感官品质产生重要影响。孔保华等[6]研究不同温度对猪肉MP凝胶特性的影响,结果显示,随着加热温度的升高,其凝胶硬度与咀嚼性呈现出先升高后降低的趋势。王正雯等[7]研究发现,70 ℃时形成的凝胶结构紧密细腻,且保水性达到最大值,并且随着加热温度的升高,凝胶网络孔径变大,保水性显著降低。但目前有关宰后早期不同温度处理对鸭肉MP氧化及凝胶特性影响的相关报道较少,且分子机制仍然不清楚。因此,本实验研究僵直期间不同温度处理对鸭肉MP氧化特征及凝胶特性的影响,为进一步提高鸭肉及制品品质提供一定的参考。
1 材料与方法
1.1 材料与试剂
麻鸭采购于江苏省南京市溧水区。
氯化钠、氯化镁、磷酸氢二钾、乙二醇双(2-氨基乙基醚)四乙酸(ethylene glycol-bis(2-aminoethylether)-N,N,N,N-tetraacetic acid,EGTA)、三氯乙酸(trichloroacetic acid,TCA)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)、5,5-二硫双(2-硝基苯甲酸)(5,5-dithiobis(2-nitrobenzoic acid),DTNB)、二硫苏糖醇(DL-dithiothreitol,DTT)
(均为分析纯) 国药集团化学试剂有限公司,NuPAGETM 十二烷基硫酸锂(lithium dodecyl sulfate,LDS)样品缓冲液 美国Thermo Fisher Scientific公司;实验所用水为超纯水。
1.2 仪器与设备
SIM-F140制冰机 日本Sanyo公司;BSA224S电子分析天平 德国Sartorius公司;T18高速匀浆机
德国IKA公司;UV2000紫外-可见分光光度计 上海舜宇恒平科学仪器有限公司;5810R多功能台式冷冻离心机 德国Eppendorf公司;SLK-O3000-S脱色摇床
美国Scilogex公司;TA-XT Plus质构仪 英国Stable Micro System公司。
1.3 方法
1.3.1 原料肉处理
将屠宰后取出的鸭胸肉立即在2 个温度(0、40 ℃)条件下孵育1 h,剔除可见的脂肪和结缔组织后用自封袋进行分装,放置于4 ℃冰箱中过夜,而后放置于-80 ℃的冰箱中冷冻保存待用。
1.3.2 MP和肌浆蛋白提取
参考Han Minyi等[8]的方法,并进行适当修改。取出适量鸭胸肉,置于50 mL离心管中,向其中加入5 倍体积的提取液(100 mmol/L NaCl、2 mmol/L MgCl2、1 mmol/L
EGTA、10 mmol/L K2HPO4,pH 7.0),用匀浆机均匀混合,4 000×g离心10 min,第1次上清倒出并保留为肌浆蛋白溶液,如此反复3 次,在第2次离心前用纱布进行过滤。离心后,将4 倍体积的提取液(12.5 mmol/L NaCl、2.5 mmol/L MgCl2、1.25 mmol/L EGTA、12.5 mmol/L
K2HPO4、1% Triton X-100,pH 7.0)加入沉淀物中匀浆,之后4 000×g离心10 min,弃上清,重复上述步骤3 次。加入4 倍体积0.1 mol/L NaCl溶解沉淀,之后4 000×g离心10 min,重复3 次,最后一次离心前过滤,离心结束后将沉淀收集即为MP。以上过程需全程在冰浴条件下进行。
1.3.3 MP羰基含量的测定
参考Soglia等[9]的方法并略做改动,利用DNPH显色法进行测定。取200 μL 15 mg/mL MP溶液5 份,每份加入1 mL 10 g/100 mL TCA,8 000 r/min离心5 min,将400 μL 5 g/100 mL SDS加入到沉淀中,99 ℃下加热15 min。向3 份平行样品中分别加入800 μL 0.3 g/100 mL DNPH,再将800 μL 3 mol/L HCl加入到另外2 份样品中作为空白,均室温静置30 min,然后均加入400 μL 40 g/100 mL TCA,混匀,8 000 r/min离心5 min。向沉淀中加入1 mL乙醇-乙酸乙酯(1∶1,V/V),14 000 r/min离心5 min,重复3 次。沉淀干燥20 min后加入1.5 mL 6 mol/L盐酸胍,置于37 ℃振动孵育20 min。之后于4 ℃、10 000 r/min离心5 min,取上清测定A280 nm和A370 nm。羰基含量按式(1)计算。
式中:A370 nm为含有DNPH的MP溶液在370 nm波长处的吸光度;A370 nm(空白)为含有HCl的MP溶液在370 nm波长处的吸光度;A280 nm为含有DNPH的MP溶液在280 nm波长处的吸光度。
1.3.4 MP巯基含量的测定
依据Zhang Yuemei等[10]的方法,采用DTNB显色法进行测定。取2 份2 mg/mL MP溶液,每份600 μL,加入1 400 μL 0.6 mol/L NaCl(含10 mmol/L K2HPO4,pH 7.0)进行稀释。取上述溶液0.5 mL于离心管中,加入2 mL 0.1 mol/L Tris-HCl,测定A412 nm和A280 nm;将溶液倒入离心管中,再添加0.5 mL 10 mmol/L DTNB混匀,在室温下避光静置30 min,再次测定A412 nm。巯基含量按式(2)计算。
式中:A412 nm(前)为未加DTNB的MP溶液在412 nm波长处的吸光度;A280 nm为未加DTNB的MP溶液在280 nm波长处的吸光度;A412 nm(后)为加入DTNB后的MP溶液在412 nm波长处的吸光度。
1.3.5 SDS-PAGE分析
将1.3.1.2节提取的MP与肌浆蛋白质量浓度均调至2 mg/mL,取上述蛋白溶液500 μL,与500 μL的LDS样品缓冲液(含有DTT)混合均匀,再加入20 μL 1 mg/mL溴酚蓝,混匀后99 ℃加热10 min。电泳条件为:恒压200 V,45 min。考马斯亮蓝染色、脱色后进行蛋白条带的拍照与分析。
1.3.6 MP凝胶的制备及凝胶特性分析
1.3.6.1 MP凝胶的制备
参考Jiang Yi等[11]的方法,将MP质量浓度调整为40 mg/mL,并放入10 mL的小烧杯中,置于75 ℃水浴锅中恒温加热30 min,取出后放于冰水浴中冷却20 min,之后4 ℃冰箱中过夜,待分析。
1.3.6.2 MP凝胶保水性的测定
参考Kocher等[12]的方法。取一定量的凝胶样品加入到50 mL离心管中,于4 ℃、8 000 r/min离心10 min,去除离心出的水分。保水性按式(3)计算。
式中:ms为离心后总质量/g;mj为空离心管质量/g;mz为离心前总质量/g。
1.3.6.3 MP凝胶强度的测定
采用质构仪测定,并参考Hachmeister等[13]的方法。测定参数如下:探头型号P/5,测试前速率0.5 mm/s,
测试速率0.5 mm/s,测试后速率0.5 mm/s,下压距离5 mm,触发力4 g。
1.3.6.4 MP凝胶低频核磁共振分析
利用核磁共振分析仪测定凝胶样品的横向弛豫时间T2,测试方法参考余永名等[14]的方法并稍加修改。仪器校准完毕后,放置待测凝胶样品,并选取CPMG序列作为自旋-自旋弛豫时间。质子共振频率设置为40 MHz,测试温度设定在32 ℃。相关参数设置如下:重复采样次数8 次,重复间隔时间2 000 ms,回波个数9 000 个,每个样品重复操作3 次。最后对采集到的数据进行批量反演。
1.3.6.5 MP动态流变特性的测定
MP质量浓度调整为40 mg/mL,流变参数设置如下:夹具选用50 mm的平板,上下板的夹缝为1 mm,频率0.1 Hz,应变2%,以1 ℃/min的速率从25 ℃升温至85 ℃,
降温速率为5 ℃/min。在测试之前,将石蜡油滴于平板边缘,以避免样品与外界的空气接触,防止样品因受热而蒸发。记录温度扫描过程中的储能模量(G)和损耗模量(G”),并计算损耗角正切值(tan δ)。
1.3.6.6 MP凝胶微观结构的观察
利用扫描电子显微镜观察MP凝胶的微观结构。凝胶样品的取样和固定方法参考Han Minyi等[8]的方法并稍加修改。将制备好的MP凝胶切成2 mm×2 mm×5 mm的方块,然后将其浸在体积分数为2.5%的戊二醛溶液中,放置于4 ℃冰箱中固定12 h后,用0.1 mol/L磷酸盐缓冲液清洗3 次,每次3 min;之后用不同体积分数乙醇溶液(50%、70%、80%、90%、100%)进行梯度洗脱。脱水后的样品用叔丁醇进行置换,之后冷冻干燥,用双面胶带将样品粘到样品台上,镀10 nm金膜,15 kV电镜观察。
1.4 数据处理
使用SPSS软件(Version 20,SPSS Inc.,美国)处理数据,采用Duncans多元检验对数据差异显著性進行分析比较,P<0.05认为差异显著。
2 结果与分析
2.1 温度对鸭肉MP氨基酸侧链的影响
2.1.1 羰基含量
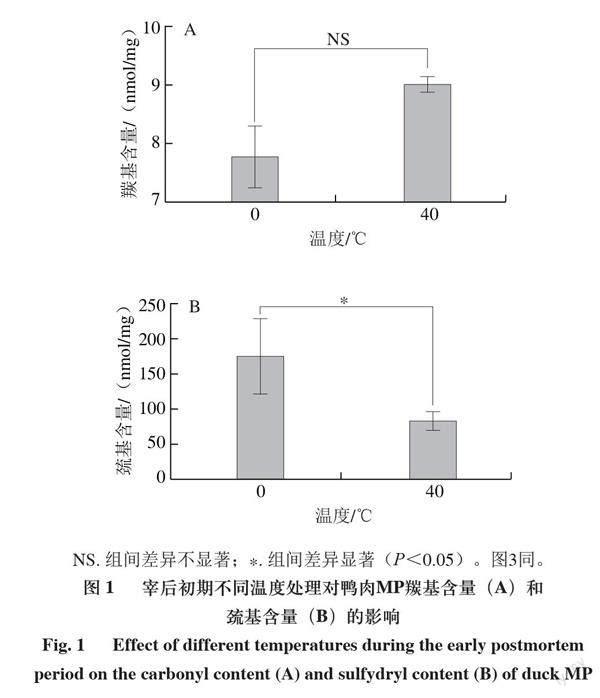
蛋白质发生氧化后的一个显著变化是羰基的形成,因此,蛋白中的羰基含量被广泛用于衡量蛋白质的氧化程度[15],一般来说,羰基含量越高,蛋白氧化程度就越大。由图1A可知,在0 ℃条件下处理的鸭肉MP中的羰基含量为7.77 nmol/mg,而在40 ℃条件下处理的鸭肉MP中的羰基含量则增加为9.01 nmol/mg,但差异不显著,说明40 ℃处理组的鸭肉MP一定程度上更容易被氧化,这表明在加热处理过程中,鸭肉中的MP伴随发生了氧化反应,诱发了肉中蛋白羰基的形成,从而导致其羰基含量升高。在正常情况下,细胞内产生的活性氧(reactive oxygen species,ROS)可作为信使分子,被超氧化物歧化酶、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和过氧化氢酶等组成的抗氧化系统清除,以维持机体正常的氧化还原稳态[16],但经热处理后的鸭肉中的ROS水平升高,破坏了体内的氧化还原平衡,从而使得蛋白发生氧化反应。同时,蛋白发生氧化的过程中会伴随脂质氧化,而脂质氧化反过来又会促进蛋白质的氧化,脂质氧化增加可以解释为抗氧化酶活性的丧失,如GSH-Px经热处理后其活性可下降高达80%[17],所以推测其羰基含量升高可能与热处理易导致抗氧化酶失活有关。
NS. 组间差异不显著;*. 组间差异显著(P<0.05)。图3同。
2.1.2 巯基含量
巯基是MP中反应活性最高、最为敏感的基团,而巯基含量的改变也是测定蛋白质氧化程度的一个重要指标。由图1B可知,0 ℃条件下处理的鸭肉MP中巯基含量为174.6 nmol/mg,而在40 ℃条件下处理的鸭肉MP中巯基含量减少52.67%,为82.7 nmol/mg,与0 ℃处理组的鸭肉相比含量显著减小,可能是由于宰后初期经过热处理,部分蛋白质变性,结构展开,巯基基团暴露,易被氧化产生二硫键,从而导致巯基含量的下降[18],而低巯基含量也说明40 ℃处理组的鸭肉MP被氧化程度更高,该结果与上述羰基含量的变化所表明的结果相一致。
2.1.3 SDS-PAGE分析
由图2A可知,电泳图中可以观察到分子质量约为180 kDa的肌球蛋白重链(myosin heavy chain,MHC)条带、分子质量约为50 kDa的肌动蛋白条带和20 kDa
附近处的肌球蛋白轻链(moysin light chain,MLC)条带[7]。40 ℃处理组的MHC条带较0 ℃处理组变浅,肌动蛋白条带未发生明显变化,可能是由于肌球蛋白在加热过程中产生了分子质量更大的蛋白交联聚合物。以上与40 ℃处理组在加样孔附近可发现部分大分子质量条带截留到浓缩胶顶端的结果一致,推测蛋白交联聚合物是由于蛋白氧化过程中氨基酸侧链间形成二硫键等化学键所致。为更全面地了解肌肉中蛋白变化概况,同时提取不同温度处理后鸭肉肌浆蛋白,由图2B可知,96 kDa和24 kDa处的蛋白条带在0 ℃处理组的鸭肉蛋白中表达量相对较高,因此蛋白条带颜色较深,而40 ℃处理组的表达量相对较少,因此蛋白条带颜色较浅;而图2A显示,不同温度处理组的MP部分差异较小,其中96 kDa蛋白在40 ℃处理组的鸭肉MP中表达量相对较高,而0 ℃处理组的表达量相对较低,且24 kDa处的蛋白条带未能清楚观察到,这可能是由于宰后经过高温处理肌浆蛋白发生变性,导致MP的结构发生改变,使得部分肌浆蛋白(96、24 kDa)附着在MP上[19],上述结果也同样被广泛证实是一种典型宰后初期高温处理造成的类PSE(pale, soft, exudative)肉的标志[20]。综合以上结果可以看出,宰后初期高温处理一方面可造成更多的肌浆蛋白变性,同时还可以造成部分MP发生交联聚集。
2.2 温度对鸭肉MP凝胶特性的影响
2.2.1 MP凝胶保水性
持水力是评价肉制品品质的重要指标之一,而鸭肉蛋白经热诱导所形成的凝胶保水性的强弱对品质有明显影响[21]。由图3A可知,0 ℃条件下处理的鸭肉凝胶保水性为55.1%,而在40 ℃条件下处理的鸭肉经热诱导所形成的凝胶保水性仅为47.3%。可能是由于40 ℃处理组的MP发生氧化变性并形成聚集体,而该蛋白聚集体改变了其结构,不利于形成稳定的三维网状结构,导致对水分的截留能力变差。MP的部分变性,尤其是结构的松散,导致疏水基团展开,客观上形成了一定的屏障,该屏障在一定程度上阻隔了水分子与MP分子的作用力,尤其是阻挡了肌球蛋白与水的接触[22],从而导致40 ℃处理组MP凝胶的保水性变差。
2.2.2 MP凝胶强度
由图3B可知,凝胶强度随处理温度的升高而下降,在0 ℃条件下处理的鸭肉经热诱导制备的凝胶强度为9.2 g/cm2,在40 ℃條件下处理的鸭肉经热诱导制备的凝胶强度为5.0 g/cm2。与0 ℃处理组凝胶相比,40 ℃处理组的凝胶强度显著降低。说明热处理后使得MP凝胶强度下降,削弱了蛋白凝胶的形成能力。
2.2.3 MP凝胶横向弛豫时间T2
由图4可知,0 ℃处理组与40 ℃处理组均出现3 个峰,10~80 ms有1 个小峰,100~1 000 ms有大峰出现,1 000 ms之后也有1 个新峰。参考韩敏义等[23]研究报道,10~1 000 ms的2 个峰所代表的是凝胶中的可移动水(T22),大于1 000 ms的峰代表的是凝胶中的自由水(T23)。一般而言,肌纤维凝胶中束缚了大量水,当氧化程度增加时,使得蛋白质的空间构象遭到破坏,从而不利于凝胶网状结构的形成,最终形成分布混乱、疏松多孔的凝胶结构,水分可以保存在其中,但在离心作用下会被轻易排出[24]。李银等[25]研究表明,凝胶中自由水的含量与凝胶的保水性呈负相关,即凝胶中的自由水含量越高,凝胶的保水性越差。但本研究结果显示,0 ℃处理组蛋白凝胶中的自由水含量与40 ℃处理组间差异不显著,推测40 ℃处理组较低保水性与蛋白理化特性改变、疏水性基团暴露导致结合水的能力下降有关。
2.2.4 MP流变特性
由图5可知,在整个加热过程中,0 ℃与40 ℃处理组MP的G趋势较为一致。0 ℃处理组在25~45 ℃这一区间内G缓慢升高,这可能是由于肌球蛋白头部受热后,部分发生变性接合。在45 ℃之后G达到峰值后急剧下降,并于60.3 ℃时达到最低值,这是因为肌球蛋白轻链开始变性,增加了蛋白的黏性,从而使得体系的流动性有所增加。可能是由于肌球蛋白尾部的解螺旋导致蛋白的流动性增强,同时不同程度上破坏了蛋白凝胶所形成的网络结构。此后一直到85 ℃,随着温度的升高,G持续上升,这主要是因为在60 ℃以后肌球蛋白充分变性展开,此时样品体系已形成良好的三维凝胶网状结构[26]。在升温过程中,40 ℃处理组样品的G在51 ℃之前的变化情况与0 ℃处理组一致,但此后没有继续下降反而显示出上升趋势,在55.1 ℃处时达到1 个小峰,而后下降,并于58.5 ℃时达到最小值;同时,40 ℃处理组的MP凝胶在60 ℃以后的G略高于0 ℃处理组,推测可能是由于僵直期间经过高温处理破坏了鸭肉MP分子内部结构,暴露出更多的疏水基团而导致[27]。0 ℃处理组样品的G”变化趋势与40 ℃处理组较为一致,25~55 ℃ G”逐渐升高,并于55.1 ℃处达到最大值。tan δ为G”与G的比值,当tan δ大于1时,表明样品的黏性大于弹性,样品为黏性流体;当tan δ小于1时,表明样品的弹性大于黏性,样品为溶胶或凝胶[28]。凝胶样品的tan δ始终小于1,并且在25~55.1 ℃呈上升趋势,从55.1 ℃开始逐渐下降,意味着鸭肉MP在55.1 ℃开始从溶胶向凝胶转变。
2.2.5 MP凝胶微观结构的观察
由图6可知,0 ℃处理组的MP经热诱导后所形成的凝胶网格结构较为均一,且结构较致密,致密的三维网络结构对水分有较强的束缚力,有利于滞留水分,因此其保水性强[29],而40 ℃处理组的MP凝胶的结构整体比较松散,对水分的束缚能力弱,导致凝胶的保水性较差,这与前文凝胶保水性的测定结果相吻合。说明经过高温处理的MP发生氧化,所形成的蛋白凝胶网格结构遭到破坏,使得凝胶的孔径变大甚至发生断裂,从而出现分离的片状结构。
3 结 论
僵直期间,40 ℃条件下处理的鸭肉MP与0 ℃处理组相比羰基含量升高,巯基含量、蛋白凝胶的保水性及凝胶强度均显著降低,MP发生氧化聚集,经热诱导所形成的MP凝胶网格结构比较松散,出现片状结构,说明MP经热处理后发生了氧化反应,使得蛋白质的结构发生变化,从而导致MP凝胶特性呈现下降趋势。本研究可以为工业上选择合适的抗氧化方法提供理论参考,并且为鸭肉的宰后生产加工过程及运输和贮藏等过程中的温度控制提供一定的研究基础。
参考文献:
[1] ZHU Xueshen, ZHANG Jiaxin, LIU Shaohua, et al. Relationship between molecular structure and heat-induced gel properties of duck myofibrillar proteins affected by the addition of pea protein isolate[J]. Foods, 2022, 11: 1040. DOI:10.3390/foods11071040.
[2] LEE S, JOO S, RYU Y. Skeletal muscle fiber type and myofibrillar proteins in relation to meat quality[J]. Meat Science, 2010, 86(1): 166-170. DOI:10.1016/j.meatsci.2010.04.040.
[3] 张建华, 夏杨毅. 氧化条件下HL-低钠盐对鹅肉肌原纤维蛋白凝胶特性的影响[J]. 食品与发酵工业, 2020, 46(10): 166-172. DOI:10.13995/j.cnki.11-1802/ts.023035.
[4] SUN X, HOLLEY R. Factors influencing gel formation by myofibrillar proteins in muscle foods[J]. Comprehensive Reviews in Food Science and Food Safety, 2010, 10(1): 33-51. DOI:10.1111/ j.1541-4337.2010.00137.x.
[5] 张骏龙, 周纷, 邵俊花, 等. 低场核磁共振技术研究淀粉添加量对肉糜保水性和质构特性的影响[J]. 食品工业科技, 2016, 37(21): 66-69; 75. DOI:10.13386/j.issn1002-0306.2016.21.004.
[6] 孔保華, 王宇, 夏秀芳, 等. 加热温度对猪肉肌原纤维蛋白凝胶特性的影响[J]. 食品科学, 2011, 32(5): 50-54.
[7] 王正雯, 田宏伟, 周富裕, 等. 加热温度对麻鸭肌原纤维蛋白结构与凝胶特性的影响[J]. 食品科学, 2020, 41(13): 61-68. DOI:10.7506/spkx1002-6630-20191128-280.
[8] HAN Minyi, ZHANG Yingjun, FEI Ying, et al. Effect of microbial transglutaminase on NMR relaxometry and microstructure of pork myofibrillar protein gel[J]. European Food Research and Technology, 2009, 228: 665-670. DOI:10.1007/s00217-008-0976-x.
[9] SOGLIA F, PETRACCI M, ERTBJERG P. Novel DNPH-based method for determination of protein carbonylation in muscle and meat[J]. Food Chemistry, 2016, 197: 670-675. DOI:10.1016/j.foodchem.2015.11.038.
[10] ZHANG Yuemei, ERTBJERG P. Effects of frozen-then-chilled storage on proteolytic enzyme activity and water-holding capacity of pork loin[J]. Meat Science, 2018, 145: 375-382. DOI:10.1016/j.meatsci.2018.07.017.
[11] JIANG Yi, LI Dahu, TU Juncai, et al. Mechanisms of change in gel water-holding capacity of myofibrillar proteins affected by lipid oxidation: the role of protein unfolding and cross-linking[J]. Food Chemistry, 2021, 344: 128587. DOI:10.1016/j.foodchem.2020.128587.
[12] KOCHER P, FOEGEDING E. Microcentrifuge-based method for measuring water-holding of protein gels[J]. Journal of Food Science, 1993, 58(5): 1040-1046. DOI:10.1111/j.1365-2621.1993.tb06107.x.
[13] HACHMEISTER K, HERALD T. Thermal and rheological properties and textural attributes of reduced-fat turkey batters[J]. Poultry Science, 1998, 77(4): 632-638. DOI:10.1093/ps/77.4.632.
[14] 余永名, 刘岩, 李学鹏, 等. 地衣芽孢杆菌对草鱼肌原纖维蛋白凝胶特性的影响[J]. 食品科学, 2016, 37(15): 31-38. DOI:10.7506/spkx1002-6630-201615006.
[15] 李艳青, 孔保华, 杨赫鸿, 等. 自由基氧化引起鲤鱼肌原纤维蛋白结构的变化[J]. 食品科学, 2012, 33(13): 70-74.
[16] YANG Yuhui, ZHANG Hui, YAN Biao, et al. Health effects of dietary oxidized tyrosine and dityrosine administration in mice with nutrimetabolomic strategies[J]. Journal of Agricultural and Food Chemistry, 2017, 65(32): 6957-6971. DOI:10.1021/acs.jafc.7b02003.
[17] HOAC T, DAUN C, TRAFIKOWSKA U, et al. Influence of heat treatment on lipid oxidation and glutathione peroxidase activity in chicken and duck meat[J]. Innovative Food Science and Emerging Technologies, 2006, 7(1/2): 88-93. DOI:10.1016/j.ifset.2005.10.001.
[18] SANTE-LHOIJTELLIER V, ASTRIJC T, MARINOVA P, et al. Effect of meat cooking on physicochemical state and in vitro digestibility of myofibrillar proteins[J]. Journal of Agricultural and Food Chemistry, 2008, 56: 1488-1494. DOI:10.1021/jf072999g.
[19] ZHU X, RUUSUNEN M, GUSELLA M, et al. High post-mortem temperature combined with rapid glycolysis induces phosphorylase denaturation and produces pale and exudative characteristics in broiler Pectoralis major muscles[J]. Meat Science, 2011, 89(2): 181-188. DOI:10.1016/j.meatsci.2011.04.015.
[20] LESI?W T, XIONG Y. A simple, reliable and reproductive method to obtain experimental pale, soft and exudative (PSE) pork[J]. Meat Science, 2013, 93(3): 489-494. DOI:10.1016/j.meatsci.2012.11.022.
[21] HUFF-LONERGAN E, LONERGAN S. Mechanisms of water-holding capacity of meat: the role of postmortem biochemical and structural changes[J]. Meat Science, 2005, 71(1): 194-204. DOI:10.1016/j.meatsci.2005.04.022.
[22] PUOLANNE E, HALONEN M. Theoretical aspects of water-holding in meat[J]. Meat Science, 2010, 86(1): 151-165. DOI:10.1016/j.meatsci.2010.04.038.
[23] 韩敏义, 费英, 徐幸莲, 等. 低场NMR研究pH对肌原纤维蛋白热诱导凝胶的影响[J]. 中国农业科学, 2009, 42(6): 2098-2104. DOI:10.3864/j.issn.0578-1752.2009.06.028.
[24] ZHU Xueshen, SHI Xiandong, LIU Shaohua, et al. Physicochemical properties and gel-forming ability changes of duck myofibrillar protein induced by hydroxyl radical oxidizing systems[J]. Frontiers in Nutrition, 2022, 9: 1029116. DOI:10.3389/fnut.2022.1029116.
[25] 李銀, 李侠, 张春晖, 等. 利用低场核磁共振技术测定肌原纤维蛋白凝胶的保水性及其水分含量[J]. 现代食品科技, 2013, 29(11): 2777-2781. DOI:10.13982/j.mfst.1673-9078.2013.11.042.
[26] JIANG Jiang, XIONG Youling. Extreme pH treatments enhance the structure-reinforcement role of soy protein isolate and its emulsions in pork myofibrillar protein gels in the presence of microbial transglutaminase[J]. Meat Science, 2013, 93: 469-476. DOI:10.1016/j.meatsci.2012.11.002.
[27] RAFAEL C, IDA E, MARTA S, et al. Underlying connections between the redox system imbalance, protein oxidation and impaired quality traits in pale, soft and exudative (PSE) poultry meat[J]. Food Chemistry, 2017, 215: 129-137. DOI:10.1016/j.foodchem.2016.07.182.
[28] ZHU Xueshen, TAN Beibei, LI Ke, et al. The impacts of different pea protein isolate levels on functional, instrumental and textural quality parameters of duck meat batters[J]. Foods, 2022, 11(11): 1620. DOI:10.3390/foods11111620.
[29] SUN Jian, LI Xue, XU Xinglian, et al. Influence of various levels of flaxseed gum addition on the water-holding capacities of heat-induced porcine myofibrillar protein[J]. Journal of Food Science, 2011, 76(3): 472-478. DOI:10.1111/j.1750-3841.2011.02094.x.
收稿日期:2023-02-20
基金项目:江苏省高校自然科学基金项目(19KJB550005;21KJA550002)
第一作者简介:朱学伸(1984—)(ORCID: 0000-0002-9162-4657),男,副教授,博士,研究方向为肉品加工与质量控制。
E-mail: xueshen_zhu@163.com
*通信作者简介:丁正峰(1981—)(ORCID: 0000-0003-3110-0488),男,教授,博士,研究方向为水生动物及疾病学。
E-mail: ding@jssnu.edu.cn
