小麦TaTLP8的抗体制备及其蛋白水平表达分析
2023-07-08孙天杰王冬梅
刘 超,孙天杰,刘 娜,陈 琰,王冬梅
(华北作物改良与调控国家重点实验室,河北省植物生理与分子病理学重点实验室,河北农业大学 生命科学学院,河北 保定 071001)
小麦叶锈菌(Pucciniatriticina)是一种专化性极强的活体营养型真菌,具有菌种变异快、分布范围广、毒性强等特点,其流行年份极易造成小麦(Triticumaestivum)大幅度减产,对我国的粮食安全构成潜在威胁[1]。因此,深入研究小麦抵御叶锈菌侵染的分子机制,挖掘广谱的抗叶锈基因,可为培育抗叶锈小麦新品种提供分子水平的借鉴,对于提升小麦抗叶锈能力具有重要意义。
植物在抵御病原菌侵染的过程中,进化出了一系列高效的防御机制,例如过敏性反应(Hypersensitive response,HR)[2]、活性氧(Reactive oxygen species,ROS)爆发[3]、病程相关蛋白(Pathogenesis-related proteins,PRs)[4]的表达等。大量研究表明,病程相关蛋白在植物抵御病原菌侵染时发挥着重要作用。Jain等[5]根据PRs的序列相似性和功能聚类划分了17个PRs家族。
类甜蛋白(Thaumatin-like proteins,TLPs)属于病程相关蛋白5(PR5)[6],因与非洲水果竹芋中的甜味蛋白索马甜(Thaumatin)的结构域相似而被命名。研究发现,TLPs蛋白可限制真菌菌丝发育,破坏真菌细胞壁,在寄主植物抵御病原真菌侵染时发挥着重要作用。Saeidi等[7]通过体外抗真菌活性试验发现,蒺藜苜蓿中的类甜蛋白MtTLP-1、2、3、4和5可显著抑制链格孢菌的孢子萌发,也可导致镰刀菌、禾谷镰孢菌和疫霉菌的菌丝发育畸形。Jiao等[8]借助扫描电子显微镜观察发现,纯化后的香蕉类甜蛋白BanTLP在体外可破坏青霉菌的细胞壁,导致青霉菌细胞渗透压发生变化,进而加速病原菌的死亡。Wang等[9]的研究发现,小麦类甜蛋白1(TaTLP1)可与小麦病程相关蛋白1(TaPR1)发生互作。利用病毒诱导的基因沉默技术(VIGS)对小麦抗叶锈菌品种TcLr19中的TaTLP1基因进行沉默,发现沉默植株中小麦对叶锈菌的抗性减弱并且H2O2积累降低。与此同时,体外分离纯化的TaTLP1蛋白可显著抑制叶锈菌孢子的萌发。Zhu等[10]通过分析番茄与疫霉菌互作的转录组数据,筛选得到了番茄中的2个类甜蛋白基因Solyc08g080660和Solyc08g080670。利用基因编辑技术在番茄中敲除Solyc08g080660和Solyc08g080670后发现,由疫霉菌引起的番茄晚疫病的发病程度升高。在番茄中过表达这2个基因后,病害程度降低。
河北省植物生理与分子病理学重点实验室前期工作已经证明,小麦中的翻译控制肿瘤蛋白(Translationally controlled tumor protein,TCTP)在小麦抵御叶锈菌侵染过程中发挥正调控作用[11]。为进一步研究TaTCTP的功能机制,借助串联亲和纯化(TAP)和质谱(MS)技术筛选到一个与TaTCTP潜在互作的小麦类甜蛋白TaTLP8,并利用酵母双杂交和双分子荧光互补试验证实了TaTCTP与TaTLP8之间存在相互作用[12]。在此基础上,本研究通过构建pET28a-TaTLP8-nosp原核表达载体,经IPTG诱导和Ni-NTA柱纯化获得了纯度较好的TaTLP8-nosp重组蛋白,并以其作为抗原注射新西兰白兔制备了兔源多克隆抗体,使用该抗体利用Western Blotting技术检测了TaTLP8蛋白在叶锈菌侵染小麦过程中的表达量变化,为进一步研究TaTLP8在小麦与叶锈菌互作过程中的功能机制奠定了基础。
1 材料和方法
1.1 试验材料
1.1.1 植物材料与供试菌株 本试验所用植物材料为小麦抗叶锈菌近等基因系TcLr26及其轮回亲本Thatcher(Tc),叶锈菌生理小种为260,其中TcLr26×260为不亲和组合,Tc×260为亲和组合。所用原核表达载体为pET28a,大肠杆菌表达菌株为BL21(DE3)。以上试验材料均由本实验室保存。
1.1.2 主要试剂 试验所用Anti-His Mouse抗体、HRP标记山羊抗小鼠IgG、HRP标记山羊抗兔IgG、T4DNA连接酶和6×Protein Loading Buffer购自全式金生物技术(北京)有限公司。限制性内切酶Hind Ⅲ 与BamH Ⅰ、高保真DNA聚合酶购自宝日医生物技术(北京)有限公司。SanPrep柱式DNA胶回收试剂盒、Ni离子亲和琼脂糖凝胶、脱脂奶粉、IPTG购自生工生物工程(上海)有限公司。质粒提取试剂盒购自诺唯赞生物科技(南京)有限公司。引物合成与基因测序由华大基因科技(北京)有限公司完成。
1.2 试验方法
1.2.1 TaTLP8生物信息学分析 根据前期质谱数据获得的TaTLP8蛋白序列ID为TraesCS4D02G015800.1,使用蛋白家族数据库Pfam和在线分析工具SignalP-6.0对TaTLP8的保守结构域及信号肽进行预测,随后使用NCBI中Protein Blast功能在大麦(Hordeumvulgare)、水稻(Oryzasativa)、拟南芥(Arabidopsisthaliana)、烟草(Nicotianatabacum)等物种中检索与TaTLP8相似度较高的蛋白序列,并下载相关序列的FASTA文件,借助MEGA X软件中ClustalW功能进行序列比对,之后利用邻接法构建进化树,设置Bootstrap检验次数为1 000。
1.2.2TaTLP8-nosp原核表达载体的构建 真核蛋白中的信号肽在原核体系中往往难以加工,容易造成目的蛋白不能够被表达[13],故本试验使用去掉信号肽编码区段的TaTLP8进行原核表达。以携带TaTLP8编码区全长的质粒为模板[12],利用无信号肽区段(TaTLP8-nosp)设计的带有BamH Ⅰ酶切位点的引物F:ggatccGCGACCTTCACCGTCATCAACA和带有Hind Ⅲ 酶切位点的引物R:aagcttTCATGGGCAGAAGATGACCTGG扩增目的片段(小写字母表示酶切位点)。随后使用T4DNA连接酶连接至pET28a载体中,转化大肠杆菌Top10菌株,经Kana抗性的培养基筛选阳性单克隆并提取质粒,双酶切验证,将质粒送至华大基因科技(北京)有限公司进行测序。构建完成的pET28a-TaTLP8-nosp重组质粒转入大肠杆菌表达菌株BL21中。
1.2.3 TaTLP8-nosp蛋白的诱导 将携带pET28a-TaTLP8-nosp重组质粒的BL21单克隆菌株培养至OD600约0.4时,分别加入终浓度为0,0.005,0.025,0.050,0.075,0.100,0.125,0.150,0.175 mmol/L的IPTG进行诱导,以确定IPTG适宜的诱导浓度。吸取1 mL诱导后菌液,9 500 r/min离心1 min收集菌体,使用重蒸水溶解破碎菌体,得到菌体中总蛋白。借助6×Protein Loading Buffer煮沸10 min,进行SDS-PAGE检测。因TaTLP8-nosp重组蛋白中携带6×His标签,利用Anti-His一抗进行Western Blotting检测,具体检测步骤可参考麻楠等[14]的方法。
为摸索合适的诱导温度,根据上述预试验确定的IPTG浓度,分别在20,28,37 ℃温度条件下诱导TaTLP8-nosp蛋白的表达,使用大肠杆菌蛋白提取液Ⅰ(50 mmol/L NaH2PO4、300 mmol/L NaCl,pH值 8.0)悬浮菌体,经超声破碎(功率130 W,超声10 s,停止5 s,持续12 min),在4 ℃条件下9 500 r/min离心20 min分离上清(可溶性蛋白)和沉淀(包涵体)并进行SDS-PAGE检测。
1.2.4 TaTLP8-nosp蛋白包涵体溶解及蛋白纯化 在300 mL包涵体中加入30 mL大肠杆菌蛋白提取液Ⅱ(50 mmol/L NaH2PO4、300 mmol/L NaCl、8 mol/L尿素,pH值8.0),超声处理(条件同1.2.3),使包涵体充分溶解。随后在4 ℃条件下9 500 r/min离心20 min,取出上清液,倒入提前灌装好Ni离子亲和琼脂糖凝胶的层析柱中,依靠液体重力使上清液在层析柱中缓慢流出,该过程中目的蛋白可和介质结合。接下来以浓度分别为0,20,50,100,250,500 mmol/L的咪唑流经层析柱以竞争结合位点,洗脱目的蛋白,随后进行SDS-PAGE检测。
1.2.5 纯化蛋白的定量 以不同浓度的牛血清白蛋白(BSA)为标准,对100 mmol/L咪唑洗脱后的目的蛋白的含量和纯度进行考马斯亮蓝R-250染色并拍照记录。纯化蛋白的总量需不小于2 mg且电泳检测无明显杂带。随后送至北京华大蛋白质研发中心进行抗体的制备。
1.2.6 TaTLP8-nosp蛋白多克隆抗体的特异性检测 多克隆抗体特异性检测步骤,可参考1.2.4中的方法获得纯化的TaTLP8-nosp重组蛋白,随后使用植物蛋白提取液(25 mmol/L Tris、150 mmol/L NaCl、NP-40 1 mL、丙三醇100 mL,pH值 7.0)提取接种叶锈菌后的小麦总蛋白。以制备的Anti-TaTLP8-nosp为一抗,分别在原核诱导TaTLP8-nosp重组蛋白和小麦总蛋白中对Anti-TaTLP8-nosp抗体的特异性进行Western Blotting检测。
1.2.7 Western Blotting检测在小麦与叶锈菌互作中TaTLP8蛋白的表达变化 在温室条件下(光照强度400 W/m2,光照时长14 h/d,温度20~25 ℃)对培养7日龄的TcLr26和Tc的第一片真叶正面接种叶锈菌生理小种260,接种后分别在0,8,12,48,72,96 h剪取接种叶片,经液氮速冻、研磨后使用植物蛋白提取液提取小麦总蛋白。以制备的Anti-TaTLP8-nosp为一抗,利用Western Blotting技术检测TaTLP8蛋白在小麦与叶锈菌互作过程中的表达情况。
2 结果与分析
2.1 TaTLP8的生物信息学分析及原核表达载体的构建
对前期研究中所获得的TaTLP8基因的序列特征进行分析。结果显示,该基因编码区全长为702 bp(图1-A),编码233个氨基酸(图1-B)(小写字母表示信号肽位置)且N-端含有信号肽(图1-C)。经Pfam数据库分析,发现TaTLP8含有一个Thaumatin结构域(图1-D)。通过在NCBI中检索与TaTLP8蛋白相似度较高的序列,并进行系统发育分析。结果表明(图1-E),小麦TaTLP8(TraesCS4D02G015800.1)与大麦HvTLP8同源性较高。
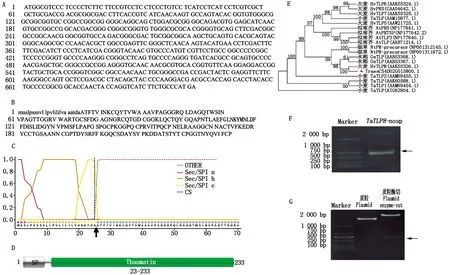
A.TaTLP8基因编码区序列;B.TaTLP8蛋白氨基酸序列;C.TaTLP8信号肽预测;D.TaTLP8保守结构域;E.TaTLP8系统发育进化树分析;F.扩增TaTLP8-nosp片段;G.pET28a-TaTLP8-nosp重组质粒酶切验证。A.TaTLP8 gene coding sequence;B.TaTLP8 protein amino acid sequence;C.TaTLP8 signal peptide prediction;D.TaTLP8 conservative domain;E.TaTLP8 phylogenetic tree analysis;F.Amplification TaTLP8-nosp fragment;G.pET28a-TaTLP8-nosp recombinant plasmid enzyme-cut.
为制备TaTLP8蛋白的抗体,以携带TaTLP8基因编码区全长的质粒为模板,PCR扩增TaTLP8无信号肽区段(图1-F),并对构建后的pET28a-TaTLP8-nosp重组质粒进行酶切验证(图1-G),扩增和酶切后的条带位置与预期(624 bp)基本一致,说明pET28a-TaTLP8-nosp原核表达载体构建成功。
2.2 TaTLP8-nosp蛋白的表达分析
为确定合适的IPTG诱导浓度,以不同浓度梯度的IPTG进行诱导,在37 ℃条件下将大肠杆菌培养至OD600约1.0,结果显示(图2-A),IPTG浓度达到0.100 mmol/L时蛋白表达量较好。为进一步分析目的蛋白的表达情况,使用IPTG终浓度为0.100 mmol/L,在不同的温度条件下诱导24 h,经超声处理后并离心分离上清与沉淀,进行SDS-PAGE检测,发现目的蛋白主要以包涵体形式存在于沉淀中,且在28 ℃表达效果最佳(图2-B)。以BSA(分子量约为66.45 ku)作阴性对照,借助Western Blotting检测含His标签的TaTLP8-nosp蛋白,结果表明(图2-C),在预期位置检测到了明显的印记信号,说明在上述诱导条件下TaTLP8-nosp重组目的蛋白被正确表达。
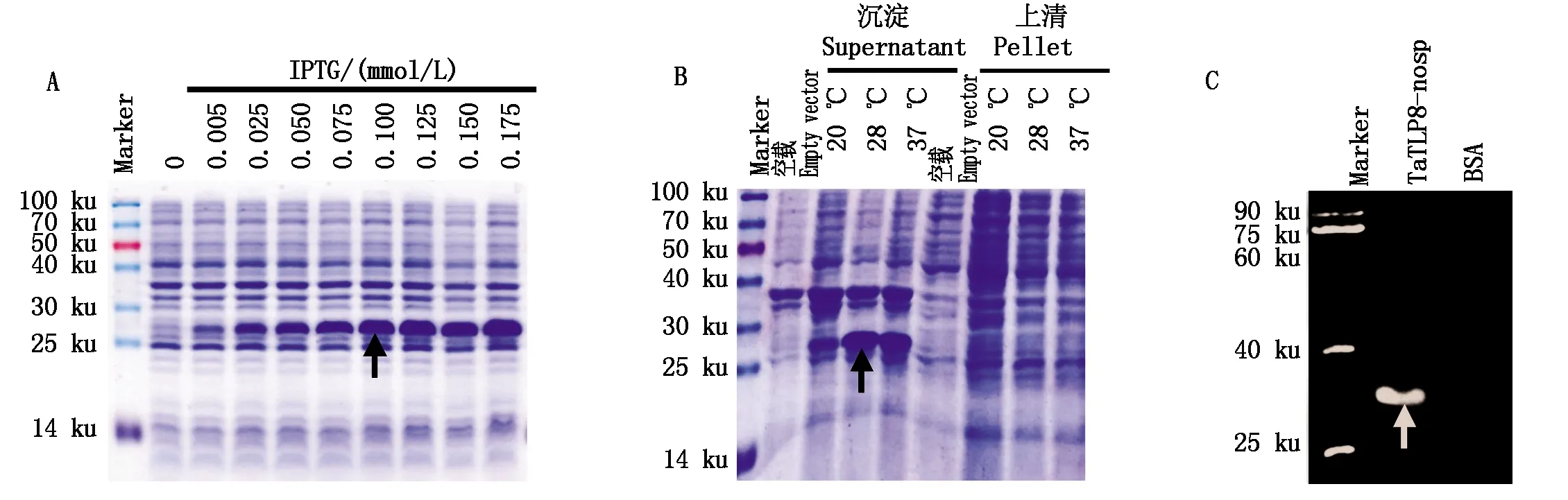
A.不同浓度的IPTG诱导TaTLP8-nosp表达;B.不同温度诱导TaTLP8-nosp的表达;C.重组蛋白表达的Western Blotting检测。A.Different concentrations of IPTG induced of TaTLP8-nosp;B.The expression of TaTLP8-nosp was induced by different temperature;C.Western Blotting detection of recombinant protein expression.
2.3 TaTLP8-nosp蛋白的纯化与定量
经2.2的诱导条件将TaTLP8-nosp蛋白在大肠杆菌中表达,离心后收集菌体,利用大肠杆菌蛋白提取液Ⅱ溶解菌体并进行超声处理,然后在4 ℃下离心,取上清液。经镍离子亲和琼脂糖凝胶柱层析处理,发现流经层析柱后的上清液中目的蛋白的含量明显降低(图3-A),说明TaTLP8-nosp蛋白上的His标签与介质结合良好。随后用不同浓度的咪唑竞争结合位点以洗脱目的蛋白,发现在浓度为100 mmol/L咪唑下洗脱效果最好(图3-A,箭头所示)。以不同浓度的BSA作为参考标准,判断目的蛋白纯化后的含量。结果显示(图3-B),目的蛋白的纯化量大于2 mg且泳道中无明显杂带,满足制备抗体的要求。

A.TaTLP8-nosp蛋白纯化;B.TaTLP8-nosp蛋白定量分析。A.Purification of TaTLP8-nosp protein;B.Quantitative analysis of TaTLP8-nosp protein.
2.4 TaTLP8-nosp抗体的特异性检测
为分析TaTLP8-nosp多克隆抗体对重组蛋白结合的特异性,以TaTLP8-nosp多克隆抗体作一抗,进行Western Blotting检测。结果显示(图4-A),在抗体按照1∶12 000倍稀释时,可检测到明显印记信号,而BSA中未检测到信号。为进一步验证TaTLP8-nosp多克隆抗体在小麦中与TaTLP8结合的特异性,对从TcLr26叶片中提取的总蛋白进行Western Blotting分析。结果显示(图4-B),当抗体按照1∶2 000倍稀释时,在小麦总蛋白中可检测到TaTLP8的杂交信号,而BSA中没有出现杂交信号。说明制备的多克隆抗体能够特异识别小麦中的TaTLP8蛋白。

A.抗体对重组蛋白的特异性检测;B.抗体对小麦总蛋白中TaTLP8的特异性检测。A.Specific detection of antibody against recombinant protein;B.Specific detection of antibodies against TaTLP8 in wheat total proteins.
2.5 小麦与叶锈菌互作过程中TaTLP8蛋白的表达变化
为研究TaTLP8蛋白在小麦与叶锈菌不同亲和性互作过程中的表达变化情况,在TcLr26和Tc接种叶锈菌生理小种260后不同时间取接种叶片并提取总蛋白,以经考马斯亮蓝R-250染色检测的小麦大亚基(Rubisco)的含量作为上样量标准,利用上述研究中制备的多克隆抗体作为一抗,进行Western Blotting检测。结果显示(图5),不亲和组合(TcLr26×260)中,从接种后8~96 h TaTLP8蛋白的表达量呈逐渐上升趋势;而亲和组合(Tc×260)中,在接种后0~12 h几乎未检测到该蛋白的表达,在48 h后检测到TaTLP8蛋白的表达,随后表达量趋于下降。以上结果表明,在小麦与叶锈菌互作过程中TaTLP8响应叶锈菌的侵染,其表达量在2种组合中存在明显差异,表明该蛋白可能与小麦对叶锈菌侵染的抵抗密切相关。

图5 TaTLP8蛋白在叶锈菌侵染小麦过程中的表达变化Fig.5 Expression changes of TaTLP8 protein during Puccinia triticina infect wheat
3 结论与讨论
TLPs是一个庞大而复杂的蛋白家族,在植物中广泛存在并与宿主的防御反应和发育过程有关。研究发现,TLPs与植物抵抗多种病原真菌和昆虫等生物胁迫方面具有重要作用[7-10,15-16]。除此之外,TLPs与植物抵御干旱、NaCl、重金属、寒冷等非生物胁迫方面密切相关且往往发挥着积极作用[17-20]。经对TLPs的晶体结构进行分析,发现TLPs一般是由3个保守结构域组成,结构域Ⅰ和Ⅱ间组成“V”形酸性裂缝,可能与TLPs参与生物/非生物胁迫、葡聚糖酶活性、潜在过敏源、诱导细胞程序性死亡等生物学功能相关[21]。因此,深入研究TLPs在植物抵御逆境胁迫过程中的表达模式,有利于人们进一步了解其在植物抗病过程中的功能及分子机制。
由于大肠杆菌的原核表达系统具有试验周期短、成本低、重组蛋白表达量大等特点被广泛应用。本研究中使用原核表达载体pET28a,该载体中含有改造λ噬菌体的T7启动子,并在下游插入lac操纵子可严格控制重组蛋白的表达[22]。为在蛋白水平探究TaTLP8在小麦与叶锈菌互作过程中的表达变化,TaTLP8特异抗体的制备是必不可少的。本试验首先借助原核表达技术获得了大量的TaTLP8-nosp重组蛋白,但该蛋白主要以包涵体形式存在,为获得纯度较高的蛋白,参考相关文献利用浓度为8 mmol/L的尿素使包涵体溶解[23],并根据该融合蛋白的6×His标签特性,经Ni离子亲和琼脂糖凝胶柱层析纯化后获得了纯度较高的重组蛋白,并以Anti-His为一抗,利用Western Blotting技术检测了TaTLP8-nosp重组蛋白表达的正确性。将纯化后的重组蛋白注射新西兰大白兔获得了TaTLP8-nosp的兔源多克隆抗体,且证明了该抗体的特异性较好。该抗体可在下一步应用免疫电镜技术(Immune electron microscopy,IEM)研究TaTLP8在小麦中的定位情况,以及利用抗原-抗体特异结合原理筛选TaTLP8的互作蛋白并对其作用机制作深入研究,为人们进一步了解TLPs提供借鉴,为全面阐释小麦抵抗叶锈菌的分子机理奠定基础。
