柠檬酸水解法制备大豆多肽的研究
2023-06-21杨培周陆书花李丛旭王泽民
杨培周,陆书花,李丛旭,王泽民
(1. 合肥工业大学食品与生物工程学院,安徽合肥 230601;2. 安徽红花食品有限公司,安徽蚌埠 233799)
大豆多肽是大豆蛋白水解后得到的分子质量在6 000 Da 以下,长度为2~20 个氨基酸的小分子蛋白片段或氨基酸链,具有一定的生物活性,有利于人体的消化吸收[1]。目前,已被国内外研究证实的保健功效包括降血压、降血糖、降胆固醇、抗肿瘤、免疫调节等[2]。虽然大豆多肽的生产已经拥有很长一段历史,但是传统工业化生产方法仍然存在着较多急需解决的难题。
大豆种子含有多种内源酶,其中蛋白酶(包括内肽酶和外肽酶) 是最重要的部分。蛋白酶可以将蛋白质水解成多肽、寡肽和游离氨基酸,从而改变蛋白质的功能、营养和感官特性[3]。Chen Y M 等人[4]在大豆水提取物中鉴定出16 种内肽酶、13 种外肽酶、24 种蛋白酶抑制剂和1 种谷氨酸脱羧酶,其中天冬氨酸内肽酶在pH 值为2.5~3.0,温度为35~45 ℃时活性最佳。大豆中的内源性蛋白酶可在酸性、中性和碱性条件下发挥水解作用[5]。柠檬酸作为人体内三羧酸循环中的主要中间代谢物,对人体健康无害,是一种安全的食品添加剂,现已广泛应用于食品、医药等行业[6]。尹彦洋等人[7]将柠檬酸与胃蛋白酶协同水解牛骨粉制备多肽,当柠檬酸作用于蛋白质时,蛋白质因其次级键受到破坏而分解,在胃蛋白酶协同作用下可获得大量低分子肽。
以大豆为研究对象,采用柠檬酸酸解大豆蛋白方法,通过调节pH 值,控制孵育温度和时间,制备大豆多肽。除添加少量柠檬酸外,不含其他任何添加剂和酶制剂,有效降低了风险,实现生产全过程的绿色高效和低能耗,降低了生产成本。所制备的大豆多肽可应用于食品等领域,具有良好的应用价值。
1 材料与方法
1.1 试剂耗材和仪器设备
黄豆,产自北京市密云区;牛血清蛋白;TEMED;三氯乙酸;十二烷基硫酸钠;考马斯亮蓝G-250;溴酚蓝;低分子量蛋白质Marker(14.4~97.4 kDa)和4×蛋白上样缓冲液(含巯基还原剂),北京索莱宝科技有限公司提供;氢氧化钠、柠檬酸、甲醇等为分析纯,均购自国药集团。
L18-P132 型高速破壁调理机,九阳股份有限公司产品;凝胶成像仪,美国Bio-Rad 公司产品;UV-1201 型紫外分光光度计,北京瑞利公司产品;EPS-300 DNA 型电泳设备、PHS-25 型pH 计,上海天能科技和大普仪器有限公司产品;HH-4 型水浴锅,国华电器公司产品;5430R 型低温高速离心机,德国Eppendorf 公司产品。
1.2 大豆多肽质量浓度和蛋白质质量浓度的测定
大豆多肽质量浓度测定的方法依据在波长238 nm处,蛋白质溶液吸光度的大小与肽键的数量呈正比[8]。配制质量浓度为10 mg/mL 的牛血清蛋白标准溶液,分别稀释成质量浓度为50~300 μg/mL 的标准溶液,以蒸馏水作为空白对照,在波长238 nm 处测定不同质量浓度的吸光度,绘制标准曲线,所得多肽标准拟合方程为Y=0.001 44X-0.054 8,R2=0.997。
蛋白质标准曲线的制作参照文献[9]考马斯亮蓝法。吸取0.1 mL 0~100 μg/mL 的标准蛋白质溶液于5.0 mL 考马斯亮蓝溶液中,充分混匀后,避光静置10 min 后于波长595 nm 处测定其吸光度。得到的蛋白质标准拟合方程为Y=0.006 2X+0.111 2,R2=0.998。
样品中多肽质量浓度的测定方法:取均质样品2 mL 于试管中添加质量分数为10%(W/V) 的三氯乙酸溶液2 mL,充分混匀后静置15 min 以沉淀蛋白,以转速3 500 r/min 离心10 min,取上清液,以去离子水为空白对照,在波长238 nm 处测定样品的吸光度,确定样品中的多肽含量。
样品中蛋白质含量的测定方法:在10 mL 试管中加入0.1 mL 样品离心后的上层清液,再加入5 mL考马斯亮蓝溶液,充分混匀后,避光静置10 min。于波长595 nm 处测定样品吸光度,确定样品中蛋白质含量。
1.3 柠檬酸浸泡对大豆蛋白水解情况的影响
为了探究打浆前柠檬酸浸泡大豆对豆浆中蛋白质含量的影响[10],每组称取大豆各50 g,用去离子水浸泡清洗2 次,沥干水分后以豆液质量比为1∶5,使用质量分数为0~15%(W/W) 的柠檬酸溶液于常温条件下浸泡15 h。浸泡后,使用去离子水清洗3 次后以豆液质量比1∶9 打浆3 min,使用100 目尼龙滤布进行过滤,去除滤渣,得到生豆浆。以转速13 000 r/min 离心5 min,取上层清液,用于蛋白质含量测定和SDS-PAGE 表征蛋白水解的情况[11]。
1.4 孵育pH 值对大豆多肽含量的影响
称取大豆50 g,清洗3~4 次后,用去离子水以豆液质量比1∶5 于常温条件下过夜浸泡。按步骤1.3 生豆浆制备的方法进行打浆、过滤。将生豆浆均匀分成7 等份(每份50 mL),利用质量分数为5%(W/W) 的柠檬酸溶液或浓度为1 mol/L 的氢氧化钠溶液将各组生豆浆pH 值分别调至3,4,5,6,7,8,9 后,置于50 ℃水浴锅中孵育5 h。孵育结束后,以转速13 000 r/min 离心5 min,取上层清液,测定多肽含量及SDS-PAGE分析蛋白水解情况。
1.5 孵育温度对大豆多肽质量浓度的影响
制备450 mL 生豆浆,使质量分数为5%(W/W)的柠檬酸溶液将pH 值调至4,均匀分成7 等份,将每组样品分别置于30,35,40,45,50,55,60 ℃的恒温水浴锅中孵育5 h。孵育结束后,以转速13 000 r/min 离心5 min,取上层清液,测定多肽质量浓度及SDS-PAGE 分析蛋白水解情况。
1.6 孵育时间对大豆多肽质量浓度的影响
制备300 mL 生豆浆,使用质量分数为5%(W/W)柠檬酸溶液将pH 值调至4,均匀分成6 等份,置于50 ℃水浴锅中分别孵育3,4,5,6,7,8 h,孵育结束后,以转速13 000 r/min 离心5 min,取上层清液,测定多肽质量浓度及SDS-PAGE 分析蛋白水解情况。
1.7 响应面优化试验
根据单因素试验的结果,选择孵育pH 值、孵育温度、孵育时间3 个指标进行响应面优化分析(三因素三水平),并通过软件模拟获得二次多项式回归方程,得出制备大豆多肽最佳的工艺参数,以大豆多肽含量为响应值。
响应面试验因素与水平设计见表1。
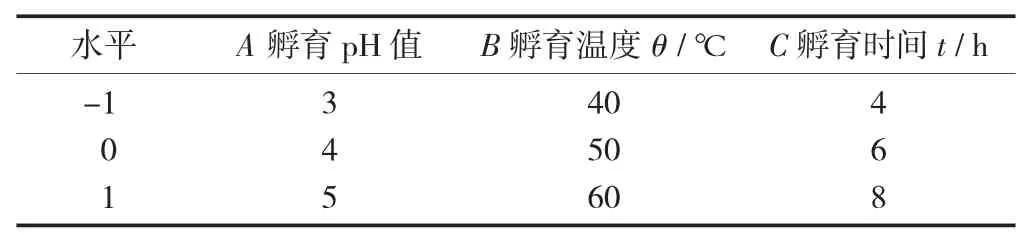
表1 响应面试验因素与水平设计
1.8 SDS-PAGE 凝胶电泳
取离心后的样品上清液30 μL 于试管中,加入10 μL 4×蛋白上样缓冲液。于100 ℃沸水中加热5 min,使蛋白变性。以转速13 000 r/min离心3 min,取上清液进行电泳。使用考马斯亮蓝染色液G-250染色,过夜脱色后拍照。
1.9 统计分析
试验数据均采用SPSS 8.0 软件进行统计分析,Origin 9.0 软件作图。
2 结果与分析
2.1 柠檬酸浸泡对蛋白质质量浓度的影响
不同质量分数柠檬酸浸泡大豆对豆浆中蛋白质质量浓度的影响见图1。
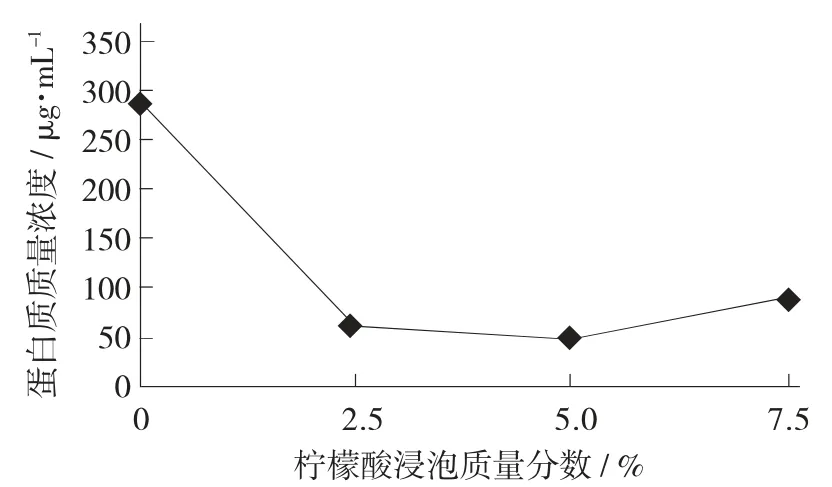
图1 不同质量分数柠檬酸浸泡对豆浆中蛋白质质量浓度的影响
由图1 可知,豆浆中蛋白质质量浓度随柠檬酸质量分数的变大先降低后增加,在柠檬酸质量分数为5%时,蛋白质质量浓度达到最低为49 μg/mL。当溶液中柠檬酸质量分数偏高时,可能破坏了大豆内源性蛋白酶的活性或未处于其最适pH 值,无法大量水解大豆蛋白。
2.2 单因素试验结果
孵育pH 值对豆浆中多肽质量浓度的影响见图2。
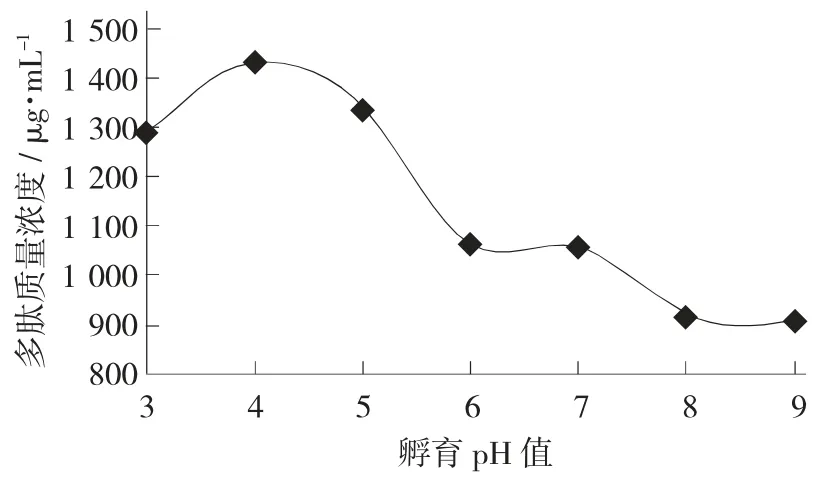
图2 孵育pH 值对豆浆中多肽质量浓度的影响
由图2 可知,随着孵育pH 值的增大,多肽质量浓度先增加后降低。孵育pH 值为4 时,豆浆体系中多肽的质量浓度达到最大值为1 429 μg/mL。此外,在孵育pH 值为6 和7 时,多肽质量浓度无明显变化,这可能由于生豆浆的孵育pH 值一般在6~7,大分子蛋白未发生水解;当孵育pH 值为8 和9 时,溶液为碱性,此时多肽质量浓度分别为920 μg/mL 和915 μg/mL。多肽含量的降低可能是由于碱性条件下,产生的多肽被大豆内源性肽酶分解为氨基酸。
孵育温度对豆浆中多肽质量浓度的影响见图3。
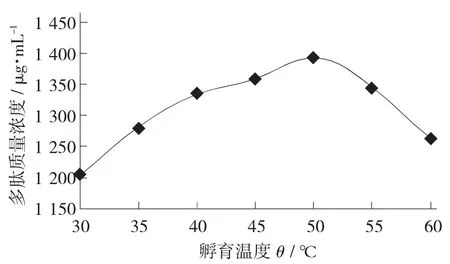
图3 孵育温度对豆浆中多肽质量浓度的影响
由图3 可知,多肽质量浓度随着温度的升高先增加后降低。50 ℃处理组中多肽质量浓度最高为1 391 μg/mL;在30~50 ℃处理组,随着温度的升高,大豆内源性酶活性逐步提高,产生的多肽质量浓度变多。当温度大于50 ℃时,样品中多肽质量浓度逐渐下降,主要原因是大豆蛋白和部分小分子多肽在内源蛋白酶和内外肽酶的作用下进一步水解产生游离氨基酸[11]。
孵育时间对多肽质量浓度的影响见图4。
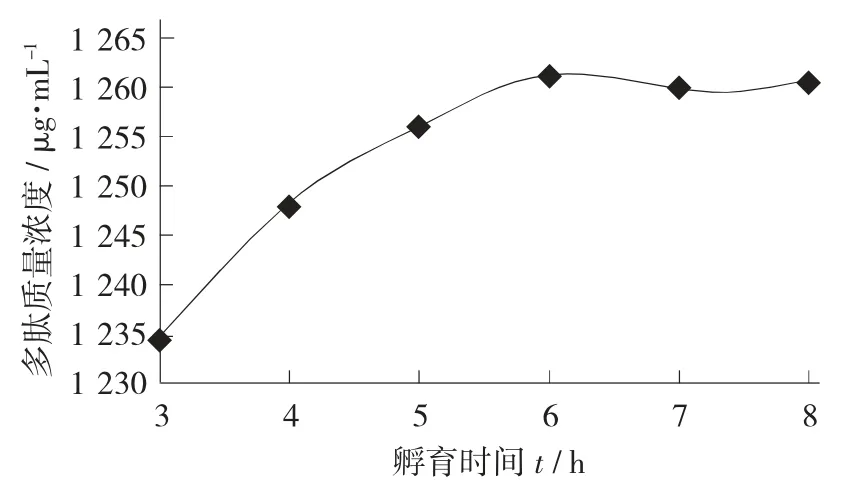
图4 孵育时间对多肽质量浓度的影响
由图4 可知,随着孵育时间的延长,多肽质量浓度快速增长,在孵育时间为6 h 时,达到最大值为1 261 μg/mL;孵育7 h 和8 h 后,多肽质量浓度分别为1 259.62 μg/mL和1 260.34 μg/mL,与孵育6 h多肽质量浓度基本保持一致,因此豆浆的最适孵育时间为6 h。
2.3 响应面试验优化结果
基于单因素试验结果,进行响应面优化试验。
响应面试验结果见表2。

表2 响应面试验结果
由表2 可知,运用Design Expert 10 软件对各因素进行回归拟合,得到二次多元回归方程:
响应面方差分析见表3。
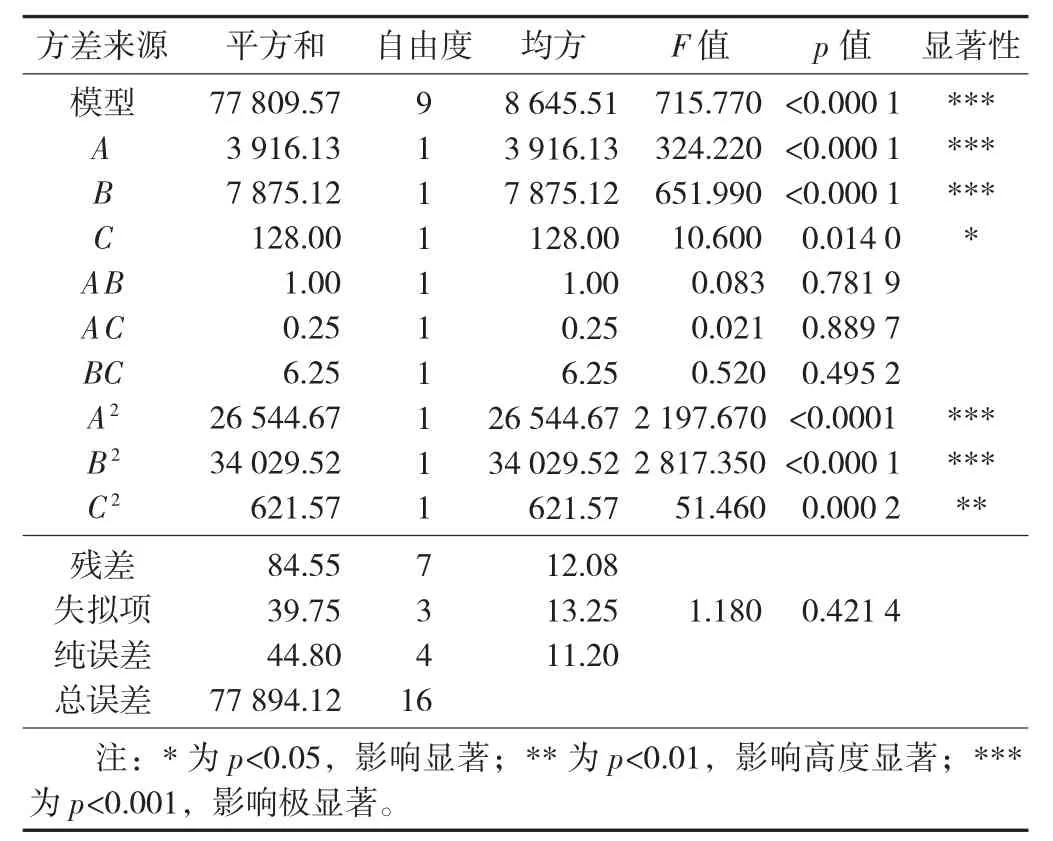
表3 响应面方差分析
方差分析是评价回归模型的有效方式之一。由表3 可看出,得到的模型p 值为0.000 1(<0.001 0),说明该模型差异极显著,失拟项为0.421 4>0.050 0不显著,表明外界非试验因素对试验结果没有显著影响。相关系数R2=0.998 9,R2Adj=0.997 5,说明模型拟合程度较好,预测得率与实际多肽得率之间有较高的拟合度,试验误差较小,方法可行。根据F 值大小可判断,3 个因素对多肽质量浓度的影响程度依次为孵育温度>孵育pH 值>孵育时间。
孵育pH 值和孵育温度对多肽质量浓度影响的响应面和等高线图见图5,孵育pH 值和孵育时间对多肽质量浓度影响的响应面和等高线图见图6,孵育温度和孵育时间对多肽质量浓度影响的响应面和等高线图见图7。
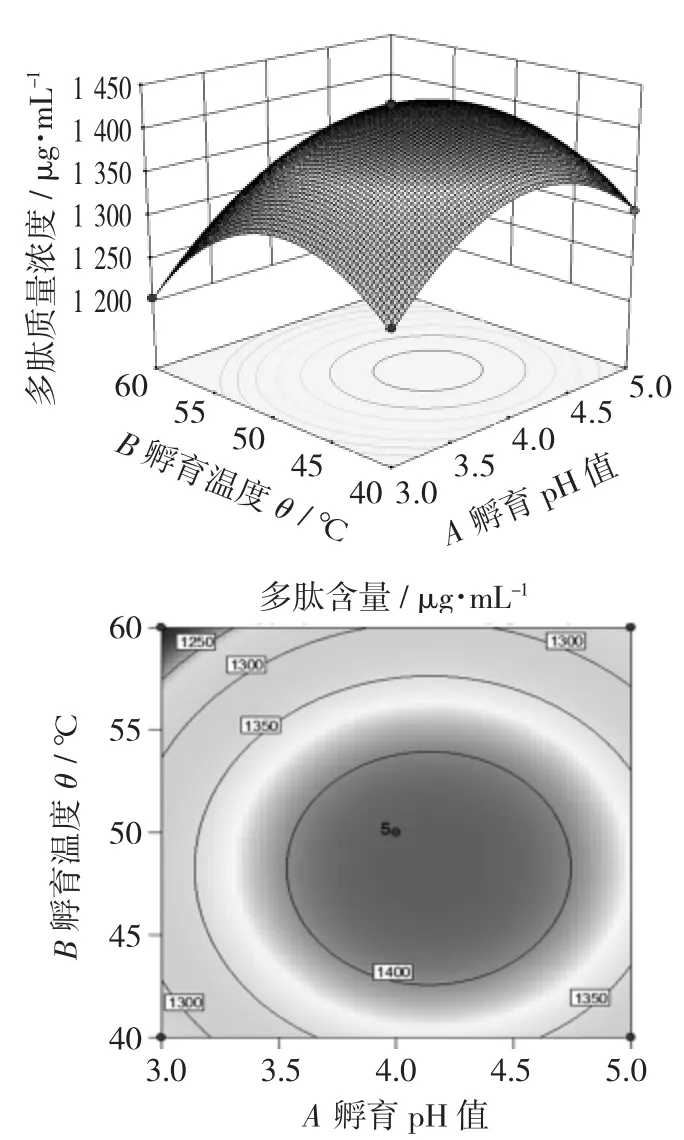
图5 孵育pH 值和孵育温度对多肽质量浓度影响的响应面和等高线图
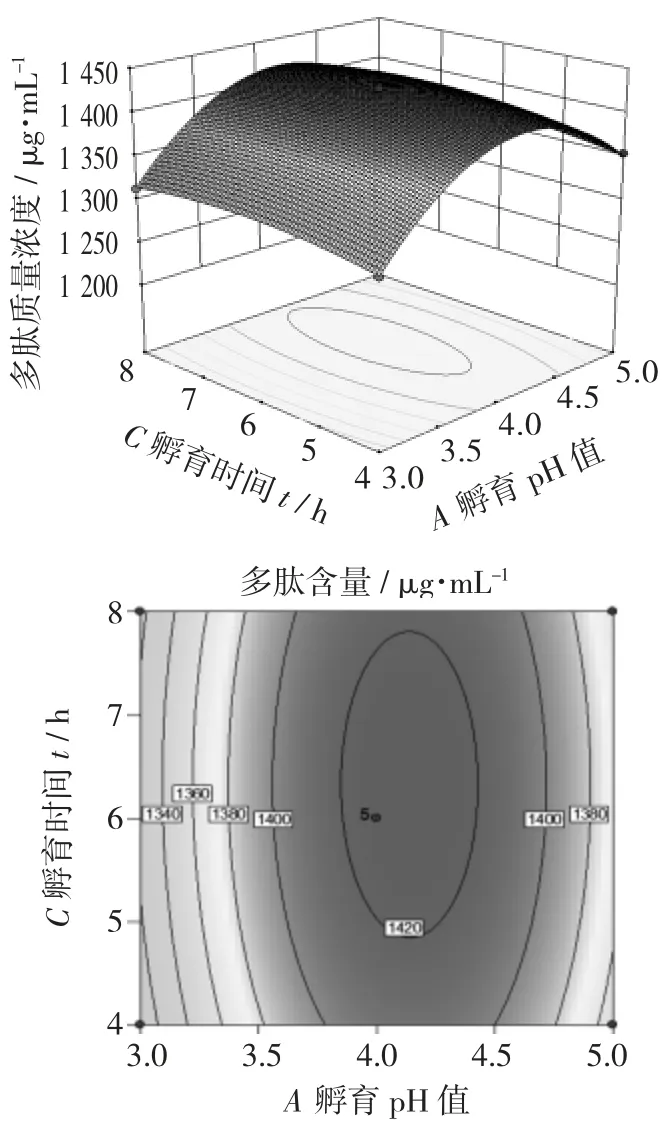
图6 孵育pH 值和孵育时间对多肽质量浓度影响的响应面和等高线图
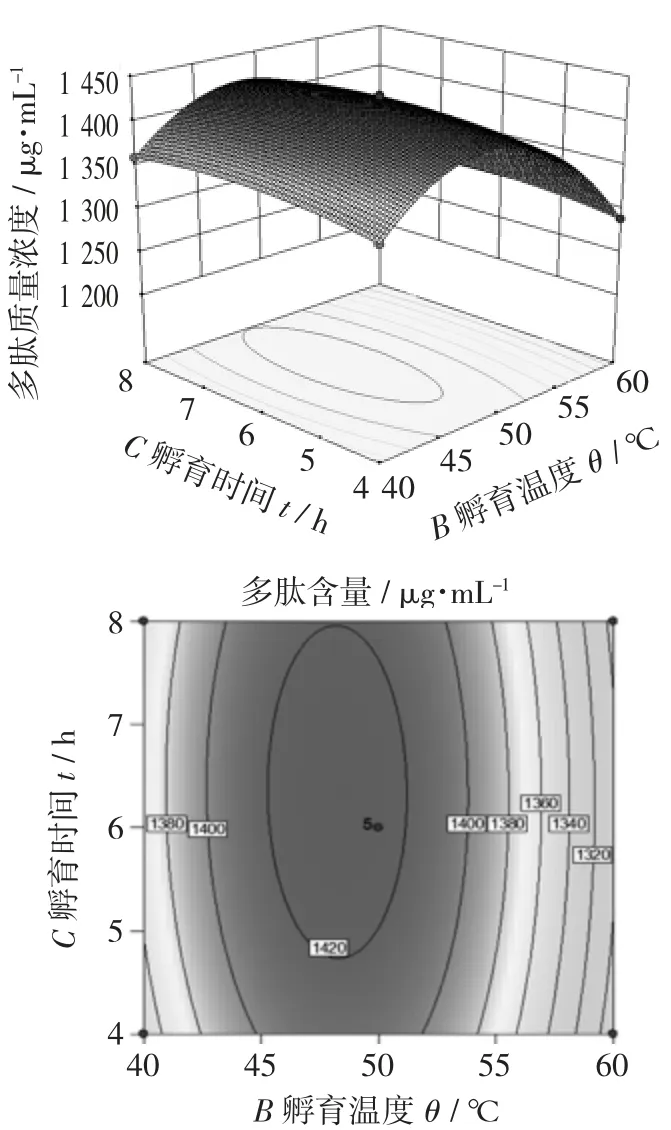
图7 孵育温度和孵育时间对多肽质量浓度影响的响应面和等高线图
图5 的鞍面最陡,说明孵育pH 值和孵育温度的交互作用对多肽质量浓度的影响最大。图6 呈现有一定坡度的斜面,说明孵育pH 值和孵育时间之间存在一定的相互作用。而图7 中的鞍面较为平缓,说明孵育温度和孵育时间之间的交互作用不显著。
通过响应面优化分析得出最佳的多肽制备条件为孵育pH 值4.18,孵育温度48.45 ℃,孵育时间6.21 h。考虑到实际操作情况将制备工艺调整如下:孵育pH 值4.0,孵育温度48 ℃,孵育时间6 h,调整后制备的多肽质量浓度为1 437 μg/mL,与理论值接近。说明上述拟合模型具有可靠性。
2.4 SDS-PAGE 凝胶图谱分析
2.4.1 不同质量分数柠檬酸浸泡对大豆蛋白水解的影响
利用SDS-PAGE 电泳,分析不同浓度柠檬酸浸泡大豆对豆浆体系中蛋白质水解的影响。
不同质量分数柠檬酸浸泡后大豆蛋白的SDSPAGE 图谱分析见图8。
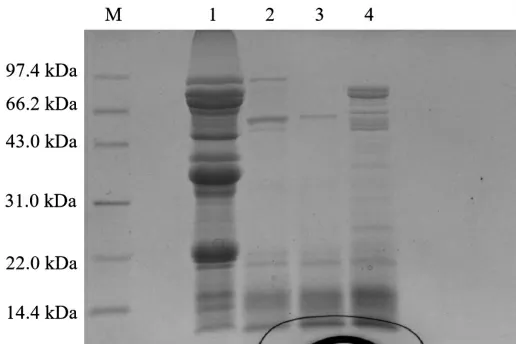
图8 不同质量分数柠檬酸浸泡后大豆蛋白的SDS-PAGE 图谱分析
由图8 可知,未添加柠檬酸处理的样品组含有较复杂的蛋白条带,质量分数最高的蛋白分子量主要集中在66,43,31,22 kDa 附近。当柠檬酸浸泡质量分数为2.5%时,分子量为97 kDa和60 kDa 左右的大分子蛋白水解效果较差,但其他大于22 kDa 的蛋白均被水解。当质量分数为5.0%时,豆浆体系中蛋白质几乎完全被分解,与2.5%相比,97.4 kDa 附近的条带消失,仅在50 kDa 和小于22.0 kDa 处有较浅的蛋白条带。当柠檬酸质量分数达到7.5%时,43~90 kDa 的范围中,出现与空白组对应的蛋白条带,说明柠檬酸质量分数过高导致的大豆内源性蛋白酶失活无法水解大豆蛋白。因此选择5%的柠檬酸浸泡大豆使后续豆浆体系中大分子蛋白充分水解为多肽和氨基酸。
2.4.2 不同孵育pH 值对大豆蛋白水解的影响
利用SDS-PAGE 电泳,分析不同孵育pH 值条件下的大豆蛋白样品。
不同孵育pH 值条件下大豆蛋白的SDS-PAGE图谱分析见图9。

图9 不同孵育pH 值条件下大豆蛋白的SDS-PAGE 图谱分析
由图9 可知,当豆浆溶液pH 值为6 和7 时,图谱显示蛋白均未发生水解,条带位置和强度基本一致。当豆浆体系为碱性;pH 值为8 和9 时,超过66.2 kDa 的部分蛋白发生少量水解,含量降低,但仍有较多的大分子蛋白未被水解。此外,在31.0 kDa和21.0 kDa 附近出现新的蛋白条带(红色箭头)。这说明,当溶液为碱性时,可在一定程度上使大豆蛋白水解为分子量较小的蛋白质;当豆浆体系为酸性即pH 值为3,4,5 时,从图谱中可看出大分子蛋白均被水解。pH 值为4 和5 时,蛋白条带基本一致(条带2 和3),条带2 蛋白含量较低颜色较浅;当pH 值为3 时,66.2 kDa 的大分子蛋白未被水解(橙色箭头),其主要原因可能是过低的pH 值使大豆内源性蛋白酶失活,难以起到辅助柠檬酸酸解大豆蛋白的作用。因此,不同pH 值处理组中蛋白质质量浓度及种类均发生变化,说明大豆内源性蛋白酶最适pH 值不同导致不同水解大豆蛋白种类。
3 结论
研究了不同质量分数柠檬酸浸泡大豆对豆浆体系中蛋白质质量浓度的影响,采用单因素试验和响应面设计试验,对柠檬酸酸解大豆蛋白制备多肽的条件进行了优化。结果表明,5%柠檬酸浸泡大豆可使豆浆中蛋白质质量浓度降低至49 μg/mL,当孵育pH 值4.0,孵育温度48 ℃,孵育时间6 h 时,制备的多肽质量浓度为1 437 μg/mL。通过SDS-PAGE 电泳发现大豆蛋白的分子量集中在43.0~97.4 kDa,不同孵育pH 值对豆浆中蛋白质的质量浓度和种类有较大的影响。经多肽质量浓度和图谱分析表明经酸性条件处理后,大豆中大部分蛋白被水解为多肽。
