斜生四链藻对水中四环素的胁迫响应及去除作用
2023-05-30陈正杰王海烽谢正鑫
杨 俊,陈正杰,王海烽, 谢正鑫, 2,唐 俊, 2*
斜生四链藻对水中四环素的胁迫响应及去除作用
杨 俊1,陈正杰1,王海烽1, 谢正鑫1, 2,唐 俊1, 2*
(1. 安徽农业大学资源与环境学院,合肥 230036;2. 农业农村部合肥农业环境观测试验站,合肥 230036)
四环素由于其低生物降解性和水溶性而在水环境中持续存在,对生态环境安全造成较高的潜在风险。为探讨水环境中残留的四环素与藻类的相互作用,以斜生四链藻为研究对象,考察了斜生四链藻对水中不同浓度四环素(0.5、1.0、1.5、2.5、4.0和6.0 mg·L-1)的胁迫响应及去除作用。结果表明,各浓度四环素处理组均对斜生四链藻的生长产生抑制作用,最高抑制率达到了72.99%,四环素对斜生四链藻的半数效应质量浓度(96 h - EC50)和抑制效应为80%质量浓度(96 h - EC80)分别为2.46和6.9 mg·L-1。在相同浓度四环素胁迫下,斜生四链藻的光合色素含量和v/m值呈现出和斜生四链藻细胞密度变化相同的趋势,与对照组相比,6.0 mg·L-1浓度处理组中斜生四链藻的叶绿素a、叶绿素b和类胡萝卜素含量在96 h的抑制率分别是87.32%、66.91%和87.58%,v/m值降幅达到了77.4%。在低、中、高浓度四环素(0.5、1.5和6.0 mg·L-1)胁迫下暴露96 h,斜生四链藻的丙二醛(MDA)含量整体呈现出先上升再下降的趋势;超氧化物歧化酶(SOD)活性和谷胱甘肽(GSH)含量均受到不同程度的诱导作用,6.0 mg·L-1浓度处理组暴露96 h时,SOD活性为对照组的1.25倍,GSH含量为对照组的1.53倍。在斜生四链藻初始OD690值为0.15,四环素浓度为4.0 mg·L-1的条件下,48 h内斜生四链藻对四环素的去除率为90%,对照组的去除率为19%。研究结果为四环素对水体初级生产者的生态毒性提供了新资料,同时也为水体中残留四环素的生态修复提供了新的方向。
四环素;斜生四链藻;急性毒性;去除作用
四环素是最常用的典型抗生素之一,被广泛应用于动物感染治疗和动物生长调节剂[1]。然而,抗生素在生物体内通常难以代谢,相当一部分四环素(30%~90%)通过动物粪便和废水释放到周围环境中[2]。由于动物粪便在农田中的应用导致抗生素广泛存在于多种环境介质中,包括邻近的地表水、沉积物、土壤和地下水[3]。受污染淡水中抗生素的浓度范围为ng·L-1至μg·L-1[4]。在某些情况下,在生产设施的局部污染源中,它们的浓度可高达50 mg·L-1[5]。四环素由于其低生物降解性和水溶性而在环境中持续存在,而残留部分由于可以刺激细菌种群中抗生素抗性基因的发展而受到广泛关注[6]。大量研究已证实四环素对多种生物具有潜在毒性,包括浮萍[7]、藻类[8]和细菌[9]。
微藻是水生生态系统的关键主要组成部分,具有高生物质生产力、全球分布广泛、高增长率等特点,可作为模式生物来评价四环素在水环境中的潜在毒性[10]。迄今为止,已有研究评估了四环素对多种藻类的影响。徐冬梅等[11]研究报道了高浓度的四环素显着增强了膜通透性并改变了藻类细胞的结构。姜蕾等[12]研究发现,四环素暴露能够阻碍铜绿微囊藻的光合作用,破坏抗氧化酶的系统平衡,抑制藻类生物量的增长。董聪聪等[13]研究认为微囊藻在四环素浓度较低时,可以通过自身调节改变PSⅡ中能量配置,提高光合效率来应对四环素胁迫。还有研究报道四环素可胁迫莱茵衣藻和羊角月牙藻产生氧化应激反应[14-15]。
此外,有研究表明利用微藻可以有效去除废水中的抗生素等新兴污染物[16]。例如,一个高效的藻池塘(HRAP)系统在长达6个月的过程中,从城市废水中去除了64种药品及个人护理品(PPCPs),包括33种抗生素(平均浓度为223 μg·L-1),抗生素去除效率比传统活性污泥法高5%~50%[17]。先前的研究还表明,微藻对污染物的去除效率主要取决于初始藻细胞密度[14]。
斜生四链藻作为一种常见的淡水微藻,由于其具有快速繁殖的能力以及对污染物的敏感性,已被广泛用作水安全评价和环境毒理学检测的模型生物[18]。虽然目前已有研究报道了四环素对其他藻类的毒性效应,但四环素的毒性机制还取决于微藻的种类。因此,本研究在分析了四环素对水环境中斜生四链藻生长特性(生物量、光合色素含量、叶绿素荧光、丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性和谷胱甘肽(GSH)含量)影响的基础上,进一步考察了斜生四链藻去除水中四环素的能力,以期为水环境中四环素的生态风险评价及污染治理提供基础数据。
1 材料与方法
1.1 材料
1.1.1 藻种来源 斜生四链藻(,FACHB-1810),购自中国科学院水生生物研究所,在无菌条件下,采用BG-11培养基于光照培养箱中培养,培养温度为(25 ± 1)℃,光暗比为14 h∶10 h,光照强度为5 000 lx,每天定时摇晃培养瓶数次。
1.1.2 主要仪器及试剂 仪器:超高效液相色谱仪(Waters UPLC,美国沃特世科技有限公司),智能人工气候箱(RGDF-1000C,合肥右科仪器设备有限公司),洁净工作台(SW-CJ-1FD,苏州安泰空气技术有限公司),紫外分光光度计(UV-1900i,日本岛津仪器公司)。
试剂:盐酸四环素标准品(纯度>97.70%),购自上海玉博生物科技有限公司,BG11培养基购自青岛海博生物技术有限公司,甲醇、乙腈均为色谱纯,购自合肥拜尔迪化学科技有限公司,其余试剂为优级纯,实验用水均为超纯水。
1.2 方法
1.2.1 毒性试验 为排除助溶剂对斜生四链藻和蛋白核小球藻生长的影响,采用超纯水溶解四环素。称取0.027 7 g 四环素,转移至50 mL容量瓶中,并使用超纯水进行定容,配制成500 mg·L-1的四环素母液,现用现配。根据OECD第 201号指南(OECD 201),四环素暴露浓度梯度设置根据不同浓度四环素对斜生四链藻生长影响的预实验结果分别进行适当优化调整,四环素处理斜生四链藻的质量浓度最终确定为0.5、1.0、1.5、2.5、4.0和6.0 mg·L-1,并设置只添加初始浓度为5×105cells·mL-1的空白对照组,实验中每个处理均设置3个平行。
1.2.2 去除试验 将处于对数生长期的斜生四链藻转接入含有4.0 mg·L-1四环素的BG11培养基中,通过控制转接后的三角锥形瓶中初始的OD690为 0.15来初步确定斜生四链藻初始添加量基本一致,并设置只添加4.0 mg·L-1四环素的BG11培养基为空白对照组,实验中每个处理均设置3个平行。培养起始点记为第0小时,然后分别在第6、12、24、36和第48小时取样,通过超高效液相色谱仪对培养基中四环素剩余浓度进行测定,利用分光光度计记录藻液的吸光度值变化。
1.3 指标测定
1.3.1 斜生四链藻的藻细胞密度测定 采用光密度法[19]。取不同密度的藻液分别测定690 nm波长下藻液的吸光度值,然后在显微镜下用血球计数板对相应的藻细胞进行计数。以吸光度值为横坐标、藻细胞密度为纵坐标,绘制标准曲线:
藻细胞密度(106个·mL-1)= 14.105690﹣0.067 7(1)
考虑到不同浓度的四环素在BG11培养基中的浊度对吸光度值测定的影响,故在计算中分别去除含有不同浓度四环素的培养基的吸光度值。其中,藻细胞密度增长抑制率可通过下式计算:
= (1-C/C)× 100% (2)
式中:C为处理组藻细胞密度;C为对照组藻细胞密度。
1.3.2 光合色素测定 收集暴露48 h和96 h后的藻细胞,采用热乙醇法提取[20],叶绿素a、叶绿素b和类胡萝卜素的计算公式如下:
叶绿素a/(mg·L-1)= 16.82665+9.28652
叶绿b/(mg·L-1)= 36.92652+16.54665
类胡萝卜素/(mg·L-1)=(1 000470–1.91C–
95.15C)/225 (3)
式中:C为叶绿素a的浓度(mg·L-1); C为叶绿素b的浓度(mg·L-1)。
1.3.3 叶绿素荧光参数测定 收集暴露48 h和96 h后的藻细胞,将样品避光暗处理30 min以后检测叶绿素荧光参数。叶绿素荧光参数使用Imaging-PAMM系列叶绿素荧光系统测量。光合量子产率值通过下式计算得到[21]:
=V/m=(m﹣0)/m(4)
式中:m为在暗适应状态下,PSII系统在打开饱和脉冲后产生的最大荧光值;v为在暗适应状态下,PSII系统在打开饱和脉冲前产生的荧光值。0为暗适应后的最小荧光值。
1.3.4 抗氧化酶活性和抗氧化物质含量的测定 收集暴露48 h和96 h后的藻细胞,在冰水浴条件下,采用超声波细胞粉碎仪超声3 s,间隔3 s,破碎20 min(150 W),10 000 r·min-1低温离心10 min,取上清液即为粗酶液,分别采用试剂盒(南京建成生物科技有限公司)测定粗酶液中蛋白质含量、丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性、谷胱甘肽(GSH)含量,以蛋白质含量为基准对MDA、SOD和GSH进行标准化处理。
1.3.5 超高效液相色谱检测条件 四环素的浓度采用超高效液相色谱(UPLC)(Waters, USA)法测定,配有PDA检测器和ACQUITY UPLC BEH C18反相柱(100 mm×2.1 mm,1.7 μm)。其中,流动相A为0.1%甲酸水溶液,流动相B为乙腈(色谱级),流速为 0.15 mL·min-1。四环素检测波长λ设置为358 nm,进样量和柱温分别设置为10 μL和40 ℃,超高效液相色谱的梯度洗脱程序如表1所示。
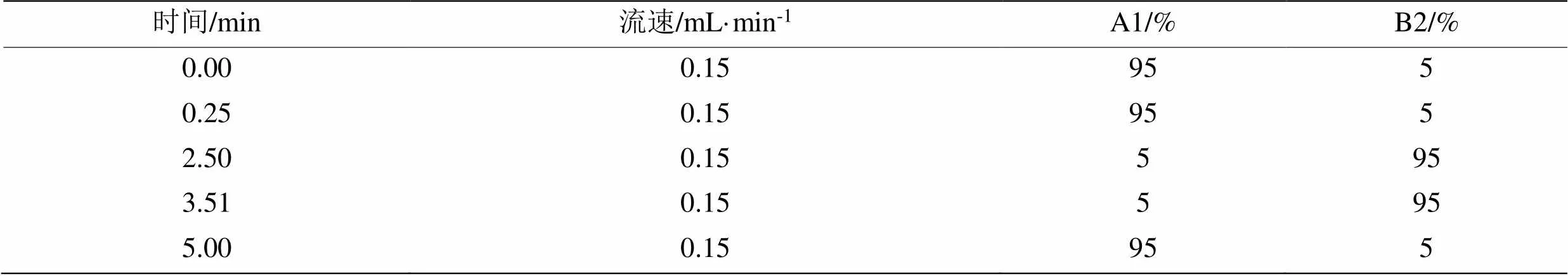
表1 超高效液相色谱仪洗脱梯度
1.4 数据处理
实验数据采用Excel进行数据整理,结果为平均值±标准偏差(= 3),使用Origin 2021作图,利用SPSS 19.0 Duncan法进行显著性差异分析,不同小写字母表示差异显著,< 0.05。
2 结果与分析
2.1 四环素对斜生四链藻生长的影响
藻细胞密度是一种外源化合物对藻细胞代谢产生抑制作用的综合参数,通常被用来评估外源化合物对藻类的毒性[22]。由图1(a)可知,在暴露96 h以后,0.5 mg·L-1四环素处理组中,斜生四链藻细胞密度与对照组相比减少了2%。6.0 mg·L-1四环素处理组中,斜生四链藻细胞密度与对照组相比减少了73%。由图1(b)可知,0.5~6.0 mg·L-1四环素均对斜生四链藻的生长表现出抑制作用,抑制率随着四环素浓度的增大而逐渐增加,处理第48 小时,斜生四链藻的生长随四环素浓度的增加分别被抑制26.32%、37.87%、43.65%、50.06%、57.45%和59.05%;处理第96 小时,抑制率分别为1.62%、23.21%、49.06%、54.29%、59.28 %和72.99 %。经SPSS软件拟合可知,四环素对斜生四链藻的半数效应质量浓度(96 h-EC50)和抑制效应为80%质量浓度(96 h-EC80)分别为2.46和6.9 mg·L-1。
生长抑制率通常用作确定污染物对藻类的毒性的替代指标[23-24]。在暴露48 h以后,研究发现低浓度0.5~1.0 mg·L-1四环素处理对斜生四链藻的抑制率开始降低,这可能是因为在长期暴露后,微藻对低浓度四环素具有更强的抗性和耐受机制。其次,可能是由于斜生四链藻对低浓度四环素的去除作用。这两个因素共同导致低浓度四环素对微藻生长的抑制率随培养时间的延长而有所降低。随着四环素添加浓度的增大,斜生四链藻的生长抑制率逐渐增大,呈现出明显的剂量-效应关系。徐冬梅等[11]在四环素类抗生素对淡水绿藻的毒性作用研究中也报道了四环素对斜生四链藻的96 h-EC50和96 h-EC80值分别为3.27和12.87 mg·L-1,均高于本研究中的96 h-EC50和96 h-EC80值,这些差异可能是由于培养条件及测定指标方法的不同而导致的。

图1 不同浓度四环素对斜生四链藻细胞密度(a)和抑制率(b)的影响
Figure 1 Effects of different concentrations of tetracycline on the cell density (a) and inhibition rate (b) of
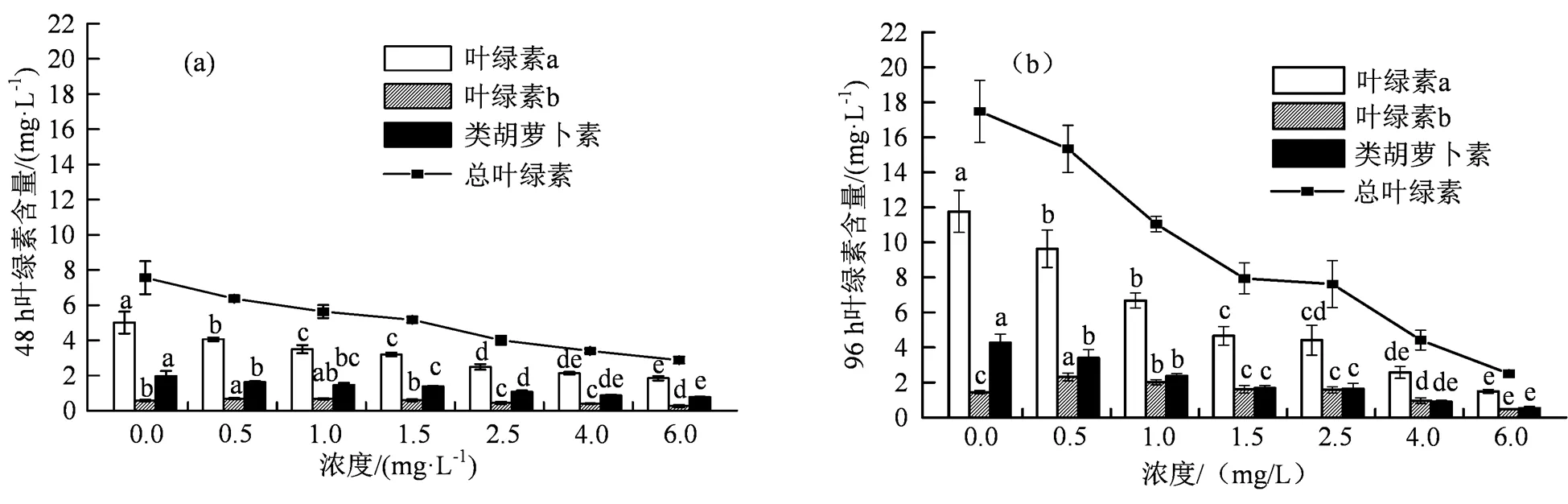
图2 不同浓度四环素胁迫斜生四链藻48 h(a)和96 h(b)光合色素含量
Figure 2 Photosynthetic pigment contents inunder different concentrations of tetracycline at 48 h (a) and 96 h (b)
2.2 四环素对斜生四链藻光合色素的影响
叶绿素作为一种光合色素,对于光捕获、能量转移和光转化为化学能至关重要,而类胡萝卜素则可防止氧化应激诱导的脂质生成,在有毒化合物的作用下,藻类的生长抑制往往与叶绿素生物合成的变化有关[20]。如图2所示,在0.5~6.0 mg·L-1四环素暴露48 h和96 h后,与对照组相比,斜生四链藻的叶绿素a、叶绿素b和类胡萝卜素的含量显著降低(< 0.05)。Li等[14]也报道了类似的结果,即随着四环素添加浓度的增加,叶绿素a、叶绿素b和类胡萝卜素含量显着下降。由图2可知,与对照组相比,6.0 mg·L-1四环素对斜生四链藻叶绿素a、叶绿素b、类胡萝卜素的抑制作用达到最大,48 h时,分别是63.12%、55.19%和60.96%;96 h时,分别是87.32%、66.91%和87.58%。光合色素含量的减少可能是由于叶绿体超微结构和膜脂过氧化的变化所致[25-26]。据研究报道,有毒污染物可以抑制藻细胞中用于合成胆色素原的氨基乙酰丙酸脱水酶和用于合成叶绿素的原叶绿素还原酶的活性,其在叶绿素合成中起重要作用[27]。在0.5~4.0 mg·L-1四环素胁迫下,48 h斜生四链藻光合色素含量较96 h有所上升,这可能是由于藻类细胞具有去除叶绿体中积累的活性氧(ROS)的自我保护机制[28]。
2.3 四环素对斜生四链藻细胞叶绿素荧光的影响
vm值代表光合活性生物体的叶绿素荧光发射参数,它主要来源于PSⅡ的叶绿素a分子,通常被用作反映环境胁迫的指标[22]。0.5~6.0 mg·L-1四环素暴露培养48和96 h时,斜生四链藻的vm值(图3)显示,处理组与对照组有显著性差异(< 0.05)。6.0 mg·L-1四环素处理组,48 h时斜生四链藻的vm值为0.079,相比对照组0.604,降幅达到了86.87%;96 h时vm值为0.149,相比对照组0.661,降幅达到了77.4%。
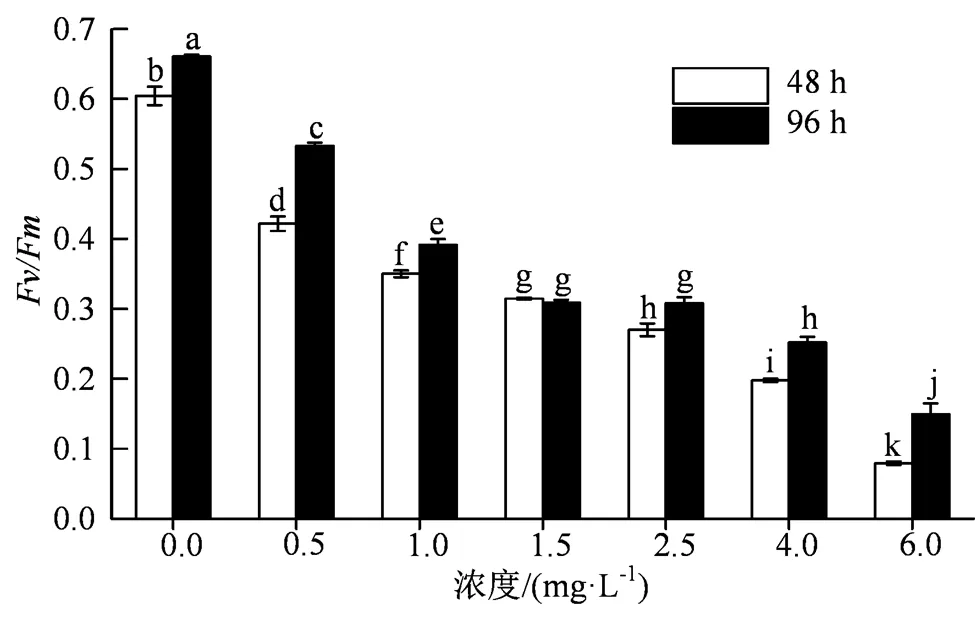
图3 不同浓度四环素对斜生四链藻Fv/Fm参数的影响
Figure 3 Effects of different concentrations of tetracycline onv/mparameters of
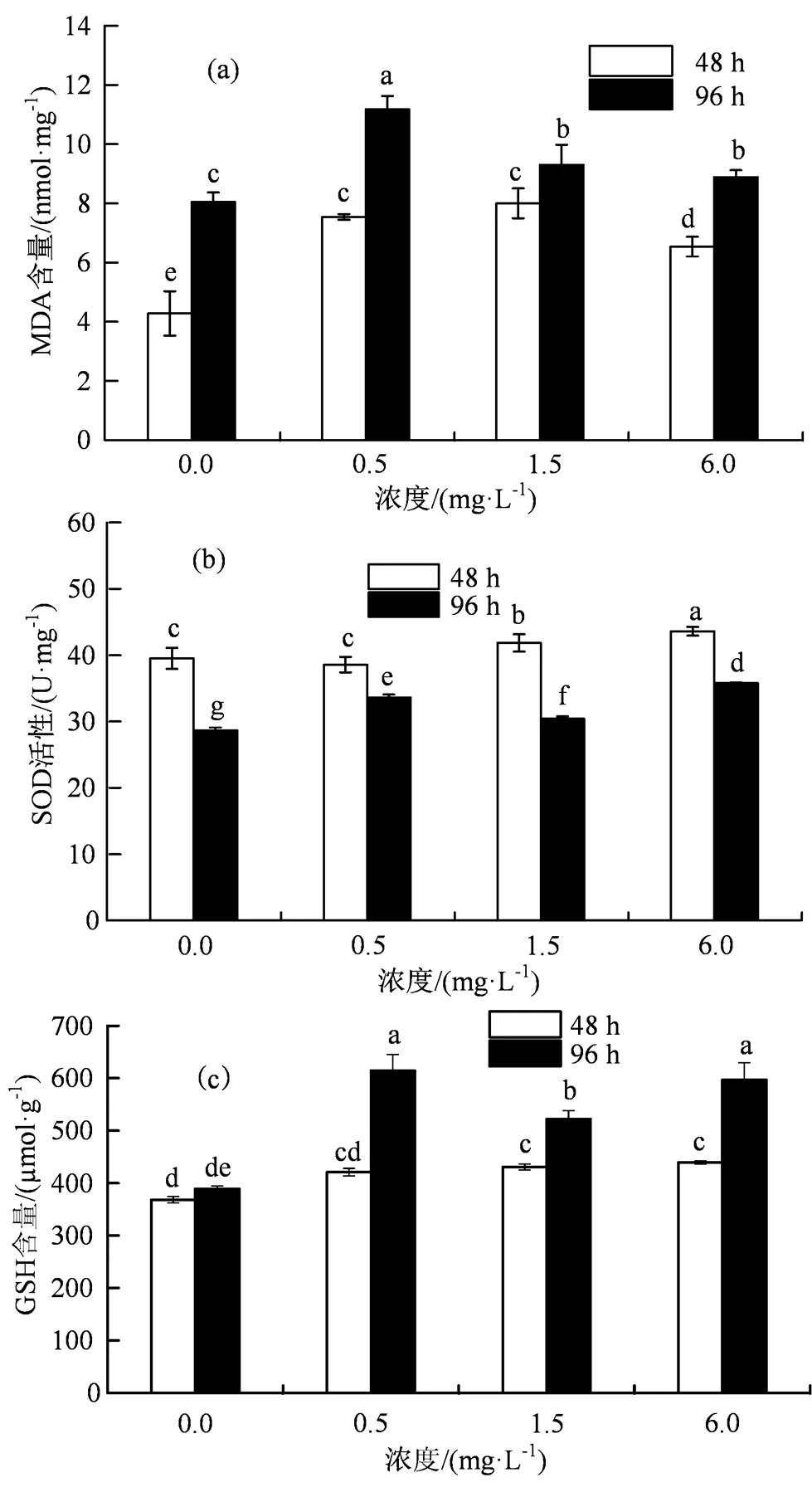
图4 不同浓度四环素对斜生四链藻MDA含量(a)、SOD活性(b)和GSH含量(c)的影响
Figure 4 Effects of different concentrations of tetracycline on MDA content (a), SOD activity (b) and GSH content (c) of
叶绿素荧光参数的变化能反映植物光合作用生理过程受到胁迫作出的反应,量化了光合作用的过程,使研究植物光合作用特征对毒性胁迫的表征得到深入[29]。已有研究表明,莫西沙星、加替沙星等抗生素胁迫会引起微囊藻细胞光化学量子产量降低[30]。本研究发现0.5~10.0 mg·L-1四环素胁迫斜生四链藻48 h和96 h时,其vm值均随着四环素胁迫浓度的增大而显著降低(< 0.05),表明四环素引起斜生四链藻细胞光合活性的损伤,损伤程度与四环素浓度呈正相关关系,这与四环素对斜生四链藻生长的影响结果一致。vm的下降是由于PSII反应中心失活所致,说明四环素可以作用于斜生四链藻细胞的PSII反应中心,并通过抑制其光合作用从而对藻细胞产生胁迫作用。96 h时不同浓度四环素处理组斜生四链藻的v/m值较48 h时均显著上升(< 0.05),说明四环素造成的斜生四链藻细胞最大光化学量子产量的可逆性损伤,在培养后期有恢复趋势。Yang等[8]的研究也观察到了类似的现象,铜绿微囊藻在暴露于低浓度四环素一段时间后,其vm值可以恢复,表明铜绿微囊藻细胞的PSII反应中心对四环素产生了耐药性
2.4 四环素对斜生四链藻抗氧化系统的影响
活性氧具有很强的氧化性能,可以通过氧化多不饱和脂肪酸(PUFA)对细胞器造成致命的破坏。 PUFA过氧化作用会降低膜的流动性,增加渗漏并引起膜蛋白的二次损伤[31]。丙二醛(MDA)是醛类化合物,是PUFA的代表性产物。由图4(a)可见,不同浓度四环素胁迫斜生四链藻48 h时,斜生四链藻MDA含量显著高于对照组(0.05),在6.5~8.0 nmol·mg-1范围内波动。四环素持续胁迫斜生四链藻96 h时,其MDA含量较48 h均有所增加,分别为48 h的1.88、1.48、1.16和1.36倍。藻细胞内MDA含量随着暴露时间的延长而升高表明在四环素胁迫下藻细胞内脂质过氧化的形成具有时间依赖性。Liu等[32]也报道了类似的结果,即在阿莫西林和螺旋霉素暴露的前24 h内未观察到铜绿微囊藻细胞内MDA含量增加 ,但随着时间的延长逐渐增加。当暴露于土霉素时,也观察到斜生栅藻细胞内MDA水平升高[33]。MDA含量的增加表明四环素对斜生四链藻细胞造成了结构和功能损伤。随着四环素浓度的增加,可以观察到藻细胞内MDA含量整体呈现出先上升再下降的趋势,同时在藻细胞内的SOD活性和GSH含量较对照组均显著上升(< 0.05),说明斜生四链藻具有提高抗氧化酶活性和抗氧化物质含量来降低藻细胞膜脂过氧化的能力。但在姜蕾等[12]的研究中,四环素暴露下铜绿微囊藻的SOD活性和POD活性均呈下降趋势,说明铜绿微囊藻不能有效清除藻细胞内的活性氧。这可能是因为不同微藻的氧化应激机制对四环素的响应方式之间存在着差异。
光合生物通过增加其抗氧化防御机制来抵消由细胞中积累的活性氧(ROS)诱导的抗生素的毒性。例如,超氧化物歧化酶(SOD)是一种抗氧化酶,提供了对抗活性氧毒性和清除自由基的第一道防线。它能将O2-转化为H2O2和O2从而阻止超氧阴离子自由基的产生[34]。由图4(b)可知,0.5 mg·L-1四环素胁迫下,48 h时斜生四链藻的SOD活性与对照组相比,无显著性差异(> 0.05);1.5和6.0 mg·L-1处理组与对照组相比,有显著性差异(< 0.05),分别是对照组的1.06和1.01倍。96 h时,斜生四链藻的SOD活性表现为应激性上升,与对照组相比,0.5~6.0 mg·L-1处理组均呈现出显著性差异(< 0.05),分别是对照组的1.17、1.06和1.25倍。这些结果与先前报道的关于暴露于四环素的普通小球藻抗氧化酶活性的观察结果一致[35]。据报道,当暴露于金霉素时,钝顶螺旋藻细胞内的SOD活性也显着增加,这可能是由于藻细胞通过提高SOD活性增强消除O2和 H2O2自由基的能力[36]。有研究报道微藻细胞内SOD催化反应产生过量的H2O2可能会在藻细胞中积累,从而导致藻类生长抑制[32]。
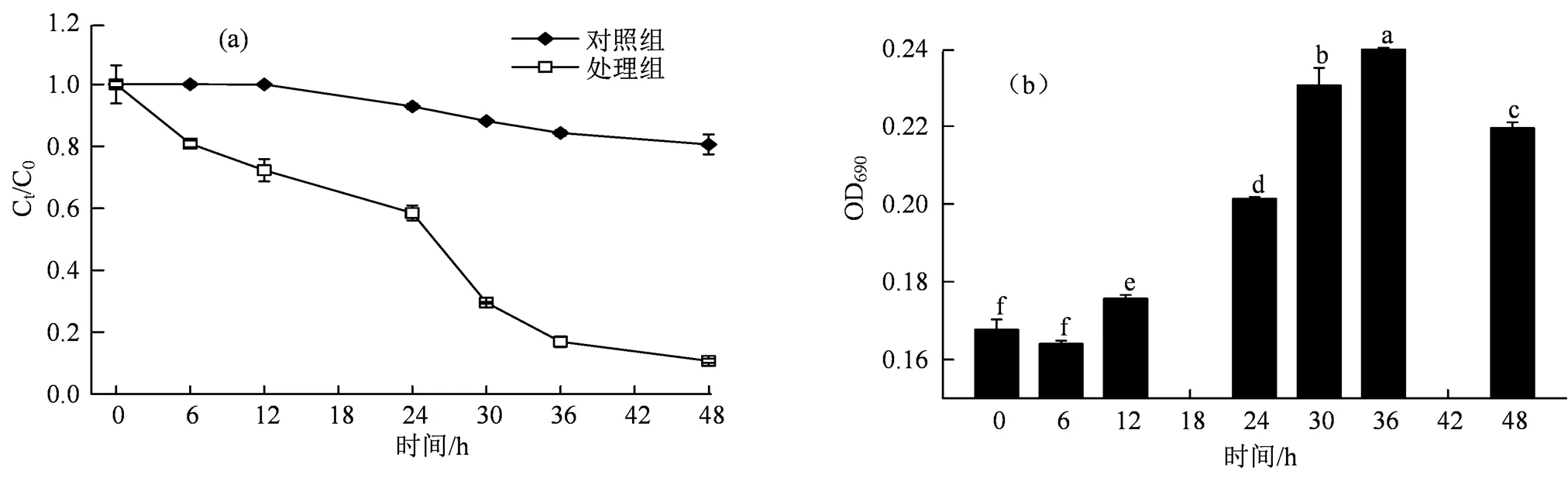
图5 斜生四链藻对四环素的去除率(a)和OD690值变化(b)
Figure 5 Removal rate (a) and OD690value (b) of tetracycline by
谷胱甘肽(GSH)是微藻细胞中一种重要的非酶抗氧化剂,它的主要作用是避免细胞中的重要酶被氧化,以维持细胞中正常的能量代谢[37]。由图4(c)可知,不同浓度四环素胁迫斜生四链藻48 h时,0.5 mg·L-1处理组与对照组相比,无显著性差异(> 0.05);1.5、6.0 mg·L-1处理组与对照组相比,有显著性差异(< 0.05),分别是对照组的1.17、1.19倍。96 h时,0.5~6.0 mg·L-1处理组藻细胞内GSH含量显著高于对照组(0.05),在522.3~614.52 μmol·g-1范围内波动。结果说明斜生四链藻可以通过提高GSH含量消除微藻细胞内产生的ROS并抵抗氧化应激反应。当微藻受到污染物的毒害时,细胞内的谷胱甘肽抗氧化系统会变得活跃起来,GSH含量对于维持细胞内谷胱甘肽还原系统的平衡以及清除细胞内过量的ROS具有重要的作用[38]。类似研究表明,铜绿微囊藻在10和20 mg·L-1的头孢拉定作用下,细胞中GSH含量显着增加,这可能是为了消除藻体内ROS和抵抗氧化应激的策略[39]。
2.5 斜生四链藻对四环素的去除作用
图5为48 h内斜生四链藻对四环素的去除率及OD690值变化。从四环素去除率来看,在36 h内,斜生四链藻对四环素的去除率较高,在36 h以后逐渐变缓。在培养48 h以后,斜生四链藻对于四环素的去除率达到了90%,对照组的去除率为19%。通过OD690值变化可以看出斜生四链藻在36 h时生长值达到最大值0.24,48 h时开始下降至0.22。这些结果表明,四环素对斜生四链藻不仅具有胁迫作用,斜生四链藻还具有快速、高效的去除四环素的能力。这种去除能力对于发展微藻生物技术去除抗生素类药物具有重要意义。已有研究报道小球藻处理的合成废水中四环素去除的主要机制是光降解和生物吸附(43 h后为92%~98%)[40]。在基于微藻和细菌的池塘中,通过间接光降解对四环素的去除率超过93%[41]。Xie等[42]在利用衣藻Tai-03去除PPCPs的研究中发现其可以完全去除四环素和双酚A,其中四环素的主要去除途径是光解和水解。Pan等[43]在利用蓝藻减轻抗生素污染的研究中发现蛋白核小球藻(2 d内去除36.7%~93.9%)和铜绿微囊藻(2 d内去除超过98%)均具有去除四环素的潜力,且生物降解在铜绿微囊藻去除四环素的过程中占主导地位(71.6%),而蛋白核小球藻仅占20.5%。说明利用微藻去除四环素能力的差异很大程度上取决于微藻种类,但有关斜生四链藻对四环素的去除机制还有待进一步研究。
3 结论
以斜生四链藻为研究对象,研究了四环素对藻细胞生长、光合色素含量、叶绿素荧光及抗氧化系统的影响以及斜生四链藻对四环素的去除作用。从所进行的实验可以得出结论:1)不同浓度的四环素胁迫均会抑制斜生四链藻的光合色素含量并引起其光合活性的损伤,并抑制其生长,呈剂量-效应关系。四环素暴露96 h时,光合色素含量以及v/m值较48 h均有所上升。2)四环素胁迫导致斜生四链藻细胞MDA含量显著增加,斜生四链藻可以通过诱导其SOD活性上升及GSH含量升高应对四环素胁迫。3)斜生四链藻具有快速、高效的去除四环素的能力。
[1] XIONG Y H, HOZIC D, GONCALVES A L, et al. Increasing tetracycline concentrations on the performance and communities of mixed microalgae-bacteria photo-bioreactors[J]. Algal Res, 2018, 29: 249-256.
[2] BAI L L, ZHAO Z, WANG C L, et al. Multi-spectroscopic investigation on the complexation of tetracycline with dissolved organic matter derived from algae and macrophyte[J]. Chemosphere, 2017, 187: 421-429.
[3] LIN Y, WU X, HAN Y, et al. Spatial separation of photogenerated carriers and enhanced photocatalytic performance on Ag3PO4catalysts via coupling with PPy and MWCNTs[J]. Appl Catal B Environ, 2019, 258: 117969.
[4] WANG Z, DU Y, YANG C, et al. Occurrence and ecological hazard assessment of selected antibiotics in the surface waters in and around Lake Honghu, China[J]. Sci Total Environ, 2017, 609: 1423-1432.
[5] YE J, DU Y P, WANG L M, et al. Toxin release of cyanobacteriumafter exposure to typical tetracycline antibiotic contaminants[J]. Toxins, 2017, 9(2): 53.
[6] CHEN D, CHU L B, WANG J L, et al. Degradation of antibiotic cephalosporin C in aqueous solution and elimination of antimicrobial activity by gamma irradiation[J]. Chem Eng J, 2019, 374: 1102-1108.
[7] HU H, ZHOU Q, LI X, et al. Phytoremediation of anaerobically digested swine wastewater contaminated by oxytetracycline via: nutrient removal, growth characteristics and degradation pathways[J]. Bioresour Technol, 2019, 291: 121853.
[8] YANG W W, TANG Z P, ZHOU F Q, et al. Toxicity studies of tetracycline onand[J]. Environ Toxicol Pharmacol, 2013, 35(2): 320-324.
[9] XU R, YANG Z H, ZHENG Y, et al. Metagenomic analysis reveals the effects of long-term antibiotic pressure on sludge anaerobic digestion and antimicrobial resistance risk[J]. Bioresour Technol, 2019, 282: 179-188.
[10] ABO B O, ODEY E A, BAKAYOKO M, et al. Microalgae to biofuels production: a review on cultivation, application and renewable energy[J]. Rev Environ Health, 2019, 34(1): 91-99.
[11] 徐冬梅, 王艳花, 饶桂维. 四环素类抗生素对淡水绿藻的毒性作用[J].环境科学, 2013, 34(9): 3386-3390.
[12] 姜蕾, 陈书怡, 尹大强. 四环素对铜绿微囊藻光合作用和抗氧化酶活性的影响[J]. 生态与农村环境学报, 2010, 26(6): 564-567.
[13] 董聪聪, 张红波, 杨燕君, 等. 四环素对微囊藻生长及光合作用的毒性效应机制[J]. 生态毒理学报, 2019, 14(6): 160-169.
[14] LI J, ZHENG X Q, LIU K C, et al. Effect of tetracycline on the growth and nutrient removal capacity ofin simulated effluent from wastewater treatment plants[J]. Bioresour Technol, 2016, 218: 1163-1169.
[15] 王雅学, 武鹏鹏, 沈洪艳. 四环素胁迫对羊角月牙藻生长及抗氧化系统的影响[J]. 河北科技大学学报, 2019, 40(6): 548-554.
[16] XIONG J Q, KURADE M B, JEON B H. Can microalgae remove pharmaceutical contaminants from water? [J]. Trends Biotechnol, 2018, 36(1): 30-44.
[17] VILLAR-NAVARRO E, BAENA-NOGUERAS R M, PANIW M, et al. Removal of pharmaceuticals in urban wastewater: high rate algae pond (HRAP) based technologies as an alternative to activated sludge based processes[J]. Water Res, 2018, 139: 19-29.
[18] CAI X Y, LIU W P, SHENG G Y. Enantioselective degradation and ecotoxicity of the chiral herbicide diclofop in three freshwater alga cultures[J]. J Agric Food Chem, 2008, 56(6): 2139-2146.
[19] LÚCIA H R R, ALEXANDRE A, MARIA T R R, et al. Algal density assessed by spectrophotometry: a calibration curve for the unicellular algae[J]. J Environ Chem Ecotoxicol, 2011, 3(8): 225-228.
[20] XIONG J Q, KURADE M B, KIM J R, et al. Ciprofloxacin toxicity and its co-metabolic removal by a freshwater microalga[J]. J Hazard Mater, 2017, 323: 212-219.
[21] YANG W F, GAO P, LI H X, et al. Mechanism of the inhibition and detoxification effects of the interaction between nanoplastics and microalgae[J]. Sci Total Environ, 2021, 783: 146919.
[22] BI Y F, MIAO S S, LU Y C, et al. Phytotoxicity, bioaccumulation and degradation of isoproturon in green algae[J]. J Hazard Mater, 2012, 243: 242-249.
[23] FAN H Y, LIU H J, DONG Y, et al. Growth inhibition and oxidative stress caused by four ionic liquids in: role of cations and anions[J]. Sci Total Environ, 2019, 651: 570-579.
[24] TUGCU G, ERTÜRK M D, SAÇAN M T. On the aquatic toxicity of substituted phenols to: QSTR with an extended novel data set and interspecies models[J]. J Hazard Mater, 2017, 339: 122-130.
[25] HU H, ZHOU Q, LI X, et al. Phytoremediation of anaerobically digested swine wastewater contaminated by oxytetracycline via: nutrient removal, growth characteristics and degradation pathways[J]. Bioresour Technol, 2019, 291: 121853.
[26] TONG M Y, LI X, LUO Q, et al. Effects of humic acids on biotoxicity of tetracycline to microalgaesp[J]. Algal Res, 2020, 50: 101962.
[27] PRASAD D D K, PRASAD A R K. Effect of lead and mercury on chlorophyll synthesis in mung bean seedlings[J]. Phytochemistry, 1987, 26(4): 881-883.
[28] KASAHARA M, KAGAWA T, OIKAWA K, et al. Chloroplast avoidance movement reduces photodamage in plants[J]. Nature, 2002, 420(6917): 829-832.
[29] MALLICK N, MOHN F H. Use of chlorophyll fluorescence in metal-stress research: a case study with the green microalga[J]. Ecotoxicol Environ Saf, 2003, 55(1): 64-69.
[30] WAN L, WU Y X, ZHANG B H, et al. Effects of moxifloxacin and gatifloxacin stress on growth, photosynthesis, antioxidant responses, and microcystin release in[J]. J Hazard Mater, 2021, 409: 124518.
[31] CHEN B, DONG J W, LI B, et al. Using a freshwater green algato evaluate the biotoxicity of ionic liquids with different cations and anions[J]. Ecotoxicol Environ Saf, 2020, 198: 110604.
[32] LIU Y, GUAN Y T, GAO B Y, et al. Antioxidant responses and degradation of two antibiotic contaminants in[J]. Ecotoxicol and Environ Saf, 2012, 86: 23-30.
[33] 武鹏鹏, 王雅学, 沈洪艳. 土霉素对斜生栅藻的毒性效应研究[J]. 生态毒理学报, 2020, 15(4): 215-223.
[34] ZHANG W J, CHENG C, CHEN L, et al. Enantioselective toxic effects of cyproconazole enantiomers against[J]. Chemosphere, 2016, 159: 50-57.
[35] XU D M, XIAO Y P, PAN H, et al. Toxic effects of tetracycline and its degradation products on freshwater green algae[J]. Ecotoxicol Environ Saf, 2019, 174: 43-47.
[36] ZHOU T, CAO L P, ZHANG Q, et al. Effect of chlortetracycline on the growth and intracellular components ofand its biodegradation pathway[J]. J Hazard Mater, 2021, 413: 125310.
[37] SMITH G A, LIN T H, SHEEHAN A E, et al. Glutathione S-transferase regulates mitochondrial populations in axons through increased glutathione oxidation[J]. Neuron, 2019, 103(1): 52-65.e6.
[38] NAVARRETE A, GONZÁLEZ A, GÓMEZ M, et al. Copper excess detoxification is mediated by a coordinated and complementary induction of glutathione, phytochelatins and metallothioneins in the green seaweed[J]. Plant Physiol Biochem, 2019, 135: 423-431.
[39] DU Y X, WANG J, ZHU F Y, et al. Comprehensive assessment of three typical antibiotics on cyanobacteria (): the impact and recovery capability[J]. Ecotoxicol Environ Saf, 2018, 160: 84-93.
[40] DE GODOS I, MUÑOZ R, GUIEYSSE B. Tetracycline removal during wastewater treatment in high-rate algal ponds[J]. J Hazard Mater, 2012, 229/230: 446-449.
[41] NORVILL Z N, TOLEDO-CERVANTES A, BLANCO S, et al. Photodegradation and sorption govern tetracycline removal during wastewater treatment in algal ponds[J]. Bioresour Technol, 2017, 232: 35-43.
[42] XIE P, HO S H, PENG J, et al. Dual purpose microalgae-based biorefinery for treating pharmaceuticals and personal care products (PPCPs) residues and biodiesel production[J]. Sci Total Environ, 2019, 688: 253-261.
[43] PAN M M, LYU T, ZHAN L M, et al. Mitigating antibiotic pollution using cyanobacteria: removal efficiency, pathways and metabolism[J]. Water Res, 2021, 190: 116735.
Response and remove ofto tetracycline in water
YANG Jun1, CHEN Zhengjie1, WANG Haifeng1, XIE Zhengxin1,2, TANG Jun1,2
(1. School of Resources and Environment, Anhui Agricultural University, Hefei 230036;2. Hefei Scientific Observing and Experimental Station of Agro-Environment, Ministry of Agriculture, Hefei 230036)
Tetracycline persists in the water environment due to its low biodegradability and water solubility, posing a high potential risk to ecological environment. In order to explore the toxic effect of tetracycline residual in water environment on algae, the stress response and removal effect ofto different concentrations of tetracycline (0.5, 1.0, 1.5, 2.5, 4.0 and 6.0 mg·L-1) in water were investigated. The results showed that the growth ofwas inhibited at each concentration of tetracycline treatment group, with the highest inhibition rate reaching 72.99%, and the half effect mass concentration (96 h-EC50) and inhibitory effect 80% mass concentration (96 h-EC80) of tetracycline onwere 2.46 and 6.9 mg·L-1, respectively. Under the stress of the same concentration of tetracycline, the photosynthetic pigment content andv/mvalue ofshowed the same trend as the cell density of. Compared with the control group, the inhibition rates of chlorophyll a, chlorophyll b and carotenoid content in 6.0 mg·L-1concentration group at 96 h were 87.32%, 66.91% and 87.58% respectively , and thev/mvalue decreased by 77.4%. Under the stress of low, medium and high concentrations of tetracycline (0.5, 1.5, 6.0 mg·L-1) for 96 h, the malondialdehyde (MDA) content ofshowed a trend of increasing first and then decreasing; the activity of superoxide dismutase (SOD) and the content of glutathione (GSH) were induced in different degrees. After exposure for 96 h, the activity of SOD and the content of GSH in the 6.0 mg·L-1group were 1.25 and 1.53 times higher than those in the control group. When the initial OD690value ofwas 0.15 and the concentration of tetracycline was 4.0 mg·L-1, the removal rate of tetracycline byreached 90% within 48 h, while that of the control group was 19%. These studies provide some new information on the ecotoxicity of tetracycline to primary producers in water, and also provide a new direction for the ecological remediation of residual tetracycline in water.
tetracycline;; acute toxicity; removal effect
X171.5; X52
A
1672-352X (2023)02-0289-08
2022-05-12
国家自然科学基金(51609001,51709002)资助。
杨 俊,硕士研究生。E-mail:anhuinongye@163.com
通信作者:唐 俊,博士,副教授。E-mail:tangjun@ahau.edu.cn
10.13610/j.cnki.1672-352x.20230511.019
2023-05-12 10:26:03
[URL] https://kns.cnki.net/kcms/detail/34.1162.s.20230511.1337.038.html
