环糊精及其衍生物对降低铅和菲的藻类毒性研究*
2016-03-13章绍康王光辉
徐 兰 李 青 章绍康 王光辉
(东华理工大学水资源与环境工程学院,江西 南昌 330013)
藻类作为水生生态系统的第一营养级,具有非常重要的水环境净化功能,不仅能去除水环境中的氮、磷等营养物质,还可吸附、吸收污水中的重金属和有机污染物[1]。当污染物浓度过高或暴露时间过长时,藻细胞会发生皱缩、畸变,严重的会出现细胞裂解而死亡,甚至可通过食物链影响人体健康。铅是一种蓄积性重金属毒物,分布广泛、毒性持久,可通过食物链富集后对生态系统以及人体产生毒害作用[2-3]。多环芳烃(PAHs)是一种持久性有机污染物[4],其中的菲、芴等先后被美国和中国列为优先控制污染物[5],具有致癌、致畸和致突变[6-7]作用。目前,国内外关于重金属或多环芳烃对斜生栅藻(Scenedesmusobliquus)的影响报道较多[8-11]。但环境中的污染物往往不是单独以一种类别存在的,而是不同种类的污染物共同作用形成复合污染[12],如何降低重金属和有机污染物复合污染对水生生物的毒性研究还相对较少,尚处于探索阶段。
环糊精(CD)是一类以α-1,4糖苷键结合的环状低聚糖,呈锥筒状。由于这类化合物本身无毒[13-14]、生物降解性好[15]、不易被土壤吸附[16],正在逐渐成为研究的热点。常见的CD同分异构体有α-CD、β-CD和γ-CD,其中以β-CD应用最为广泛,对β-CD进行化学修饰,可以得到水溶性更好的CD衍生物。徐兰等[17]用天冬氨酸与β-CD合成了水溶性极好的天冬氨酸-β-CD(ACD),其对土壤中镉等重金属和芴等有机物都具有很好的去除作用。CD及其衍生物主要通过与环境中的污染物(包括有机污染物和重金属)形成主客体包结物和配合物达到降低或去除其毒性的作用。WANG等[18-19]关于β-CD及其衍生物的一些研究为解决实际环境问题提供了重要思路。笔者选用重金属铅和PAHs菲作为代表性污染物,研究CD及其衍生物加入前后斜生栅藻与重金属和有机污染物间的相互作用,旨在揭示CD及其衍生物对降低重金属和有机污染物的藻类毒性作用机制。
1 材料与方法
1.1 材料、试剂和仪器
材料:斜生栅藻和BG-11培养基配方由中国科学院水生生物研究所淡水藻种库提供。
试剂:硫酸铅、α-CD、β-CD、γ-CD、羟丙基-β-CD(HP-β-CD)、无水甲醇、氢氧化钾、环氧氯丙烷、天冬氨酸均为分析纯,菲的质量分数>97%,ACD根据文献[20]的方法合成。
仪器:XYH-4A型体视显微镜,LHP-250型智能人工气候培养箱,722型可见分光光度计,VS-1300型无菌操作台,YXQ-LS-50SII型立式高压蒸汽灭菌锅,HC-2068型高速离心机。
1.2 培养条件
所用玻璃器皿和培养液、蒸馏水均经过121 ℃灭菌20 min,斜生栅藻培养液培养量为100 mL,pH为7.1,所有实验均在智能人工气候培养箱中进行,培养温度为(25±1) ℃,光照强度为2 000 lx,光暗比为12 h∶12 h,每天振荡2~3次并随机更换装有斜生栅藻培养液的锥形瓶位置。
1.3 实验方法
1.3.1 斜生栅藻的培养与吸光度的测定
[21]的方法,收到藻种后,在无菌条件下转入50 mL三角瓶(含30 mL BG-11培养基)内,封好瓶口,置于智能人工气候培养箱中培养。每隔24 h用可见分光光度计在650 nm处进行吸光度(A650)的测定,并在体视显微镜下进行细胞计数得到藻细胞浓度(N,107个/mL),从而建立藻细胞浓度和吸光度之间的相关关系(见式(1)),R2=0.992 2,因此可以通过测定A650推算藻细胞浓度。
N=3.808 3A650+0.059 8
(1)
1.3.2 ACD对斜生栅藻生长的影响
在1.2节的培养条件下考察新合成的ACD(100 mg/L)对斜生栅藻的影响,以不加任何CD及其衍生物(α-CD、β-CD、γ-CD、HP-β-CD和ACD)的斜生栅藻培养液作为空白对照。
1.3.3 ACD对铅胁迫下斜生栅藻生长的影响
用硫酸铅配制两组0、0.01、0.10、1.00、10.00、100.00 mg/L的铅溶液,将含有ACD(100 mg/L)的斜生栅藻培养液接种到其中一组铅溶液中,将没有加入ACD的斜生栅藻培养液接种到另一组铅溶液中,考察ACD对铅胁迫下斜生栅藻生长的影响。
1.3.4 ACD对菲胁迫下斜生栅藻生长的影响
由于菲不溶于水,实验过程中需加入3 mL无水甲醇以增加菲的溶解度,因此单独考察添加3 mL无水甲醇对斜生栅藻生长的影响,并以添加3 mL蒸馏水的斜生栅藻培养液作为空白,以确定无水甲醇的干扰。
配制两组0、5、10、20、50、100 μg/L的菲溶液,将含有ACD(100 mg/L)的斜生栅藻培养液接种到其中一组菲溶液中,将没有加入ACD的斜生栅藻培养液接种到另一组菲溶液中,所有溶液中均添加3 mL无水甲醇,考察ACD对菲胁迫下斜生栅藻生长的影响。
1.3.5 CD及其衍生物对复合污染胁迫下斜生栅藻生长的影响
将含有CD及其衍生物质量浓度为100 mg/L的斜生栅藻培养液接种到含有1.00 mg/L铅和10 μg/L菲的复合溶液中,将不含CD及其衍生物的斜生栅藻培养液接种到另一份含有1.00 mg/L铅和10 μg/L菲的复合溶液中,考察CD及其衍生物对铅和菲复合污染胁迫下斜生栅藻生长的影响。
1.3.6 数据处理
藻细胞的生长速率和抑制率分别根据以下公式计算:
V=ln(Nt/N0)/t
(2)
I=(V0-V)/V0×100%
(3)
式中:V为藻细胞的生长速率,h-1;Nt为t时刻的藻细胞浓度,107个/mL;N0为初始藻细胞浓度,107个/mL;t为培养时间,h;I为藻细胞抑制率,%;V0为不加任何CD及其衍生物的斜生栅藻培养液在1.2节的培养条件下藻细胞的生长速率,h-1。
暴露96 h的半数效应浓度(EC50)根据抑制率和暴露浓度的剂量—效应关系得到。
2 结果与讨论
2.1 ACD对斜生栅藻生长的影响
ACD对斜生栅藻生长的影响如图1所示。由图1可见,在相同培养时间下,添加100 mg/L ACD后藻细胞浓度明显大于空白对照,并且随着培养时间的延长,藻细胞浓度均逐渐增加,表明ACD对斜生栅藻的生长具有促进作用。
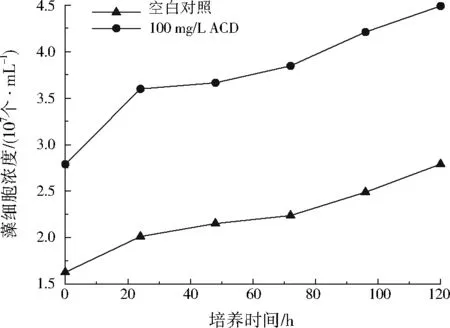
图1 ACD对斜生栅藻生长的影响Fig.1 Effects of ACD on Scenedesmus obliquus
2.2 ACD对铅胁迫下斜生栅藻生长的影响
铅对斜生栅藻生长的影响如图2所示。由图2可见,在相同培养时间下,铅质量浓度为0.01 mg/L时藻细胞浓度几乎都比0 mg/L时高,说明低浓度的铅促进了藻细胞的生长,这是因为微量的铅是藻细胞自身生长所需的营养元素[22]。当铅质量浓度≥0.10 mg/L时,与铅质量浓度为0 mg/L时相比,斜生栅藻的生长均受到了不同程度的抑制;当铅质量浓度≥10.00 mg/L时,藻细胞浓度随培养时间的延长急剧下降,斜生栅藻的生长完全受到抑制,且随培养时间的延长抑制作用增强:说明高浓度的铅对斜生栅藻产生了毒性效应。
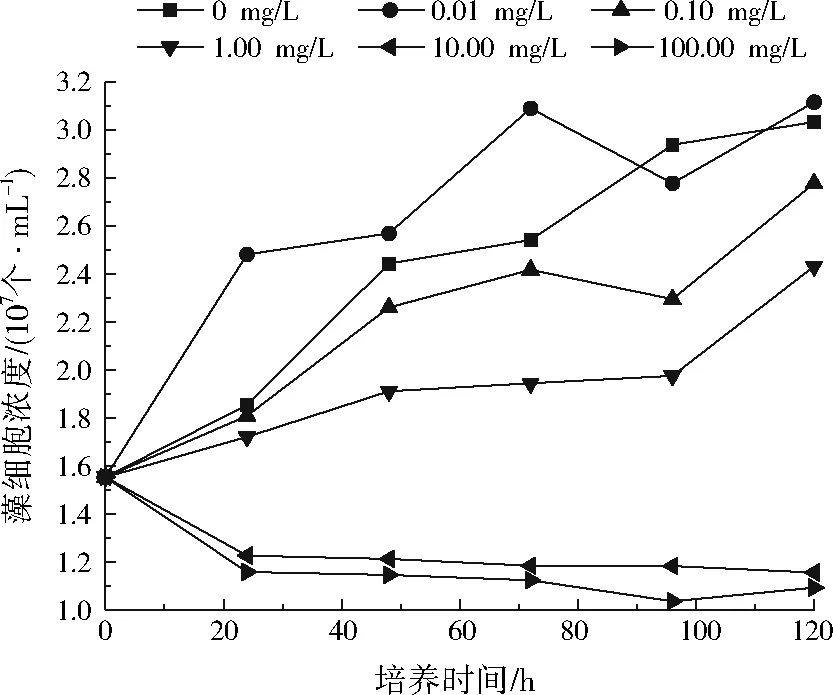
图2 铅对斜生栅藻生长的影响Fig.2 Effect of Pb on Scenedesmus obliquus
ACD对铅胁迫下斜生栅藻生长的影响如图3所示。与图2相比,在相同铅浓度和相同培养时间条件下,含有100 mg/L ACD的斜生栅藻培养液中藻细胞浓度基本比不含ACD的斜生栅藻培养液高。但从图3来看,铅质量浓度为0.01mg/L时藻细胞浓度比0 mg/L时低,这可能是ACD与铅发生了作用,导致两者对斜生栅藻生长的促进作用均减弱。
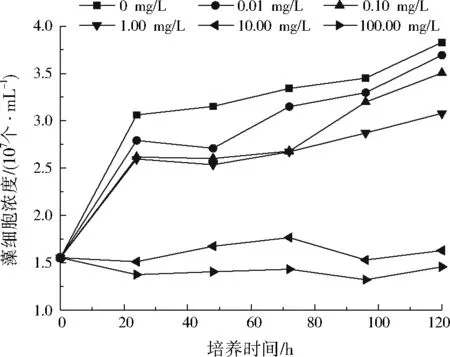
图3 ACD对不同质量浓度铅胁迫下斜生栅藻生长的影响Fig.3 Effect of ACD on Scenedesmus obliquus stressed by Pb of different concentrations
由此可见,由于ACD对斜生栅藻具有促生长作用,因此可以在一定程度上降低高浓度铅对斜生栅藻的毒性效应。
2.3 ACD对菲胁迫下斜生栅藻生长的影响
从图4可以看出,3 mL无水甲醇对斜生栅藻的生长几乎没有影响,从而排除了加入助溶剂对研究菲胁迫下斜生栅藻生长的干扰。

图4 甲醇对斜生栅藻生长的影响Fig.4 Effect of methanol on Scenedesmus obliquus
菲对斜生栅藻生长的影响如图5所示。从图5可以看出,与重金属铅对斜生栅藻生长的影响类似,菲质量浓度为5 μg/L时藻细胞浓度比0 μg/L时高,说明低浓度的菲不仅不会抑制斜生栅藻的生长,反而会促进其藻细胞的生长。当菲质量浓度≥10 μg/L时,与菲质量浓度为0 μg/L时相比,斜生栅藻的生长都受到了不同程度的抑制;当菲质量浓度为100 μg/L时,斜生栅藻的生长完全受到抑制:说明高浓度的菲对斜生栅藻产生了毒性效应。金香琴等[23]在研究菲胁迫下美人蕉对斜生栅藻生长的影响时也观察到这种“低促高抑”的现象。原因可能是斜生栅藻能利用低浓度的菲作为碳源,但随着菲浓度的升高,菲的毒性效应逐渐显现,超过了斜生栅藻的承受极限,出现中毒症状。
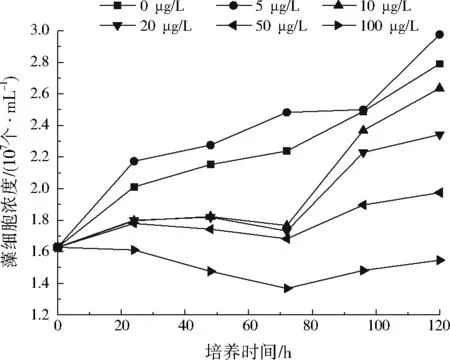
图5 菲对斜生栅藻生长的影响Fig.5 Effect of phenanthrene on Scenedesmus obliquus
ACD对不同质量浓度菲胁迫下斜生栅藻生长的影响如图6所示。与图5相比,在相同菲浓度和相同培养时间条件下,含有100 mg/L ACD的斜生栅藻培养液中藻细胞浓度均比不含ACD的斜生栅藻培养液高,说明ACD分子能够与有机污染物发生作用,使菲的毒性降低。但从图6来看,菲质量浓度为5 μg/L时藻细胞浓度基本比0 μg/L时低,这也是因为ACD与菲发生了相互作用,从而导致两者对斜生栅藻的促进作用均减弱。从ACD的分子结构分析,是因为其内部具有立体空腔结构,能够以类似于细胞吞噬的方式将有机物包结于腔体内。
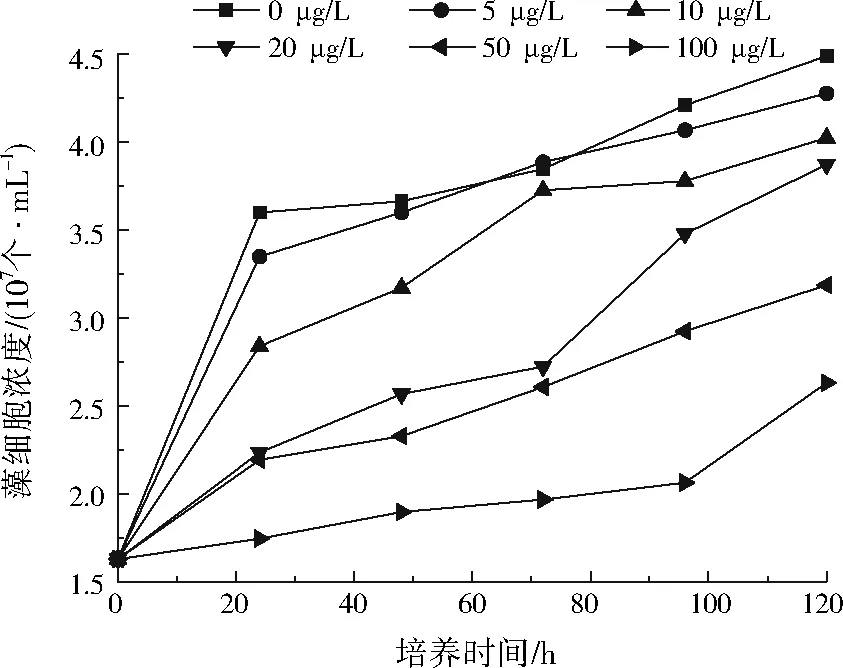
图6 ACD对不同质量浓度菲胁迫下斜生栅藻生长的影响Fig.6 Effect of ACD on Scenedesmus obliquus stressed by phenanthrene of different concentrations
2.4 CD及其衍生物对复合污染胁迫下斜生栅藻生长的影响
在含有1.00 mg/L铅和10 μg/L菲的复合污染胁迫下,不同CD及其衍生物对斜生栅藻生长的影响如图7所示。由图7可知,CD及其衍生物都能降低铅和菲复合污染对斜生栅藻的毒性效应,但不同的CD及其衍生物对降低铅和菲复合污染的毒性效应效果不同,表现为ACD>HP-β-CD>β-CD>γ-CD>α-CD。这是因为CD分子对菲的包结作用与CD空腔大小有关,其中β-CD的腔体大小(0.79 nm)与菲分子大小(0.79 nm)最为匹配,结合最为牢固,而γ-CD腔体直径较大(0.80 nm),包结的菲有可能漏出,α-CD腔体直径较小(0.78 nm),不能完全包结菲分子。CD衍生物由于增加了新的基团,除空腔结构可以包结菲外,还能与重金属铅发生配位作用,且ACD中的氨基、羧基对铅的配位能力比HP-β-CD中的羟基强。
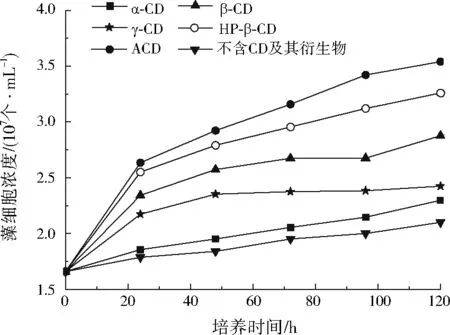
图7 CD及其衍生物对复合污染胁迫下斜生栅藻生长的影响Fig.7 Effect of CD and its derivatives on Scenedesmus obliquus stressed by combined pollution
2.5 ACD对污染物胁迫下斜生栅藻相关指标的影响
根据剂量—效应关系得到,加入100 mg/L ACD可以使铅对斜生栅藻96 h的EC50由0.96 mg/L增加到了3.79 mg/L,菲对斜生栅藻96 h的EC50由40 μg/L增加到104 μg/L,进一步证明了ACD可以降低铅或菲等污染物对斜生栅藻的毒性效应。
从表1来看,100 mg/L ACD可以使铅对斜生栅藻的藻细胞抑制率由58%下降到29%,菲对斜生栅藻的藻细胞抑制率由13%下降到5%;在铅和菲的复合污染下,藻细胞抑制率明显增强,在不含CD及其衍生物和含100 mg/L ACD的情况下藻细胞抑制率分别为88%、57%,说明铅和菲的复合污染表现出协同作用,ACD也能降低铅和菲复合污染对斜生栅藻的毒性效应。

表1 ACD对污染物胁迫下斜生栅藻藻细胞抑制率的影响
3 结 论
(1) 铅和菲对斜生栅藻的生长都表现出“低促高抑”的现象。当铅质量浓度≥0.10 mg/L或菲质量浓度≥10 μg/L时,斜生栅藻的生长都受到不同程度的抑制。
(2) ACD对斜生栅藻的生长具有促进作用,从而可以降低铅和菲对斜生栅藻的毒性效应。质量浓度为100 mg/L的ACD可以显著降低铅和菲的藻类毒性。
(3) 比较不同CD及其衍生物对降低铅和菲复合污染的毒性发现,效果优劣表现为ACD>HP-β-CD>β-CD>γ-CD>α-CD。
参考文献:
[1] 郭静,阮宜纶,林荣忱.水生植物对地热废水净化作用的研究[J].环境科学学报,1995,15(2):251-255.
[2] 秦文淑,邹晓锦,仇荣亮.广州市蔬菜重金属污染现状及对人体健康风险分析[J].农业环境科学学报,2008,27(4):1638-1642.
[3] 晁雷,周启星,崔爽,等.铅与对二氯苯复合污染对小麦和大白菜种子发芽及幼苗期生长的毒性[J].生态学杂志,2006,25(8):944-949.
[4] DICKHUT R M,CANUEL E A,GUSTAFSON K E,et al.Automotive sources of carcinogenic polycyclic aromatic hydrocarbons associated with particulate matter in the Chesapeake Bay region[J].Environmental Science & Technology,2000,34(21):4635-4640.
[5] 周文敏,傅德黔,孙宗光.水中优先控制污染物黑名单[J].中国环境监测,1990,6(4):1-3.
[6] FRNANDES M B,SICRE M A,BOIREAU A,et al.Polyaromatic hydrocarbon(PAH) distributions in the Seine River and its estuary[J].Marine Pollution Bulletin,1997,34(11): 857-867.
[7] LARSEN R K,BAKER J E.Source apportionment of polycyclic aromatic hydrocarbons in the urban atmosphere:a comparison of three methods[J].Environmental Science & Technology,2003,37(11):1873-1881.
[8] 吴明珠,何梅琳,邹山梅,等.纳米MgO对斜生栅藻的毒性效应及致毒机理[J].环境化学,2015,34(7):1259-1267.
[9] CHEN B Y ,CHEN C Y,GUO W Q,et al.Fixed-bed biosorption of cadmium using immobilizedScenedesmusobliquusCNW-N cells on loofa (Luffacylindrica) sponge[J].Bioresource Technology,2014,160:175-181.
[10] 许文武,侯梅芳,潘栋宇,等.多环芳烃(芘)对斜生栅藻的毒性研究[J].生态环境学报,2015,24(8):1361-1365.
[11] ANYANWU I N,SEMPLE K T.Biodegradation of phenanthrene-nitrogen-containing analogues in soil[J].Water,Air,& Soil Pollution,2015,226(8):1-10.
[12] ROIVAINEN P,MAKKONEN S,HOLOPAINEN T,et al.Element interactions and soil properties affecting the soil-to-plant transfer of six elements relevant to radioactive waste in boreal forest[J].Radiation and Environmental Biophysics,2012,51(1):69-78.
[13] MARTIN E M,VALLE D.Cyclodextrin and their uses:a review[J].Process Biochemistry,2004,39(9):1033-1046.
[14] SARAH G,ROBERT C S.2-Hydroxypropyl-β-cyclodextrin (HP-β-CD):a toxicology review[J].Food and Chemical Toxicology,2005,43(10):1451-1459.
[15] FENYYESI E,GRUIZ K,VERSTICHEL S,et al.Biodegradation of cyclodextrins in soil[J].Chemosphere,2005,60(8):1001-1008.
[16] EHSAN S,PRASHER S O,MARSHALL W D.Simultaneous mobilization of heavy metals and polychlorinated biphenyl (PCB) compounds from soil with cyclodextrin and EDTA in admixture[J].Chemosphere,2007,68(1):150-158.
[17] 徐兰,胡苏杭,章绍康,等.天冬氨酸-β-环糊精对土壤中芴和镉的分配行为研究[J].环境污染与防治,2016,38(7):56-60.
[18] WANG Guanghui,YANG Lanlan,WU Feng,et al.Carboxymethyl-β-cyclodextrin enhanced TiO2removal of Acid Red R and lead ions in suspended solutions[J].Journal of Chemical Technology and Biotechnology,2014,89(2):297-304.
[19] WANG Guanghui,ZHOU Yueming,WANG Xuegang,et al.Simultaneous removal of phenanthrene and lead from artificially contaminated soils with glycine-β-cyclodextrin[J].Journal of Hazardous Materials,2010,184(1/2/3):690-695.
[20] 戴荣继,张姝,李方,等.含有氨基和羧基的β-环糊精衍生物合成及性能测试[J].北京理工大学学报,1998,18(2):159-164.
[21] 金相灿,屠清瑛.湖泊富营养化调查规范[M].北京:中国环境科学出版社,1990.
[22] 刘益浩.斜生栅藻与重金属的相互作用研究[D].南京:河海大学,2007.
[23] 金香琴,杨萌尧,边红枫,等.菲胁迫下湿生植物美人蕉(Cannaindica)对斜生栅藻(Scenedesmusobliquus)生长的影响[J].生态毒理学报,2015,10(2):290-296.
