血清mutL同源基因1在晚期胃癌患者XELOX新辅助化疗中的监测意义
2023-05-23夏永欣田春阳
方 玲 夏永欣 田春阳
南阳市中心医院消化内科二病区 (河南 南阳 473000)
胃癌是当前世界上发病率、死亡率增长最快的恶性肿瘤,其已位居恶性肿瘤发病率、死亡率的前列[1-2]。胃癌起病隐匿,早期缺乏特异性诊断手段,而且易发生侵袭转移,为此在明确诊断时往往已处于晚期[3-4]。研究显示XELOX新辅助化疗能提高晚期胃癌的生存率,但是任何化疗措施都对患者有一定的不良反应,同时患者对辅助化疗耐受性也有所要求[5]。DNA错配修复系统(MMR)是人体细胞的一种修复 DNA碱基错配的安全保障体系,也是由错配修复基因组成的修复系统,mutL同源基因1(MLH1)基因是DNA错配修复系统的一员,全长约 58kb,含 19个外显子,cDNA全长为2268bp,编码含756个氨基酸的蛋白质[6]。现代研究显示由幽门螺杆菌感染引起的MMLH1基因的甲基化与胃癌的病理特征存在相关性,也可预测患者的预后与化疗敏感性状态[7]。本文具体探讨了血清MLH1在晚期胃癌患者XELOX新辅助化疗中的监测意义,以明确MLH1的作用机制与价值。现报道如下。
1 资料与方法
1.1 研究对象2018年12月到2020年10月,选择在本院进行诊治的80例晚期胃癌患者作为胃癌组,本次研究得到了医院伦理委员会的批准。纳入标准:病理学证实为晚期胃癌者;有完整的随访资料者;具有XELOX新辅助化疗的指征;年龄20-80岁;预后生存时间≥6个月;血液学指标、肝肾功能在正常范围;确诊前均未接受过其他抗肿瘤方法治疗;知情同意。排除标准:病理诊断组织学分类不清者:病理诊断为小细胞胃癌者。
在80例患者中,男42例,女38例;平均年龄63.22±3.28岁;平均病程为3.22±0.34年;组织学类型(腺癌/鳞癌):45/35例;临床分期(Ⅲ期/Ⅳ期):45/35例;淋巴结转移48例。
1.2 治疗方法所有晚期胃癌患者都给予XELOX新辅助化疗,使用奥沙利铂(国药准字H20093892,费森尤斯卡比(武汉)医药有限公司),130mg/体表面积,d1;同时口服卡培他滨(正大天晴药业集团股份有限公司,国药准字 H20213044 ),1000mg/平方米(体表面积),2次/d(早晚饭后各1次),d1-d14,然后休息1周,为一个治疗周期,治疗观察4个周期。
1.3 血清MLH1表达检测抽取所有患者治疗前后的空腹静脉血2-3ml,分离血清后,采用QIAGEN试剂盒提起血清的总核酸。逆转录为cDNA后,采用实时荧光定量PCR方法检测MLH1基因的相对表达水平,以U2作为内参。
1.4 观察指标疗效标准:在治疗后对基线肿瘤病灶定期行影像学检查,疗效评价依据实体肿瘤疗效评价标准记为CR、PR、SD、PD四种结果。CR(完全缓解):所有病灶消失,无新病灶出现。PR(部分缓解):病灶长径总和缩小≥30%,或无新病灶出现。SD(疾病稳定):基线病灶长径总和有缩小但未达PR,或无新病灶出现;PD(疾病进展):基线病灶长径总和增加≥20%;或出现一个或多个新病灶。疗效评价指标为有效率(RR)为标准,也就是(CR+PR)/总例数。
不良反应:观察胃癌组患者化疗期间出现的不良反应情况,对不良反应进行0-4度分度,不良观察类型包括胃肠反应、神经系统损伤、过敏反应、肝肾损伤、血液系统疾病等。
死亡率:观察观察的死亡分析指标,主要为1年死亡率。
1.5 统计方法选择SPSS 22.00软件进行数据分析,计量数据与计数数据采用均数±标准差、率等表示,两两对比方法为t检验与卡方χ2检验分析,多因素分析采用多元Logistic回归分析,检验水准为α=0.05。
2 结 果
2.1 血清MLH1相对表达水平对比治疗后晚期胃癌患者的血清MLH1相对表达水平明显高于治疗前(P<0.05)。见表1。

表1 晚期胃癌患者XELOX新辅助化疗前后血清MLH1相对表达水平对比
2.2 血清MLH1相对表达水平与晚期胃癌病理特征的相关性在晚期胃癌患者中,不同临床分期、淋巴结转移患者的血清MLH1相对表达水平对比有明显差异(P<0.05)。见表2。
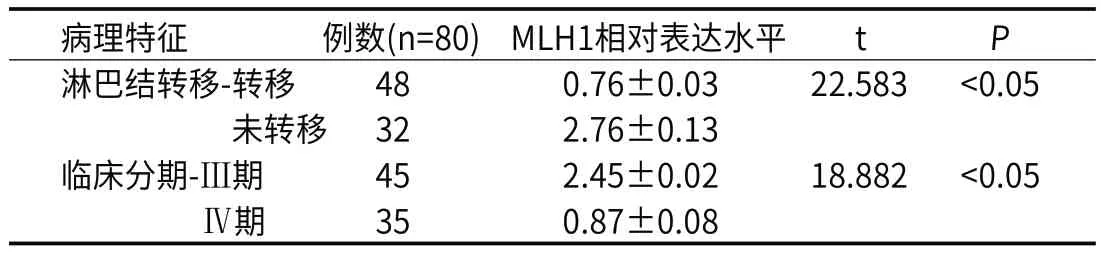
表2 血清MLH1相对表达水平与晚期胃癌病理特征的相关性
2.3 治疗总有效与不良反应情况对比80例患者治疗后CR 40例,PR 25例,SD 10例,SD 5例,总有效率为81.3%。在化疗期间发生不良反应18例,发生率为22.5%,其中8例胃肠反应,神经系统受损6例,肝肾损害2例,过敏反应1例,血液系统受损1例。不良反应的分度情况见表3。

表3 晚期胃癌XELOX新辅助化疗的不良反应情况(n=18)
2.4 生存情况所有患者随访1年,80年患者生存67例,死亡13例,死亡率为16.3%。以预后1年死亡率作为因变量,以调查的内容作为自变量,多元Logistic回归分析显示临床分期、淋巴结转移、血清MLH1相对表达水平都是影响患者预后1年死亡率的重要因素(P<0.05)。见表4。

表4 影响晚期胃癌患者XELOX新辅助化疗1年死亡率的多因素分析(n=80)
3 讨 论
恶性肿瘤是多种因素共同作用的以细胞周期紊乱,细胞无限增殖为表现的病理过程。尽管近年来晚期胃癌的多学科综合治疗水平有了较大的进步,但是由于胃癌起病隐匿,早期没有特异的诊断方法,80.0%的胃癌患者在确诊时已经失去手术机会,导致疗效很不满意,1年生存率也比较低[8-9]。现代研究表明胃癌在发生是经历胃黏膜萎缩-肠上皮化生-非典型增生-癌症的过程,在这个过程中涉及多个基因与蛋白的异常表达。完整的错配修复功能可有效地维持基因组稳定、防止基因突变与恶性肿瘤的发生。MLH1基因是错配修复系统主要组成部分,通过结合hPMS2蛋白生成异二聚体hMutL,然后参与错配碱基修复过程[10]。人MLH1位于染色体3p21,很多恶性肿瘤患者伴随有hMLH1基因突变。MLH1基因的异常甲基化是引起微卫星DNA不稳定的重要原因,MLH1的沉默或低表达都可以引起DNA错配修复功能发生异常,导致恶性肿瘤的发生[11]。而MLH1基因高表达可在一定程度上阻碍损伤所致细胞恶变、DNA突变,可抑制恶性肿瘤的发生与发展。本研究显示治疗后晚期胃癌患者的血清MLH1相对表达水平明显高于治疗前(P<0.05),表明晚期胃癌患者多伴随有血清MLH1的低表达,而XELOX新辅助化疗的应用能促进血清MLH1表达水平。
本研究显示80例患者治疗后CR 40例,PR 25例,SD 10例,SD 5例,总有效率为81.3%。化疗对患者有一定影响,其中不良反应主要为胃肠道反应、神经系统反应与过敏反应。本研究显示80例患者在化疗期间发生不良反应18例,发生率为22.5%,其中8例胃肠反应,神经系统受损6例,肝肾损害2例,过敏反应1例,血液系统受损1例,也表明XELOX新辅助化疗治疗晚期胃癌的主要不良反应为为胃肠道反应、神经系统受损与肝肾损害等,多为轻度不良反应,经过对症处理后都明显好转。
研究显示,MLH1在肿瘤组织中几乎不表达,而在正常组织有高水平的表达[12]。本研究显示在晚期胃癌患者中,不同临床分期、淋巴结转移患者的血清MLH1相对表达水平对比有明显差异(P<0.05);多元Logistic回归分析显示临床分期、淋巴结转移、血清MLH1相对表达水平都是影响患者预后1年死亡率的重要因素(P<0.05)。当前也有研究显示,MLH1相对表达水平与恶性肿瘤的淋巴结转移及肿瘤分期存在一定相关性,若MLH1基因表达下调或缺失则有可能引起特定染色体突变,可导致胃癌的发生。
总之,晚期胃癌患者多伴随有血清MLH1的高表达,而XELOX新辅助化疗的应用能促进降低血清MLH1表达水平,血清MLH1表达水平与患者的病理特征存在相关性,也是影响胃癌患者预后1年死亡率的重要因素。
