信号肽优化提高葡萄糖氧化酶在毕赤酵母中的表达量
2023-05-17张娜闫亚茹武运张宇宏张伟
张娜, 闫亚茹, 武运*, 张宇宏*, 张伟
(1.新疆农业大学食品科学与药学学院,乌鲁木齐 830052; 2.中国农业科学院生物技术研究所,北京 100081)
葡萄糖氧化酶(glucose oxidase,GOD)是一种需氧脱氢酶,能够专一地氧化葡萄糖生成葡萄糖酸和过氧化氢,具有脱氧、除葡萄糖、杀菌以及生成葡萄糖酸的作用[1],近年来被广泛用于与人体健康密切相关的食品、医药、生物技术等行业[2]。GOD 能够有效地改善小麦面筋的组织结构,提高面团的持气性、弹性、韧性和持水性,从而改善面包品质[3];在白葡萄酒生产中加入GOD 可有效防止酚类对白葡萄酒产生的严重褐变[4];GOD 催化产生的过氧化氢可充当漂白剂在纺织品中使用[5];在口腔护理产品中添加GOD 可起到抑制微生物的作用[6];此外,GOD 是新型传感器中的重要组成部分,可以用来测定糖含量[7]。
多种动植物和真菌都可产生GOD,而商业GOD 主要来源于黑曲霉和青霉菌发酵[8]。在发酵过程中,黑曲霉和青霉菌会生成过氧化氢酶和纤维素酶等其他副产物,产生的大量杂蛋白会使后期的分离纯化工作变复杂,且增加生产成本。近年来研究发现,使用重组基因工程菌株表达葡萄糖氧化酶有望解决这些问题,在这其中,巴斯德毕赤酵母(Pichia pastoris)是更具高效生产GOD潜力的微生物[9-10],Valdivieso-ugarte 等[11]克隆了黑曲霉BT18的葡萄糖氧化酶基因,并将其作为表达盒的一部分整合到酿酒酵母宿主菌株的核糖体DNA中,获得了含有高达90%低聚果糖的最终糖浆。Li 等[12]将密码子优化的水仙凝集素(narcissus tazetta lectin,NTL)基因在毕赤酵母中成功表达,并在5 L 规模的发酵罐中发酵96 h 后得到重组NTL蛋白质,产量高达1.2 g·L-1。周亚凤等[13]将来源于黑曲霉的GOD 基因在毕赤酵母中进行了重组表达,诱导所得发酵液的酶活为30~40 U·mL-1。将克隆的GOD 基因与宿主表达载体连接后转化毕赤酵母获得基因工程菌株,通过甲醇诱导表达的方法可得到大量GOD 蛋白。毕赤酵母本身内源蛋白的分泌量很少,且可以将外源目的蛋白分泌到培养基中,所以后期的蛋白纯化操作较为简单[14]。近年来,许多蛋白质在毕赤酵母中实现了高效表达,但仍然有多种蛋白质表达量相对较低[15-16]。提高毕赤酵母外源蛋白质的表达量是降低工业化生产成本的关键。
在毕赤酵母表达体系中,菌株、培养基以及发酵工艺等已经逐渐成熟,构建高效表达的载体是提高外源基因表达量的重要因素。利用毕赤酵母生产异源蛋白质,最常见的分泌信号是酿酒酵母α 信号肽(α mature factor)[17]。分泌信号由2 部分组成,一部分是19 个氨基酸的N-末端信号序列,指导易位进入内质网(endoplasmic reticulum,ER);另一部分是66 个氨基酸的蛋白区,介导受体依赖性包装进入内质网衍生的COP Ⅱ转运囊泡[18-19],重组蛋白通过ER 腔中的Kex 2 蛋白酶去除α 因子信号序列。α 因子信号肽在毕赤酵母中能有效分泌多种异源蛋白质,但不同蛋白的表达水平差异较大,因此,人们不断探索新的方法改造信号肽,以提高蛋白表达水平或分泌效率。Tanaka 等[20]使用嗜酸性木聚糖酶自身信号肽、α 信号肽、酸性磷酸酶(PHO1)信号肽在GS115 中分泌表达显示,α 信号肽引导的目的蛋白表达量是其他信号肽的2倍。Ghosalkar等[21]用IFN-α2自身信号肽及α 信号肽在毕赤酵母GS115 中分泌表达,结果表明,α 信号肽引导的目的蛋白高效分泌,产量达200 mg·L-1,而自身信号肽引导的目的蛋白不能分泌表达。应用α信号肽也成功实现了Insulin、plectasin等多种蛋白在毕赤酵母中的高效表达[22]。以上研究结果表明,α 信号肽在应用中较其他信号肽更为有效。为了在原有基础上进一步提高蛋白表达和分泌效率,有必要对α 信号肽进行优化升级。Lin-cereghino 等[23]利用酿酒酵母α 因子分泌信号的缺失诱变确定了可以被去除并改善分泌的氨基酸段,并利用这些结果为其潜在结构生成模型。熊爱生等[24]通过在酿酒酵母的α因子信号肽序列N 端分别引入1~10 个毕赤酵母AOX1蛋白质的N 端氨基酸构建了10种不同的分泌信号肽序列,结果以N端加入A、I、P这3个氨基酸的信号肽序列对植酸酶基因的表达量影响最大。然而,目前关于通过改变信号肽核酸序列(氨基酸序列不变)而改善葡萄糖氧化酶表达量的研究尚未见报道。因此,本研究以重组表达GOD 的菌株AGODm-pPICZαA 为出发菌株,利用毕赤酵母密码子偏好性对α 因子信号肽序列进行改造,重新构建连有不同α信号肽的葡萄糖氧化酶重组表达酵母菌株,提高GOD 在毕赤酵母中的表达量,解决原始基因在毕赤酵母中表达量低的缺陷,进一步降低酶蛋白生产成本。
1 材料与方法
1.1 试剂
巴斯德毕赤酵母(Pichia pastoris)菌株GS115、表达载体pPICZαA 及带有葡萄糖氧化酶基因的质粒AGODm-pPICZαA 均由本实验室保存。
PCR 相关试剂和大肠杆菌(Escherichia coli)TOP10感受态细胞购自北京全式金生物技术有限公司;限制性内切酶购自Thermo 公司;抗生素Zeocin(100 mg·mL-1)购自Invitrogen 公司;PCR 产物纯化试剂盒和质粒提取试剂盒购自天根生化科技有限公司;重组酶2×Clone Express Mix 购自南京诺唯赞生物科技股份有限公司;辣根过氧化物酶、邻联茴香胺、生物素和YNB(酵母无氨基氮源)购自Amresco 公司;其他普通化学试剂为国产分析纯。
10×YNB:YNB 用 蒸 馏水 配 制为134 g·L-1,0.22 μm滤膜过滤灭菌。
500×生物素:生物素用蒸馏水配制为0.2 g·L-1,0.22 μm滤膜过滤灭菌。
YPD 培养基:蛋白胨20 g·L-1,酵母提取物10 g·L-1,葡 萄 糖20 g·L-1,固 体 培 养 基 另 加 入15 g·L-1琼脂粉,108 ℃下高压灭菌30 min。
YPDZ固体培养基:蛋白胨20 g·L-1,酵母提取物10 g·L-1,葡 萄 糖20 g·L-1,琼 脂 粉20 g·L-1,108 ℃下高压灭菌30 min;待温度下降至60 ℃以下,加入Zeocin(300 μg·mL-1)。
LB 培 养 基:蛋 白 胨10 g·L-1,酵 母 提 取 物5 g·L-1,氯 化 钠10 g·L-1,固 体 培 养 基 另 加 入15 g·L-1琼脂粉,121 ℃下高压灭菌20 min。
BMGY 培养基:蛋白胨20 g·L-1,酵母提取物10 g·L-1,K2HPO43 g·L-1,KH2PO411.8 g·L-1,甘油1 g·L-1,121 ℃下高压灭菌20 min;待温度下降至60 ℃以下,加入1/10 体积的10×YNB、1/500 体积的500×生物素。
BMMY 培养基:蛋白胨20 g·L-1,酵母提取物10 g·L-1,K2HPO43 g·L-1,KH2PO411.8 g·L-1,121 ℃下高压灭菌20 min;待温度下降至60 ℃以下,加入1/10 体积的10×YNB、1/500 体积的500×生物素和1%甲醇(体积分数)。
1.2 仪器
主要仪器包括PCR 仪(美国Bio-Rad 公司)、JS-680D 凝胶成像仪(上海培清科技有限公司)、电热恒温水浴锅(上海一恒科学仪器有限公司)、立式高速离心机(日本HITACHI 公司)、恒温培养箱(上海一恒科学仪器有限公司)、UV-2800 型紫外可见分光光度计(尤尼柯上海仪器有限公司)、L-550 台式大容量离心机(湘仪离心机仪器有限公司)、平板摇床(德国Heidolph公司)。
1.3 不同α因子信号肽的优化与载体构建
1.3.1 α 因子信号肽的优化与合成 试验用表达载体为pPICZαA,信号肽为α 因子。在不改变α因子信号肽氨基酸序列的前提下,根据毕赤酵母密码子偏好性和mRNA 二级结构能量,对α 因子信号肽DNA 序列进行重新设计,从而得到一系列新的信号肽DNA 序列。并计算其对应的密码子适应指数(codon adaptation index, CAI)(BitGene软件),使用RNAfold WebServer 软件预测mRNA二级结构和能量,委托南京金斯瑞生物科技有限公司进行信号肽DNA合成。
1.3.2 α 因子信号肽与表达载体的重组 实验室前期已经构建了葡萄糖氧化酶的重组表达载体AGODm-pPICZαA。根据不同信号肽序列,分别设计引物α-signal-F和α-signal-R,详见表1。引物两端各含有20 bp 与AGODm-pPICZαA 同源的序列。以α-signal-F 和α-signal-R 为引物,以合成的各信号肽DNA 为模板进行PCR 扩增,获得各信号肽的PCR 扩增产物。PCR 体系如下:phanta 酶1 μL,2×phanta buffer 25 μL,dNTP 1 μL,引 物α-signal-F 2 μL,引物α-signal-R 2 μL,α 信号肽质粒1 μL,ddH2O 18 μL。PCR 程序为:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 15 s,30 个循环;72 ℃5 min。PCR 产物经核酸电泳检测后,进行琼脂糖凝胶回收备用。

表1 基因扩增引物Table 1 Primers for gene amplification
设计引物ZT-pPICZαA-F 和ZT-pPICZαA-R(表1),以AGODm-pPICZαA 质粒为模板进行PCR,PCR 方法同1.3.2,获得含有GOD 基因表达盒的DNA 片段。PCR 产物经核酸电泳检测后,进行琼脂糖凝胶回收备用。将上述2种DNA片段与2×Clone Express Mix 重 组 酶 混 合,25 ℃反 应15 min 后取出置于冰上静置5 min,进行后续转化操作。
1.3.3 重组质粒转化大肠杆菌 将10 μL 上述重组产物加入到大肠杆菌TOP10 感受态细胞中,混匀,冰浴30 min,在42 ℃水浴中热激60 s 后立即置于冰上冰浴2 min,加入300 μL 的LB 培养基,37 ℃摇床(200 r·min-1)孵育1 h,取200 μL 菌液,涂布含有Zecion(25 μg·mL-1)的LB 平板,倒置于37 ℃培养箱培养过夜。待LB 平板转化子长出后,通过PCR 方法进行鉴定,PCR 体系如下:Taq DNA 聚 合 酶0.4 μL,10×Easy Taq buffer 2 μL,dNTP 1.6 μL,引物α-signal-F 2 μL,引物3-AOX 2 μL,模板1 μL,ddH2O 10 μL。PCR 程序:95 ℃5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 120 s,30 个循环;72 ℃ 5 min。阳性克隆即为连有不同信号肽的葡萄糖氧化酶重组质粒的大肠杆菌菌株,将其命名为α-signal-AGODm-pPICZαA。
1.3.4 重组质粒在毕赤酵母GS115中的表达 将阳性克隆接种到含Zecion(25 μg·mL-1)液体的LB培养基中,37 ℃摇床(200 r·min-1)过夜培养,用质粒小提试剂盒提取质粒。使用SacⅠ限制性内切酶将质粒酶切线性化;然后加入0.8倍体积的异丙醇将线性化后的DNA 片段沉淀,75%乙醇清洗2 次,沉 淀 干燥后用15 μL 超 纯水溶解,置于-20 ℃备用。
取上述处理过的线性化质粒10 μL,加入100 μL 毕赤酵母GS115 感受态细胞中,轻轻混匀后冰上静置20 min,2.5 kV 电击6.0 ms 后,立即加入500 μL冰预冷的1 mol·L-1山梨醇溶液和500 μL的YPD培养基,28 ℃恒温摇床(200 r·min-1)中孵育2 h。菌体涂布YPDZ 固体培养基,28 ℃恒温培养箱中培养48 h,直至酵母阳性克隆子长出。
1.4 重组葡萄糖氧化酶的诱导表达
挑取酵母阳性克隆子接种于含有500 μL BMGY 培养基的48 孔平板中,28 ℃恒温振荡(750 r·min-1)培养36 h;离心去除上清,菌体用500 μL BMMY 培 养 基 重 悬,28 ℃恒 温 振 荡(750 r·min-1)培养,每隔24 h 补加1%甲醇,培养72 h 后离心去除菌体,上清即为葡萄糖氧化酶粗酶液。
上述酶活力诱导表达重复进行4 次,用于确认筛选结果。
1.5 GOD酶活力测定和数据处理
在试管中加入除葡萄糖氧化酶之外的其余反应底物(1.25 mL 的邻联茴香胺缓冲液;0.15 mL 的18%葡萄糖溶液;0.05 mL 的90 U·mL-1辣根过氧化物酶溶液),30 ℃保温2 min 后,加入葡萄糖氧化酶溶液0.05 mL,反应3 min 后,加入1 mL H2SO4(2 mol·L-1)终止反应,测定540 nm 处的吸光值,根据制定的GOD 酶活测定标准曲线方程计算酶活力。使用Origin 8.5 软件对GOD 酶活力数据进行处理和统计分析。
葡萄糖氧化酶(GOD)酶活单位(U)定义为:30 ℃、pH 6.0 条件下,每分钟催化1 μmoL β-D-葡萄糖生成葡萄糖酸和过氧化氢所需的酶量。
1.6 重组葡萄糖氧化酶蛋白纯化
使用截留分子量为10 kD 的超滤膜包对重组葡萄糖氧化酶进行脱盐和浓缩,浓缩后的酶液采用阴离子交换层析柱HiTrap CaptoQ(5 mL)进行纯化,详细步骤参照文献[6]。将纯化后的5 种重组蛋白进行SDS-PAGE分析。
2 结果与分析
2.1 α信号肽优化及分析
2.1.1 5 种不同信号肽的优化设计 以野生型信号肽αWT为基础,根据毕赤酵母密码子偏好性和信号肽mRNA 二级结构能量,设计了4 种不同信号肽α1、α2、α3与α4,5种α 信号肽序列比对结果如图1 所示。α1和α2信号肽中使用了大量毕赤酵母最高频率密码子,而α3和α4信号肽则使用了大量毕赤酵母低频率密码子。

图1 5种不同信号肽DNA序列比对Fig. 1 DNA sequence alignment of five different signal peptide
2.1.2 5 种不同信号肽的序列分析 根据5 种α信号肽各自的基因序列分析得到对应的mRNA二级结构,如图2 所示,左侧为每种信号肽的最小自由能结构,右侧是最小自由能结构的山形图。由各个信号肽的最小自由能(图3)和密码子适应指数(图4)可知,αWT信号肽的自由能为-53.8 kcal·moL-1;α1和α2信号肽中采用了高频密码子,密码子适应指数分别为0.96和0.82,自由能分别为-46.9 和-54.2 kcal·moL-1;而α3和α4信号肽对应的密码子适应指数分别为0.46 和0.40,自由能分别为-91.7和-99.9 kcal·moL-1。
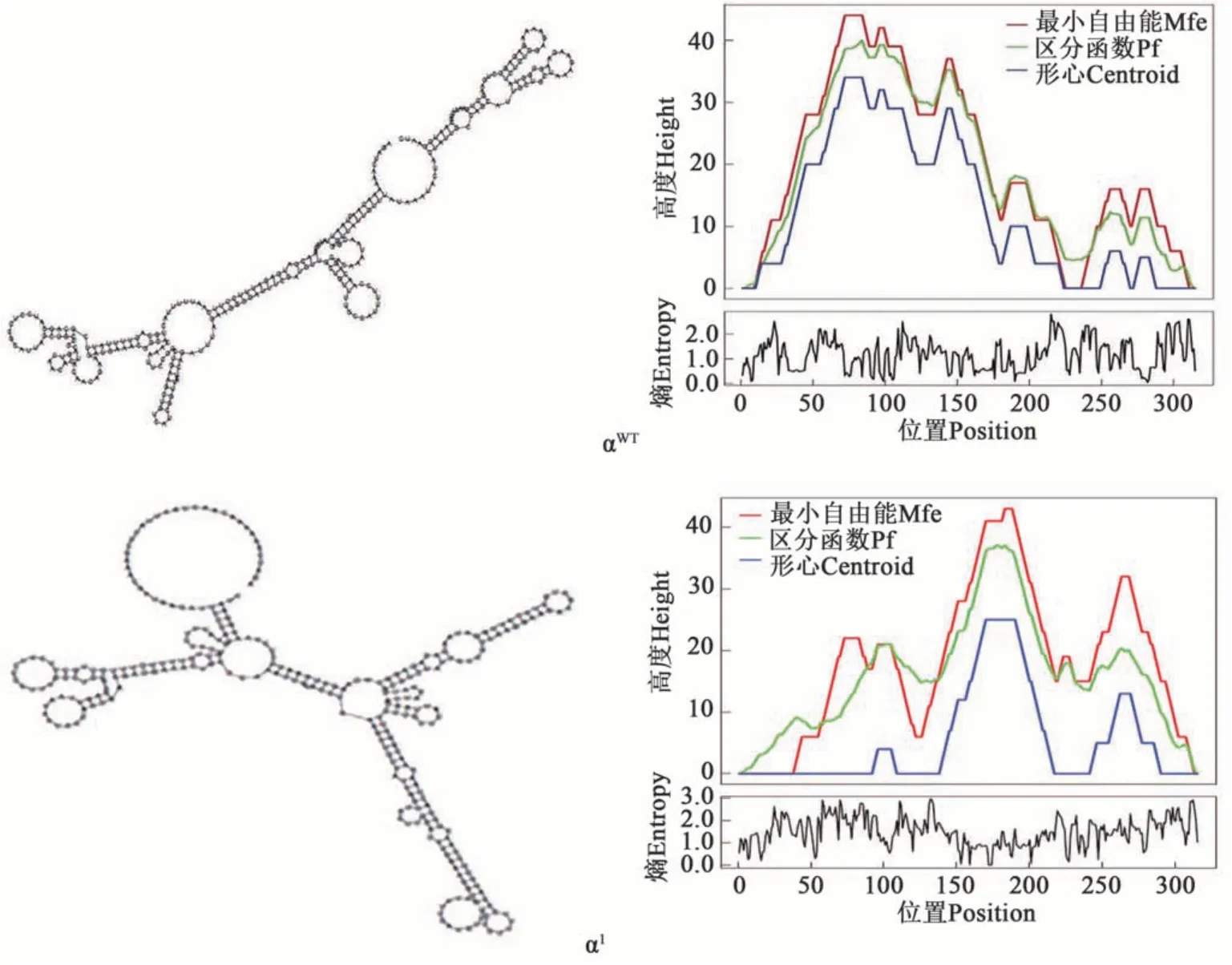

图2 5种 α 信号肽mRNA二级结构图Fig. 2 Secondary structure of five α-signal peptide mRNAs

图3 5种α信号肽的mRNA二级结构能量Fig. 3 mRNA secondary structure energy of five α-signal peptides

图4 5种α信号肽的密码子适应指数Fig. 4 Codon adaptation indices of five α-signal peptides
2.2 连接不同α 信号肽的重组菌株的葡萄糖氧化酶活力
将优化后的4 种信号肽与野生型信号肽分别在毕赤酵母GS115 中进行表达,电击转化GS115毕赤酵母后,每种信号肽对应的重组菌株均含有200 个以上重组子,各随机选取24 个单克隆进行酶液诱导。将含各种信号肽的重组菌株酶活力分别与含野生型信号肽的重组菌株酶活力进行对比。结果(图5)显示,αWT信号肽对应重组菌株的平均酶活力为5.32 U·mL-1;连有α1、α2信号肽重组菌株的GOD 酶活力明显高于野生型菌株。其中连有α1信号肽重组菌株的平均酶活力10.74 U·mL-1,是野生型αWT的2.01 倍;连有α2信号肽重组菌株的酶活力是9.62 U·mL-1,是野生型αWT的1.80 倍;而连有α3、α4信号肽重组菌株的酶活力明显降低,其中α4信号肽重组菌株酶活力仅为野生型αWT的41%。

图5 不同信号肽重组菌株及野生型信号肽重组菌株的GOD酶活力Fig. 5 GOD enzyme activity of recombinant strains with different signal peptides and recombinant strains containing wild-type signal peptides
上述结果经验证具有可重复性(图6),与αWT信号肽重组菌株相比,α1的表达量远高于野生型;而使用低频率密码子构建的α4信号肽重组菌株的酶活力最低,远低于野生型。
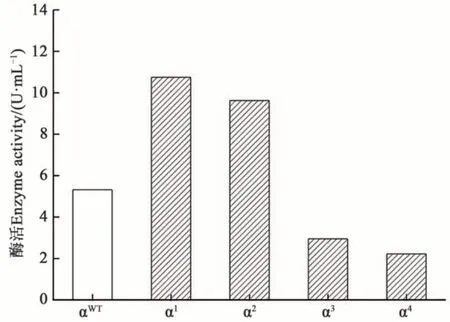
图6 酶活力平均值Fig. 6 Enzyme activity average
2.3 重组葡萄糖氧化酶SDS-PAGE分析
粗酶液经10 kD 的超滤膜包脱盐及HiTrap CaptoQ 阴离子交换层析柱纯化后,经SDS-PAGE分析,重组GOD与野生型GOD蛋白的分子量大小一致,均为80 kD左右(图7)。

图7 重组菌株GOD的SDS-PAGE分析Fig. 7 SDS-PAGE analysis of recombinant strains GOD
3 讨论
大多数氨基酸由多个密码子编码,在各种宿主中,密码子的选择对蛋白质的表达有重要影响。Goodman 等[25]建立并测量了大肠杆菌中14 000 多个合成报告基因的表达,表明用N 端稀有密码子代替普通密码子可使蛋白表达量增加14 倍(中位数4 倍)。mRNA 分子中的同义密码子突变可改变DNA 序列的化学特性及其翻译速率。但是,由于共翻译错误折叠,密码子翻译速率的变化可能导致新生蛋白质发生功能异常[26]。
酿酒酵母α因子信号肽目前是毕赤酵母中使用最多且成功率最高的信号肽。Barrero等[27]设计了1 种由酿酒酵母Ost1 信号序列组成的分泌信号,与使用原始α 因子分泌信号肽所获得的表达水平相比,该信号肽序列将红色荧光蛋白E2-Crimson 提 高 了20 倍,脂 肪 酶BTL2 增 加 了10倍。Lsada-lombana等[28]通过信号肽和PMP1t促进共同翻译易位导致蛋白的胞外水平升高,使细胞外mRFP 和β-葡萄糖苷酶的水平分别提高了5.8和7.1倍。
信号肽提高了重组蛋白在毕赤酵母中的表达水平,其原因是α 信号肽能够介导新生肽翻译并同时转运到内质网腔表面,从而提高蛋白质的表达水平。这种效应与信号肽本身共翻译转运途径的功能及信号肽疏水核心的疏水强度有密切关系。信号肽疏水性的增强可以提高信号肽的转运效率。Oberste等[29]研究发现,酵母PhoA 信号肽疏水核心Leu/Ala 值为6∶4 时,信号肽分泌能力随着疏水性的增强而提高,此时前体蛋白质能较好地分泌。
自由能是衡量mRNA 二级结构稳定性的重要因素,能量值越小,结构越稳定,但越不利于后期的解折叠及翻译。本研究中,α4信号肽自由能为-99.9 kcal·moL-1,能量值最小,GOD的表达量也最低。而对应的,α1信号肽自由能为-46.9 kcal·moL-1,在各组信号肽中能量值最高,其GOD 表达量也最高。本研究并未改变目的蛋白的DNA和氨基酸序列,也未改变信号肽的氨基酸序列,仅通过优化信号肽的密码子改变其mRNA结构,从而改变了GOD蛋白的表达量,揭示了毕赤酵母表达框N 端的mRNA 结构可能对外源蛋白表达有较大影响。因此本研究提供了1 种新的改善毕赤酵母外源蛋白表达量的策略,但后期仍需要通过多种不同外源蛋白进行验证。
本研究在不改变氨基酸序列的前提下,对毕赤酵母α 因子信号肽进行改造,使用毕赤酵母高频密码子的α1、α2信号肽,其对应重组菌株的GOD 酶活力明显高于野生型,最高可达野生型的2.01 倍;而使用毕赤酵母低频密码子且自由能较低的α3、α4信号肽,其对应重组菌株的酶活力低于野生型,最低仅为野生型的41%。
