MRI多序列扫描诊断不同脑胶质瘤的影像特征及应用分析①
2023-05-09张勇
张 勇
(荥阳市人民医院医学影像科,河南 荥阳 450100)
胶质瘤是大脑最常见的原发肿瘤,分为低级别胶质瘤和高级别胶质瘤,与恶性程度相关。胶质瘤的分级对于治疗计划和评估预后至关重要,磁共振成像(MRI)是检测脑肿瘤的基本影像学手段[1,2]。T1加权(T1W)图像的对比度增强反映了血脑屏障(BBB)的破坏区域,因此可以用于脑肿瘤分级,而常规影像学方法在脑肿瘤诊断的临床应用有限且无特异性[3,4]。单一MRI方法的诊断敏感性和特异性差异很大,MRI模式结合可有助于实现更准确的胶质瘤分级。目前临床上脑胶质瘤的检查方法为采用MRI进行扫描诊断,多序列的MRI成像,对于诊断脑胶质瘤疾病具有很好的特异性[5]。本文将对MRI多序列扫描诊断不同脑胶质瘤的影像特征及应用进行分析,现报道如下。
1 资料与方法
1.1 一般资料
选取2018-06~2019-06本院神经外科手术且病理确诊为脑胶质瘤76例患者为研究对象,纳入标准:(1)所有患者均经过手术病理确诊为脑胶质瘤;(2)手术前和手术后均行MRI多序列扫描诊断;(3)磁共振影像、受访记录及临床资料完整。排除标准:(1)身体内带有支架、心脏起搏器、人造心脏瓣膜等;(2)手术前长期接收镇静、镇痛治疗的患者;(3)合并慢性病疼痛史、精神类疾病的患者;(4)临床资料及随访记录不完整的患者。本研究经所有患者及家属同意并签署知情同意书。所有患者术前行头颅MRI多序列扫描显示,低级别脑胶质瘤37例,高级别脑胶质瘤39例,男45例,女31例,年龄38~75岁,平均(46.5±8.2)岁,其中临床表现为视物模糊12例、恶心及呕吐19例、头痛27例、头晕9例、抽搐9例。
1.2 方法
设备采用美国GE公司生产1.5磁共振成像扫描,采用呼吸门控双反快速自回转波序列增强扫描,患者仰卧,头部先行进入,双耳采用专用耳罩,患者保持头部及上半身不动,本次扫描序列为MRI平扫(2DGRE T1 WI,DWI,TSE T2 WI,SWI)、3D VIBE(动脉期、静脉期、平衡期)。静脉期团注对比剂扎喷酸葡胺,采用流速2mL/s注射量为0.1mL/kg,注射生理盐水25mL;动脉期在注射对比剂后20s采用,静脉期60s后采集,平衡期在注射对比剂2min后采集,DWI图像参数TR 1700S,TE90ms,翻转90°,层厚6mm,矩阵FOV 120mm×192mm,扩散敏感因子b值分别为0和800s/mm2进行扫描。
1.3 观察指标
收集患者的诊断结果临床资料进行分析;对比低级别与高级别脑胶质瘤的信号、强化方式、ADC值等情况; 判断SWI序列对低级别、高级别脑胶质瘤出血灶检查率。
1.4 统计学方法
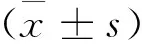
2 结果
2.1 受试者病理临床诊断结果资料比较
76例脑胶质瘤患者中星形细胞瘤54例,少枝胶质瘤12例,室管膜瘤5例,髓母细胞瘤5例;其中星形细胞高级别25例,低级别29例;少枝胶质瘤高级别7例,低级别5例;室管膜瘤高级别3例,低级别2例;髓母细胞瘤高级别4例,低级别1例,见表1。
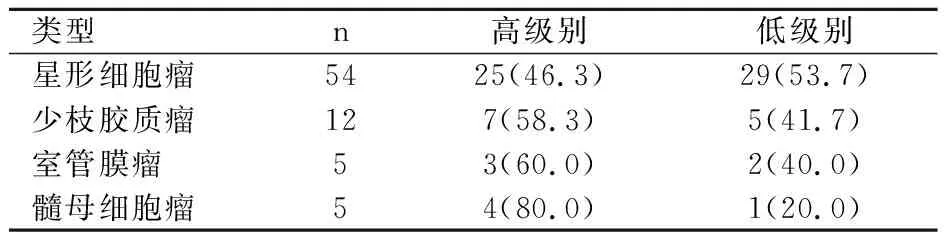
表1 76例患者的诊断资料比较[n(%)]
2.2 低级别与高级别脑胶质瘤的信号、强化方式、ADC值比较
胶质瘤实质部分主要表现长T1与T2信号,低级别与高级别脑胶质瘤在增强扫描实质部分的强化程度低级别表现为边缘强化,而高级别表现为节点强化,且低级别的ADC值高于高级别(P<0.05),见表2。

表2 低级别与高级别脑胶质瘤的信号、强化方式、ADC值等情况比较
2.3 SWI序列对低级别、高级别脑胶质瘤出血灶检出率比较
低级别脑胶质瘤37例患者中8例显示为出血灶;高级别脑胶质瘤患者39例患者中25例显示出血灶,SWI序列的低级别中2例显示点片状低信号,而高级别中12例显示点片状低信号,高级别脑胶质瘤SWI序列出血灶检出率明显高于低级别脑胶质瘤SWI序列出血灶检出率(χ2=5.899,P=0.016)。
3 讨论
胶质细胞为存在于人体中枢、周围神经系统的一类支持细胞,根据形态不同分为星形胶质细胞、少突胶质细胞核无突胶质细胞,具有支持与迁移神经元的作用,对异常神经系统具有修复作用,脑胶质瘤是发生在神经外胚层的常见肿瘤,起病缓慢[6]。研究显示放射因素、病毒感染、细菌感染和遗传等因素等为其发病机制,脑胶质瘤的治疗方案取决于患者临床症状及身体状态,最常用的检查手段为颅脑MRI,随着影像学技术不断提高,MRI有助于提高脑胶质瘤诊断率,高、低级别的脑胶质瘤在颅脑MRI检查的差异性不仅体现在周围水肿范围及钙化情况上,ADC值及SWI序列对高、低级别的脑胶质瘤的差异也具有很好的体现[7~9]。同行研究者显示颅脑磁共振在颅脑胶质瘤诊断中具有独特优势。本研究通过收集脑胶质瘤患者的影像学资料,并针对图像进行分析,结果显示:76例脑胶质瘤患者中星形细胞瘤54例,少枝胶质瘤12例,室管膜瘤5例,髓母细胞瘤5例;其中星形细胞高级别25例,低级别29例;少枝胶质瘤高级别7例,低级别5例;室管膜瘤高级别3例,低级别2例;髓母细胞瘤高级别4例,低级别1例;胶质瘤实质部分主要表现长T1与T2信号,低级别与高级别脑胶质瘤在增强扫描实质部分的强化程度低级别表现为边缘强化,而高级别表现为节点强化,且低级别患者ADC值高于高级别,分析其原因,由于DWI成像原理为水分子布朗运动原理,体现感兴趣区的水分子扩散能力,而ADC值是反映不同物质水分子的扩散运动的重要指标,因此脑胶质瘤的恶性程度与ADC值具有一定的关系[10~12]。本文显示随着肿瘤细胞结构的增加,ADC值会相应减小。另外,SWI是一种基于T2效应和被成像组织之间敏感性差异的MRI序列。SWI对于检测新生血管增多、出血和钙化等具有极高灵敏度,且已成为检测胶质瘤内部结构不可或缺的工具[13]。高级别脑胶质瘤SWI序列出血灶检出率明显高于低级别脑胶质瘤SWI序列出血灶检出率,由于SWI对于出血灶具有较高的敏感性和特异性,对于脑胶质瘤患者由于随着脑胶质瘤的出现生长会形成微血管,会对脑胶质瘤的内部结构造成一定影响。高级别的脑胶质瘤更易表现出血灶,刘安龙等[14]研究显示MRI多序列扫描对于脑胶质瘤的形态特点、部位及大小诊断中可发挥重要价值。
综上所述,MRI多序列扫描诊断不同脑胶质瘤的强化方式和ADC值具有显著的差异,进而评估脑胶质瘤的高、低级别,SWI对于出血灶具有较高的敏感性和特异性,可以为脑胶质瘤的诊断提供精确的评估,值得临床推广。
