基于Wnt/β-catenin信号通路探讨川芎提取物对慢性心力衰竭大鼠的干预作用Δ
2023-03-21黄冀娜保定市第二医院心血管内科河北保定073000
高 嘉,黄冀娜,李 珍(保定市第二医院心血管内科,河北 保定 073000)
慢性心力衰竭(chronic heart failur,CHF)是由于心肌梗死、心肌病、血流动力学负荷过重及炎症等原因引起的心肌损伤,患者临床表现主要为活动或生气时出现呼吸困难,还会出现消化不良、腹胀等症状[1-2]。川芎提取物是伞形科植物川芎根茎的提取物,可以抑制炎症反应、调控细胞凋亡、改善血管收缩功能,治疗心力衰竭[3-4]。Wnt信号通路可促进核内恶性肿瘤相关基因转录调节分子,其功能最常见于胚胎发育和恶性肿瘤,决定细胞的分化命运。Wnt/β-catenin信号通路也参与心脏重要的生物学进程,心脏受损后,Wnt/β-catenin信号促进心脏成纤维细胞的纤维化、瘢痕形成和有害心肌扩张[5-6]。本研究将通过诱导大鼠CHF模型,探讨川芎提取物对CHF大鼠的干预作用,并探究Wnt/β-catenin信号通路的变化,为临床使用川芎提取物治疗及辅助治疗CHF提供分子基础和依据。
1 材料
1.1 动物
雄性8~10周龄SPF级SD大鼠,购于北京维通利华实验动物中心。
1.2 仪器
Leica RM2015型切片机(德国Leica公司);-80 ℃超低温保存箱(美国Thermo公司);4 ℃冰箱(合肥美菱股份有限公司);SC-3610型低速离心机(安徽中科中佳科学仪器有限公司);Western blot电泳仪(美国BIO-RAD公司)。
1.3 药品与试剂
川芎提取物购自广州朋远化工有限公司(批号:20150412,-20 ℃避光保存,使用时用2%吐温80先溶解,再用0.9%氯化钠溶液稀释,终浓度为5 mg/mL;戊巴比妥钠(批号:020919)购自天津市申泰化学试剂有限公司;苏木精(批号:H9627)、伊红(批号:861006)购于美国Sigma公司;去水平段极性蛋白3(Dvl3)抗体 (ab76081)、糖原合成酶激酶-3(GSKβ)抗体 (ab185141)、β-连环蛋白(β-catenin)抗体(ab32572)和二抗(ab150113)购于美国Abcam公司。
2 方法
2.1 大鼠分组及饲养条件
8~10周龄雄性SD大鼠于SPF级鼠房饲养,室温调节在(25±2)℃,相对湿度40%~65%,12 h/12 h昼夜交替照明,自由摄取食物和饮用水,适应性饲养1周后造模。
2.2 大鼠CHF模型的建立
大鼠称重后按10%水合氯醛0.4 mL/100 g行腹腔注射麻醉,将大鼠以背位固定于鼠板上,气管插管后将针形心电图导联电极刺入大鼠四肢,观察并记录心电图,暴露左侧胸腔,于左侧第3—4肋间开胸,逐层分离筋膜、肌肉,打开大鼠胸膜,挤压大鼠右侧胸腔,托举心脏,钝性撕开心包膜,于距离左冠状动脉前降支起点2 mm处用缝线结扎前降支,并予以利多卡因注射液0.1 mL防止发生室性心律失常。结扎结束后缝合,观测心电图可见ST段明显抬高,说明结扎成功。造模后半量饲料饥饿喂养,并对大鼠进行每日力竭式游泳1次[7]。
2.3 大鼠分组及给药
随机选择CHF大鼠20只,分为模型组和实验组。取10只未造模大鼠作为对照组。实验组大鼠使用川芎提取物(100 mg/kg)干预,1日1次,连续干预4周。对照组和模型组大鼠分别给予等量0.9%氯化钠溶液灌胃。
2.4 大鼠心脏苏木精-伊红(HE)染色
取出各组大鼠心脏后,对组织进行包埋后切片,进行脱蜡覆水,以苏木精染色5 min,5%乙酸1 min,伊红染色1 min,脱水:70%、80%、90%和100%酒精各10 s,二甲苯1 min,通风橱自然晾干再封片,于显微镜下进行检查[8]。
2.5 大鼠心肌组织超微结构观察
取各组大鼠左室心尖心脏组织,置于4%戊二醛固定液中,固定后用磷酸盐缓冲液(PBS)清洗2次,1%锇酸固定,PBS清洗2次,脱水,包埋后制备心肌超薄切片,厚度50 nm,采用枸橼酸铅-醋酸铀双重染色后,经透射电镜观察大鼠心肌组织超微结构[9]。
2.6 大鼠实验终点心率及呼吸频率检测
实验终点采用大/小鼠脉搏血氧呼吸监护仪对各组大鼠心率及呼吸频率进行检测。测量时,保持室温在22~26 ℃,每次测量前,打开大鼠固定装置的电源开关,预热15~20 min,达到设定温度时加热灯泡自动熄灭,温度下降时灯泡自动开启,维持加热板在39~40 ℃;将待测大鼠放入预热箱中固定,露出尾部,安装袖带及光电容积搏动传感器,检测心率。呼吸频率采用注射麻醉,仰卧固定,记录呼吸频率。
2.7 大鼠实验终点大鼠左心室舒张末期内径(LVIDd)、左心室收缩末期内径(LVIDs)、左心室射血分数(LVEF)和左心室缩短分数(LVFS)检测
大鼠麻醉采用5%戊巴比妥钠(以0.9%氯化钠溶液溶解过滤)麻醉 4 min后立即检测;检测:通过M型超声心功能的测定仪检测大鼠LVIDd、LVIDs、LVEF和LVFS。
2.8 蛋白质印迹法检测大鼠心脏组织Dvl3、GSKβ和β-catenin蛋白的表达
对各组大鼠心脏进行研磨,采用RIPA蛋白裂解液心脏细胞总蛋白,进行SDS-PAGE电泳,80 V、15 min,120 V、2 h,聚偏二氟乙烯(PVDF)膜转模120 V、2.5 h,TBST漂洗3次(每次10 min),使用5%脱脂奶粉封闭,TBST漂洗3次(每次10 min),加入一抗,二抗温孵育后,TBST漂洗3次(每次10 min),超敏化学发光液显色,发光仪曝光、拍照[10-11]。
2.9 统计学方法
3 结果
3.1 CHF大鼠造模前后心电图变化情况
大鼠CHF造模前心电图表现为P波及PR间期明显,R波降支与T波相交;大鼠CHF大鼠造模后心电图显示T波低平或倒置明显,ST段较术前明显抬高或下降(绝对值≥0.1 mV),见图1。
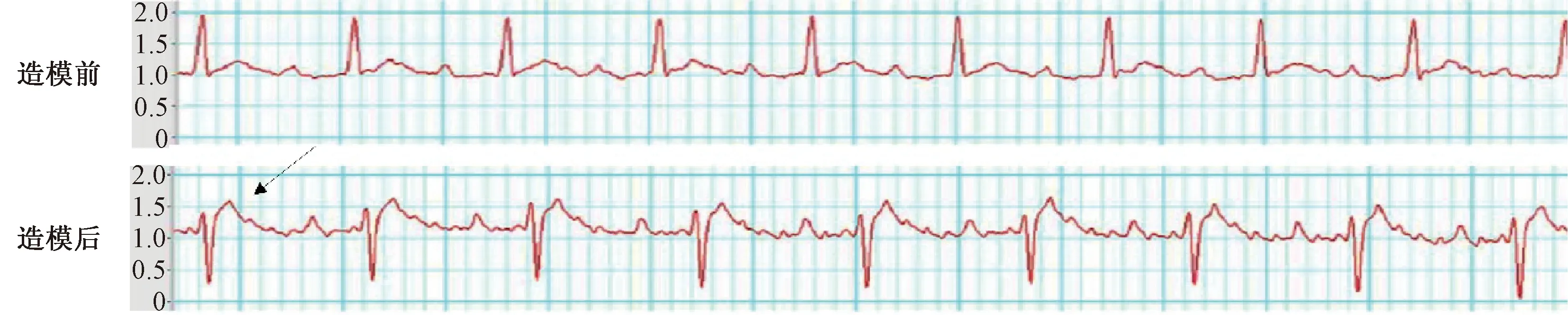
图1 CHF大鼠造模前后心电图比较Fig 1 Comparison of ECG in rats with chronic heart failure before and after modeling
3.2 CHF大鼠心脏HE染色比较
对照组大鼠心脏组织切片排列有序、细胞规则,心脏结构完整,未见明显细胞损伤;模型组大鼠细胞肿胀,心脏细胞边界不清晰,模糊,心肌细胞受损伤严重;实验组大鼠心脏损伤相对于模型组有明显改善,见图2。
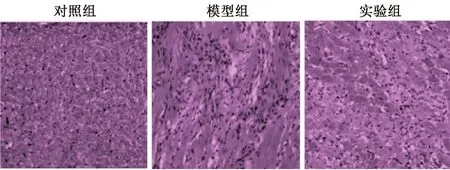
图2 各组大鼠心脏HE染色情况比较(×200)Fig 2 Comparison of HE staining in heart of rats in each group (×200)
3.3 CHF大鼠心脏超微结构比较
对照组大鼠心肌细胞排列整齐,胞核及胞膜清晰,明暗带界限清,线粒体膜结构清晰,数量丰富,基质排列紧密,线粒体内脊形态清晰可见,同时糖原颗粒完整,整体上细胞间质也无水肿;模型组大鼠心肌排列紊乱,纤维断裂、消失,细胞间质出现水肿,线粒体数量减少且肿胀,线粒体内脊紊乱甚至消失;实验组大鼠心肌纤维结构较模型组均有改善,水肿有所减轻,糖原数量有所增加,线粒体空泡化相比与模型组有所改善,见图3。

图3 各组大鼠心脏超微结构比较(×10 000)Fig 3 Comparison of cardiac ultrastructure of rats in each group(×10 000)
3.4 各组大鼠实验终点心率及呼吸频率比较
模型组大鼠的心率和呼吸频率显著高于对照组,实验组大鼠的心率和呼吸频率显著低于模型组,差异均有统计学意义(P<0.05),见表1。

表1 各组大鼠实验终点心率及呼吸频率比较次/min)Tab 1 Comparison of heart rate and respiratory rate of rats in each group at the end of experiment
3.5 各组大鼠实验终点LVIDd、LVIDs、LVEF和LVFS水平比较
模型组大鼠的LVIDd、LVIDs显著高于对照组,LVEF、LVFS显著低于对照组;实验组大鼠的LVIDd、LVIDs显著低于模型组,LVEF、LVFS显著高于模型组,差异均有统计学意义(P<0.05),见表2。

表2 各组大鼠实验终点LVIDd、LVIDs、LVEF和LVFS水平比较Tab 2 Comparison of LVIDd、LVIDs、LVEF、LVFS in each group at the end of experiment
3.6 各组大鼠心脏组织Dvl3、GSKβ及β-catenin蛋白表达水平比较
与对照组相比,模型组大鼠Dvl3、GSKβ和β-catenin表达水平有上升趋势;实验组大鼠Dvl3、β-catenin显著高于对照组,而实验组相比于模型组有显著下降趋势,差异有统计学意义(P<0.05),见图4。

*P<0.05,**P<0.01;*P<0.05,**P<0.01图4 各组大鼠心脏组织Dvl3、GSKβ及β-catenin的蛋白表达水平Fig 4 Protein expression levels of Dvl3, GSKβ and β-catenin in heart tissues of rats in each group
4 讨论
CHF指持续存在的心力衰竭状态,是各种病因所致心脏疾病的终末阶段,其主要特点为呼吸困难、水肿和乏力,一般均有代偿性心脏扩大或肥厚及其他代偿机制参与,常伴有静脉压升高导致的器官充血性病理改变,可有心房、心室附壁血栓和静脉血栓形成,均可造成心肌结构和功能的变化,最后导致心室泵血和充盈功能低下[12-13]。川芎常用于活血行气、祛风止痛,其提取物成分主要为川芎嗪、黑麦草碱、川哚、藁本内酯和洋川芎醌等,具有辛散、解郁、通达及止痛等功能[14]。本研究通过结扎左冠状动脉前降支和竭力式游泳建立大鼠CHF模型,并给予大鼠川芎提取物干预,探究川芎提取物对大鼠心力衰竭的干预作用。结果表明,川芎提取物可以显著降低大鼠心脏组织的损伤,提高心肌组织线粒体结构的恢复。线粒体占心肌细胞中体积的35%~40%,心肌活动所需95%的腺苷三磷酸(ATP)均由线粒体产生。本研究结果提示,川芎提取物可以逆转线粒体受损,促进维持线粒体正常功能,进而部分恢复受损的心脏功能。本研究还发现,川芎提取物可以降低CHF引发的呼吸急促,缓解心率增快的病症,稳定大鼠的心肺功能。本研究通过进一步比较LVIDd、LVIDs、LVEF和LVFS水平,证实了川芎提取物能够改善大鼠心肌细胞收缩功能,起到恢复心脏功能、降低心脏损伤的作用。
Wnt/β-catetin信号通路是经典的Wnt信号通路,在进化过程中高度保守。Wnt/β-catetin由Wnt1、Wnt3、Wnt3a、Wnt7a和Wnt8激活,并参与转化。Wnt信号可通过上调Caspase抑制剂Survivin等抗凋亡蛋白来阻止细胞凋亡,并通过上调血管内皮生长因子来刺激血管生成。一些能够降解细胞外基质的蛋白酶,如供应基质裂解蛋白、基质金属蛋白酶(MMP)7和MMP26,以及细胞黏附分子,如CD44和NrCAM,都是Wnt的靶基因,并且可以促进肿瘤的侵袭和转移。心脏受损后,Wnt/β-catenin信号同时参与心脏成纤维细胞的纤维化、瘢痕形成和有害心肌扩张,同时Wnt信号通路参与心肌梗死后心肌组织愈合过程的调控,参与心脏发育和心肌诱导分化等重要过程[15-16]。本研究结果表明,CHF大鼠的Wnt/β-catenin信号通路关键分子Dvl3、GSKβ和β-catenin表达水平显著升高,而川芎提取物干预后,Dvl3、GSKβ和β-catenin表达水平显著降低;同时,川芎提取物干预后Dvl3、β-catenin水平仍高于对照组,而GSKβ水平与对照组的差异无统计学意义(P>0.05),提示川芎提取物对Dvl3、β-catenin的调控作用弱于对GSKβ的调控作用。GSKβ是进化上非常保守的丝氨酸/苏氨酸激酶,可以使磷酸基团加到β-catenin氨基端的丝氨酸/苏氨酸残基上,磷酸化的β-catenin被蛋白酶体降解,从而导致β-catenin表达水平降低。总体上,本研究推测,川芎提取物可以逆转CHF引发的Wnt/β-catenin激活,从而起到心脏保护作用。
综上所述,川芎提取物对CHF大鼠的心脏有保护作用,其作用机制与Wnt/catanin信号通路的抑制有关。
