基于DNA甲基化测序技术研究青蒿琥酯干预脑胶质瘤的分子机制
2023-03-21闫向英KojiMizunoKatsukiOkuyama张彦琼TakashiSato
闫向英,毛 霞#,李 涛,Koji Mizuno,Katsuki Okuyama,林 娜,张彦琼*,Takashi Sato*
• 药理与临床 •
基于DNA甲基化测序技术研究青蒿琥酯干预脑胶质瘤的分子机制
闫向英1,毛 霞1#,李 涛1,Koji Mizuno2,Katsuki Okuyama2,林 娜1,张彦琼1*,Takashi Sato2*
1. 中国中医科学院中药研究所,北京 100700 2. 东京药科大学 生物化学系,东京 192-0392
探究青蒿琥酯干预胶质母细胞瘤(glioblastoma,GBM)的药效及其潜在分子机制。采用Cell Titer-Blue检测青蒿琥酯对U87和U251 2种人源胶质母细胞瘤细胞活性和增殖的影响;流式细胞术检测青蒿琥酯对2种细胞周期的调节作用;采用qRT-PCR和Western blotting检测青蒿琥酯对2种细胞自噬水平的影响。采用DNA甲基化联合网络药理学从表观遗传学层面研究青蒿琥酯干预GBM的靶标基因,并建立蛋白质-蛋白质相互作用网络,通过计算网络中各节点的网络拓扑特征值,筛选出青蒿琥酯干预GBM的核心靶点并进行生物功能富集分析;采用AutoDock v4.2.6和AutoDock Vina v1.2.0软件开展分子对接虚拟计算,考察青蒿琥酯与其候选关键靶点的结合能力,并采用Western blotting验证青蒿琥酯对2种脑胶质瘤细胞中关键靶点表达的影响。青蒿琥酯可显著抑制U87细胞的活性和增殖(<0.05、0.01、0.001),而对U251细胞的药效不显著;高剂量青蒿琥酯可影响2种细胞周期分布;高剂量青蒿琥酯可显著提高U87细胞中3种自噬标志分子[自噬关键分子酵母Atg6同系物(ATG6 autophagy related 6 homolog,)、泛素结合蛋白(ubiquitin-binding protein,)、微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,)]的mRNA表达水平(<0.001),而仅高剂量青蒿琥酯升高U251细胞中的mRNA表达水平(<0.05);低、中、高剂量青蒿琥酯可显著提高U87细胞中Beclin1、p62、LC3B蛋白表达水平(<0.05、0.01),仅中、高剂量青蒿琥酯可以影响U251细胞中Beclin1、p62、LC3B蛋白表达。利用给药前后的U87与U251细胞进行DNA甲基化测序与网络药理学整合分析,在获得青蒿琥酯敏感型和耐药型脑胶质瘤细胞的差异基因集,以及青蒿琥酯干预2种细胞效应基因集的基础上,发现其干预2类脑胶质瘤细胞的关键网络靶标共同参与GBM恶性进展密切相关的血小板衍生生长因子受体α(platelet derived growth factor receptor α,PDGFRA)-大鼠肉瘤基因(rat sarcoma viral oncogene homolog,RAS)-B-Raf原癌基因(B-Raf proto-oncogene,BRAF)-丝裂原活化蛋白激酶激酶(mitogen-activated protein kinase kinase,MEK)-细胞外信号调节激酶(extracellular signal regulated kinase,ERK)通路,且青蒿琥酯与其直接靶标(PDGFRA、BRAF)具有较强的亲和力。Western blotting实验证实青蒿琥酯可以抑制U87和U251细胞中关键靶点PDGFRA和BRAF蛋白的表达(<0.05、0.01、0.001)。青蒿琥酯可能通过靶向调控PDGFRA-RAS-BRAF-MEK-ERK信号通路,从而抑制GBM细胞的生长和扩散,为青蒿琥酯治疗GBM提供了体外实验依据,也为解决临床抗肿瘤药物的耐药问题提供了新思路和新方法。
青蒿琥酯;胶质母细胞瘤;DNA甲基化分析;耐药;PDGFRA-RAS-BRAF-MEK-ERK信号通路
胶质瘤是最常见的恶性原发性脑肿瘤,其中胶质母细胞瘤(glioblastoma,GBM)是最普遍及侵袭性最强的一类形式。研究表明,全球每10万人就有0.59~3.69人患病[1],中位生存期仅有15个月[2]。目前标准治疗方式主要是手术及放疗或化疗,同时口服替莫唑胺。然而替莫唑胺治疗受到获得性化学抗性的限制,并不能很好地控制脑胶质瘤的转移,5年生存率低于5.5%[3]。因此,开发GBM的新疗法成为现代神经科学和肿瘤学最首要的任务之一。
青蒿琥酯是青蒿素的衍生物,可以抑制多种肿瘤细胞的增殖、迁移和侵袭[4]。已有研究证实,青蒿琥酯具有治疗GBM的潜能[5-6],但对于抗GBM的机制研究尚不充分。随着对表观遗传学的深入研究,DNA甲基化测序技术也逐渐成熟并被运用到研究多种疾病进展的分析中。研究表明,DNA甲基化在维持细胞功能、遗传印记、胚胎发育以及人类肿瘤的发生中起着重要作用。截至目前,大多数关于GBM表观遗传改变的研究都指出了DNA甲基化的作用,如全基因组低甲基化、基因特异性低甲基化和高甲基化[7]。此外,关于GBM的表观遗传学研究发现,表观遗传学修饰与其生物学特征和治疗靶点相关[8]。基因启动子甲基化等遗传生物标志物是GBM患者重要的预后影响因素,被认为是患者治疗和预后的重要靶点[9]。因此,本研究基于给予青蒿琥酯前后人脑星形胶质母细胞瘤U87细胞和人胶质瘤U251细胞2种细胞模型,进行药效观察和细胞功能实验,结合DNA甲基化和网络药理学分析,从表观遗传学层面探讨青蒿琥酯干预GBM的分子机制,为GBM的治疗提供新思路。
1 材料
1.1 细胞
U87细胞(批号CL-0238)、U251细胞(批号CL-0237)购自武汉普诺赛生命科技有限公司。
1.2 药品与试剂
青蒿琥酯(批号1042850);替莫唑胺(批号PHR1437-1G)购自美国Sigma公司;CellTiter-Blue®试剂(批号G8080)购自美国Promega公司;PBS(批号SH30256.01)、DMEM高糖培养基(批号8122292)、双抗(批号SV30010)购自美国Hyclone公司;胎牛血清(fetal bovine serum,FBS,批号16000-044)购自美国Gibco公司;DNA含量检测试剂盒(批号CA1510)购自北京索莱宝科技有限公司;Trizol试剂(批号10296028)、逆转录试剂盒(批号K1691)购自Invitrogen公司;自噬关键分子酵母Atg6同系物(ATG6 autophagy related 6 homolog,Beclin1)兔单克隆抗体(批号A21191)、微管相关蛋白1轻链3B(microtubule-associated protein 1 light chain 3B,LC3B)兔单克隆抗体(批号A19665)、泛素结合蛋白(ubiquitin-binding protein,p62)兔单克隆抗体(批号A19700)、血小板衍生生长因子受体α(platelet derived growth factor receptor α,PDGFRA)兔单克隆抗体(批号A2103)、B-Raf原癌基因(B-Raf proto-oncogene,BRAF)兔单克隆抗体(批号A21612)购自ABclonal公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号60004-1-IG)、山羊抗小鼠IgG多克隆抗体(批号SA00001-1)购自Proteintech公司;山羊抗兔IgG多克隆抗体(批号7074S)购自美国CST公司;DNeasy组织试剂盒(批号69506)购自Qiagen公司;EZ DNA甲基化试剂盒(批号D5001/D5003)购自Zymo Research。
1.3 仪器
5840R型低温离心机(德国Eppendorf公司);Multiskan GO全波长酶标仪、ND-2000型Nanodrop超微量分光光度计、3.0 Quibt Fluorometer荧光定量仪(美国Thermo Fisher Scientific公司);NovoCyte流式细胞仪(美国Agilent公司)。
2 方法
2.1 细胞培养
U87细胞和U251细胞用含10% FBS、1%双抗的DMEM高糖培养基,于5% CO2、37 ℃的培养箱中培养,于对数生长期传代备用。
2.2 Cell Titer-Blue检测青蒿琥酯对细胞活性和增殖的影响
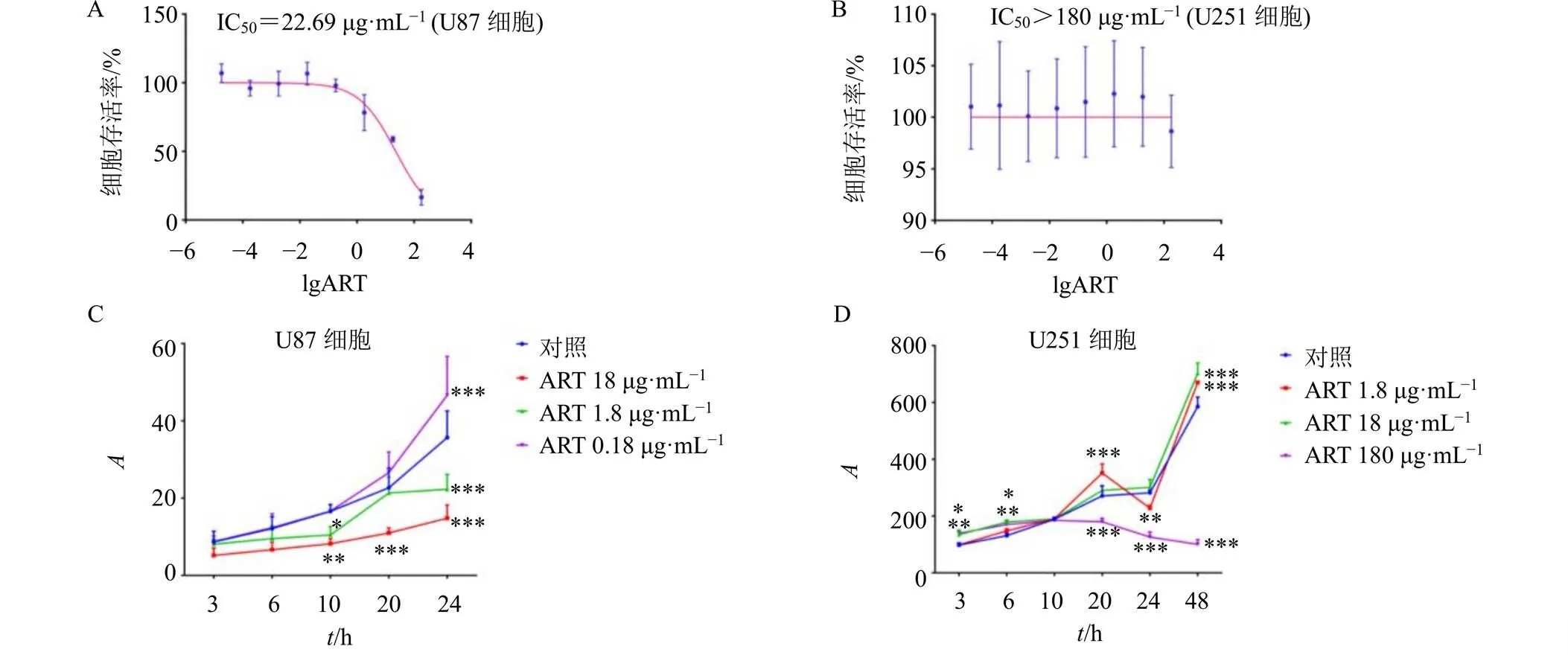
取对数生长期的细胞以5×103个/孔接种于96孔板,培养24 h后,给药组加入200 μL含药培养基(分别含0.000 018、0.000 18、0.001 8、0.018、0.18、1.8、18、180 μg/mL青蒿琥酯),对照组加入等体积培养基,并设置不含细胞的空白孔,每组设置6个复孔。培养24 h后,每孔加入20 μL Cell Titer-Blue试剂,于37 ℃、5% CO2培养箱中孵育2 h,于560 nm/590 nm处测定吸光度()值,计算细胞存活率,探索药物的半数抑制浓度(half inhibitory concentration,IC50)。
细胞存活率=(给药-空白)/(对照-空白)
取对数生长期的细胞以5×103个/孔接种于96孔板,培养24 h后,U87细胞给药组加入200 μL含药培养基(分别含0.18、1.8、18 μg/mL青蒿琥酯),对照组加入等体积培养基,每组设置6个复孔。分别在培养3、6、10、20、24 h后,每孔加入20 μL Cell Titer-Blue试剂,于37 ℃、5% CO2培养箱中孵育2 h,于560 nm/590 nm处测定值。U251细胞给药组加入200 μL含药培养基(分别含1.8、18、180 μg/mL青蒿琥酯),对照组加入等量培养基,每组设置6个复孔。分别在培养3、6、10、20、24、48 h后测定值。
2.3 流式细胞术检测青蒿琥酯对细胞周期的影响
取对数生长期的细胞以1×105个/孔接种于6孔板,培养24 h后,对照组加入完全培养基,U87细胞给药组加入22.69 μg/mL青蒿琥酯,U251细胞给药组加入180 μg/mL青蒿琥酯。处理细胞24 h后,弃去培养基,用胰酶消化细胞,离心弃去上清。PBS清洗细胞2遍,加入70%乙醇固定细胞,4 ℃过夜;离心并弃去上清,加入1 mL PBS重悬细胞,1000 r/min离心5 min,PBS清洗细胞,加入细胞周期染色工作液,37 ℃避光孵育30 min后,采用流式细胞仪进行细胞周期检测,结果用Flow jo v9软件进行分析。
2.4 qRT-PCR检测青蒿琥酯对细胞自噬相关基因表达的影响
取对数生长期的细胞以1×105个/孔接种于6孔板,培养24 h后,对照组加入完全培养基,U87细胞和U251细胞给药组加入180 μg/mL青蒿琥酯。处理细胞24 h后,用Trizol试剂提取U87和U251细胞的总RNA,对其定量,并按照逆转录试剂盒,将适量RNA逆转录为cDNA,以此为模板进行扩增,进行qRT-PCR分析,引物序列见表1。
2.5 Western blotting检测青蒿琥酯对细胞自噬及通路相关蛋白表达的影响
取对数生长期的细胞以1×105个/孔接种于6孔板,培养24 h后,对照组加入完全培养基,U87细胞给药组分别加入11.35、22.69、45.38 μg/mL青蒿琥酯,阳性对照组加入100 μg/mL替莫唑胺;U251细胞给药组分别加入90、180、360 μg/mL青蒿琥酯,阳性对照组加入250 μg/mL替莫唑胺。处理细胞24 h后,置于冰上裂解提取蛋白,采用BCA法测定蛋白浓度,蛋白变性后,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,封闭后分别加入Beclin1(1∶2000)、LC3B(1∶2000)、p62(1∶2000)、PDGFRA(1∶2000)、BRAF(1∶2000)和GAPDH(1∶5000)抗体,4 ℃孵育过夜;洗涤后加入二抗(1∶5000),室温孵育30 min,洗涤后进行化学发光和成像,检测目标条带,采用Image J软件对蛋白进行定量分析。

表1 引物序列
2.6 甲基化测序与分析
采用DNeasy组织试剂盒从细胞中分离DNA。采用Nanodrop超微量分光光度计和Quibt Fluorometer荧光定量仪测定DNA的纯度和浓度。使用EZ DNA甲基化试剂盒将每个样品的500 ng DNA进行亚硫酸氢盐转换,委托北京致美伊诺生物科技有限公司测序。原始数据在R v3.5.2软件中使用ChAMP v2.16.0包进行分析,用β值表示DNA甲基化水平和各CpG位点的甲基化比例。使BMIQ对β值矩阵进行归一化,调整I型和II型探针偏置;使用SVA v3.34.0分析芯片间和芯片上样本位置不同产生的批间差,使用Combat算法对批间差进行校正。非配对样本使用ChAMP v2.16.0包的champ. DMP函数进行差异甲基化位点DMP分析,配对样本使用等方差双尾配对检验。对于计算结果的值,使用Benjamini & Hochberg法进行多重假设检验,减少假阳性。差异分析结果(adj.<0.05、|∆β|≥0.2或adj.<0.01、|∆β|≥0.06)以火山图和热图展示。差异基因功能富集分析通过京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)数据库进行。
2.7 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络的构建与核心靶点的筛选
选取启动子区域甲基化数据,根据<0.05筛选U87(青蒿琥酯敏感型)和U251(青蒿琥酯耐药型)胶质母细胞瘤细胞的差异甲基化基因;根据adj.<0.01、|∆β|≥0.81筛选U87和U251胶质母细胞瘤细胞给予青蒿琥酯前后的差异甲基化基因。运用STRING v10.0软件构建PPI网络,运用Cyto Hubba v0.1计算PPI网络中各节点的网络拓扑特征值包括度值、最大集团中心、介数中心性和接近中心性,筛选4者均大于相应中位数的节点为核心靶点。
2.8 核心靶点的功能富集分析
利用DAVID v6.8对关键网络靶点进行基因本体(gene ontology,GO)生物过程和KEGG信号通路富集分析(<0.05),研究关键网络靶点参与的生物过程并筛选青蒿琥酯干预脑胶质瘤相关的信号通路。
2.9 分子对接
从PDB蛋白质数据库获取PDGFRA(ID:5K5X)和BRAF(ID:7MOX)的pdb格式文件,使用AutoDock v4.2.6对2个蛋白进行去水、加氢处理。从TCMSP数据库下载青蒿琥酯的mol2格式文件,利用AutoDock v4.2.6和AutoDock Vina v1.2.0进行对接,计算结合能。使用Pymol v2.5进行结果可视化。
2.10 统计学分析

3 结果
3.1 青蒿琥酯对U87细胞的抑制作用强于U251细胞
如图1所示,给药24 h后,青蒿琥酯对U87细胞的IC50为22.69 μg/mL,而对U251细胞的IC50则大于180 μg/mL。与对照组比较,18 μg/mL的青蒿琥酯在给药10~24 h后,对U87细胞增殖有显著抑制作用(<0.01、0.001);而180 μg/mL的青蒿琥酯在给药10 h后,可抑制U251细胞增殖(<0.001)。细胞活性和增殖实验结果显示,青蒿琥酯可抑制2种GBM细胞,与U251细胞相比,青蒿琥酯对U87细胞更为敏感。
3.2 青蒿琥酯可阻滞U87和U251细胞周期
如图2所示,与对照组比较,22.69 μg/mL青蒿琥酯处理后,U87细胞的G2/M期的细胞数量增加6.2%;180 μg/mL青蒿琥酯处理后,U251细胞的S期和G2/M期细胞数量均增加,且S期细胞数量增加具有显著性差异(<0.05)。表明青蒿琥酯可抑制U87细胞的G2/M期,以及U251细胞的S期和G2/M期。相比于U251细胞,较低剂量的青蒿琥酯更能将U87细胞阻滞在G2/M期,通过阻止细胞快速增长来抑制GBM细胞的活性。
ART-青蒿琥酯 与对照组比较:*P<0.05 **P<0.01 ***P<0.001,下图同
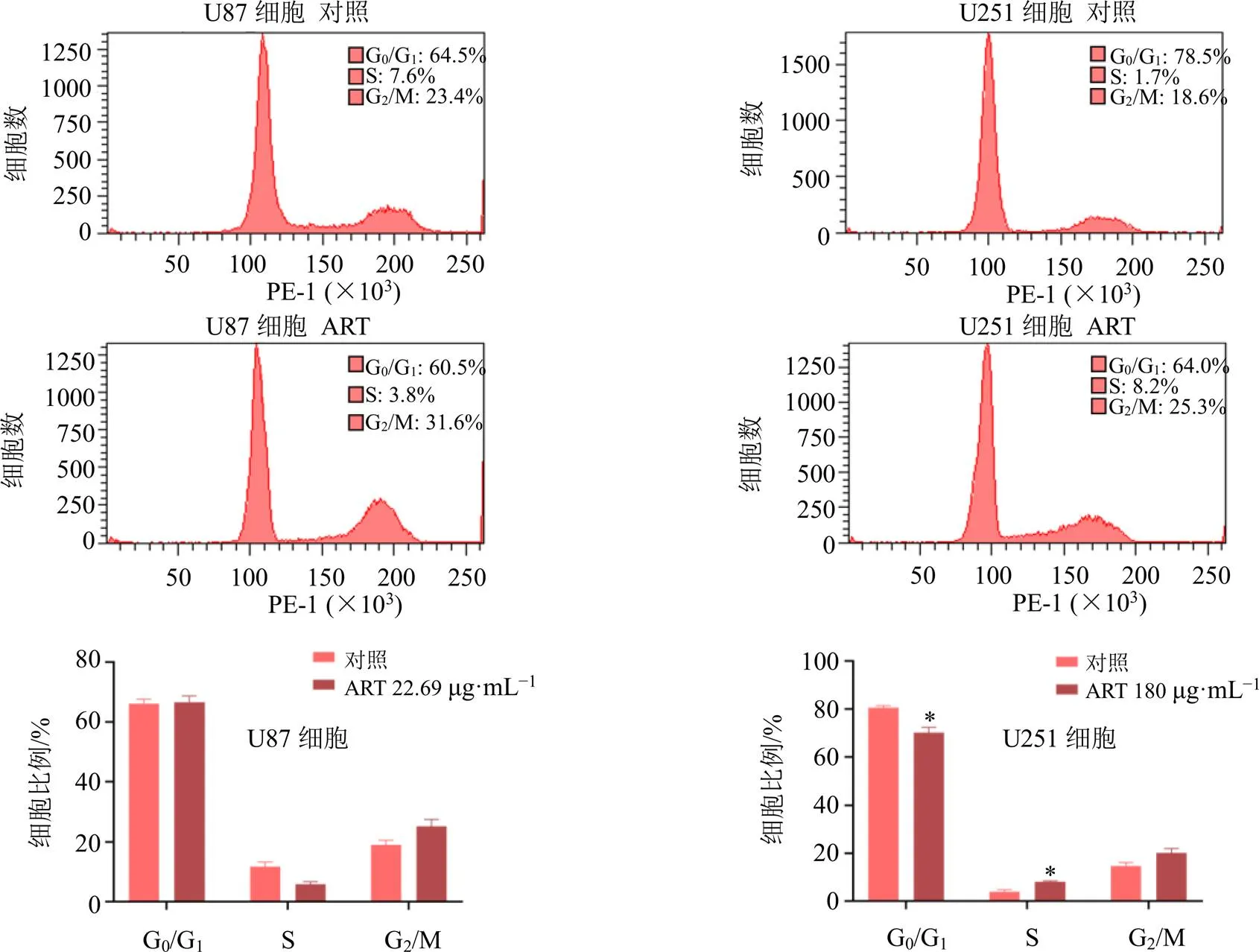
图2 青蒿琥酯对U87和U251细胞周期的影响(, n = 4)
3.3 青蒿琥酯可促进U87和U251细胞的自噬
采用qRT-PCR检测经180 μg/mL青蒿琥酯处理后U87和U251细胞的自噬标志分子(、、)mRNA表达水平,如图3-A所示,180 μg/mL青蒿琥酯处理后,U87细胞中、、mRNA表达水平均显著升高(<0.001),而U251细胞中仅mRNA表达增加(<0.05)。Western blotting结果(图3-B)显示,11.35 μg/mL的青蒿琥酯显著升高U87细胞中LC3B蛋白表达水平(<0.05),22.69 μg/mL的青蒿琥酯显著升高U87细胞中Beclin1蛋白表达水平(<0.05),45.38 μg/mL的青蒿琥酯显著升高U87细胞中p62蛋白表达水平(<0.05),180、360 μg/mL的青蒿琥酯可使U251细胞中Beclin1、p62、LC3B蛋白表达趋势升高,但无显著性差异。
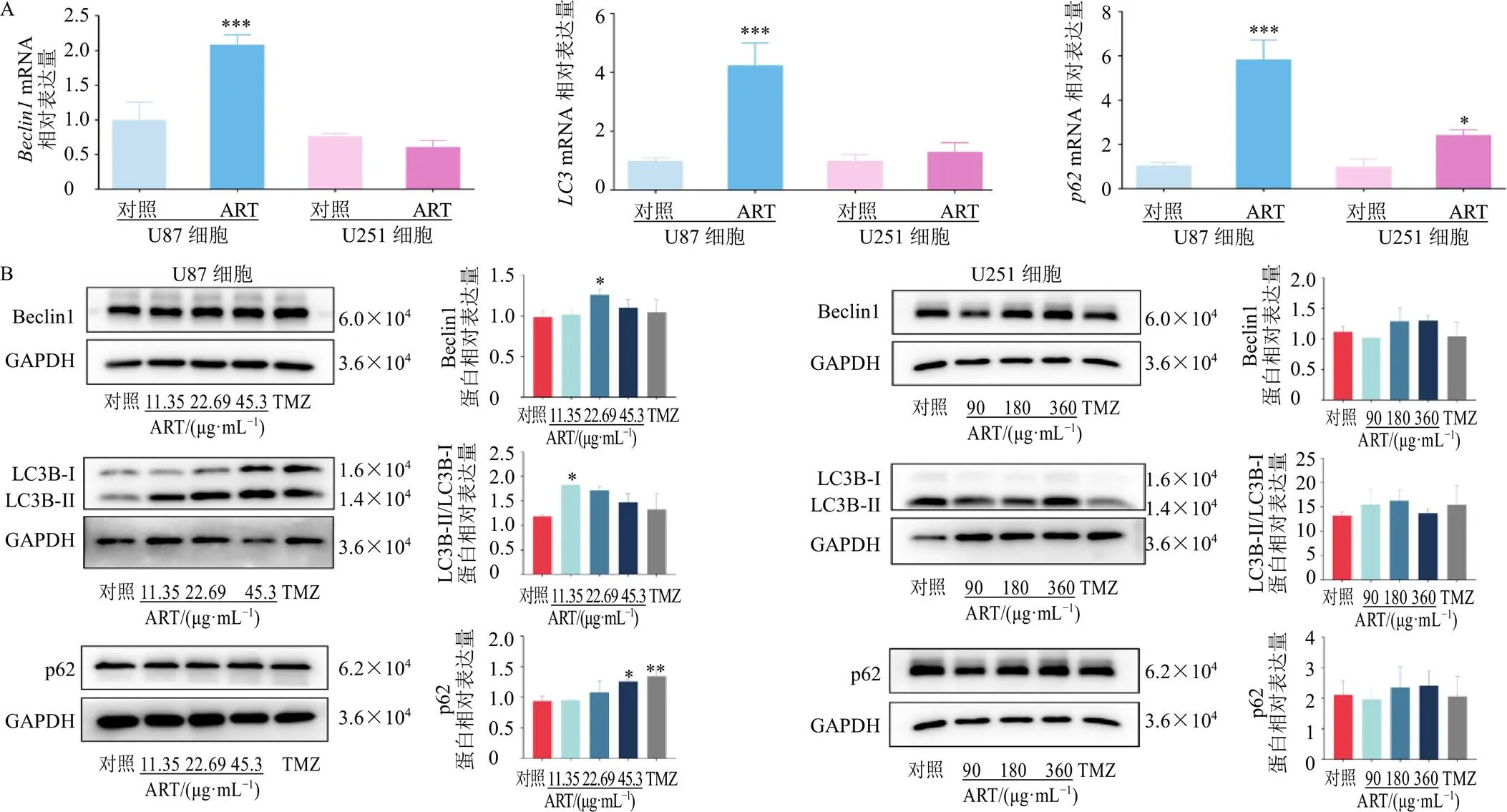
TMZ-替莫唑胺,图7同
3.4 甲基化和去甲基化基因分布
前期的药效和细胞功能实验结果显示,青蒿琥酯对U87细胞较为敏感,而对U251细胞耐药,为了探究青蒿琥酯在治疗GBM中发挥药效的机制以及产生耐药的原因,本研究将给药前后的U87与U251细胞进行甲基化测序与分析,选取启动子区域进行甲基化数据分析。筛选U87和U251 2种细胞的差异基因数(U87U251),得到“U87与U251细胞差异基因集”;筛选2种细胞给予青蒿琥酯前后的差异基因数(U87U87-ART、U251U251-ART),得到“青蒿琥酯干预U87细胞效应基因集”以及“青蒿琥酯干预U251细胞效应基因集”。如图4所示,U87U251中共有226 058个差异基因,其中包括61 891个甲基化基因和164 167个去甲基化基因;U87U87-ART中共有3345个差异基因,其中包括3294个甲基化基因和51个去甲基化基因;U251U251-ART中共有420个差异基因,其中包括243个甲基化基因和177个去甲基化基因。
通过对各组的差异基因进行功能富集,选取富集度最高的前10个通路进行功能模块富集,主要富集到6大功能模块。包括代谢、遗传信息、环境信息、细胞过程、有机系统以及人类疾病。其中U87U251主要富集到了代谢(包括药物代谢-细胞色素P450信号通路)和细胞功能、人类疾病[包括癌症相关、表皮生长因子受体(epidermal growth factor receptor,EGFR)相关信号通路]功能模块;U87U87-ART主要富集到了代谢、环境信息(细胞外基质-受体相互作用信号通路)、细胞功能(自噬、黏着连接信号通路)、有机系统等功能模块;U251U251-ART主要富集到了代谢、遗传信息(基因复制、同源重组信号通路)、细胞功能(细胞凋亡相关信号通路)等功能模块。根据以上信息,初步表明青蒿琥酯具有干预GBM的潜能。
3.5 青蒿琥酯干预GBM的核心靶点筛选
3.5.1 差异基因筛选 选取启动子区域甲基化数据,根据adj.和∆β,筛选青蒿琥酯干预GBM效应基因以及青蒿琥酯敏感型和耐药型细胞系差异基因。U87U251中共有1881个差异基因,其中包含893个甲基化基因和988个去甲基化基因;U87U87-ART中共有342个差异基因,其中包含181个甲基化基因和161个去甲基化基因;U251U251-ART中共有56个差异基因,其中包含26个甲基化基因和30个去甲基化基因。

火山图中,甲基化基因用红色表示,去甲基化基因用蓝色表示,未甲基化基因用灰色表示
差异基因筛选数据可见,U87和U251 2类细胞差异基因数以及青蒿琥酯给药前后U87细胞差异基因数较多,而青蒿琥酯给药前后U251细胞差异基因数较少,这与青蒿琥酯对U87细胞较敏感,而对U251细胞耐药的体外实验结果相呼应。
3.5.2 核心靶点预测 基于STRING v10.0软件,挖掘“U87与U251细胞差异基因集”、“青蒿琥酯干预U87细胞效应基因集”以及“青蒿琥酯干预U251细胞效应基因集”各自的相互作用关系。如图5-A所示,U87U251中包含1016个节点和2353对相互作用;U87U87-ART中包含288个节点和160对相互作用;U251U251-ART中包含53个节点和4对相互作用。
运用Cyto Hubba v0.1分别计算PPI网络中各节点的网络拓扑特征值(度值、最大集团中心、介数中心性和接近中心性),筛选4者均大于相应中位数的节点为关键网络靶标,共得到290个U87U251核心靶点(最大集团中心为4、度值为4、接近中心性为203.6、介数中心性为1 220.3)和53个U87U87-ART核心靶点(最大集团中心为2、度值为2、接近中心性为13.6、介数中心性为0)。
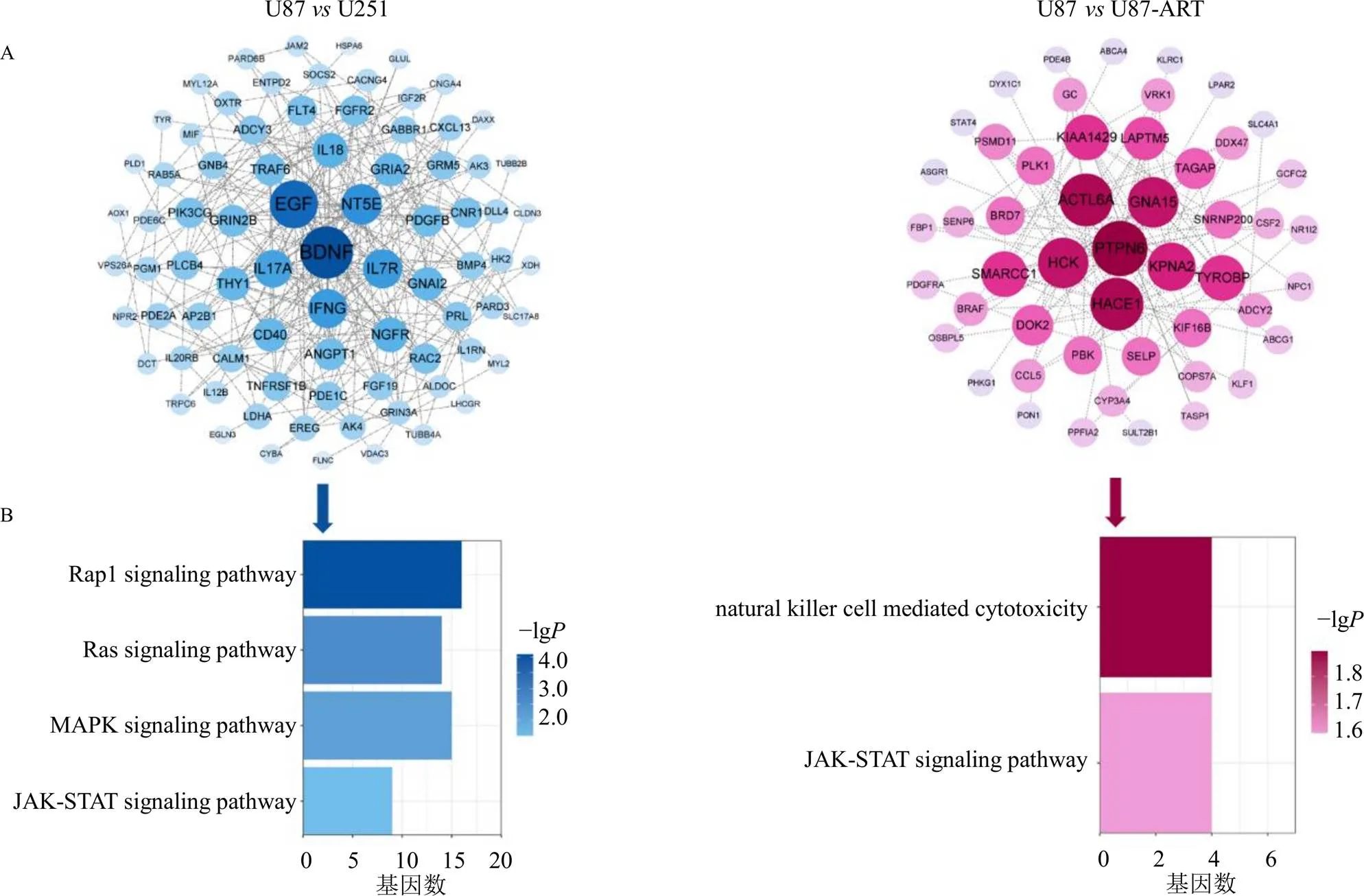
图5 U87 vs U251、U87 vs U87-ART关键靶点PPI网络(A) 及主要富集通路(B)
3.6 核心靶点的富集分析
基于DAVID v6.8数据库,对青蒿琥酯干预GBM效应基因以及青蒿琥酯敏感型和耐药型细胞系差异基因的关键网络靶点进行KEGG信号通路富集分析。生物功能富集结果显示,U87U251核心节点共富集到23条信号通路(<0.05),包含神经系统相关通路以及与调节细胞功能和免疫-炎症反应相关的信号通路;U87U87-ART核心节点共富集到2条信号通路(<0.05),分别是Janus激酶(Janus kinase,JAK)-信号转导和转录激活因子(signal transducers and activators of transcription,STAT)信号通路和自然杀伤细胞介导的细胞毒性信号通路(图5-B)。其中,与细胞增殖分化密切相关的JAK-STAT信号通路为共同富集通路,对富集到该通路的基因进行分析。
分析结果显示,该条通路上的基因与GBM密切相关,该基因发生突变后会促进肿瘤的恶性进展。进一步文献调研发现PDGFRA和BRAF普遍在GBM患者发生突变。甲基化数据结果也显示,和基因在U87U87-ART中被甲基化沉默(adj.<0.05),且均与GBM的发生发展有关。
3.7 青蒿琥酯与关键靶点的分子对接结果分析
采用AuotDock和AutoDock Vina 2种对接方法考察青蒿琥酯与关键靶点BRAF和PDGFRA的结合能力。如图6所示,青蒿琥酯与BRAF蛋白的结合能分别为−22.06、−31.4 kJ/moL,青蒿琥酯与PDGFRA蛋白的结合能分别为−24.58、−34.75 kJ/moL,由此看出,青蒿琥酯与BRAF和PDGFRA这2种蛋白的结合能力较强。
3.8 青蒿琥酯对关键靶点的蛋白表达影响
为了验证青蒿琥酯对BRAF和PDGFRA 2种蛋白表达的影响,用11.35、22.69、45.38 μg/mL的青蒿琥酯处理U87细胞,90、180、360 μg/mL的青蒿琥酯处理U251细胞,采用Western blotting进行检测,如图7所示,11.35、22.69、45.38 μg/mL的青蒿琥酯均可降低U87细胞中PDGFRA蛋白表达水平(<0.05、0.01),11.35、45.38 μg/mL的青蒿琥酯可降低BRAF蛋白表达水平(<0.01);90、180、360 μg/mL的青蒿琥酯对U251细胞中PDGFRA蛋白表达无显著影响,90 μg/mL的青蒿琥酯可显著降低BRAF蛋白表达(<0.001)。

图6 青蒿琥酯与BRAF (A) 和PDGFRA (B) 蛋白的分子对接结果
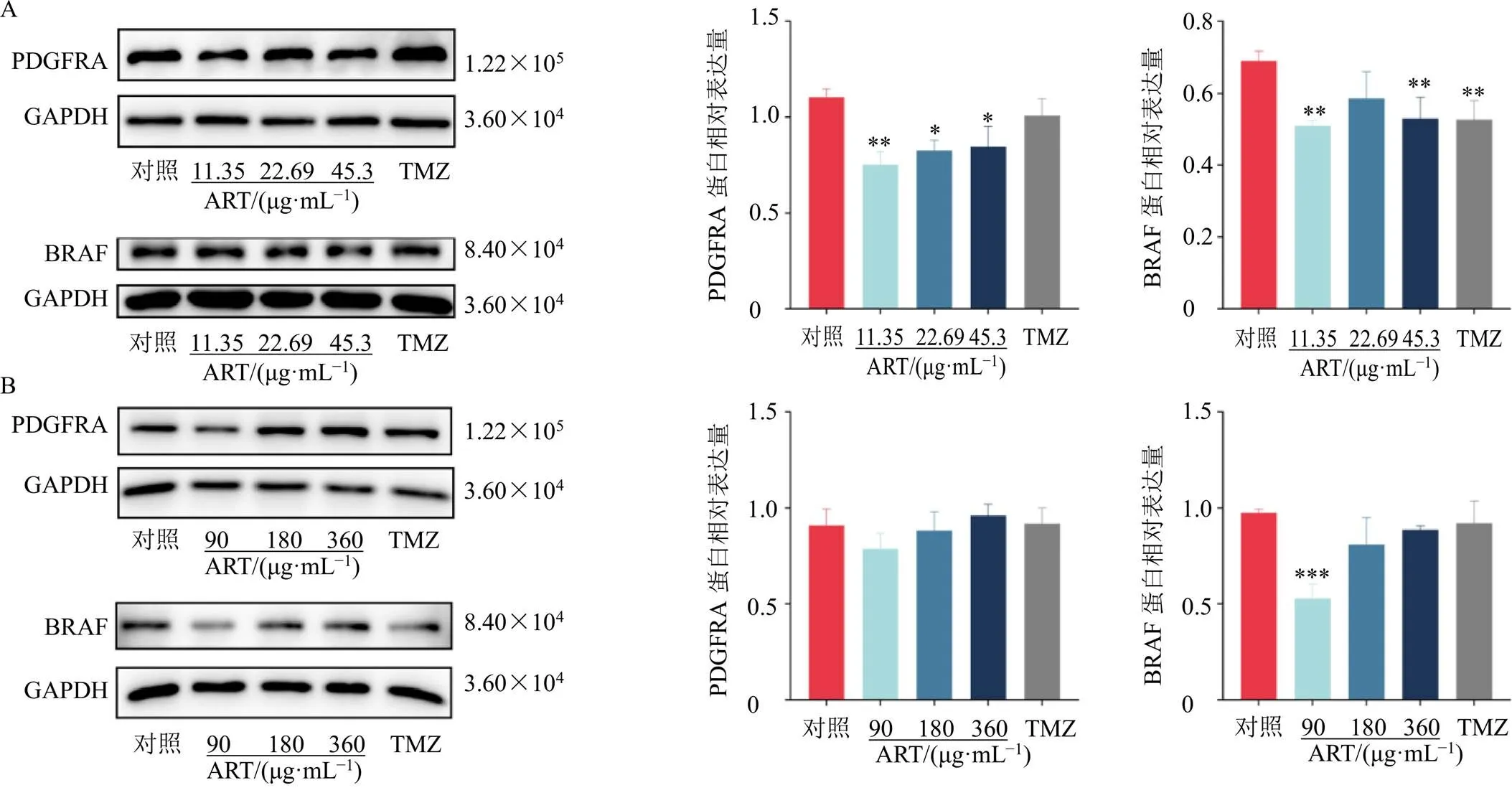
图7 青蒿琥酯对U87 (A) 和U251 (B) 细胞中PDGFRA和BRAF蛋白表达的影响(, n = 3)
4 讨论
脑胶质瘤作为一种中枢神经系统的恶性肿瘤,具有高度侵袭性,因部分临床患者存在化疗耐药性,且肿瘤抑制因子和癌基因的多重功能障碍的存在使其成为最难治疗的恶性肿瘤之一[10]。目前主要存在预后差及复发率高等问题,亟需挖掘新的抗GBM治疗药物。本研究基于2种GBM细胞U87和U251的药效实验和甲基化数据分析,旨在探讨具有抗肿瘤活性的一类青蒿素衍生物青蒿琥酯发挥抗GBM的药效,并初步挖掘其作用机制以及临床产生耐药相关的分子机制。
细胞活性和增殖结果显示,青蒿琥酯对U87细胞的抑制作用比U251细胞强;中、高剂量的青蒿琥酯从早期开始即可抑制U87细胞的增殖,而仅有高剂量青蒿琥酯才能影响耐药型细胞U251的增殖。此外,高剂量青蒿琥酯可阻滞U87和U251脑胶质瘤细胞周期分布,低、中、高剂量青蒿琥酯促进U87细胞3种自噬标志分子(Beclin1、p62、LC3)的表达,而仅有中、高剂量才能影响U251细胞的自噬标志分子表达。以上实验表明青蒿琥酯对U87细胞敏感,而对U251细胞耐药。为进一步揭示青蒿琥酯在治疗GBM中发挥药效的分子机制和潜在的耐药机制,本研究将给药前后的U87与U251细胞进行甲基化测序与分析,筛选出的核心靶点显著富集于癌症、细胞增殖、凋亡相关通路,其中青蒿琥酯干预GBM的关键靶标显著参与了PDGFRA-大鼠肉瘤基因(rat sarcoma viral oncogene homolog,RAS)-BRAF-丝裂原活化蛋白激酶激酶(mitogen-activated protein kinase kinase,MEK)-细胞外信号调节激酶(extracellular signal regulated kinase,ERK)通路。甲基化数据显示,青蒿琥酯给药后,该通路上的PDGFRA和BRAF被甲基化沉默,导致其转录和表达受到抑制,进而阻止下游RAS-RAF-MEK-ERK信号通路的激活。青蒿琥酯与蛋白质PDGFRA和BRAF的分子对接结果显示青蒿琥酯与2种蛋白质有较好的结合能力。Western blotting结果证实青蒿琥酯可以抑制PDGFRA和BRAF 2种关键蛋白在U87和U251细胞中的表达。
研究表明,GBM的恶性进展可能与PDGFRA的过表达有关[11]。PDGFRA作为细胞表面受体,在调节胚胎发育和细胞增殖中起着重要的作用,可介导RAS的激活[12]。此外,G34R/V型胶质瘤(G34R/V HGGs)中PDGFRA的高激活突变,可观察到明显的ERK磷酸化,表明下游有丝分裂原激活蛋白激酶(mitogen-activated protein kinases,MAPK)/ERK途径被激活,促进了肿瘤的发生[13];在GBM细胞中,具有GTP酶活性的RAS蛋白被上游PDGFRA激活后,通过与BRAF的端结构域结合使BRAF活化,参与恶性肿瘤的形成和发展。此外,其突变也与许多癌症类型的预后不良有关[14]。突变使BRAF蛋白持续激活,磷酸化MEK,从而诱导MAP激酶信号转导途径,并持续作用于下游的唯一底物ERK进入细胞核,通过影响DNA和蛋白质合成以及细胞周期进入来促进细胞增殖和分化[15],其中ERK2还可以通过调节线粒体来促进肿瘤生长[16]。相关研究表明,抑制MAPK/ERK通路可以逆转阿霉素对乳腺癌的耐药性[17]。因此,推测青蒿琥酯缓解GBM可能通过调节PDGFRA的表达,从而抑制下游RAS-RAF-MEK-ERK信号通路;或通过直接抑制BRAF及其下游MEK-ERK途径,即青蒿琥酯可通过上述2条途径切断MEK-ERK的信号传导,从而阻止GBM细胞的增殖扩散发挥治疗作用(图8)。
目前临床前已有多种有效药物靶向GBM中的PDGFRA,包括酪氨酸激酶抑制剂达沙替尼,然而,达沙替尼的单药治疗未能改善成人高级别胶质瘤(high- grade gliomas,HGG)的结局[18];此外,BRAF抑制剂维莫非尼以及达拉非尼也具有抗GBM活性[19-21]。临床上单纯抑制PDGFRA或BRAF对GBM的疗效有限,而青蒿琥酯不仅可抑制PDGFRA,还可进一步作用于BRAF,具有治疗GBM的潜能。
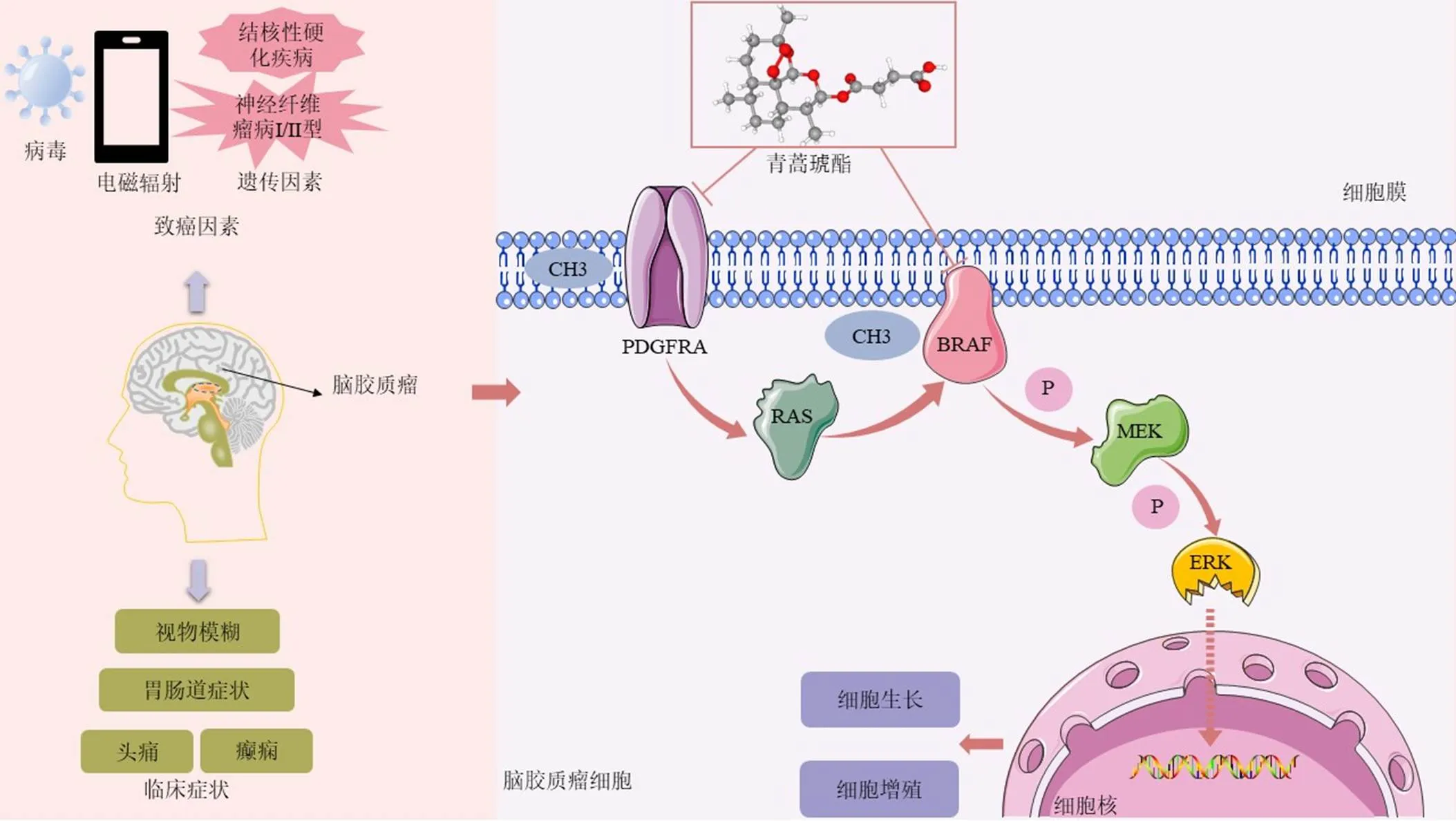
图8 青蒿琥酯可能通过调节PDGFRA-RAS-BRAF-MEK-ERK信号通路来抑制胶质瘤细胞
综上所述,本研究结合药物对2类GBM细胞的体外实验和甲基化数据分析,发现青蒿琥酯可能通过抑制PDGFRA-RAS-BRAF-MEK-ERK途径,发挥抑制GBM细胞的生长和扩散的治疗作用。研究结果不仅为GBM提供潜在新的治疗方案,也为临床中GBM患者对药物产生耐药的机制探索提供方法学参考。
利益冲突 所有作者均声明不存在利益冲突
[1] Pearson J R D, Regad T. Targeting cellular pathways in glioblastoma multiforme [J]., 2017, 2: 17040.
[2] Chen S M, Zhang Z Y, Zhang B X,. CircCDK14 promotes tumor progression and resists ferroptosis in glioma by regulating PDGFRA [J]., 2022, 18(2): 841-857.
[3] Xie Y D, Xiao Y, Liu Y Y,. Construction of a novel radiosensitivity- and ferroptosis-associated gene signature for prognosis prediction in gliomas [J]., 2022, 13(8): 2683-2693.
[4] 巩会杰, 唐建荣, 姚兰杰, 等. 青蒿琥酯通过miR-21/PTEN通路对人大肠癌CCL229细胞恶性生物学行为抑制作用的研究[J]. 中草药, 2021, 52(8): 2331-2342.
[5] Wei S P, Liu L L, Chen Z Y,. Artesunate inhibits the mevalonate pathway and promotes glioma cell senescence [J]., 2020, 24(1): 276-284.
[6] Lian S Z, Shi R Y, Huang X,. Artesunate attenuates glioma proliferation, migration and invasion by affecting cellular mechanical properties [J]., 2016, 36(2): 984-990.
[7] Kloosterhof N K, de Rooi J J, Kros M,. Molecular subtypes of glioma identified by genome-wide methylation profiling [J]., 2013, 52(7): 665-674.
[8] Uddin M S, Mamun A A, Alghamdi B S,. Epigenetics of glioblastoma multiforme: From molecular mechanisms to therapeutic approaches [J]., 2022, 83: 100-120.
[9] Kurdi M, Katib Y, Faizo E,. Association between CD204-expressed tumor-associated macrophages and-promoter methylation in the microenvironment of grade 4 astrocytomas [J]., 2022, 13(3): 117-125.
[10] Brennan C W, Verhaak R G, McKenna A,. The somatic genomic landscape of glioblastoma [J]., 2013, 155(2): 462-477.
[11] Filbin M G, Tirosh I, Hovestadt V,. Developmental and oncogenic programs in H3K27M gliomas dissected by single-cell RNA-seq [J]., 2018, 360(6386): 331-335.
[12] Ben Jemii N, Tounsi-Kettiti H, Yaiche H,. Dysregulated PDGFR alpha expression and novel somatic mutations in colorectal cancer: Association to RAS wild type status and tumor size [J]., 2020, 18(1): 440.
[13] Chen C C L, Deshmukh S, Jessa S,. Histone H3.3G34-mutant interneuron progenitors Co-optfor gliomagenesis [J]., 2020, 183(6): 1617-1633.e22.
[14] 李建英, 毛玉环, 张晓, 等. 循环肿瘤DNA与转移性结直肠癌靶向治疗及耐药机制的相关研究 [J]. 实用预防医学, 2021, 28(12): 1450-1454.
[15] Avery T Y, Köhler N, Zeiser R,. Onco-immunomodulatory properties of pharmacological interference with RAS-RAF-MEK-ERK pathway hyperactivation [J]., 2022, 12: 931774.
[16] Zou J R, Lei T T, Guo P,. Mechanisms shaping the role of ERK1/2 in cellular senescence [J]., 2019, 19(2): 759-770.
[17] Llovet P, Sastre J, Ortega J S,. Prognostic value of BRAF, PI3K, PTEN, EGFR copy number, amphiregulin and epiregulin status in patients with KRAS12 wild-type metastatic colorectal cancer receiving first-line chemotherapy with anti-EGFR therapy [J]., 2015, 19(6): 397-408.
[18] Miklja Z, Yadav V N, Cartaxo R T,. Everolimus improves the efficacy of dasatinib in PDGFRα-driven glioma [J]., 2020, 130(10): 5313-5325.
[19] Kaley T, Touat M, Subbiah V,. BRAF inhibition in BRAF V600-mutant gliomas: Results from the VE-BASKET study [J]., 2018, 36(35): 3477-3484.
[20] Hargrave D R, Bouffet E, Tabori U,. Efficacy and safety of dabrafenib in pediatric patients with BRAF V600 mutation-positive relapsed or refractory low-grade glioma: Results from a phase I/IIa study [J]., 2019, 25(24): 7303-7311.
[21] Wen P Y, Stein A, van den Bent M,. Dabrafenib plus trametinib in patients with BRAFV600E-mutant low-grade and high-grade glioma (ROAR): A multicentre, open-label, single-arm, phase 2, basket trial [J]., 2022, 23(1): 53-64.
Molecular mechanism of artesunate on intervening glioblastoma based on DNA methylation sequencing technology
YAN Xiang-ying1, MAO Xia1, LI Tao1, Koji Mizuno2, Katsuki Okuyama2, LIN Na1, ZHANG Yan-qiong1, Takashi Sato2
1. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China 2. Department of Biochemistry, Tokyo University of Pharmacy and Life Sciences, Tokyo 192-0392, Japan
To explore the efficacy and mechanism of artesunate in intervening glioblastoma.Cell Titer-Blue was used to detect the effect of artesunate on viability and proliferation of U87 and U251 human glioblastoma cells; Flow cytometry was used to detect the regulation effect of artesunate on two cell cycles; qRT-PCR and Western blotting were used to detect the effect of artesunate on autophagy level of two kinds of cells. Further, target genes of artesunate intervention in glioblastoma were studied from the epigenetic level by using the analysis strategy of DNA methylation combined with network pharmacology, and a protein-protein interaction network was established. By calculating the network topological eigenvalues of each node in network, core targets of artesunate intervention in glioblastoma were screened out and biological function enrichment analysis was carried out. Finally, AutoDock v4.2.6 and AutoDock Vina v1.2.0 software were used to carry out molecular docking virtual calculation, to investigate the binding ability of artesunate and its candidate key targets, and verify the influence of artesunate on the expressions of key targets in two types of glioma cells by Western blotting.Artesunate significantly inhibited the activity and proliferation of U87 cells (< 0.05, 0.01, 0.001), but had no significant effect on U251 cells. High-dose artesunate could affect the distribution of two cell cycles. High-dose artesunate significantly increased the mRNA expression levels of three autophagy markers [ATG6 autophagy related 6 homolog (), ubiquitin-binding protein (), microtubule-associated protein 1 light chain 3 ()] in U87 cells (< 0.001), while only high-dose artesunate increased the mRNA expression level ofin U251 cells (< 0.05). Low-, medium- and high-dose of artesunate could significantly improve the expression levels of Beclin1, p62 and LC3B proteins in U87 cells (< 0.05, 0.01), only medium- and high-dose of artesunate could affect Beclin1, p62 and LC3B protein expressions in U251 cells. Furthermore, DNA methylation sequencing and network pharmacologic integration analysis were performed on U87 and U251 cells before and after drug administration, on the basis of obtaining the differential gene sets of artesunate-sensitive and drug-resistant glioma cells, and effector gene sets of two types of cells after artesunate intervention, it was found that key network targets of two types of glioma cells were involved in platelet derived growth factor receptor α (PDGFRA)-rat sarcoma viral oncogene homolog (RAS)-B-Raf proto-oncogene (BRAF)-mitogen-activated protein kinase kinase (MEK)-extracellular signal regulated kinase (ERK) pathway, which were closely related to the malignant progression of glioblastoma, and artesunate had strong affinity with its direct targets (PDGFRA and BRAF). Western blotting analysis confirmed that artesunate could inhibit the expressions of PDGFRA and BRAF proteins in U87 and U251 cells (< 0.05, 0.01, 0.001).Artesunate may exert its medicinal effect on inhibiting the growth and proliferation of glioblastoma cells by targeting PDGFRA-RAS-BRAF-MEK-ERK signaling pathway, which provides anexperimental basis for artesunate in treatment of glioblastoma, and also provides new ideas and methods for solving the drug resistance problem of clinical anti-tumor drugs.
artesunate; glioblastoma; DNA methylation analysis; drug resistance; PDGFRA-RAS-BRAF-MEK-ERK signaling pathway
R285.5
A
0253 - 2670(2023)06 - 1814 - 11
10.7501/j.issn.0253-2670.2023.06.013
2022-09-29
国家自然科学基金青年项目(8210143224);中国中医科学院优秀青年科技人才(创新类)(ZZ15-YQ-029)
闫向英,硕士研究生,研究方向为中药药理与毒理学。E-mail: yxy1254253857@163.com
张彦琼,研究员,主要从事中医药生物信息学研究。E-mail: yqzhang@icmm.ac.cn Takashi Sato,日本东京药科大学教授,主要从事药理学研究。E-mail: satotak@toyaku.ac.jp
#共同第一作者:毛 霞,助理研究员,研究方向为抗炎免疫中药药理学。E-mail:xmao@icmm.ac.cn
[责任编辑 李亚楠]
