淡豆豉炮制过程中不产毒黄曲霉菌的分布特征及其对产毒菌的拮抗作用
2023-03-21李翠英戴家齐王立元周立分杨安金翁美芝谢小梅
李翠英,贺 婧,戴家齐,龙 凯,王立元,周立分,杨安金,徐 佳,翁美芝*,谢小梅*
淡豆豉炮制过程中不产毒黄曲霉菌的分布特征及其对产毒菌的拮抗作用
李翠英1,贺 婧2#,戴家齐1,龙 凯1,王立元1,周立分1,杨安金3,徐 佳1,翁美芝1*,谢小梅1*
1. 江西中医药大学,江西 南昌 330004 2. 南昌大学转化医学研究院,江西 南昌 330031 3. 江西中医药大学附属医院,江西 南昌 330006
明确淡豆豉炮制中不产毒黄曲霉菌的分布特征及其拮抗能力。按实验室前期已建立的规范炮制工艺制备淡豆豉,获取淡豆豉炮制中9个不同时间点的样本,各样本用氯硝胺18%甘油培养基(DG-18)进行培养、分离纯化,经形态学初筛、分子生物学鉴定为黄曲霉菌。通过紫外荧光法初筛和超高效液相色谱-串联质谱法(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)测定黄曲霉菌产毒能力,确定为不产毒黄曲霉菌(简称:不产毒菌)。用平板对峙法检测不产毒菌及其代谢产物对产毒黄曲霉菌标准株(产毒菌)生长的影响。从淡豆豉炮制过程中共筛选出21株不产毒菌,其中“黄衣上遍”过程中的第3、6天分别筛选出3、6株,“再闷”过程中的第3、6、9天分别筛选出2、7、3株,再闷第6天筛选到的不产毒菌最多。不产毒菌对产毒菌的生长抑制率在26.75%~36.69%,抑制效果最好的是F6-L8(指第1批在“黄衣上遍”阶段的发酵第6天样品中筛选到的第8株疑似黄曲霉菌),为36.69%,发酵上清液对产毒菌的抑制率在14.29%~43.23%,抑制效果最好的是Z3-X1(指第2批在“再闷”阶段的第3天样品中筛选到的第1株疑似黄曲霉菌),达43.23%。淡豆豉炮制过程中存在不产毒黄曲霉菌,且在炮制的不同时间点其数量变化呈现“上升-下降-再上升-再下降”的独特趋势,不产毒菌及其发酵液具有抑制产毒菌生长的作用。为进一步研究不产毒黄曲霉菌在淡豆豉炮制过程中的作用、黄曲霉毒素污染的生物防控提供实验依据。
淡豆豉;黄曲霉毒素;不产毒黄曲霉菌;超高效液相色谱-串联质谱技术;拮抗能力;黄衣上遍;再闷
淡豆豉是豆科大豆属植物大豆(L.) Merr.的成熟种子的发酵品,以黑色种皮品系大豆为主料,桑叶、青蒿为辅料经自然发酵而成的药食两用传统中药。黄曲霉毒素(aflatoxins,AFTs)是黄曲霉菌、寄生曲霉菌等产生的一类剧毒次生代谢产物,目前发现AFTs有20多种,其中以黄曲霉毒素B1(aflatoxin B1,AFB1)毒性最强,具有强烈的致癌、致畸和致突变作用[1]。在我国产AFTs的曲霉菌主要为黄曲霉菌,并不是所有的黄曲霉菌都产AFTs,产毒黄曲霉菌(简称:产毒菌)约占自然界黄曲霉菌的30%~80%,从世界各地分离的黄曲霉菌产AFTs能力有很大差别,不产毒黄曲霉菌(简称不产毒菌)在我国常作为曲种应用于黄酒生产[2]。
迄今未见我国传统发酵豆制品中黄曲霉菌的相关研究,仅本实验室从2021年开始关注淡豆豉炮制中的黄曲霉菌、AFTs。本课题组前期研究已发现在淡豆豉炮制过程中AFTs含量呈动态变化[3];用曲霉素培养基从淡豆豉炮制不同时间点样本中分离出不同产毒能力的7株黄曲霉菌,3株不产毒菌[4]。研究表明,不产毒菌能够有效抑制产毒菌的产毒[5]。
基于此,本研究应用黄曲霉菌的最佳培养基——氯硝胺18%甘油培养基(DG18),尝试从淡豆豉炮制过程的不同时间点样本中分离出更多的不产毒菌,并同时考察其对产毒菌的拮抗作用。研究成果对揭示淡豆豉的炮制机制、将不产毒菌应用于中药材、发酵类中药和食品加工中消除AFTs污染开辟新途径。
1 材料与仪器
产毒黄曲霉标准株,购于中国普通微生物菌种保藏中心,编号CGMCC3.4408;溜曲霉菌(MA3)、黑曲霉菌(JC2)、桔青霉菌(ME3)均为本实验室从淡豆豉炮制过程中筛选鉴定并保存,由江西中医药大学谢小梅教授和王立元副教授鉴定和命名;曲霉素琼脂培养基,批号20191026,青岛海博生物技术有限公司;DG18琼脂基础,批号20210916,北京奥博星生物技术有限责任公司;AFTs混合对照品(AFB1、AFB2、AFG1、AFG2),批号2A00I21,质量浓度分别为1.0、0.3、1.0、0.3 μg/mL,质量分数≥98.0%,Pribolab公司;植物基因组DNA提取试剂盒、2×Taq PCR master Mix,批号Cat#DP305-02、Cat.CW0632S,北京天根生化科技有限公司;HypersilGold(100 mm×2.1 mm,1.7 μm)柱,赛默飞世尔科技有限公司;甲醇、乙腈,批号2003191、20022221,上海易恩化学技术有限公司。MJ-150I型霉菌培养箱,上海一恒科技有限公司;Nexera X2型超快速液相色谱仪,日本岛津公司;AB Sciex QTRAP 4500型三重四极杆线性离子肼串联质谱仪,美国AB Sciex公司。
2 方法与结果
2.1 淡豆豉的炮制和取样
本课题组参照《中国药典》2010年版已建立规范的淡豆豉炮制工艺(历版《中国药典》记载的淡豆豉制法相同,含2020年版)。本实验按此法制备淡豆豉并分别获取炮制过程中不同时间点样本。具体操作如下:取桑叶90 g、青蒿100 g,分次加入10、8倍生药量的水煎煮1 h,滤过,合并滤液并浓缩至1000 mL,晾凉拌于1000 g净黑大豆中,浸泡6 h,待黑大豆充分膨胀,煎煮液吸收完全,1.5 h隔水蒸透,取出,稍晾,再置容器内,用煎过的桑叶、青蒿渣铺底并覆盖豆粒,放置于温度为(30±2)℃,湿度为70%的恒温恒湿培养箱中发酵6 d至“黄衣上遍”。取出,除去药渣,洗净,置于陶瓷罐内,在温度为(30±2)℃,湿度为70%的恒温恒湿培养箱“再闷”15 d(每3天翻动1次)。至充分发酵、香气溢出时,取出,隔水蒸0.5 h,干燥即得。“黄衣上遍”阶段中,取发酵第0、3、6天样品,记为F0、F3、F6;“再闷”阶段中,取再闷第3、6、9、12、15天样品和蒸后成品,依次记为Z3、Z6、Z9、Z12、Z15和SSP,各样品放4 ℃冰箱储存,在1周之内检测。
2.2 淡豆豉炮制过程中黄曲霉菌的筛选和分离
取适量淡豆豉炮制不同时间点样品,研碎,精密称取研碎后的样品各10 g,加90 mL无菌生理盐水,摇床振荡30 min,取1 mL液体,用无菌生理盐水依次梯度稀释,得到0.1、0.01、0.001、1×10−4、1×10−5、1×10−6、1×10−7的稀释液,F3、Z3、Z6选择0.001、1×10−4、1×10−5稀释液,F6选择1×10−4、1×10−5、1×10−6稀释液,F0、Z9、Z12、Z15、SSP选择0.1、0.01、0.001稀释液,分别取100 μL加入到DG18培养基平皿中涂布均匀,每个稀释度做3个平行,于培养箱中28 ℃避光培养5~8 d。
待培养皿上开始形成孢子时,将呈明黄色疑似黄曲霉菌的单菌落孢子转接到新的DG18培养基上,在28 ℃避光倒置培养3~5 d。用液体石蜡斜面保存初筛菌株并编号。菌株命名遵循以下规律:“F”和“Z”分别表示“黄衣上遍”阶段和“再闷”阶段,“L”表示第1批筛选的菌株,“X”表示第2批扩筛的菌株(先后2批菌株是在同1批次淡豆豉样本中筛选,用“L”和“X”编号区分),如“F6-L5”指第1批在“黄衣上遍”阶段的发酵第6天样品中筛选到的第5株疑似黄曲霉菌;“Z3-X1”指第2批在“再闷”阶段的第3天样品中筛选到的第1株疑似黄曲霉菌,依此类推。
2.3 不产毒黄曲霉菌的筛选和鉴定
2.3.1 形态学初步鉴定[6]将分离的疑似黄曲霉菌于曲霉素琼脂培养基(AFPA)平皿上培养3~5 d,选择培养基背面为亮橘色的菌株进行分子鉴定。结果有61株待测菌在AFPA培养基背部形成了溜曲霉菌、黑曲霉菌、桔青霉菌等截然不同的亮橙黄色的特征菌落,如图1所示,初步鉴定为黄曲霉菌。
2.3.2 紫外荧光法初筛 将初步筛选的疑似黄曲霉菌接种在含有2,6-二甲基-β-环糊精的PDA培养基上,于28 ℃霉菌培养箱培养5~8 d。将培养基置于波长365 nm紫外灯下观察。利用黄曲霉毒素在该波长紫外灯下显蓝紫色或者黄绿色荧光这一特性,可初步区分产毒和不产毒的黄曲霉菌。结果产毒黄曲霉菌菌落周围均显蓝紫色,如图2所示。
2.3.3 分子生物学鉴定 采用植物基因组DNA提取试剂盒提取各菌株DNA,18S rDNA通用引物ITS1/ITS4(ITS1:5’-CTTGGTCATTTAGAGGAAG- TAA-3’,ITS4:5’-TCCTCCGCTTATTGATATGC-3’)进行扩增。PCR反应体系:模板DNA 2 μL,上下游引物各1 μL(浓度10 μmol/L),2×Taq PCR master Mix 12.5 μL,补充ddH2O至25 μL。反应程序:94 ℃、1 min;94 ℃、30 s,56 ℃、30 s,72 ℃、1 min,30个循环;72 ℃、10 min。
扩增产物用1%琼脂糖凝胶电泳,将PCR产物送测序公司测序。测序结果在NCBI网站上比对、下载同源性高的序列及模式菌株的序列在MEGA 7.0软件上建系统发育树。结果与黄曲霉菌相似度达99%以上,鉴定为黄曲霉菌,结果见表1。构建系统发育树如图3所示。
2.4 UPLC-MS/MS法测定黄曲霉菌的产AFTs能力
本课题组前期已建立UPLC-MS/MS法测定黄曲霉菌的产AFTs能力。具体色谱及质谱条件参考本实验室前期实验结果[4]。
2.4.1 对照品溶液的制备 精密吸取AFTs混合对照品(AFB1、AFB2、AFG1、AFG2质量浓度分别为1.00、0.03、1.00、0.03 μg/mL)溶液0.5 mL于1 mL棕色量瓶中,用甲醇稀释至刻度,于−20 ℃冰箱避光保存,备用。
2.4.2 供试品溶液的制备[4]将活化好的黄曲霉菌分别加入适量无菌生理盐水洗脱孢子,无菌纱布滤过制成孢子悬浮液,血球计数板计数,调整孢子浓度为1×106.59cfu/mL。吸取2 mL各孢子悬浮液于25 mL液体发酵培养基中,置28 ℃、120 r/min摇床中培养5 d。分别吸取1.5 mL发酵液于2 mL离心管中,10 000×离心10 min,取1 mL各发酵上清液用氮气吹至近干,加甲醇复溶,12 000×离心10 min,取上清液经0.22 μm滤膜滤过,上机测定。
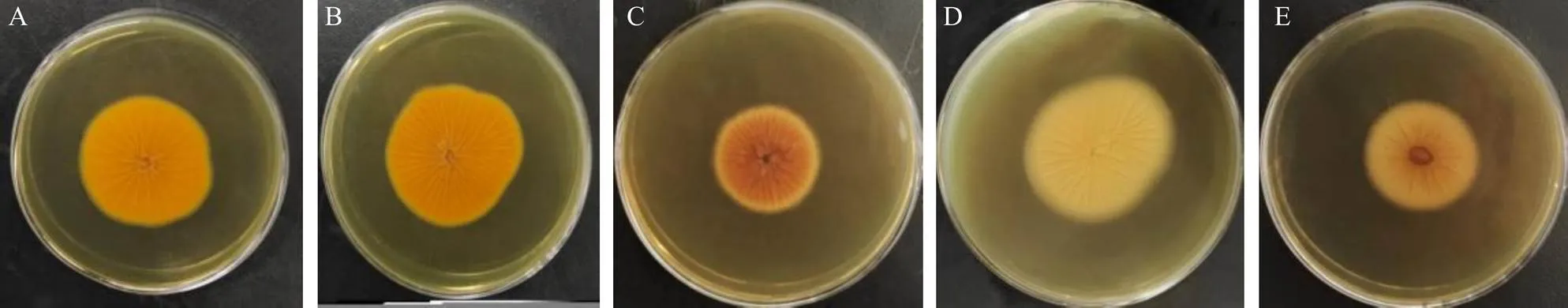
A-产毒标准黄曲霉菌 B-淡豆豉中分离的黄曲霉菌 C-溜曲霉菌 D-黑曲霉菌 E-桔青霉菌

A-产毒标准黄曲霉菌 B-淡豆豉中分离的产毒黄曲霉菌 C、D-不产毒黄曲霉菌

表1 黄曲霉菌NCBI基因序列比对结果
2.4.3 UPLC-MS/MS法方法学考察
(1)线性关系考察:精密吸取AFTs混合对照品溶液,用甲醇稀释成建立标准曲线的系列质量浓度,混匀,上机测定。将质量浓度作为横坐标(),各质量浓度对应的峰面积作纵坐标(),进行线性回归,得回归方程:AFB1=4300+849,= 0.999 1;AFB2=3570+107,=0.999 4;AFG1=1930+255,=0.999 4;AFG2=3760-50.5,=0.999 9;结果表明,AFB1、AFG1在0.5~200.0 ng/mL线性关系良好,AFB2、AFG2在0.3~60.0 ng/mL线性关系良好。
(2)精密度考察:配制AFTs混合对照品溶液(AFB1和AFG1质量浓度为5 ng/mL,AFB2和AFG2质量浓度为1.5 ng/mL),连续重复进样6次。AFB1、AFB2、AFG1、AFG2峰面积的RSD分别为1.26%、1.48%、0.85%、2.52%,表明仪器精密度良好。
(3)稳定性考察:取无菌发酵液1份,加AFTs混合对照品(AFB1和AFG1加入量为5 ng/mL,AFB2和AFG2加入量为1.5 ng/mL)制备供试品溶液,分别于0、4、8、12、16、20、24 h测定,以4种AFTs质量分数来计算,RSD分别为1.60%、1.82%、2.38%、2.10%,表明供试品溶液在24 h内稳定性良好。
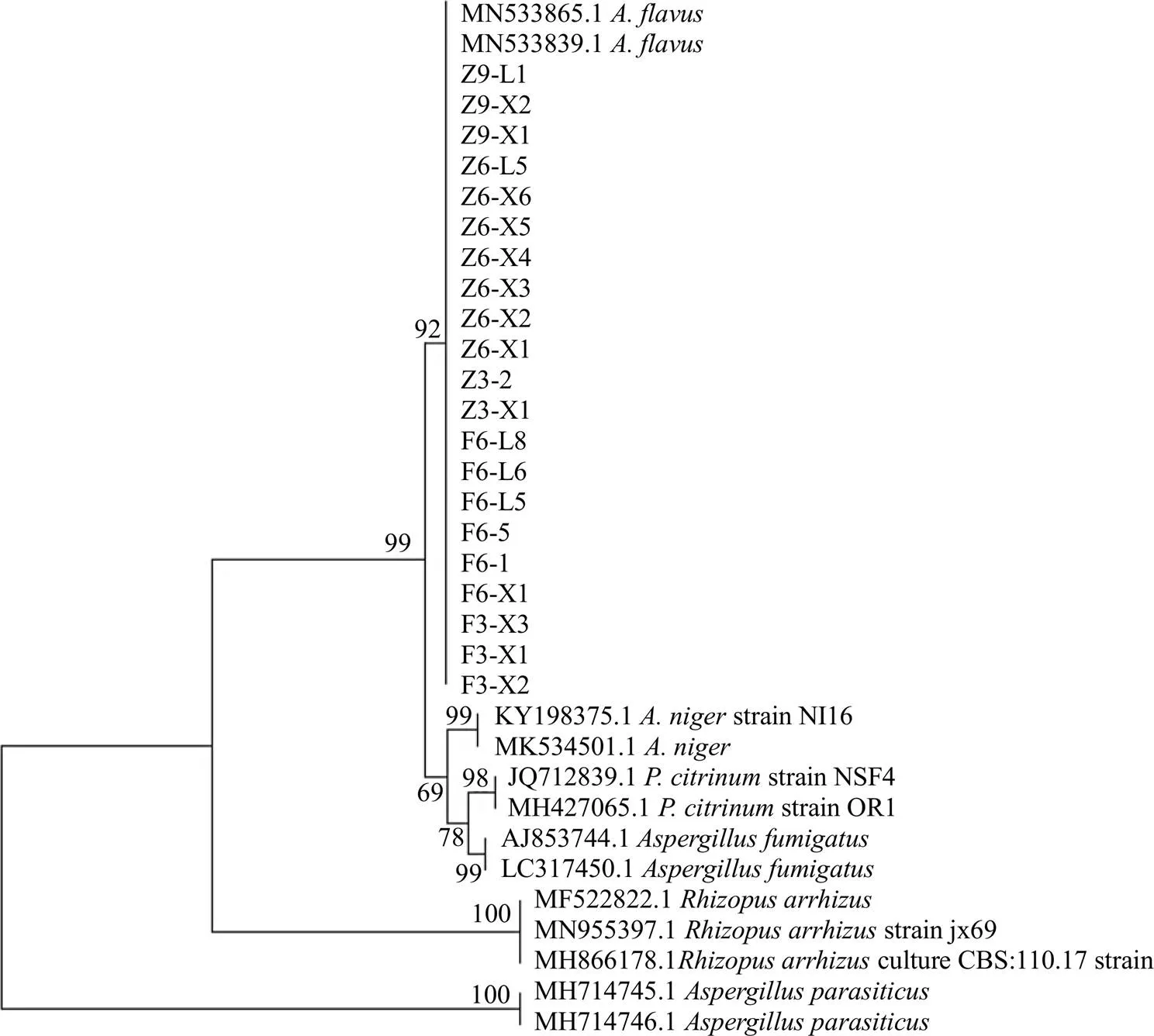
图3 曲霉菌系统发育树
(4)重复性考察:平行取无菌发酵液6份,精密加AFTs混合对照品(AFB1、AFG1加入量为5 ng/mL,AFB2、AFG2加入量为1.5 ng/mL)溶液,分别进样2 μL进行测定,以4种AFTs质量分数来计算,AFB1、AFB2、AFG1、AFG2的RSD分别为1.69%、2.89%、1.04%、2.39%,表明该方法重复性良好。
(5)加样回收率考察:平行取无菌发酵液6份,分别精密加入低、中、高3种质量浓度的AFTs混合对照品溶液(AFB1和AFG1分别添加5、50、100 ng/mL,AFB2和AFG2分别添加1.5、15、30 ng/mL),每种质量浓度各3份,计算加样回收率,4种AFTs的加样回收率为92.63%~98.84%,RSD在1.14%~2.23%。
2.4.4 黄曲霉菌的产毒能力分析 采用UPLC-MS/ MS法测定黄曲霉菌的产毒能力,结果得到18株不产毒的黄曲霉菌株,见图4。本课题组前期已筛选出10株黄曲霉菌,其中3株是不产毒黄曲霉菌[4]。结合本课题组前期的筛选结果,本实验室一共筛选到71株黄曲霉菌,其中21株为不产毒的黄曲霉菌,不产毒黄曲霉菌在淡豆豉炮制过程中不同时间点的分布情况见表2。

A、B-产毒黄曲霉菌F6-L7、Z6-L2 C、D-不产毒黄曲霉菌F3-X2、Z9-L1

表2 淡豆豉炮制过程中不产毒黄曲霉菌在不同时间点的分布情况
不产毒菌占比=不产毒菌株数/黄曲霉菌株数
proportion of non-toxic bacteria = number of non-toxic bacteria/number of
2.5 不产毒菌的拮抗能力测定
2.5.1 两点对峙培养法检测不产毒菌对产毒黄曲霉菌标准株CGMCC3.4408生长的抑制作用 将1×105cfu/mL的标准株孢子液10 μL接于PDA培养基的一侧,于另一侧相同距离处接种等体积的各待测菌孢子液。以仅接种1×105cfu/mL的标准株孢子于培养基的一侧作为对照组,分别置于28 ℃霉菌培养箱培养5 d,量取并记录标准株菌落直径,每组3个平行。结果见表3和图5,平板对峙法发现有4株不产毒黄曲霉对产毒黄曲霉菌标准株生长的抑制作用相对明显,抑制率达到了35%以上,分别为F3-X2 36.41%、Z9-X2 36.13%、F6-L8 36.69%和F6-L5 35.15%。
抑菌率=(对照组菌落直径-实验组菌落直径)/对照组菌落直径
2.5.2 不产毒菌发酵上清液对产毒菌的抑制作用 取各待测菌发酵液离心,上清液过滤除菌后吸取8 mL加入培养皿中,倾注20 mL PDA培养基与之混匀,在平皿中央接种20 μL 1×105cfu/mL的黄曲霉标准株孢子液,以平皿中央仅接种1×105cfu/mL黄曲霉标准株孢子液作对照。分别置28 ℃霉菌培养箱培养5 d,记录菌落直径,计算抑菌率,每组3个平行[7]。结果见表3和图6,有4株不产毒黄曲霉发酵液对产毒黄曲霉菌标准株生长的抑制作用相对明显,抑制率达到了35%以上,分别为Z3-X1(43.23%)、Z6-X3(35.71%)、Z6-X4(35.09%)、Z9-X2(42.36%)。
表3 不产毒菌孢子液及其发酵上清液对产毒黄曲霉菌标准株生长的影响(, n = 3)
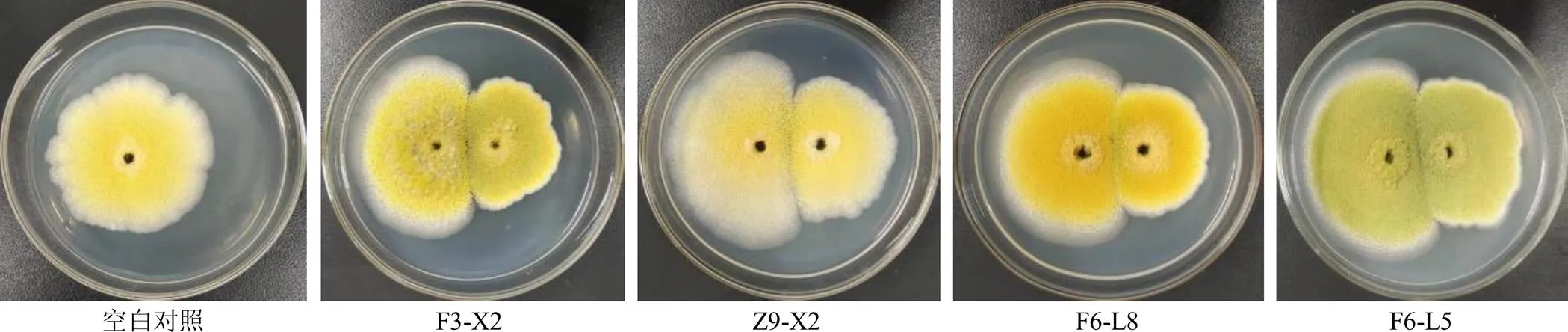
左侧为产毒黄曲霉菌标准株,右侧为各不产毒黄曲霉菌

图6 各不产毒菌发酵上清液对产毒黄曲霉菌标准株的影响
3 讨论
自然界中存在大量产毒能力不同的黄曲霉菌。国内外从大豆、花生等农产品以及酒类制品中筛选不产毒黄曲霉的报道屡见不鲜[8-10]。但从发酵制品、中药材中筛选分离出不产毒黄曲霉菌的报道很少,仅在一些发酵茶的发酵过程中发现有黄曲霉菌大量生长,黄曲霉菌的生长受到了原料茶中微生物、抗氧化组分等的抑制作用,黄曲霉菌的产毒能力大大减弱,甚至检测不到黄曲霉毒素[11-12]。
本研究借鉴研究者对我国土壤、花生中黄曲霉菌的研究成果[13],从淡豆豉炮制不同时间点中分离出黄曲霉菌71株,经紫外荧光初筛和UPLC-MS/MS筛选到21株不产毒菌。经分析,淡豆豉自然发酵过程中,不同时间点样品中黄曲霉菌的数量分布存在呈现出“上升-下降-再上升-再下降”的“M”型独特趋势。其中“黄衣上遍”阶段的发酵第6天(F6)和“再闷阶段”第6天(Z6)样品中黄曲霉菌株数量较多,分别为27株和18株,发酵第0天(F0)样品和淡豆豉成品(SSP)中均未筛选到黄曲霉菌,说明在淡豆豉炮制中,产毒菌与不产毒菌既不由原料中携带,也并未出现在淡豆豉成品中,只在炮制过程中产生和分布。值得注意的是,从淡豆豉炮制不同时间点样品中筛选到的不产毒黄曲霉菌株数量和黄曲霉菌株数量分布呈现相似的“M”型变化趋势(表3),这表明样本中黄曲霉菌的基数与能筛选到的不产毒黄曲霉菌数量呈正相关。
黄曲霉菌不产毒,与其毒素合成基因以及调控毒素次级代谢的相关基因的缺失或非正常表达有密切联系[14],在淡豆豉自然发酵过程中,拮抗微生物和炮制逆环境的双重作用加大了黄曲霉毒素合成基因和调控基因突变和抑制表达的可能。这可能也是淡豆豉炮制中所筛选到的黄曲霉菌不产毒率相较自然环境高的主要原因。且从产毒菌和不产毒菌呈现相似分布趋势的实验结果来看,淡豆豉炮制中某一时间点黄曲霉菌基数越大,不产毒黄曲霉菌分布也就越多,反之亦然。这可能是因为在淡豆豉炮制的特殊环境下,某一时间点较大的黄曲霉菌基数同时也增大了相关毒素合成和调控基因的突变频率,使不产毒黄曲霉菌数随之增加,反之亦然。
本实验从淡豆豉炮制过程中分离出的产毒菌和不产毒菌株数量呈现的这种独特“M”型趋势,不仅和淡豆豉炮制工艺及发酵环境有直接联系,还与发酵过程中其他微生物数量的更迭密切相关,“黄衣上遍”阶段中发酵第0~6天,由于处于开放环境,O2含量充足且温湿度适宜,空气中黄曲霉、溜曲霉、酵母菌等需氧真菌数量上升,该过程对应“M”型趋势的”上升”段,进入“再闷”前需洗去黄衣,该操作将豆粒表面包括黄曲霉菌在内的多种微生物数量减少,对应“M”型趋势的”下降”段,进入“再闷”阶段初始黄曲霉菌数量有所上升,可能原因如下:(1)洗净操作清除了大部分发酵微生物,有利于黄曲霉菌的竞争繁殖;(2)发酵环境密闭,但O2还有部分残留,能使需氧的黄曲霉菌等微生物数量有所上升;(3)由于O2含量的骤减,厌氧细菌的繁殖也会抑制黄曲霉菌的繁殖,使得“再闷”阶段前期黄曲霉菌的增长速度不及之前,该过程反应对应于于“M”型趋势的“再上升”段;至“再闷”第6天黄曲霉菌数再达峰值之后,由于枯草芽孢杆菌和乳酸菌等细菌逐渐成为优势菌[15],加之O2含量的进一步减少等因素,“再闷”第9天黄曲霉菌数量开始下降,直至“再闷”第12天后再未筛选到黄曲霉菌,对应“M”型趋势的“再下降”段。
一系列拮抗微生物,如细菌[7,16]、酵母和真菌已用于黄曲霉毒素污染的生物防治[17]。使用不产毒黄曲霉菌抑制AFTs合成也是减少黄曲霉毒素污染的有效策略[18]。研究表明,不产毒黄曲霉菌会对产毒菌形成竞争抑制作用[19]。另外,部分研究表明不产毒菌株释放的挥发性有机化合物组合可以显着减少产毒菌株产生的AFTs和环哌唑酸[20]。本实验结果表明不产毒菌对产毒黄曲霉菌标准株生长抑制率在26.75%~36.69%,提示不产毒菌对标准黄曲霉菌形成了明显的竞争抑制。
另外,本实验还采用除菌后的不产毒菌发酵上清液对产毒标准株进行抑制实验,排除了不产毒菌菌株本身的干扰,结果显示抑制率在14.29%~43.23%。这表明不产毒黄曲霉菌发酵次级代谢产物也会对产毒标准株形成抑制,本研究可为淡豆豉AFTs的精准防控提供科学依据,将不产毒菌应用于中药材、发酵类中药和食品加工中消除AFTs污染开辟新途径。本实验室后续将进一步研究不产毒黄曲霉菌的不产毒机制和拮抗机制。
利益冲突 所有作者均声明不存在利益冲突
[1] 张宁慧, 王瑱, 毛垣元, 等. 植物精油及活性成分防控黄曲霉生长及其毒素产生的研究进展 [J]. 中草药, 2020, 51(20): 5348-5359.
[2] 夏艳秋, 朱强, 汪志君. 高产糖化酶黄曲霉菌的选育及初步应用 [J]. 微生物学通报, 2009, 36(10): 1542-1546.
[3] 马书伟, 李春玲, 周鸿, 等. 淡豆豉炮制过程中黄曲霉毒素含量的动态变化规律分析 [J]. 中国医院药学杂志, 2022, 42(21): 2216-2219.
[4] 李春玲, 贺婧, 王立元, 等. 淡豆豉炮制中黄曲霉毒素产毒株的筛选鉴定和产毒能力测定 [J]. 中草药, 2022, 53(5): 1411-1417.
[5] Schamann A, Schmidt-Heydt M, Geisen R. Analysis of the competitiveness between a non-aflatoxigenic and an aflatoxigenicstrain on maize kernels by droplet digital PCR [J]., 2022, 38(1): 27-36.
[6] 刘俊, 张国朋, 张智猛, 等. 不产毒黄曲霉菌株的筛选鉴定及分子机理研究 [J]. 花生学报, 2018, 47(3): 8-13.
[7] 李春玲, 贺婧, 王立元, 等. 淡豆豉炮制过程中拮抗菌对黄曲霉毒素B1的拮抗能力考察 [J]. 中草药, 2021, 52(12): 3544-3551.
[8] 邢福国, 刘阳, 王利敏,等. 不产毒黄曲霉在降解黄曲霉毒素方面的应用: 中国, CN107279686A [P]. 2017-10-24.
[9] Vaamonde G, Patriarca A, Pinto V F,. Variability of aflatoxin and cyclopiazonic acid production bysection flavi from different substrates in[J]., 2003, 88(1): 79-84.
[10] 惠明, 尚小利, 田青, 等. 酒曲中一株不产毒黄曲霉的分离与鉴定 [J]. 中国酿造, 2012, 31(12): 80-82.
[11] 李亚莉, 邢倩倩, 涂青, 等. 外源接种黄曲霉污染普洱茶安全性研究 [J]. 茶叶科学, 2017, 37(5): 513-522.
[12] 张浩. 茶叶发酵过程中多酚变化及其对黄曲霉产毒的抑制效应[D]. 杨凌: 西北农林科技大学, 2014.
[13] 张初署. 中国四个生态区花生土壤中黄曲霉菌分布、产毒特征及遗传多样性研究 [D]. 北京: 中国农业科学院, 2013.
[14] 邢福国, 李旭, 张晨曦. 黄曲霉毒素的产生机制及污染防控策略 [J]. 食品科学技术学报, 2021, 39(1): 13-26.
[15] 朱海针, 谢卫华, 龙凯, 等. PCR-DGGE技术研究淡豆豉炮制过程中微生物菌群的动态变化 [J]. 中草药, 2017, 48(9): 1757-1765.
[16] Shu X, Wang Y, Zhou Q,. Biological degradation of aflatoxin B1by cell-free extracts ofDY3108 with broad pH stability and excellent thermostability [J]., 2018, 10(8): 330.
[17] Ren X F, Zhang Q, Zhang W,. Control of aflatoxigenic molds by antagonistic microorganisms: Inhibitory behaviors, bioactive compounds, related mechanisms, and influencing factors [J]., 2020, 12(1): 24.
[18] 魏丹丹, 周露, 张初署, 等. 不产毒黄曲霉菌对产毒黄曲霉菌产毒抑制效果分析 [J]. 现代食品科技, 2014, 30(6): 92-97.
[19] Mehl H L, Cotty P J. Nutrient environments influence competition amonggenotypes [J]., 2013, 79(5): 1473-1480.
[20] Moore G G, Lebar M D, Carter-Wientjes C H. Cumulative effects of non-aflatoxigenicvolatile organic compounds to abate toxin production by mycotoxigenic[J]., 2022, 14(5): 340.
Distribution characteristics and antagonistic ability of atoxigenicin processing of
LI Cui-ying1, HE Jing2, DAI Jia-qi1, LONG Kai1, WANG Li-yuan1, ZHOU Li-fen1, YANG An-jin3, XU Jia1, WENG Mei-zhi1, XIE Xiao-mei1
1. Jiangxi University of Chinese Medicine, Nanchang 330004, China 2. Institute of Translational Medicine, Nanchang University, Nanchang 330031, China 3. The Affiliated Hospital of Jiangxi University of Chinese Medicine, Nanchang 330006, China
To clarify the distribution characteristics and antagonistic ability ofduring the processing of Dandouchi (, SSP).The fermenting process of SSP was based on the established a standardized fermentation processing technology of own laboratory, and samples were taken at nine different time points during the fermenting process of SSP.from each samples at different time points in the fermenting process of SSP were cultured, isolated and purified by clonitramine 18% glycerol medium (DG-18), and were identified by morphological primary screening and molecular biology. The toxin-producing ability ofwas determined by ultraviolet fluorescence method primary screening and ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS), and it was determined that it was a non-toxigenic(atoxigenic). The effects of atoxigenicand their metabolites on the growth of toxigenicstandard strain (toxigenic) was detected by plate confrontation method.A total of 21 strains of atoxigenicwere screened out from the process of SSP, among which three and six strains were screened out on the 3rdand 6thd of the “yellow cladding” stage respectively. During the “secondary fermentation” stage, two, seven, and three strains were screened out on the 3rd, 6thand 9thd respectively. The number of atoxigenicscreened on the 6thd of the “secondary fermentation” stage was the most. The growth inhibition rate of atoxigenicto toxigenicwas between 26.75% and 36.69%, and the best inhibitory effect was F6-L8 (referred to the eighth suspectedscreened from the first batch of samples on the 6thd of fermentation in the “yellow cladding” stage), which was 36.69%. The inhibition rate of fermentation supernatant to toxigenicwas 14.29%—43.23%, and Z3-X1 (referred to the first suspectedscreened from the second batch of samples on the 3rd d of the “secondary fermentation” stage) had the best inhibitory effect, reaching 43.23%.Atoxigenicwas found in the processing of SSP and its quantity change showed a unique trend of “rising - decreasing - rising-re-decreasing” at different time points during processing. The atoxigenicand its fermentation supernatant have an inhibitory effect on the growth of toxigenic. This result provides an experimental basis for further research on the role of atoxigenicin the processing of SSP and the biological control of aflatoxin pollution.
(SSP); aflatoxins; atoxigenic; ultra performance liquid chromatography- tandem mass spectrometry; antagonistic ability; yellow cladding; secondary fermentation
R283.6
A
0253 - 2670(2023)06 - 1775 - 08
10.7501/j.issn.0253-2670.2023.06.009
2022-10-09
国家自然科学基金项目(82060709);国家自然科学基金项目(81660664);国家自然科学基金项目(82060699);江西省教育厅科技研究项目(GJJ190634)
李翠英(1996—),女,江西永丰人,硕士研究生,从事药理学研究。Tel: 18279613153 E-mail: 2507753468@qq.com
谢小梅(1964—),女,江西永新人,教授,博士,研究生导师,从事微生物学研究。Tel: (0791)87118707 E-mail: jxxm1964@sina.com
翁美芝(1982—),女,江西宜春人,副教授,博士,主要从事中药溶栓研究。Tel: (0791)87118921 E-mail: meizhiweng@whu.edu.cn
#共同第一作者:贺 婧(1990—),女,江西南昌人,讲师,博士,从事微生物学研究。Tel: 15972204520 E-mail: whuncuhejing@qq.com
[责任编辑 郑礼胜]
