凝结芽孢杆菌混合碳源乳酸发酵研究
2023-03-12陈铭浩刘志豪王永红
陈铭浩,刘志豪,王永红
(华东理工大学生物工程学院,上海 200000)
乳酸(Lactic acid,LA)是一种非常重要的有机酸,分子式为CH3-CHOHCOOH,在食品、化工、纺织、医药等领域都有重要的应用价值[1−3]。生物法生产乳酸具有环境友好、节能等优势,常用细菌或者根霉作为生产菌株,凝结芽孢杆菌(Bacillus coagulans)具有耐高温(50~55 ℃)、耐低pH、适应开放式发酵[4]和产高光学纯度L-乳酸等优势,因此在乳酸发酵行业备受关注[5−6]。
凝结芽孢杆菌的工业乳酸发酵主要以玉米质淀粉水解液作为原料,由于分解代谢物阻遏(Carbon catabolite repression,CCR)效应使发酵后期存在以异麦芽糖、海藻糖等为主的残糖,从而影响乳酸得率、发酵周期和后期纯化成本[7]。分解代谢物阻遏效应是一种细胞在多种碳源并存情况下优先选择速效碳源进行生长的经典代谢调控机制。Nair等[8]已阐明厚壁菌门细菌在营养充足即有葡萄糖存在的情况下,通过上调诱导物排斥效应机制中的关键基因ccpA和hprK,触发CCR效应。
混合碳源乳酸发酵过程中,在速效碳源利用向缓效碳源利用转变期间,菌体由于得不到充足的碳源供应而出现明显自溶的现象[9],这种菌体为响应各种环境压力而出现的自溶在维持细胞稳态中起到重要作用[10−11]。菌体自溶不仅会延长发酵周期,还会影响后期产品纯化,所以减少菌体自溶在发酵调控中非常关键。发酵环境中的溶氧、pH、金属离子和渗透压都会对菌体自溶造成不同程度的影响[12],但目前对于凝结芽孢杆菌菌体自溶的报道较少,因此研究影响菌体自溶的关键因素对于优化凝结芽孢杆菌乳酸发酵条件和提高发酵效率具有重要意义。
为探究影响菌体自溶的关键因素以及优化发酵条件,本文首先研究了不同pH、通气量和中和剂对5 L罐凝结芽孢杆菌混合碳源乳酸发酵的影响。随后研究了金属离子、渗透压等条件对在饥饿环境中菌体自溶和活性的影响。本研究为凝结芽孢杆菌混合碳源乳酸发酵过程代谢转变调控机理的研究奠定基础。
1 材料与方法
1.1 材料与仪器
凝结芽孢杆菌(B. coagulans)ATCC7050 为NCBI上已记录的菌株,美国模式培养物保藏所;氨基酸 分析纯,阿拉丁;无机盐 分析纯,凌峰化学;葡萄糖、海藻糖 分析纯,泰坦科技。
ICS3000型离子色谱、NanoDrop 2000c型超微分分光光度计 美国Thermo公司;DGU-20A型HPLC 日本岛津公司;FE-20型pH计 瑞士梅特勒托利多公司;5 L生物反应器 国强生化装备公司;OM819.C型冰点渗透压仪 雅森博科科学仪器有限公司;752型紫外可见分光光度计 菁华科技仪器有限公司(上海)。
1.2 实验方法
1.2.1 凝结芽孢杆菌的活化和培养
1.2.1.1 种子培养 从−20 ℃冰箱中取出B.cagulansATCC7050甘油冻存管,解冻后吸取250 μL菌液到斜面培养基,并用竹签涂抹均匀,放到50 ℃恒温培养箱培养24 h得到一级斜面,用竹签刮取菌苔涂布于两个新的斜面中,放到50 ℃恒温培养箱培养14 h得到二级斜面。用50 mL无菌水将活化后的菌体从二级斜面上洗脱下来接入(接种量为15%,V/V)100 mL MRS培养基中,在50 ℃摇床中100 r/min,培养12 h[9]。
1.2.1.2 5 L生物反应器发酵 将无菌水洗涤后的种子液接入含有混合碳源合成培养基MCDM3++[9]的5 L罐中(接种量为10%,V/V)50 ℃培养,发酵体积为4 L,转速100 r/min,控制相应通气量,使用相应中和剂控制pH。合成培养基MCDM3++[13](g/L):葡萄糖20、海藻糖20、乙酸钠2、K2HPO40.3、KH2PO40.3、柠檬酸氢二铵1、丙氨酸0.5、半胱氨酸0.5、谷氨酸0.5、精氨酸0.5、组氨酸0.5、异亮氨酸0.5、甲硫氨酸0.5、亮氨酸0.5、苏氨酸0.5、缬氨酸0.5、酪氨酸0.5、鸟嘌呤0.075、硫胺素0.005、叶酸0.005、MgSO40.5、FeSO40.02、MnSO40.05。
1.2.2 单因素实验
1.2.2.1 乳酸发酵条件的单因素实验 本实验考察了氢氧化钠作为中和剂,不同通气量(0、2.4、4.8、7.2和24 L/h)和不同pH(5.5、6.0、6.5)分别对凝结芽孢杆菌乳酸发酵特性的影响;氢氧化钙作为中和剂,通气量为7.2 L/h时,不同pH(5.5、6.0、6.5)对凝结芽孢杆菌乳酸发酵特性的影响。
1.2.2.2 菌体自溶的单因素实验 分别考察渗透压相同的不同盐溶液(CaCl20.2 mol/L,NH4Cl 0.3 mol/L,NaCl 0.3 mol/L,MgCl20.2 mol/L,KCl 0.3 mol/L)、不同渗透压的NaCl溶液(0.1、0.2、0.3、0.5 mol/L)以及渗透压相同而Na+:Ca2+摩尔比不同(1:0、1:2、1:1、2:1、0:1)的NaCl和CaCl2混合溶液分别对凝结芽孢杆菌在饥饿状态下菌体自溶的影响。本实验收集发酵8 h时的菌体重悬于上述溶液并保持OD620一致,50 ℃恒温培养箱静置培养24 h后测定OD620、菌落形成单位(Colony forming units,CFU)以及胞外溶出蛋白。
1.2.3 指标检测和计算方法
1.2.3.1 菌体光密度测定 本实验采用可见光分光光度计在620 nm处测定菌体光密度。取适量的菌液并用1 mol/L的稀盐酸稀释到适当倍数(排除碳酸钙固体对测量的干扰),分光光度计的读数控制在0.2~0.8,超出此范围会影响数值的准确性。
1.2.3.2 菌落形成单位测定 取菌液稀释到一定的倍数,吸取100 mL菌液涂布于平板培养基上,培养24 h后数菌落数(每个平板菌落数控制在50个左右)乘稀释倍数并记录。
1.2.3.3 糖含量测定 使用离子色谱系统HPIC检测,搭配Dionex Carbopac PA 20分离柱(3 mm×150 mm)和Dionex Carbopac PA 20保护柱(3 mm×30 mm),淋洗液体系由超纯水、200 mmol/L NaOH溶液两部分组成,并用氮气隔绝空气。取10 mL发酵液样品4 ℃,4000 r/min离心10 min,将上清和饱和草酸钠溶液按照1:3的比例进行混合(除去发酵液中Ca2+),4 ℃,4000 r/min离心23 min,留上清;然后将上清和无水乙醇按照1:5的比例混合(沉淀蛋白质),常温静置8 h以上,离心。检测过程中梯度洗脱方法:0~20 min用超纯水与200 mmol/L NaOH 按照9:1比例进行洗脱;20~30 min用200 mmol/L NaOH进行洗脱;30~60 min用超纯水与200 mmol/L NaOH 按照 9:1比例进行平衡柱子[7]。葡萄糖和海藻糖的标曲方程见表1。

表1 葡萄糖和海藻糖及乳酸测定标曲方程Table 1 Standard equation for the determination of glucose,trehalose and lactic acid
1.2.3.4 乳酸含量测定 使用HPLC检测,采用氢柱(VARIAN Metacarb-H plus column),柱前加保护柱,检测器为SPD-20AV,流动相为0.01 μmol/L稀硫酸,流速0.4 mL/min,紫外检测波长210 nm,进样量10 μL,柱温50℃,检测时间45 min。样品前处理:取10 mL发酵液离心,0.22 μm水相滤膜过滤上清液至液相小瓶中,用于HPLC测定[14]。乳酸的标准方程见表1。
1.2.3.5 溶出蛋白的测定 菌体自溶实验培养24 h后的菌液取5 mL,4000 r/min离心23 min,取上清,用超微量分光光度计测蛋白浓度。
1.2.3.6 糖酸转化率计算 为了分析不同条件下混合碳源乳酸发酵特性,可以通过计算不同碳源的糖酸转化率来进行评价,糖酸转化率公式如下:
式中:Yp/s为糖酸转化率,g/g;CfLac为检测点乳酸浓度,g/L;CiLac为初始乳酸浓度,g/L;CfCar为检测点糖浓度,g/L;CiCar为初始糖浓度,g/L。
1.2.3.7 菌体自溶率计算 为了分析不同自溶实验条件对菌体自溶程度的影响,可以通过计算菌体自溶率进行评价,菌体自溶率公式如下:
式中:ODi为初始OD620;ODf为最终OD620。
1.2.3.8 菌体存活率计算 为了分析菌体自溶前后的活性变化,可以通过计算菌体存活率进行评价,菌体存活率公式如下:
式中:CFUi为初始菌落数;CFUf为最终菌落数。
1.3 数据处理
本研究每个样品设置三个生物学重复,采用Excel和OriginPro(2021)进行数据处理和作图。
2 结果与分析
2.1 凝结芽孢杆菌混合碳源乳酸发酵特性
B. coagulansATCC7050 5 L罐混合碳源乳酸发酵过程可分为三个阶段:阶段I为葡萄糖消耗阶段,阶段II为有机酸消耗阶段,阶段III为海藻糖消耗阶段。
由图1可知,阶段I(0~10 h)菌体立即进入对数生长期OD620在发酵10 h达到5.4;阶段II(10~15 h)菌体快速自溶,OD620在15 h下降至2.0;阶段III(15 h至发酵结束)OD620维持在1.4左右直至发酵结束。乳酸生成呈现明显的分段现象,阶段I发酵到10 h乳酸浓度为17.53 g/L,乳酸生成速率为1.95 g/L/h,糖酸转化率为0.88 g/g,阶段III乳酸生成较为缓慢,发酵结束乳酸浓度为23.29 g/L乳酸,乳酸生成速率0.08 g/L/h,糖酸转化率为0.64 g/g。用NaOH作为中和剂的混合碳源乳酸发酵有明显的碳源分级利用现象,阶段I菌体将葡萄糖耗尽,葡萄糖消耗速率为2.12 g/L/h,但海藻糖未被利用。阶段III海藻糖利用逐渐加快,至发酵结束仍有9.82 g/L的海藻糖未被利用,海藻糖消耗速率为0.13 g/L/h。
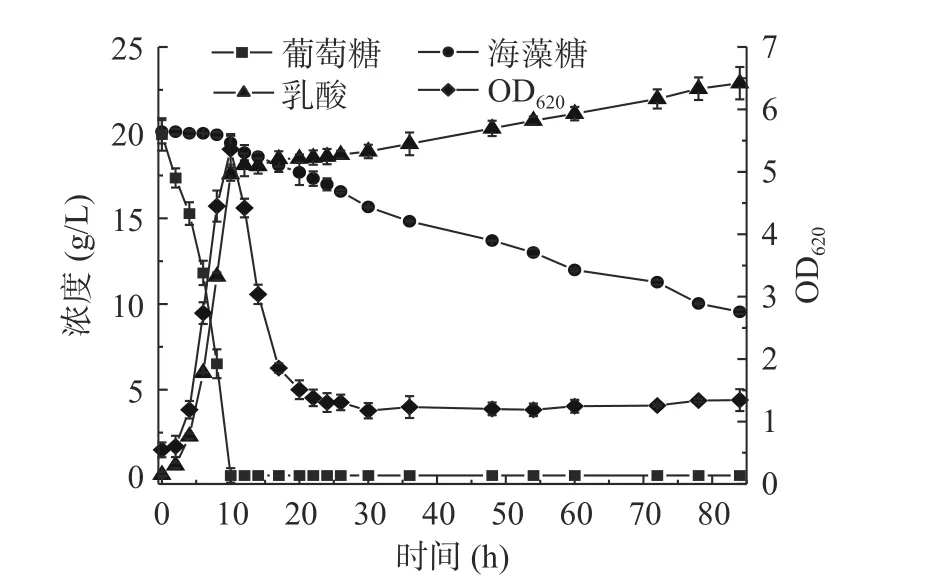
图1 B.coagulans ATCC7050混合碳源5 L罐乳酸发酵Fig.1 Profiles of lactic acid fermentation by B. coagulans ATCC7050 with mixed carbon sources at 5 L bioreactor
葡萄糖耗完后菌体的大量自溶不仅会造成发酵周期变长、乳酸得率降低和纯化产物流程复杂,而且不利于分解代谢物阻遏效应的研究[4]。为了缓解5 L罐中菌体降解[15],以及提高发酵后期海藻糖利用效率,需对5 L罐的发酵条件进行优化。
2.2 不同通气量对发酵特性的影响
凝结芽孢杆菌为兼性厌氧菌,溶氧会影响胞内的氧化还原水平,从而影响乳酸的生成[16−18]。由图2可知,不同通气量都在发酵10 h OD620达到最高,通气量为0、2.4、4.8、7.2和24 L/h的最高OD620分别为4.57、5.60、5.37、5.36和4.66。阶段II不同通气量的OD620均快速下降,阶段III的OD620维持在1.4左右直至发酵结束。不同通气量的乳酸浓度在阶段I和阶段II差距不大,在阶段III 7.2 L/h通气量的乳酸生成最高,直至发酵结束为22.89 g/L;0和24 L/h通气量的乳酸浓度较低,直至发酵结束分别为18.49和16.64 g/L。通气量为7.2 L/h的海藻糖消耗速率为0.12 g/L/h,均快于其他通气量组。
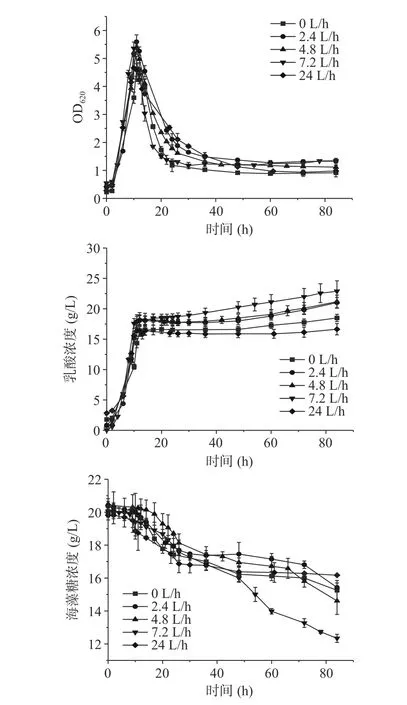
图2 B. coagulans ATCC7050混合碳源不同通气量的5 L罐发酵结果Fig.2 Profiles of lactic acid fermentation by B. coagulans ATCC 7050 with mixed carbon sources in 5 L bioreactor under different ventilation
综上所述,不同通气量对菌体生成和自溶影响较小,菌体自溶现象并未得到改善。在7.2 L/h通气量下底物消耗速率和产酸速率要优于其他通气量,可能是该阶段菌体代谢主要以消耗海藻糖产乳酸为主,过高或过低的通气量会破坏胞内的氧化还原平衡不利于乳酸合成[19]。
2.3 不同pH对发酵特性的影响
由图3可知,不同的pH都在阶段I发酵10 h OD620达到最高,pH为5.5、6.0和6.5的最高OD620分别为5.57、5.36和4.22。阶段II pH为5.5的OD620下降缓慢,其余两组都快速下降。阶段III pH为6.0的OD620维持在1.3左右直至发酵结束,pH为6.5菌体有二次生长现象OD620从最低的1.22上升到发酵结束的2.45。在乳酸生成方面,阶段I pH5.5的乳酸生成略低于pH6.0和6.5组,阶段III pH5.5没有乳酸生成,而pH6.0共生成4.34 g/L乳酸,pH6.5乳酸共生成16.62 g/L乳酸。阶段III pH5.5不利用海藻糖,pH6.0共消耗11.45 g/L海藻糖,pH6.5海藻糖全部耗尽。pH5.5、6.0和6.5在阶段I的糖酸转化率分别为0.81、0.91、0.85 g/g,pH6.0和6.5在阶段III的糖酸转化率分别为0.38和0.81 g/g。
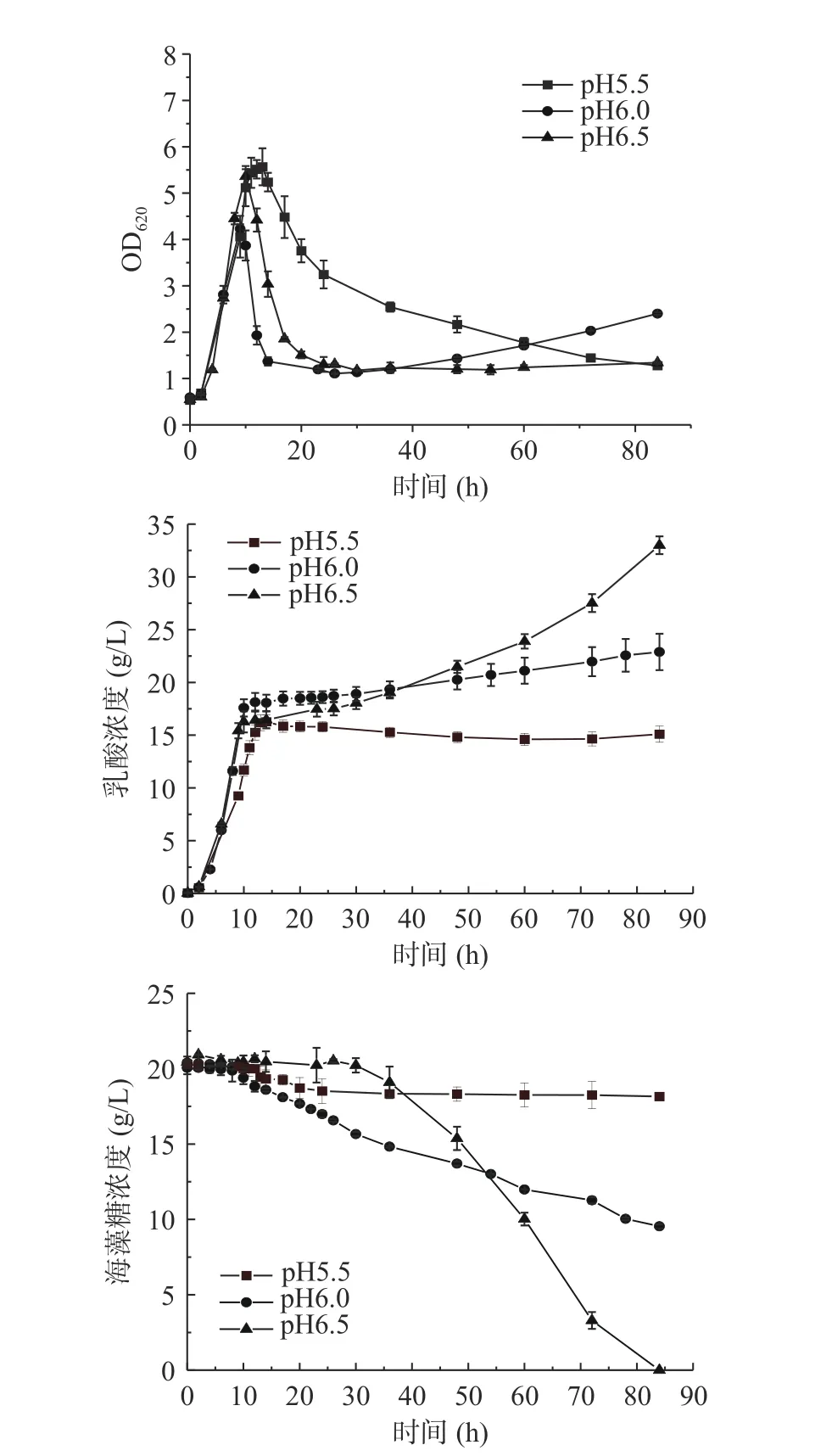
图3 NaOH作为中和剂的B. coagulans ATCC7050混合碳源不同pH的5 L罐发酵结果Fig.3 Profiles of lactic acid fermentation by B. coagulans ATCC7050 with mixed carbon sources in 5 L bioreactor under different pH
综上所述,pH越高在阶段I不利于菌体生长,但在阶段III海藻糖消耗和乳酸生成优势明显。虽然pH5.5在阶段II的菌体自溶略有缓解,但在阶段III OD620仍持续降低,原因可能是pH5.5时菌体整体代谢较为缓慢,并不足以维持较高的OD620,因此pH也并非引起菌体自溶的关键因素。pH对凝结芽孢杆菌混合碳源乳酸发酵的菌体生长[20−22]和代谢影响显著,可能是由于不同的pH会影响胞内代谢途径。Chen等[23]通过代谢网络模型模拟发现,凝结芽孢杆菌乳酸发酵提高pH能提高乳酸生成通量。
2.4 不同中和剂对发酵特性的影响
目前工业乳酸发酵常用氢氧化钠或氢氧化钙作为中和剂,前述用氢氧化钠作为中和剂控制不同的pH时在葡萄糖消耗完菌体都大量自溶。氢氧化钙作为中和剂的发酵结果如图4所示,相同pH用氢氧化钙作为中和剂的最高OD620都高于用氢氧化钠作为中和剂,且阶段II菌体自溶明显减少。pH6.5在阶段III直至发酵结束乳酸浓度为32.82 g/L,明显高于其余两组,pH5.5和6.0直至发酵结束乳酸浓度分别为21.60和26.86 g/L。pH6.5发酵结束海藻糖全部耗尽,其余两组都未耗完。pH5.5、6.0和6.5在阶段I的糖酸转化率分别为0.77、0.82、0.77 g/g,在阶段III的糖酸转化率分别为0.50、0.64和0.87 g/g。
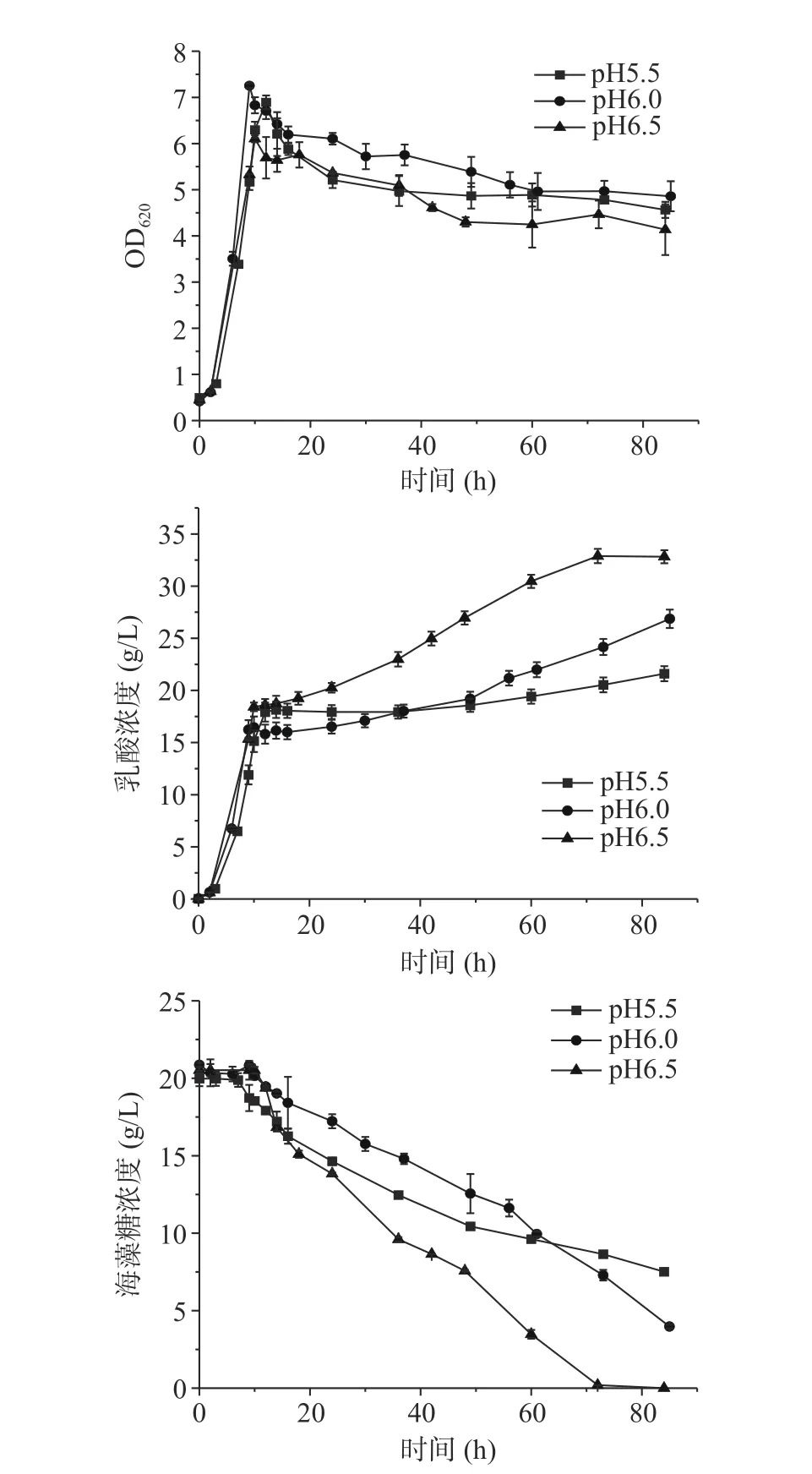
图4 Ca(OH)2作为中和剂的B. coagulans ATCC7050混合碳源不同pH的5 L罐发酵结果Fig.4 Profiles of lactic acid fermentation by B. coagulans ATCC7050 with mixed carbon sources in 5 L bioreactor under different pH using Ca(OH)2 as neutralizer
用Ca(OH)2在阶段I有更高的菌浓,且阶段II菌体自溶明显得到缓解,使得阶段III能维持较高的菌浓有利于海藻糖消耗和乳酸生成。用Ca(OH)2和NaOH控制pH呈现明显不同的发酵现象,可能是由于中和剂会造成发酵环境中金属离子和渗透压的差异[24−25]。金属离子在细胞代谢中起着重要作用,许多蛋白质均需要金属离子作为辅因子才能具有活性[26−28],故接下来研究了不同金属离子、渗透压等因素对饥饿状态下凝结芽孢杆菌自溶的影响。
2.5 金属离子对菌体自溶的影响
不同渗透压对菌体自溶的影响如图5A所示,0.2 mol/L NaCl组存活率明显高于其他组,说明在附近渗透压更有利于存活。0.5 mol/L组的自溶率明显低于其余组,且如图6A所示胞外蛋白浓度最少,可能是由于高渗环境中菌体脱水死亡,但菌体不裂解。不同离子对菌体自溶的影响如图5B所示,Ca2+和Mg2+组菌体自溶率明显低于其他一价金属离子组,分别为28%和27%,如图6B蛋白浓度和自溶成正比。Na+、K+和Mg2+组菌体的存活率显著(P<0.05)高于Ca2+和NH4+组,NH4+不仅不能缓解菌体自溶,且对菌体有害[29]。为了进一步探究Ca2+和Na+对菌体的影响,使用不同Na+:Ca2+混合溶液的结果如图5C所示,当有Ca2+存在时菌体自溶率均显著(P<0.05)降低,有Ca2+存在时菌体的存活率远低于仅含有Na+组,如图6C胞外蛋白浓度也能反映出菌体的自溶程度。
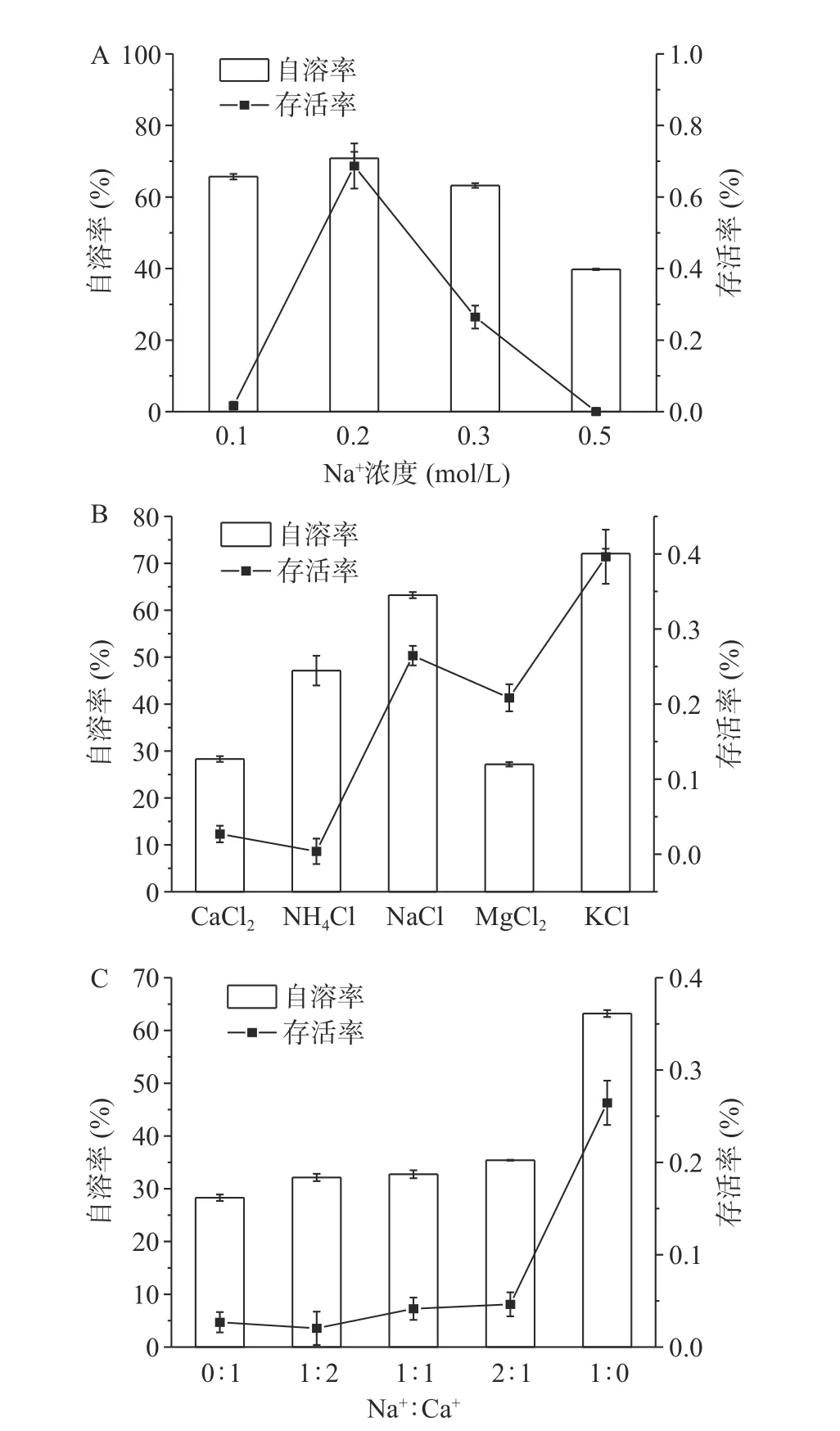
图5 不同条件对菌体自溶的影响Fig.5 Effects of different conditions on cell autolysis
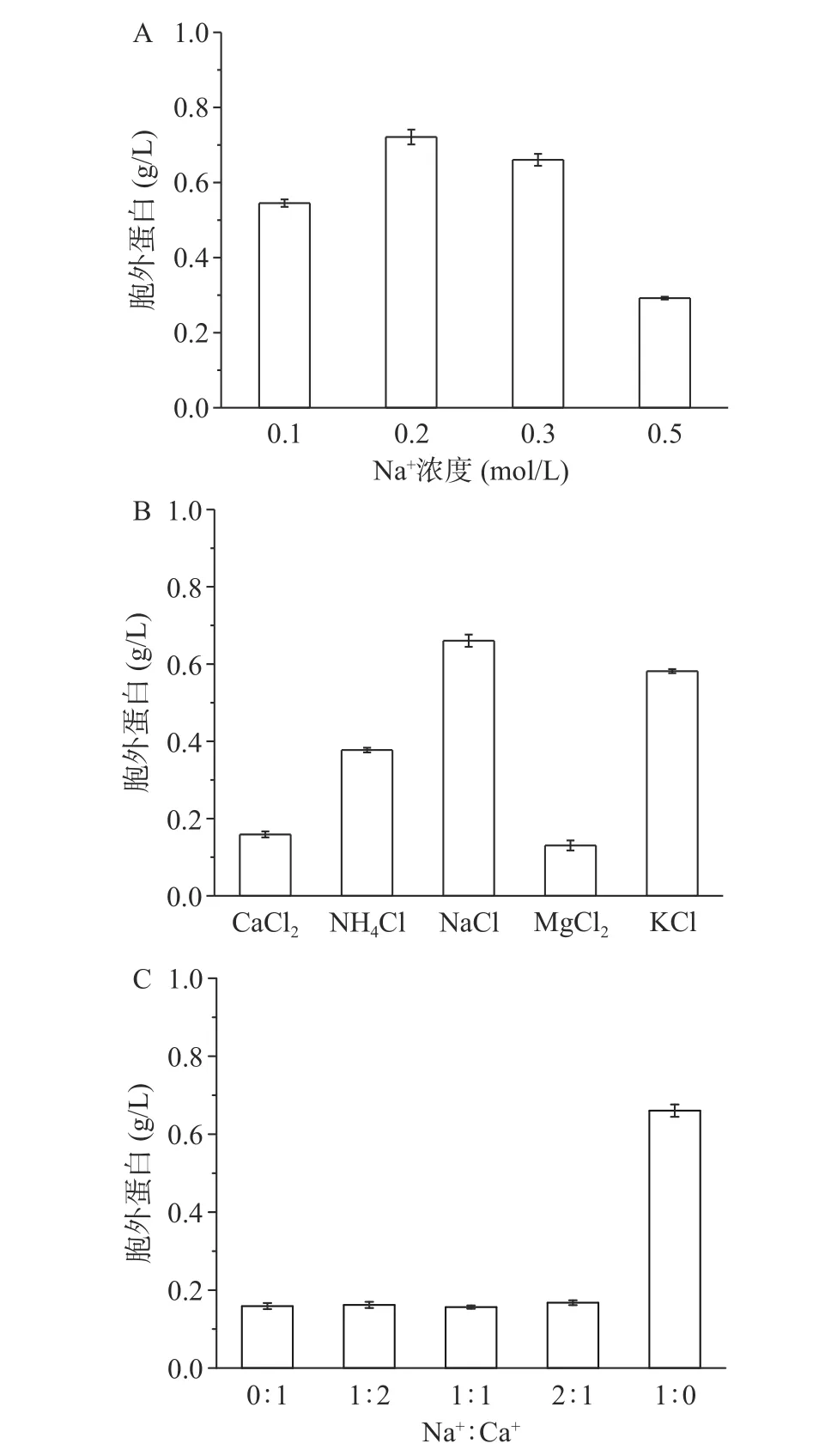
图6 不同条件对胞外蛋白浓度影响Fig.6 Extracellular protein concentrations under the different conditions
综上所述,Ca2+和Mg2+对菌体自溶有一定的缓解作用,可能是通过下调细胞壁水解相关基因同时上调细胞生长分裂相关基因来缓解自溶[30],而Na+和K+在饥饿环境中有利于维持菌体的活性。Lo等[31]也提出Mg2+离子可能对真核生物和原核生物细胞膜保护起到一定的作用,但目前机制尚未清楚。这也就能解释用Ca(OH)2作为中和剂在阶段I有较高菌浓,且在葡萄糖消耗完后,OD620缓慢下降直至启用海藻糖,使阶段III维持较高菌浓缩短发酵周期。
3 结论
本文用葡萄糖+海藻糖混合碳源模拟凝结芽孢杆菌工业乳酸发酵过程,并研究了不同通气量、pH、中和剂对混合碳源乳酸发酵过程的影响。研究发现不同通气量在阶段I和阶段II对糖耗和菌体生长影响不大,在阶段III通气量为7.2 L/h的海藻糖消耗和乳酸生成优于其他通气量。控制pH为6.5时,在阶段I虽然菌浓较低,但糖酸转化率高,与pH5.5和6.0差异不大;在阶段III耗糖和产酸速率均明显优于pH5.5和6.0,但较阶段I仍有较大差距。与用NaOH作为中和剂相比,用Ca(OH)2做为中和剂在阶段I有更高的菌浓,且阶段II菌体自溶明显得到缓解,在阶段III能维持较高的菌浓有利于海藻糖消耗和乳酸生成。最后通过研究金属离子、渗透压和不同钙钠离子比在饥饿环境中对菌体自溶和活性的影响,发现Ca2+和Mg2+能缓解菌体自溶,Na+和K+在饥饿环境中有利于维持菌体的活性。
