栀子酒炙前后挥发油成分及保肝作用比较 Δ
2023-02-27唐怡周立分严志宏邵坚江西省中西医结合医院药剂科南昌000江西中医药大学实验室服务中心南昌0004江中药业股份有限公司南昌0096
唐怡 ,周立分 ,严志宏 ,邵坚 (1.江西省中西医结合医院药剂科,南昌 000;.江西中医药大学实验室服务中心,南昌 0004;.江中药业股份有限公司,南昌 0096)
栀子为茜草科植物栀子Gardenia jasminoides Eillis的干燥成熟果实[1],具有清热、凉血、解毒的功效[2]。栀子苦寒,易伤脾胃,故入药的栀子需炮制。从古至今,栀子的炮制品有生栀子、炒栀子、焦栀子、姜栀子、栀子炭、盐栀子、蜜栀子、酒栀子、童便炒栀子、甘草水炒栀子等[3]。其中,酒栀子可以利用黄酒的性大热、味甘辛、气味芳香、能升能散的性质缓解栀子的苦寒收敛,与其他炙法相比还可矫正苦寒、宣行药势[3―4]。本课题组前期研究发现,栀子生品和炒制品以及栀子不同提取部位都具有保肝作用[5―6],至于酒栀子是否也有保肝作用,目前尚不清楚。基于此,本实验采用水蒸气蒸馏法提取生栀子和酒栀子中的挥发油,利用气相色谱-质谱联用仪鉴定并比较栀子酒炙前后挥发油成分的变化,并以四氯化碳建立肝损伤大鼠模型,比较生栀子和酒栀子的保肝作用,以期为酒栀子的临床应用提供理论支持。
1 材料
1.1 主要仪器
本研究所用主要仪器包括ME204T/02型电子天平[梅特勒-托利多仪器(上海)有限公司];L-500型低速离心机(湖南湘仪实验室仪器开发有限公司);Agilent 8890型气相色谱-质谱联用仪(美国安捷伦公司);AU480型全自动生化分析仪和AllegraTM64R型高速离心机(美国贝克曼库尔特有限公司);UV-1800型紫外可见分光光度计(日本岛津公司);T10型分散机(德国艾卡公司);BA410EF-UPR型显微镜(麦克奥迪实业集团有限公司)。
1.2 主要药品与试剂
栀子药材采集于江西樟树天齐堂中药材规范化种植基地,2021年9月果实成熟时采收,除去果柄及杂质,沸水中略烫,取出,干燥,经江西省中西医结合医院药剂科唐莉华副主任中药师鉴定为茜草科植物栀子G. jasminoides Ellis的干燥成熟果实。山西桂花黄酒[酒精度15%(V/V)]购自山西省四达酒类饮料有限责任公司;联苯双酯滴丸(批号A02130315,规格1.5 mg)购自万邦德制药集团股份有限公司;苏木精-伊红(HE)染液和丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒均购自南京建成生物工程研究所,批号分别为20201215、2014121、20141025;腺苷脱氨酶(adenosine deaminase,ADA)、碱性磷酸酶(alkaline phospholipase,ALP)、丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、直接胆红素(direct bilirubin,DBIL)、总胆汁酸(total bile acid,TBA)、总胆红素(total bilirubin,TBIL)、乳酸脱氢酶(lactate dehydrogenase,LDH)、总蛋白(total protein,TP)、前白蛋白(prealbumin,PA)检测试剂盒均购自南昌百特生物高新技术股份有限公司,批号分 别 为 141107、141015、141022、141013、141021、140930、140929、140519、141016、140910;二氯甲烷(分析纯)购自西陇化工股份有限公司;无水硫酸钠(分析纯)购自天津市大茂化学试剂厂;四氯化碳、无水乙醇和甲醛均购自国药集团化学试剂有限公司;水为蒸馏水。
1.3 实验动物
SPF级雄性SD大鼠,体质量(200±20)g,购自湖南斯莱克景达实验动物有限公司,实验动物生产许可证号为SCXK(湘)2019-0004。
2 方法
2.1 药材预处理
2.1.1 生栀子 称取栀子药材1 kg,研碎,过六号筛。
2.1.2 酒栀子 将生栀子与黄酒混合,拌匀,至酒尽,于180 ℃下炒制3 min左右,至药材表面呈金黄色,取出,放凉。每500 g生栀子用100 g黄酒。
2.2 栀子酒炙前后挥发油成分的变化考察
2.2.1 挥发油成分提取 分别称取生栀子或酒栀子粉末100 g,置于圆形挥发油提取器中,加6倍量蒸馏水浸泡过夜,后置于1 000 mL电热套中,提取6 h至挥发油量不再增加为止。收集蒸馏液,置于分液漏斗中,取等量二氯甲烷萃取3次后,用无水硫酸钠除水浓缩至1 mL左右,再用0.45 μm滤膜过滤,即得。经计算,生栀子和酒栀子的挥发油质量分数分别为0.8、0.9 μL/g。
2.2.2 阴性对照溶液制备 精确移取5 mL黄酒于离心管中,加入3 mL二氯甲烷和1 g氯化钠,4 000 r/min离心10 min,吸取下层相,同法再萃取1次,合并2次萃取液于15 mL离心管中。在离心管中加入约l g无水硫酸钠,充分混匀,吸取有机层,浓缩至0.5 mL,用0.45 μm滤膜过滤,即得。
2.2.3 气相色谱条件 气相色谱条件如下:采用石英毛细管柱(0.25 μm×250 μm×30.0 m),载气为高纯氦气(99.999%),柱流速为1.0 mL/min,汽化室温度为250 ℃。升温程序如下:50 ℃保持15 min,以4 ℃/min升温到130 ℃,再以10 ℃/min升温到220 ℃,再以10 ℃/min升温到280 ℃,保持10 min;分流比为50∶1,进样量为1.0 μL。
2.2.4 质谱条件 质谱条件如下:采用电子轰击离子源,电子能量为70 eV,质量扫描范围为m/z 50.00~500.00,柱箱温度为40.0 ℃,进样温度为280.0 ℃,进样模式为分流,流量控制模式为总流量14.0 mL/min、柱流量1.00 mL/min、吹扫流量3.0 mL/min,压力为49.5 kPa,离子源温度为200 ℃,接口温度为250 ℃,四极杆温度为230 ℃,检测模式为全离子扫描监测,溶剂延迟时间为3.5 min。
2.2.5 化合物鉴定 总离子流图中的各色谱峰经质谱扫描后得到相应的质谱图,经过计算机质谱数据系统检索(质谱数据库:NIST17库),结合各个物质的美国化学会的下设组织化学文摘社(Chemical Abstracts Service,简称CAS)号比对相关信息,确定其归属。
2.3 栀子酒炙前后保肝作用考察
2.3.1 药液制备 称取生栀子或酒栀子150 g,加10倍量55%乙醇回流2次,每次60 min[7],趁热抽滤,合并滤液,置于水浴锅中蒸发,后恒温减压干燥处理,制成生栀子或酒栀子的冻干粉。临用时,用蒸馏水将相应冻干粉溶解制成所需浓度的药液。
2.3.2 动物分组、给药与建模 大鼠适应性饲养1周后,随机分为正常组,模型组,阳性对照组(联苯双酯混悬液35 mg/kg[5―6]),生栀子低、高剂量组[1、2 g/kg(以生药量计)[5―6]],酒栀子低、高剂量组[1、2 g/kg(以生药量计)[5―6]],每组10只。正常组和模型组大鼠灌胃蒸馏水,各给药组大鼠灌胃相应药液,给药体积为0.02 mL/g,连续给药7 d。末次给药2 h后,除正常组外其余各组大鼠腹腔注射40%四氯化碳3 mL/kg[5―6],建立肝损伤模型。
2.3.3 生化指标检测 大鼠注射给药后,禁食不禁水16 h,观察其状态后眼球取血,2 000 r/min离心15 min,取上层血清,于4 ℃密封保存。采用AU480型全自动生化分析仪检测各组大鼠血清中ADA、AST、ALT、ALP、LDH、TBA、TBIL、DBIL、TP、PA的水平。取血后脱颈处死大鼠,摘取肝组织。取部分肝组织制成匀浆,以2 000 r/min离心15 min,取上清液。按试剂盒说明书操作,采用紫外可见分光光度计检测各组大鼠肝组织匀浆上清液中SOD和MDA的水平。
2.3.4 肝组织病理检查 取剩余的肝组织用10%甲醛固定,常规石蜡包埋,切片(厚度约4.5 μm),脱蜡,用HE染色,脱水,光学树脂胶封片,显微镜下观察肝组织病理变化。
2.4 统计学方法
3 结果
3.1 栀子酒炙前后的挥发油成分
依据上述气相色谱和质谱条件,得生栀子、酒栀子和阴性对照溶液(黄酒)的总离子流图(图1)。在默认的积分设置下,生栀子和酒栀子均检测到100多个化合物,但有一部分化合物的匹配度非常低。本研究仅选取匹配度≥85%,相对质量分数>1%的化合物进行鉴定,用峰面积归一化法测定其相对质量分数,结果见表1。
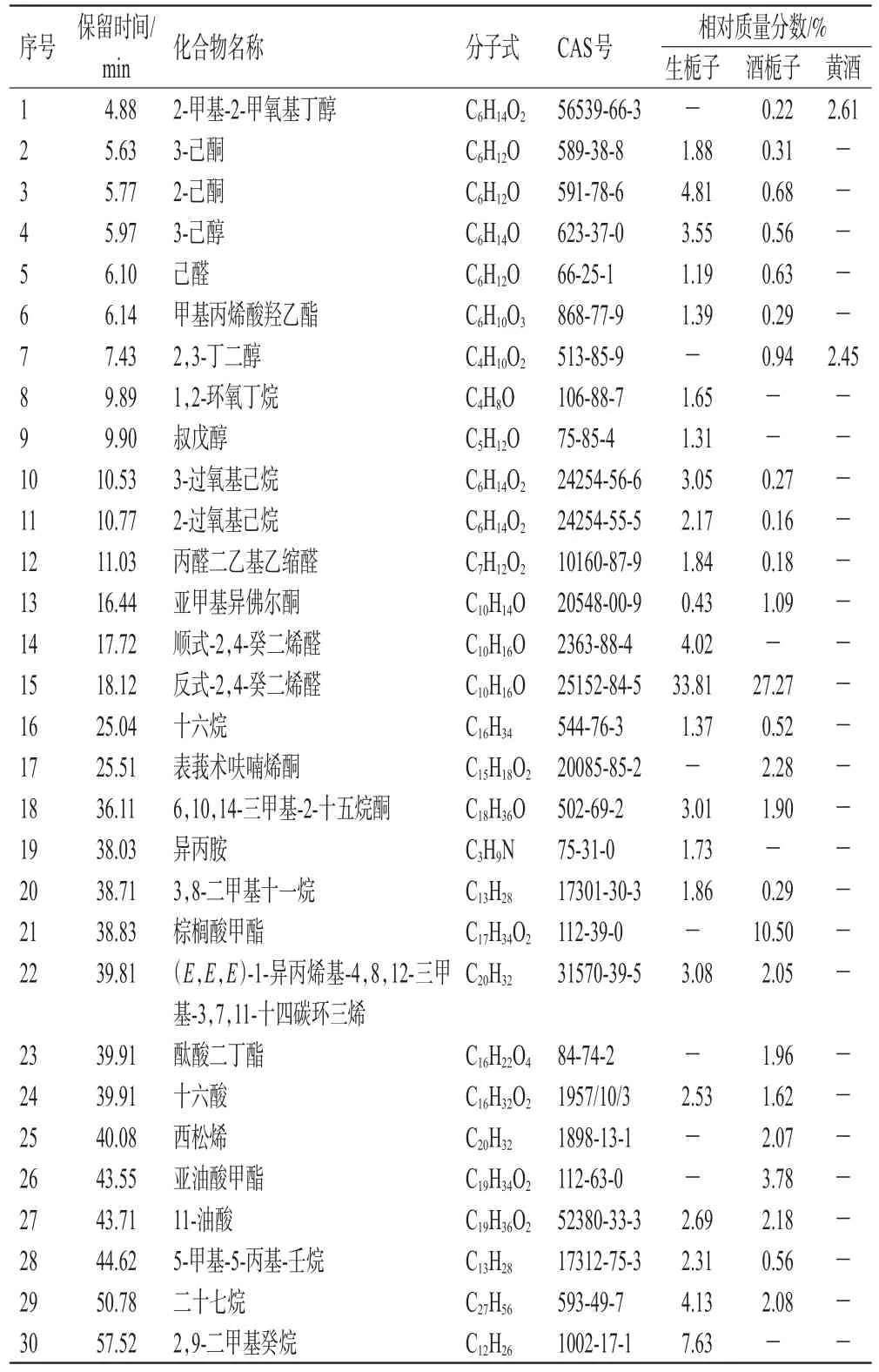
表1 生栀子、酒栀子和黄酒的挥发油成分及其相对质量分数
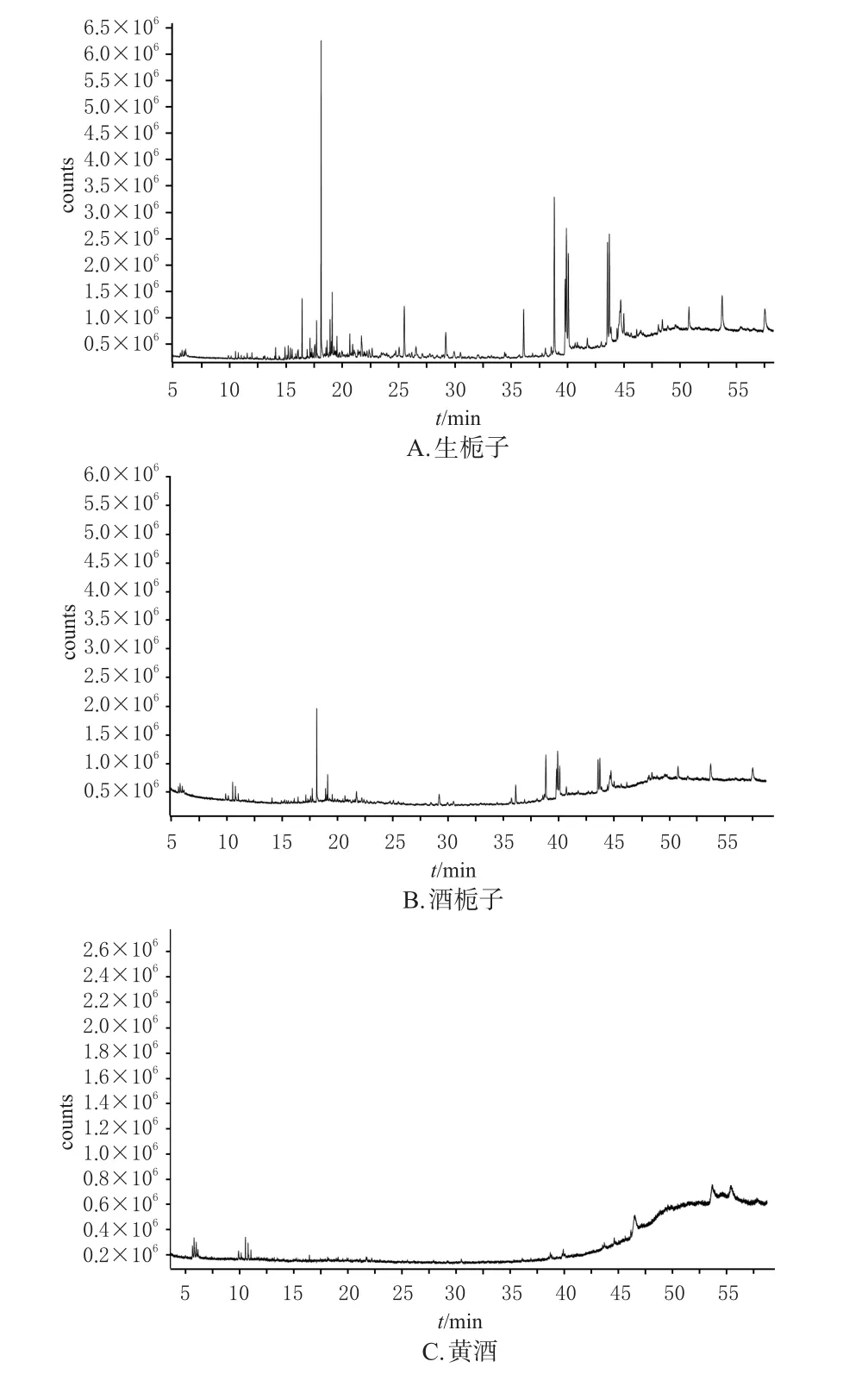
图1 生栀子、酒栀子、黄酒的挥发油的总离子流图
3.2 栀子酒炙前后保肝作用比较
3.2.1 大鼠状态 正常组和阳性对照组大鼠无明显异常,状态良好。模型组大鼠出现活动减少、成群蜷卧、弓背神萎、皮毛无光泽等萎靡症状;相比模型组,生栀子和酒栀子的各剂量组大鼠上述萎靡症状均有不同程度改善。
3.2.2 血清生化指标 与正常组比较,模型组大鼠血清中ADA、ALP、ALT、AST、DBIL、LDH、PA、TBA、TBIL水平均显著升高,TP水平显著降低,差异均有统计学意义(P<0.05或P<0.01)。与模型组比较,各给药组大鼠血清中ADA、ALT、AST、DBIL、LDH、PA、TBA、TBIL水平均显著降低,TP水平均显著升高,差异均有统计学意义(P<0.05或P<0.01),但各给药组大鼠上述大部分指标都没有恢复到正常组水平。结果见表2。
表2 各组大鼠血清生化指标结果(±s,n=10)
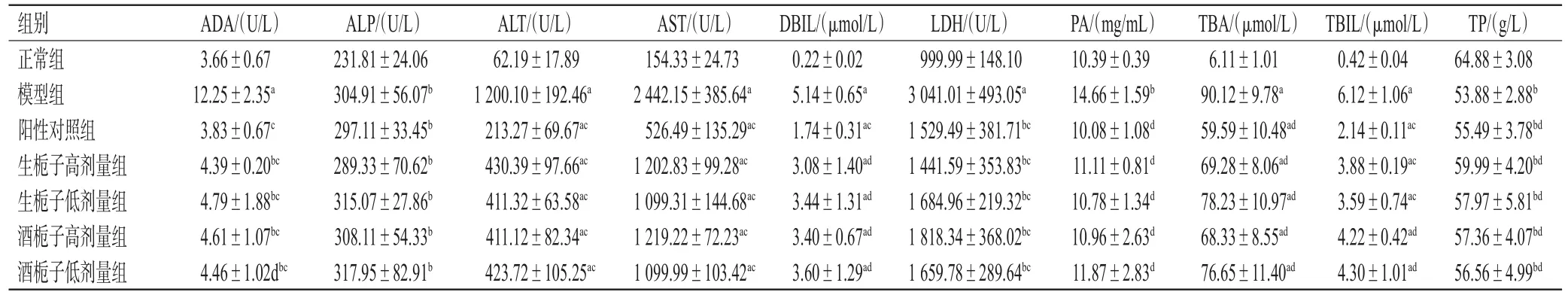
表2 各组大鼠血清生化指标结果(±s,n=10)
a:与正常组比较,P<0.01;b:与正常组比较,P<0.05;c:与模型组比较,P<0.01;d:与模型组比较,P<0.05
组别正常组模型组阳性对照组生栀子高剂量组生栀子低剂量组酒栀子高剂量组酒栀子低剂量组TP/(g/L)64.88±3.08 53.88±2.88b 55.49±3.78bd 59.99±4.20bd 57.97±5.81bd 57.36±4.07bd 56.56±4.99bd ADA/(U/L)3.66±0.67 12.25±2.35a 3.83±0.67c 4.39±0.20bc 4.79±1.88bc 4.61±1.07bc 4.46±1.02dbc ALP/(U/L)231.81±24.06 304.91±56.07b 297.11±33.45b 289.33±70.62b 315.07±27.86b 308.11±54.33b 317.95±82.91b ALT/(U/L)62.19±17.89 1 200.10±192.46a 213.27±69.67ac 430.39±97.66ac 411.32±63.58ac 411.12±82.34ac 423.72±105.25ac AST/(U/L)154.33±24.73 2 442.15±385.64a 526.49±135.29ac 1 202.83±99.28ac 1 099.31±144.68ac 1 219.22±72.23ac 1 099.99±103.42ac DBIL/(μmol/L)0.22±0.02 5.14±0.65a 1.74±0.31ac 3.08±1.40ad 3.44±1.31ad 3.40±0.67ad 3.60±1.29ad LDH/(U/L)999.99±148.10 3 041.01±493.05a 1 529.49±381.71bc 1 441.59±353.83bc 1 684.96±219.32bc 1 818.34±368.02bc 1 659.78±289.64bc PA/(mg/mL)10.39±0.39 14.66±1.59b 10.08±1.08d 11.11±0.81d 10.78±1.34d 10.96±2.63d 11.87±2.83d TBA/(μmol/L)6.11±1.01 90.12±9.78a 59.59±10.48ad 69.28±8.06ad 78.23±10.97ad 68.33±8.55ad 76.65±11.40ad TBIL/(μmol/L)0.42±0.04 6.12±1.06a 2.14±0.11ac 3.88±0.19ac 3.59±0.74ac 4.22±0.42ad 4.30±1.01ad
3.2.3 肝组织生化指标 与正常组比较,模型组大鼠肝组织中SOD水平显著降低,MDA水平显著升高,差异均有统计学意义(P<0.05)。与模型组比较,各给药组大鼠肝组织中MDA水平均显著降低(P<0.05),SOD水平有降低趋势,但差异无统计学意义。结果见表3。
表3 各组大鼠肝脏中SOD和MDA水平测定结果(±s,n=10)
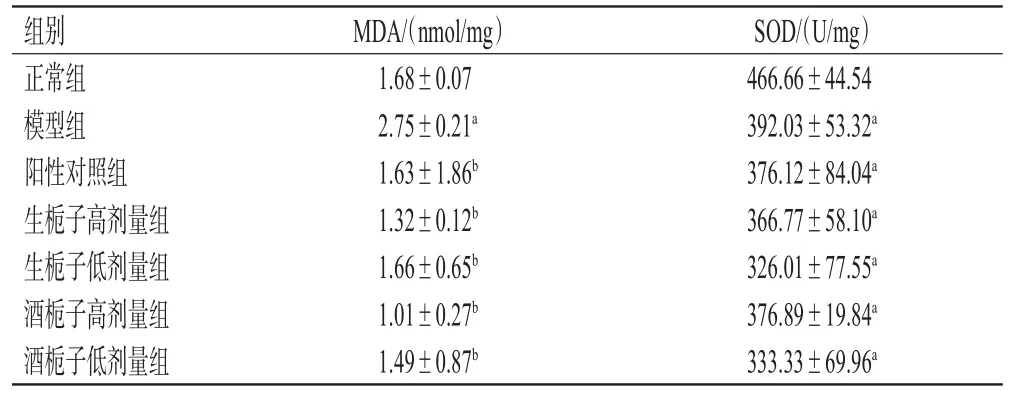
表3 各组大鼠肝脏中SOD和MDA水平测定结果(±s,n=10)
a:与正常组比较,P<0.05;b:与模型组比较,P<0.05
组别正常组模型组阳性对照组生栀子高剂量组生栀子低剂量组酒栀子高剂量组酒栀子低剂量组MDA/(nmol/mg)1.68±0.07 2.75±0.21a 1.63±1.86b 1.32±0.12b 1.66±0.65b 1.01±0.27b 1.49±0.87b SOD/(U/mg)466.66±44.54 392.03±53.32a 376.12±84.04a 366.77±58.10a 326.01±77.55a 376.89±19.84a 333.33±69.96a
3.2.4 肝组织病理变化 正常组大鼠肝细胞结构完整、呈正常的放射状整齐排列,细胞形态正常;模型组大鼠肝细胞出现气球样变化,高度肿胀,多数细胞的胞浆内有很大的空泡(肝细胞变性的特征),细胞核聚集且增多;各给药组大鼠肝细胞变性较模型组均有不同程度的改善。显微图见图2。
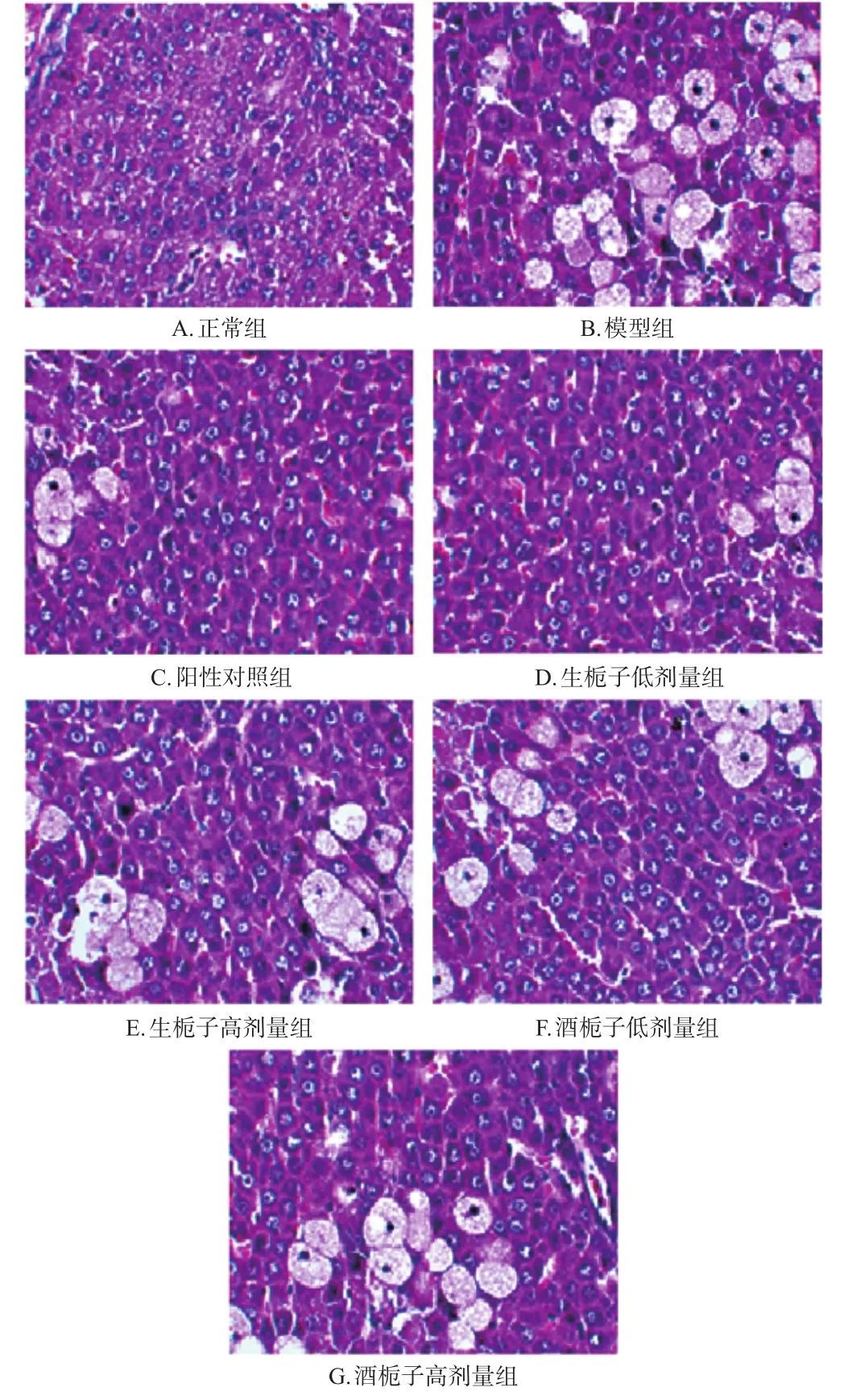
图2 生栀子和酒栀子对模型大鼠病理改变的影响(HE,×200)
4 讨论
4.1 栀子酒炙前后挥发油总离子流图比较
从图1可以看出,生栀子和酒栀子的挥发油总离子流图较为相似。生栀子和酒栀子挥发油的差异主要集中在16.44~19.59、20.83~25.51、38.80~41.01 min。在这3个时间段,酒栀子挥发油的离子流强度均弱于生栀子挥发油,这可能与栀子经酒炙后有些挥发油成分经高温破裂或随着黄酒的加入一起挥发减少有关。另酒栀子挥发油和黄酒在4.88、7.43 min时均显示有峰,而生栀子挥发油却没有显示,且黄酒在此时间段的离子流强度高于酒栀子,结合表1发现,酒栀子和黄酒共有2个醇类成分,且酒栀子中的含量低于黄酒,说明这些成分可能来源于黄酒。
4.2 栀子酒炙前后挥发油成分变化
本实验鉴定出了生栀子挥发油成分23个,酒栀子挥发油成分25个,黄酒挥发油成分2个,其中生栀子和酒栀子共有挥发油成分18个。生栀子炮制至酒栀子的过程中,有17个挥发油成分含量降低,这可能也与栀子经酒炙后有些挥发油成分经高温破裂或随者黄酒的加入一起挥发减少有关。另外,生栀子炮制至酒栀子的过程中,亚甲基异佛尔酮的含量升高,这可能是随着炮制温度的提高和黄酒的升散性质,药材组织变得蓬松,从而致使其含量升高。
4.3 栀子酒炙前后保肝作用比较
血清生化指标结果显示,生栀子和酒栀子均可显著降低肝损伤模型大鼠的ADA、ALT、AST、DBIL、LDH、PA、TBA、TBIL水平,提高TP水平,可见生栀子和酒栀子具有明显的降肝酶能力,还可改善肝脏蛋白质合成功能,具有一定的保肝作用。
SOD作为体内重要的自由基-超氧自由基的天然清除剂,是免除自由基损伤的主要防御酶,其水平高低可间接反映清除氧自由基的能力;MDA作为脂质过氧化反应的重要产物,其水平高低可间接反映机体细胞受自由基攻击的严重程度,肝组织中二者水平能有效指示肝功能的状况[8―10]。本实验结果显示,模型组大鼠肝组织中SOD水平显著低于正常组,MDA水平显著高于正常组,表明肝损伤建模成功。各给药组大鼠肝组织中MDA水平显著低于模型组。结合血清生化指标、肝组织生化指标和肝组织病理图片,可知生栀子和酒栀子的各给药组大鼠虽然大部分指标都没有恢复到正常组水平,但相比模型组,均有一定的肝保护作用。
综上所述,生栀子炮制至酒栀子的过程中,有17个共有挥发油成分含量降低,有1个共有挥发油成分含量升高。酒栀子具有一定的保肝作用。
