欧前胡素对恶病质模型小鼠的改善作用及机制研究 Δ
2023-02-27王雅娴杨全军郭澄上海中医药大学药学院上海0103上海交通大学医学院附属第六人民医院药剂科上海0033
王雅娴 ,杨全军 ,郭澄 (1.上海中医药大学药学院,上海 0103;.上海交通大学医学院附属第六人民医院药剂科,上海 0033)
肿瘤恶病质是一种以骨骼肌质量持续损失为特征的多因素综合征,或伴随着脂肪组织的损耗[1],传统的营养支持不能完全逆转。其伴随着肌原纤维蛋白水解、脂肪组织分解增加、胰岛素抵抗、能量代谢异常和食物摄入量减少[2],从而降低患者的治疗效果和生活质量,进一步恶化肿瘤患者的病情[3]。2020年全球有1 930万新发癌症病例和近1 000万癌症死亡病例[4],然而50%~80%的晚期癌症患者会出现恶病质,其中至少20%直接因恶病质而死亡[5],而非因为肿瘤本身。肿瘤恶病质发病机制复杂,迄今为止,仍然缺乏有效的干预手段,治疗方法多为营养治疗加体育锻炼[6]。在药物治疗方面,醋酸甲地孕酮作为唯一一个获批用于治疗肿瘤相关恶病质的药物,临床上常用其来刺激食欲,使得患者体质量增加,但其增加的是体脂含量而不是骨骼肌质量[7]。在肿瘤恶病质中,骨骼肌又是蛋白质丢失的主要部位[8],肌肉质量和力量慢慢丧失,导致患者身体功能下降,且骨骼肌萎缩降低了患者对几种常见癌症治疗方法的耐受性[9],因此研究肿瘤恶病质引起肌肉萎缩的治疗方法具有重要的临床意义。
欧前胡素是一种天然的呋喃香豆素类化合物,广泛存在于各类植物中[10]。欧前胡素的药理作用广泛,主要集中在抗氧化、抗肿瘤、抗炎、抗菌、抗病毒、抗过敏和神经保护方面[11―12]。因此,本研究通过构建肿瘤恶病质小鼠模型,旨在探索欧前胡素改善肿瘤恶病质肌肉萎缩的作用效果及机制,以期为临床治疗肿瘤恶病质提供更多实验依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有ABI ViiA7型实时荧光定量PCR仪、NanoDrop 2000型核酸蛋白浓度分析仪(美国Thermo Fisher Scientific公司),Ⅸplore Standard型荧光倒置显微镜(日本Olympus公司),Mini型蛋白电泳系统电泳仪和转膜仪(美国Bio-Rad公司),KZ-Ⅲ-F型低温型研磨仪(武汉赛维尔生物科技有限公司),Amersham Imager 600型化学发光成像仪(美国GE Healthcare Bio-Sciences AB公司)。
1.2 主要药品与试剂
欧前胡素(货号MUST-21030804,纯度>98%)购自成都曼思特生物科技有限公司;羧甲基纤维素钠(CMCNa,货号G1121)购自北京索莱宝科技有限公司;BCA蛋白定量试剂盒(货号P0011)购自上海碧云天生物技术有限公司;苏木素-伊红(HE)染料、麦胚凝聚素(WGA)染料均购自武汉赛维尔生物科技有限公司,货号分别为G1001、GDP1020;兔源肌细胞生成素(Myogenin,Myog)单克隆抗体、兔源肌肉萎缩盒F蛋白(Muscle atrophy F box,MAFbx)多克隆抗体均购自英国Abcam公司,货号分别为ab1835、ab168372;兔源B细胞淋巴瘤2(B-cell lymphoma-2,Bcl-2)单克隆抗体、兔源Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)单克隆抗体、山羊抗兔辣根过氧化物酶标记的IgG二抗、山羊抗鼠辣根过氧化物酶标记的IgG二抗均购自美国CST公司,货号分别为15071、89477、7074S、7076S;兔源磷酸化信号转导和转录因子3(phosphorylation-signal transducer and activator of transcription 3,p-STAT3)单克隆抗体、兔源信号转导和转录因子3(signal transducer and activator of transcription 3,STAT3)多克隆抗体、兔源胱天蛋白酶 3(Caspase3)单克隆抗体均购自武汉爱博泰克生物科技有限公司,货号分别为AP0705、A1192、A19654;鼠源微管蛋白(β-tubulin)单克隆抗体(货号bsm-33034M)购自北京博奥森生物技术有限公司;ECL超灵敏化学发光检测试剂盒(货号SQ201)购自上海雅酶生物科技有限公司;引物序列由生工生物工程(上海)股份有限公司设计合成,详见表1。

表1 RPS18等基因引物序列和引物长度
1.3 动物与细胞
SPF级雄性C57BL/6J小鼠(6周龄)15只,体质量18~22 g,购于上海计划生育研究所实验动物经营部,生产许可证号为SCXK(沪)2018-0006。动物实验已通过上海市第六人民医院动物福利伦理委员会批准,编号为DWLL2022-0545。小鼠肺癌LLC细胞购于中国科学院典型培养物保藏委员会细胞库。
2 方法
2.1 动物分组、建模及给药
将15只雄性C57BL/6J小鼠随机分为空白对照组、模型组和欧前胡素组,每组5只。参考相关文献[13]的方法建立模型,除空白对照组外,余下2组小鼠均于背部皮下接种0.1 mL LLC细胞混悬液(细胞密度约为1×106个/mL),空白对照组注射等体积的生理盐水。接种LLC细胞混悬液第7 天观察,除空白对照组小鼠外,其余小鼠可见肿瘤,并于第7天开始每日灌胃给药干预。参考相关文献[14]并结合前期预实验结果,欧前胡素组按60 mg/kg灌胃欧前胡素混悬液(溶剂为0.5%CMC-Na溶液),空白对照组和模型组给予等体积0.5%CMC-Na溶液,连续给药13 d。
2.2 指标检测
2.2.1 一般指标检测 给药期间,每日定时记录小鼠的摄食量和体质量;每两日测量一次肿瘤的长径(x)和短径(y),计算肿瘤体积V(V=x×y2/2);取材当日称量肿瘤质量和骨骼肌质量,并计算去瘤体质量。
2.2.2 取材 末次给药结束后,用1%戊巴比妥按体质量5 mL/kg对小鼠进行麻醉,然后颈椎脱臼处死小鼠,取下肿瘤和双侧后肢骨骼肌,将部分骨骼肌置于4%多聚甲醛中固定,剩余部分放在-80 ℃冷冻保存用于后续实验检测。
2.2.3 骨骼肌病理学检测和纤维横截面积计算 将4%多聚甲醛固定的骨骼肌组织包埋于石蜡中,制作石蜡切片,用常规方法进行HE染色,于显微镜下观察病理变化,采集图片。另取石蜡切片进行WGA染色,观察骨骼肌纤维横截面积的变化,每组测量100个骨骼肌纤维横截面积大小,并使用Image Pro Plus 6.0软件对小鼠骨骼肌纤维横截面积进行计算。
2.2.4 骨骼肌萎缩和凋亡相关蛋白表达检测 采用Western blot法进行检测。取出部分存于-80 ℃的各组小鼠骨骼肌用于总蛋白提取,BCA法测量蛋白浓度,对蛋白浓度进行调平。每组动物均随机选取3个蛋白样本进行实验,蛋白经10%SDS-PAGE电泳分离后,电转至PVDF膜上,5%牛血清白蛋白封闭1 h,分别加入β-tubulin、p-STAT3、STAT3、Myog、MAFbx、Bcl-2、Bax、Caspase3一抗(稀释比均为1∶1 000),于4 ℃摇床孵育过夜。次日用TBST洗膜4次,每次5 min,加入相应二抗(稀释比均为1∶10 000),常温孵育1 h后,用TBST洗膜3次,每次5 min,ECL化学发光法显影成像。收集图片,使用Image J软件进行灰度值计算,以目标蛋白与内参β-tubulin灰度值的比值作为其表达量,以p-STAT3与STAT3灰度值的比值反映STAT3的磷酸化水平,空白对照组作为统计结果矫正组。
2.2.5 骨骼肌萎缩和凋亡相关基因表达检测 采用实时荧光定量PCR法进行检测。取20 mg骨骼肌,加入1 mL Trizol,放入研磨机中低温匀浆裂解,提取组织总RNA,测定纯度和浓度后,取1 μg RNA配制成20 μL反应体系,将RNA反转为cDNA。逆转录采用两步法反应程序:95 ℃预变性 10 min;95 ℃变性 15 s,60 ℃退火 60 s,40个循环反应。以RPS18为内参,采用2-ΔΔCt计算各基因的相对表达量,空白对照组作为统计结果矫正组。
2.3 统计学分析
采用GraphPad Prism 8.0软件、SPSS 22.0软件对数据进行统计学分析和作图,数据均以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 欧前胡素对恶病质模型小鼠一般指标的影响
与空白对照组比较,模型组小鼠体质量、骨骼肌质量均显著降低(P<0.05),摄食量有所下降;与模型组比较,欧前胡素组小鼠经过给药干预后体质量下降的变化速度有所减缓,最终的体质量、去瘤体质量、骨骼肌质量均显著升高(P<0.05),摄食量有所提高,同时肿瘤质量和肿瘤体积均显著降低(P<0.05),表明欧前胡素在抗肿瘤恶病质的基础上兼有抗肿瘤功效。结果见图1。
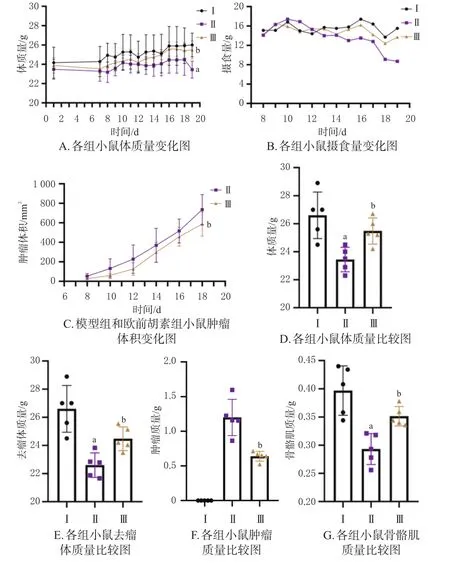
图1 欧前胡素对恶病质模型小鼠一般指标的影响(n=5)
3.2 欧前胡素对恶病质模型小鼠骨骼肌病理状态及纤维横截面积的影响
HE染色切片可以看出空白对照组小鼠骨骼肌排列紧密且整齐,细胞间隙较小,细胞多呈圆形或多边形;模型组小鼠骨骼肌排列疏松,细胞间隙较大;与模型组比较,欧前胡素组小鼠骨骼肌纤维排列紧密,细胞间隙较小。WGA染色结果显示,与空白对照组比较,模型组小鼠骨骼肌纤维横截面积显著缩小(P<0.05);与模型组比较,欧前胡素组小鼠骨骼肌纤维横截面积显著增大(P<0.05),说明欧前胡素能够改善骨骼肌萎缩的症状。结果见图2。

图2 各组小鼠骨骼肌HE染色和WGA染色结果
3.3 欧前胡素对恶病质模型小鼠骨骼肌中肌萎缩相关蛋白表达量的影响
与空白对照组比较,模型组小鼠骨骼肌中p-STAT3/STAT3比值和MAFbx蛋白表达量均显著升高(P<0.05),Myog蛋白表达量显著降低(P<0.05)。与模型组比较,欧前胡素组小鼠骨骼肌中p-STAT3/STAT3比值和MAFbx蛋白表达量均显著降低(P<0.05),Myog蛋白表达量显著升高(P<0.05)。结果见图3。

图3 欧前胡素对恶病质模型小鼠骨骼肌中肌萎缩相关蛋白表达的影响(n=3)
3.4 欧前胡素对恶病质模型小鼠骨骼肌中凋亡相关蛋白表达量的影响
与空白对照组比较,模型组小鼠骨骼肌中Bcl-2蛋白表达量显著降低(P<0.05),Bax、Caspase3蛋白表达量均显著升高(P<0.05)。与模型组比较,欧前胡素组小鼠骨骼肌中Bcl-2蛋白表达量显著升高(P<0.05),Bax、Caspase3蛋白表达量均显著降低(P<0.05)。结果见图4。

图4 欧前胡素对恶病质模型小鼠骨骼肌中凋亡相关蛋白表达的影响(n=3)
3.5 欧前胡素对恶病质模型小鼠骨骼肌中肌萎缩和凋亡相关基因表达的影响
与正常对照组比较,模型组小鼠骨骼肌中MAFbx、Bax、Caspase3 mRNA表达水平均显著升高(P<0.05),Myog、Bcl-2表达水平均显著降低(P<0.05)。与模型组比较,欧前胡素组小鼠骨骼肌中MAFbx、Bax、Caspase3 mRNA表达水平均显著降低(P<0.05),Myog、Bcl-2 mRNA表达水平均显著升高(P<0.05)。结果见图5。
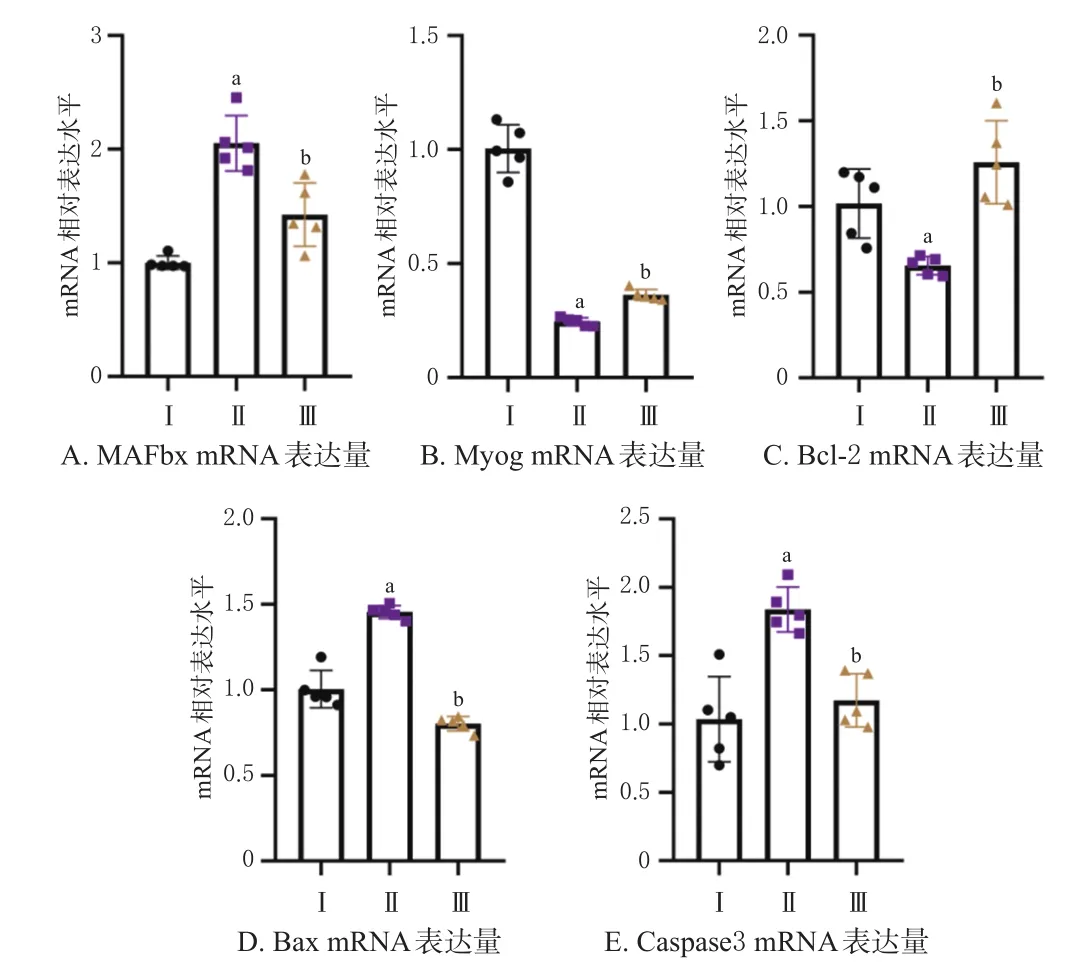
图5 欧前胡素对恶病质模型小鼠骨骼肌萎缩和凋亡相关基因表达的影响(n=5)
4 讨论
肿瘤恶病质是一种复杂的全身性疾病,涉及不同组织和器官的不同代谢途径,无论脂肪是否减少,均伴随着骨骼肌的消耗[15],因此能否缓解骨骼肌的消耗性萎缩,成为治疗肿瘤恶病质的关键。蛋白质合成减少、水解加快,则是骨骼肌消耗性萎缩的关键原因[16]。蛋白水解主要涉及泛素依赖的蛋白水解途径,MAFbx是泛素-蛋白酶体系统中参与蛋白降解的主要E3泛素连接酶,在肌细胞中特异性表达,介导肌蛋白的降解并抑制蛋白合成[15]。Myog是骨骼肌生长、发育和再生的关键转录因子[17]。本研究发现,恶病质模型小鼠MAFbx表达升高,Myog表达降低,蛋白合成减少、降解增多,骨骼肌被大量消耗;欧前胡素干预后显著降低促进蛋白水解的相关蛋白MAFbx的表达,且升高肌生成相关蛋白Myog的表达,且与mRNA表达结果一致。
STAT3是信号传导及转录激活因子STATs家族中的一员,在正常的生理状态下STAT3会被短暂快速地激活几分钟,然而持续激活STAT3会引起与细胞增殖、分化和凋亡相关的基因异常表达[18],STAT3可通过增强肿瘤的发生、转移和免疫抑制来促进恶病质的发展。抑制STAT3激活可阻断骨骼肌萎缩,并抑制泛素-蛋白酶体系统,保存肌肉质量[19]。本研究发现,模型组小鼠相较于空白对照组,p-STAT3/STAT3比值显著升高,提示造模后STAT3信号通路被激活;与模型组比较,欧前胡素组p-STAT3/STAT3比值显著降低,表明欧前胡素可通过抑制STAT3信号通路,影响肌萎缩和肌生成相关蛋白,从而改善恶病质模型小鼠的肌萎缩。
细胞凋亡是调节多种刺激诱导的骨骼肌分解代谢的重要过程,并已成为肌肉质量损失的潜在控制点[20]。细胞凋亡的激活先于与肌肉消耗相关的蛋白质分解[21],Bcl-2、Bax和Caspase3是细胞凋亡过程的关键调控因子,主要位于线粒体中,参与调节线粒体凋亡途径[22]。本研究发现,模型组小鼠Bax和Caspase3蛋白表达量均显著升高,Bcl-2蛋白表达量显著降低,表明恶病质模型小鼠骨骼肌细胞处于过度凋亡状态;经过欧前胡素给药干预后,凋亡情况有所好转。
综上所述,欧前胡素改善肿瘤恶病质的机制可能通过抑制STAT3信号通路中STAT3磷酸化的激活从而改变泛素-蛋白酶体系统中与肌萎缩相关的蛋白和基因的表达,改善恶病质模型小鼠骨骼肌过度消耗的状况,并通过调节细胞凋亡相关蛋白和基因的表达,减缓恶病质模型小鼠骨骼肌的萎缩进程。
