间歇性禁食肥胖小鼠源粪肠球菌与乳酸杆菌分离鉴定及药敏试验
2023-02-15李鑫月曾梦秋张海华李红强
李鑫月, 曾梦秋, 刘 云, 张 斌, 张海华, 李红强,2
[1.河北科技师范学院动物科技学院,河北昌黎 066600;2.河北省特色动物种质资源挖掘与创新重点实验室(筹),河北昌黎 066600]
肥胖可诱发糖尿病等与脂代谢相关的疾病[1],导致肥胖最常见的原因是高脂饮食,因此可通过间歇性禁食来干预肥胖[2],合理的间歇性禁食在维持肥胖个体葡萄糖稳态和减脂减重等方面起到重要作用[3]。研究表明,肠道微生物群在能量稳态中发挥重要作用,其结构失调可导致肥胖[4],而间歇性禁食可通过调节动物肠道菌群的结构来改善肠道微生物环境。肠道微生物有特定的生活节律,特定时间禁食可打破肠道微生物平衡[5],为研究禁食对肠道微生物影响提供了方向。肠道微生物种类繁多[6],包括粪肠球菌、乳酸杆菌、双歧杆菌、链球菌等,其中粪肠球菌和乳酸杆菌作为乳酸菌的一类,在维持肠道正常生理状况方面发挥着不同的作用。
粪肠球菌(Enterococcus)属于肠球菌属,为革兰氏阳性(G+)球菌,普遍存在于大自然中,可作益生菌,也可视为有害菌。在畜牧生产中,肠球菌常被制成益生菌添加剂来调节动物肠道菌群,如Pajarillo等给猪喂养2周粪肠球菌,发现猪肠道细菌的多样性和丰富度提高[7];孔祎等研究发现,在饲料中添加适量粪球杆菌可促进乌鳢生长[8],因此粪肠球菌作为肠道益生菌群的一部分,在动物饲养和保护肠道生态平衡中有重要作用[9-10]。此外,粪肠球菌可以作为抗生素的替代品来促进动物生长,减少因过度使用抗生素导致动物的耐药性和有效性损失[11]。同时,粪肠球菌还可引起感染性疾病,如加重上呼吸道感染等症状[12]。可见,粪肠球菌具有一定的耐药性[13]。乳酸杆菌(Lactobacillaceae)属于乳杆菌属,为革兰氏染色阳性厌氧菌,有时也需氧,不产生芽孢,在调节肠道菌群平衡、促进机体生长和增强机体免疫等方面具有重要的作用[14-15]。在畜牧生产中,乳酸杆菌常被制成益生菌添加剂来调节动物肠道菌群,如汪昭睿等研究发现乳酸杆菌可降低仔猪的腹泻率,促进仔猪生长,并改善其肠道菌群稳态[14];邓军等给仔猪喂养含乳酸杆菌的饲料发现,猪肠道绒毛发育得到改善,仔猪的抗感染能力得到提高[15]。这说明了乳酸杆菌可作为益生菌调节机体肠道微生物稳态,抑制外来细菌生长,并刺激肠道产生保护其自身的黏液物质,形成良好的保护膜[16]。
在使用粪肠球菌和乳酸杆菌时,应全面考虑其利弊并合理使用。若将粪肠球菌和乳酸杆菌添加进饲料中或将其制成益生菌添加剂,需要更加严格的安全检测和评价机制。因此,本研究通过对高脂小鼠进行0 ∶24 h、12 ∶12 h、16 ∶8 h等3种间歇性禁食方式处理,以禁食后的新鲜小鼠粪便为材料,分离粪肠球菌和乳酸杆菌,以探究不同禁食时间对小鼠肠道中粪肠球菌和乳酸杆菌生长代谢的影响,并通过耐酸试验和药敏试验,从而筛选出耐酸性强和抗药性强的菌株,为开发利用肠道益生菌提供一定的参考依据。
1 材料与方法
1.1 试验动物及处理
试验于2021年4月在河北科技师范学院农学与生物科技学院基础实验室完成。试验所需的材料为河北科技师范学院鼠房养育的C57BL/6J肥胖小鼠新鲜粪便。在取材之前,对C57BL/6J小鼠进行高脂喂食8周,形成肥胖模型,然后经过0 ∶24 h(禁食不禁水0 h,喂食24 h)、12 ∶12 h(禁食不禁水12 h,喂食12 h,即06:00开始禁食,18:00喂食)、16 ∶8 h (禁食不禁水16 h,喂食8 h,即06:00开始禁食,22:00喂食)3种间歇性禁食模式处理2周,再采集粪便。除禁食期间外,其他时间正常喂食。在禁食前对小鼠进行分组,记禁食0 h的小鼠为A组,禁食12 h为B组,禁食16 h为C组。
1.2 主要试剂
MRS(寒天)固体培养基、MRS液体培养基、LB固体培养基、无水乙醇、硝酸钾等均购自北京索莱宝科技有限公司。
1.3 样品处理
将收集的3组小鼠粪便标号为A、B、C组后各称取0.1 g,放入装有9.9 mL无菌生理盐水的离心管中,将离心管放入37 ℃摇床中培养15 min后,离心取上清进行梯度稀释,稀释梯度为10-2~10-4。
1.4 细菌的分离鉴定与药敏试验
1.4.1 粪肠球菌
1.4.1.1 粪肠球菌的分离 吸取 100 μL 菌液用涂布棒均匀涂布于MRS固体培养基平皿中,37 ℃培养24~48 h,其间观察菌落生长状况。挑取有明显溶钙圈的单菌落于 MRS固体培养基中划线培养,进行多次分离纯化,纯化的菌株用30%甘油于-80 ℃保存备用。
1.4.1.2 粪肠球菌的鉴定 形态学鉴定:分离纯化后的菌株进行革兰氏染色,再依次涂片、风干、火焰固定、结晶紫溶液染色1 min、蒸馏水水洗、碘液媒染1 min、水洗、95%乙醇脱色30 s、水洗、番红染液复染1 min、水洗,光学显微镜下用油镜观察[11]。生化鉴定:参照《常见细菌系统鉴定手册》以及《伯杰氏细菌鉴定手册》[17],对分离纯化出来的粪肠球菌菌群(SY-1)进行生化鉴定。
1.4.1.3 粪肠球菌的耐酸性测定 从MRS固体培养基中挑取长势良好的单菌落接种于装有 MRS液体培养基的离心管中,将离心管放置于37 ℃摇床培养箱中培养5 h后取出,混匀,吸取适量菌悬液打入含有 MRS液体培养基的离心管中使其稀释100倍,之后吸取已被稀释的菌悬液加入到用浓盐酸配制好的pH值为2、3、4的MRS液体培养基的离心管中[18],将离心管放置于37 ℃摇床培养箱中培养3 h后取出,吸取适量菌悬液涂布于 MRS固体培养基中,放置于37 ℃恒温培养箱中培养16 h后取出,进行活菌计数,以正常pH值(7.5)处理的为空白对照,每个处理设置3次重复。
1.4.1.4 粪肠球菌的药敏鉴定 采用KB法[19],选取5种常见抗敏药物对菌株进行药敏试验[20]。取100 μL菌悬液涂布于MRS固体培养基中,用无菌镊子夹取氨苄西林、链霉素、青霉素、卡那霉素、四环素药敏纸片对称放置于培养基中,以不经过药水浸泡处理的纸片为对照,每种药品设置3组重复。将培养皿放入 37 ℃恒温培养箱中培养24 h后取出,观察抑菌圈,并用游标卡尺测量抑菌圈直径,用作判定指标,将结果分为敏感(S)、中介(I)、耐药(R)[21]。
1.4.2 乳酸杆菌
1.4.2.1 乳酸杆菌的分离 取100 μL菌液涂布于MRS固体培养基上,每组3个重复,在37 ℃培养 2 d 后,挑选溶钙圈较大且较为明显的单菌落进行平板划线,纯化培养2~3次。
1.4.2.2 乳酸杆菌的鉴定 形态鉴定:从MRS固体培养基中挑长势良好的单菌落,革兰氏染色后用显微镜观察细胞形态。生化鉴定:根据《常见细菌鉴定手册》中的说明对菌落进行生化鉴定。
1.4.2.3 乳酸杆菌的耐酸性测定 取适量活化菌液加入MRS液体培养基内,37 ℃振荡培养4 h,之后接种至pH值为正常(6.4)、3、4的培养基中,37 ℃ 振荡培养3 h,最后分别涂布至固体MRS平板,每组3个重复,在37 ℃恒温培养24 h后进行菌落计数。
1.4.2.4 乳酸杆菌的药敏鉴定 选取5种常见的抗敏药物对菌株进行药敏试验(见“1.3.5”节)。
1.5 细菌16S rRNA扩增及测序
用细菌基因组提取试剂盒分别提取2组分离菌株的基因并作为模板,使用通用引物27F和1492R[22]进行扩增,PCR反应体系50μL:2×TaqMix 25μL,0.4 μmol/L正、反向引物各2 μL,DNA模板 4μL,ddH2O 17 μL。扩增程序为:94 ℃ 5 min;94 ℃ 15 s,53 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 5 min;20 ℃ 5 min。产物通过琼脂糖凝胶电泳检测并用胶回收试剂盒回收PCR目的片段,送至北京天一辉远生物科技有限公司测序。
2 结果与分析
2.1 菌落形态观察和镜检结果分析
观察图1-A分离纯化的培养基,可见圆形、光滑突起、湿润、边缘整齐的菌落,周围有明显的溶钙圈。将分离纯化得到的单菌落涂片,革兰氏染色如图1-C所示,可见呈短链排列或2个对生的蓝紫色革兰氏阳性球菌,可初步判断其为粪肠球菌属,命名为SY-1。由图1-B可知,观察到菌落形态呈现为无色半透明圆形凸起的菌落;革兰氏染色结果见图1-D,细胞染色为紫色,大多呈短杆状,均无鞭毛,可初步判断是乳酸杆菌属,并命名为 SY-2。

2.2 16S测序结果及系统进化树的构建
经北京天一辉远生物科技有限公司测序得到的序列通过NCBI上Blast比对可以发现,分离出来的SY-1基因序列与GenBank中已经注册的粪肠球菌的序列相似性高达99.93%,说明分离的SY-1菌株为粪肠球菌;SY-2基因序列与GenBank中已经注册的乳酸杆菌相似度为99.86%,说明 SY-2 菌株为乳酸杆菌。进一步选取10种菌株构建16S rRNA系统进化树,由图2-A可以得出SY-1与粪肠球菌ATCC 19433和粪肠球菌JCM 5803在同一进化分支上,由图2-B可以得出SY-2与乳酸杆菌NBRC 14221在同一进化分支上。

2.3 细菌的生化鉴定结果分析
由表1可知,对3组禁食处理的粪肠球菌进行生化鉴定结果一致,并判断该菌接触试验、淀粉水解试验、吲哚试验为阴性,表明粪肠球菌不分解过氧化氢、淀粉和色氨酸,甲基红试验、VP 试验、硝酸盐还原试验为阳性,表明粪肠球菌分解糖类和还原硝酸。由表2可知,A、B、C组结果相同,接触试验阴性表明乳杆菌不分解过氧化氢,甲基红和VP试验证明可以乳杆菌分解糖类,吲哚试验阳性证明乳杆菌可以分解色氨酸产生吲哚,硝酸还原试验证明乳杆菌不还原硝酸。

表1 粪肠球菌生理生化鉴定

表2 乳酸杆菌生理生化鉴定
2.4 细菌的耐酸性测定结果分析
以各组正常pH值处理为对照,计算存活率[15]。根据表3可以看出,A 组在pH值≥4处理环境下粪肠球菌存活率受影响较小;而当pH值≤3时,其存活率呈现出一定的下降趋势,并随着 pH值的下降而下降;B、C等2组在各pH梯度下的存活率均低于A组,但B组相对来说存活率更低。根据表4可知,分离出的乳酸杆菌在pH值为2的培养基上基本不能生长,pH值为3的培养基上只有C组有少量生长,说明对于过强的酸性环境,只有经过禁食改善过的C组乳酸杆菌较为适应;在pH值为4的培养基上A组的菌落存活率很低,不能正常生长,B组有少量生长,C组则可以良好适应,能够长出大量菌落;pH值正常的对照处理中各组都能良好生长。

表3 不同pH处理下各组禁食处理的粪肠球菌存活率

表4 不同pH处理下各组禁食处理的乳酸杆菌存活率
2.5 细菌的药敏检测
对2种细菌3组处理进行药敏试验,分别测量各种药敏纸片周围所产生的抑菌圈大小,对2种细菌药物敏感程度进行判定。从表5可以看出, 粪肠球菌对氨苄西林、四环素敏感,对链霉素、青霉素、卡那霉素耐药。从表6可以看出,乳酸杆菌对卡纳霉素、青霉素和链霉素耐药,没有形成抑菌圈, 基本都可以正常生长;而对含有氨苄西林和四环素的药敏纸片均敏感,且对比抑菌圈总体大小可以看出对于四环素敏感度高。
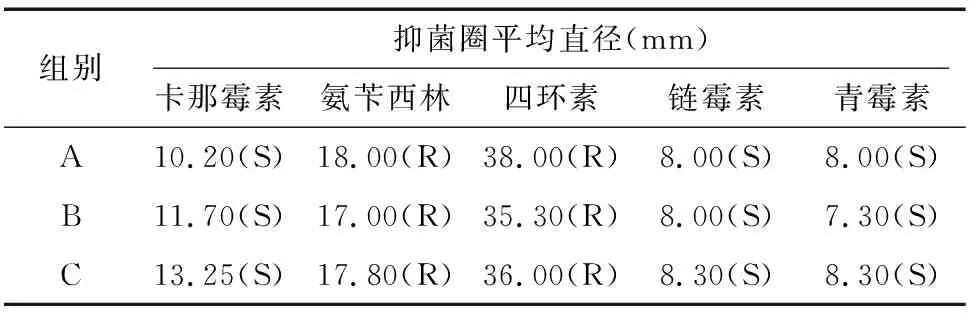
表5 粪肠球菌药敏试验结果

表6 乳酸杆菌药敏试验结果
3 讨论
有研究表明,在使用益生菌时,如乳酸杆菌可提高营养物质的消化率,减少肠道中病原体的定殖,改善胃肠道微生物群平衡[23]。本试验通过多次分离纯化从禁食小鼠粪便中得到粪肠球菌(SY-1)和乳酸杆菌(SY-2)。由形态观察发现,分离得到的SY-1菌落呈圆形、边缘整齐并且周围有明显的溶钙圈,初步观察其符合粪肠球菌的菌落特点;进一步通过革兰氏染色发现,分离的SY-1呈短链或2个对生排列的蓝紫色的革兰氏阳性球菌的特点,同时结合生理生化分析,初步判断该菌落为粪肠球菌,与慈洋等分离出来的粪肠球菌形态[24]一致。SY-2菌落形态呈无色、半透明、圆形凸起且边缘不规则,进一步通过革兰氏染色发现细菌为紫色,大多数呈短杆状,之后进行生理生化分析初步判断该菌落为乳酸杆菌,该结果与梁东梅等鉴定的乳酸杆菌形态[25]基本一致。为进一步鉴定2种菌株的类型,本研究采用16S rRNA测序并构建系统进化树,测序结果显示分离株SY-1与粪肠球菌相似性高达99.93%,构建进化树结果显示其与粪肠球菌菌株在同一分支上,遗传距离最近;分离株SY-2与乳酸杆菌相似度高达99.86%,进化树结果显示其与乳酸杆菌菌株在同一分支上,可以确定分离的 SY-1 是粪肠球菌,SY-2是乳酸杆菌。继续研究其生物学特性,本研究对3组不同禁食处理方式的2种分离菌进行酸碱性测定,结果发现粪肠球菌具有一定的耐酸能力,耐强酸能力较差,这与鲍延娥等研究的粪肠球菌具有耐酸性结果[26]一致,但不同禁食方式对粪肠球菌耐酸能力有一定的影响,12 h禁食处理的粪肠球菌表现出较其他2组禁食处理更差的耐酸性,由此可以得出将粪肠球菌作为益生菌添加剂时,不能与强酸性物质混合使用,且12 h禁食处理可减少酸性条件下粪肠球菌的数量。乳酸杆菌在pH值为4时生长状况良好,pH值为3时有少量生长,与植物乳酸杆菌可以在pH值为3时的酸性环境下生长结果[27]一致,但不同禁食时间处理下分离的乳酸杆菌耐酸性不同,0 h禁食处理的乳酸杆菌耐酸性差,16 h禁食处理的乳酸杆菌在pH值为3时耐酸能力较强,说明16 h禁食方式改变了小鼠肠道微生物平衡,该结果提示可以通过禁食方式筛选和训化对强酸性环境抗性强的菌株,同时对使用益生菌制剂改善肠道环境提供参考,以上结果说明不同时间禁食可以影响动物肠道微生物的生理活动。
抗生素的长期使用引起了全世界对抗生素抗性微生物的关注,这些微生物对人类健康和环境构成威胁[28],包括抗生素替代品益生菌在内。为此本研究对粪肠球菌和乳酸杆菌进行了药敏试验,选用5种常见抗生素药物,结果显示粪肠球菌对氨苄西林和四环素敏感,且禁食12 h组的敏感性较低,0 h禁食处理组的敏感性较高,对链霉素、青霉素、卡那霉素耐药,这一结果与梁权辉等的试验结果[29]一致。该结果提示粪肠球菌对不同抗生素的耐药性不同,因此当动物使用氨苄西林、四环素等抗生素治疗时,应避免与含粪肠球菌添加剂的饲料同时饲喂。同时对乳酸杆菌药敏检测发现,其对氨苄和四环素敏感,其中禁食0 h组的乳酸杆菌对其敏感度较高,产生的抑菌圈较大,对卡那霉素、青霉素、链霉素不敏感,这与马祥兆等研究的乳酸杆菌对青霉素敏感[30]不同,可推测目前该菌种对青霉素已产生耐药性。可见,不同禁食时间对不同菌株的耐药性有一定的干预作用。综上可知,从不同禁食方式处理的肥胖小鼠肠道粪便中筛选得到的粪肠球菌和乳酸杆菌对强酸性环境耐受能力不同,后续可继续对2种菌株的产酸能力进行测定,比较在不同禁食时间干预下2种菌的产酸能力是否提升。同时将已确定更有优势的C组(禁食16 h)粪肠球菌和乳酸杆菌继续培养,制定完善的乳酸菌食品制剂方案,将制剂再喂食高脂处理小鼠,通过观察小鼠体质量变化,测定小鼠血液中葡萄糖、胆固醇和甘油三酯等生理指标含量,来探究这2个菌株对小鼠体内脂肪代谢的影响。
4 结论
本试验成功地从经过禁食处理的肥胖小鼠粪便中分离并通过对甲基红、VP 试验、硝酸盐还原试验、接触试验、 淀粉水解反应和吲哚试验等生理生化方法鉴定了粪肠球菌和乳酸杆菌,之后对其分别进行药物敏感性试验,确定粪肠球菌和乳酸杆菌的敏感性药物均为氨苄西林和四环素,为开发利用益生菌提供更加可靠的参考依据。
