江西铅山红芽芋植物抗病反应蛋白编码基因的克隆和表达分析
2023-02-15张艺欣钱华卉桑智玥陶月琴涂辰钰
张艺欣, 聂 蒙, 钱华卉, 邱 莉, 桑智玥, 陶月琴, 涂辰钰
(1.上饶师范学院生命科学学院,江西上饶 334001; 2.上饶农业技术创新研究院,江西上饶 334001;3.上饶市药食同源植物资源保护与利用重点实验室,江西上饶 334001;4.上饶市薯芋类作物种质保存与利用重点实验室,江西上饶 334001)
江西铅山红芽芋(ColocasiaesculentaL. Schoot var.cormosus‘Hongyayu’)为天南星科本草植物,其营养全面,粉糯爽口,具有宽肠胃、补脾胃、消痨散结、增强免疫、调节免疫等功效[1],是江西省知名名优特农产品和国家地理标志农产品[2]。植物的生长发育一直受外界各种微生物的威胁和挑战,在与病原菌长期的共进化过程中,植物逐渐进化出一套复杂而精细的保护自身免受病原微生物侵害的免疫应答调控机制[3]。植物抗病反应蛋白能够特异地识别病原微生物分泌的效应蛋白,从而触发免疫响应,产生或激活能够特异识别效应因子的抗性蛋白,以对抗病原微生物的侵扰[4]。因此,克隆江西铅山红芽芋植物抗病反应蛋白编码基因并检测其组织表达特异性对了解江西铅山红芽芋抗病品种选育具有重要意义。
关于植物抗病反应蛋白(plant disease resistance response protein)编码基因的研究尚少见报道。目前的研究发现,大多数植物抗病蛋白(plant disease resistance protein)含有一系列富含亮氨酸的重复序列(LRRs)、1个核苷酸结合位点(NBS)和1个假定的氨基末端信号结构域,它们被称为NBS-LRR蛋白。来自许多生物体多种蛋白质的LRRs是作为蛋白质相互作用平台和蛋白质活化的调节模块。在遗传学上,植物抗病蛋白的LRRs是反映特异性的决定因素,它们的作用可以导致植物细胞以常见的超敏反应(HR)的形式死亡[5]。目前,对红芽芋的研究主要集中在脱毒快繁[6]、微芋诱导[7]、下游加工[2]、成分分析[1]等方面,关于红芽芋植物抗病反应蛋白方面的研究尚未见报道。因此,本研究利用逆转录PCR(RT-PCR)技术克隆江西铅山红芽芋植物抗病反应蛋白编码基因,并用生物信息学方法和实时定量PCR技术进行序列分析和组织表达分析,为揭示江西铅山红芽芋植物抗病反应蛋白的生物学功能提供理论依据,为从分子水平选育江西铅山红芽芋抗病品种提供新思路。
1 材料与方法
1.1 试验材料
试验所用材料为江西铅山红芽芋试管苗,试验时间为2021年5—9月。
1.2 试验方法
1.2.1 总RNA的提取和cDNA第1链的合成 用TRIzol试剂提取江西铅山红芽芋试管苗的总RNA,提取步骤按说明书进行,使用紫外分光光度计和琼脂糖凝胶电泳检测RNA的浓度和完整性。以提取获得的RNA为模版,按照M-MLV cDNA第1链合成试剂盒说明书合成cDNA第1链。逆转录引物用Oligo(dT)18Primer:5′-G G C C A C G C G T C G A C T A G T A C T T T T T T T T T T T T T T T T T T-3′,具体步骤参照说明书进行。
1.2.2 植物抗病反应蛋白编码基因的克隆 采用转录组组装的Unigene序列信息(TRINITY_DN22649_c0_g1),用Primer Premier 5.0设计引物(F:5′-A T G T C C G T A T T A T T C A T C A T T T A T C-3′;R:5′-T C A A T A G T T G A A G A C T G T C A C G T T G-3′)。PCR扩增条件:95 ℃ 2 min;95 ℃ 30 s,55.3 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 10 min。PCR产物经1%琼脂糖凝胶电泳检测后,将含有目的基因的条带与pMD19-T载体连接并用热激法转化到感受态细胞EscherichiacoliDH5α中,将鉴定正确的阳性转化子提取质粒送往生工生物工程(上海)股份有限公司进行测序。
1.2.3 植物抗病反应蛋白编码基因的生物信息学分析 使用BioEdit软件将基因序列翻译为氨基酸序列,用ProtParam预测酶的理化性质,用ProtScale预测酶的疏/亲水性。用GORⅠ软件在线预测酶的二级结构,用SWISS-MOLD在线预测酶的三级结构,用WoLFPsort在线预测基因的表达部位。通过软件DNAMAN、Bioedit进行氨基酸序列比对,用MEGA 5.0进行系统进化树的构建。
1.2.4 植物抗病反应蛋白编码基因的组织表达分析 分别取500 ng来自江西铅山红芽芋试管苗根、茎、叶、试管球茎(初期、中期和末期)的RNA,将其反转录为cDNA。通过荧光定量PCR(qRT-PCR,SYBR GreenⅠ)检测,发现内参基因为GAPDH。设计引物(F:5′-T G C C C T G A G C G T T C C C T A C-3′;R:5′-A C C C G C C T C C A C T T C T T C C-3′;大小为178 bp;Tm为58.3 ℃)。qRT-PCR检测采用20 μL反应体系,PCR反应程序:95 ℃ 10 min;95 ℃ 10 s,60 ℃ 34 s,95 ℃ 15 s,40个循环。用2-ΔΔCT法计算基因的表达水平。试验重复3次,所有数据表示为平均值±标准差,用SPSS 19.0进行统计分析,用单因素方差分析(One-way ANOVA)检验植物抗病反应蛋白编码基因组织表达的差异显著性(α=0.05)。
2 结果与分析
2.1 江西铅山红芽芋植物抗病反应蛋白编码基因的cDNA序列
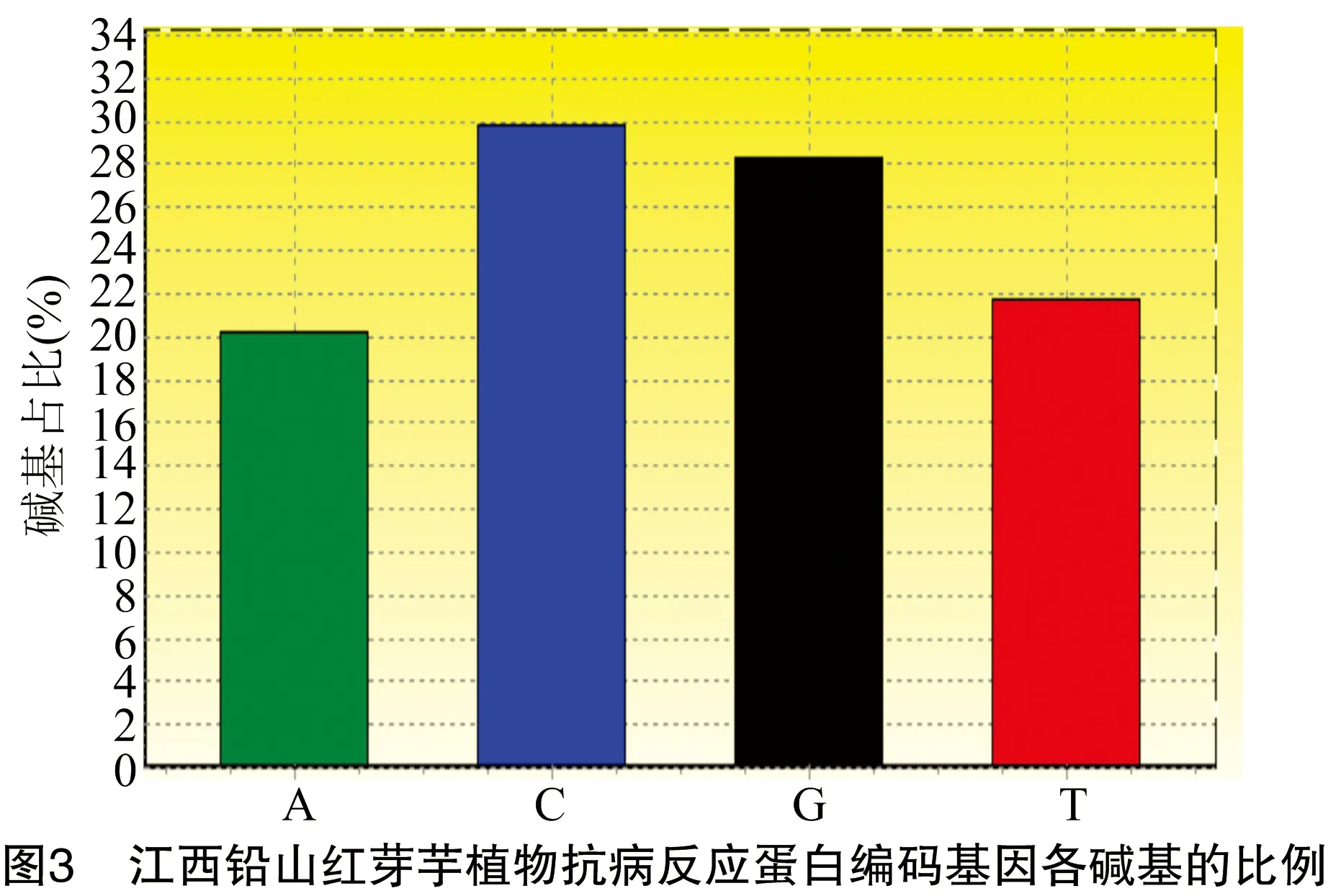
采用转录组组装的Unigene序列信息(TRINITY_DN22649_c0_g1),用Primer Premier 5.0设计引物进行PCR扩增。PCR扩增结果显示,江西铅山红芽芋植物抗病反应蛋白编码基因的cDNA总长度为534 bp,G+C含量为58.05%(图1、图2、图3)。


2.2 江西铅山红芽芋植物抗病反应蛋白的氨基酸序列
通过Protparam预测,得到江西铅山红芽芋植物抗病反应蛋白氨基酸序列(图4)。江西铅山红芽芋植物抗病反应蛋白由177个氨基酸组成,相对分子量为19 369.13 u,等电点为6.09,为疏水性蛋白质。各氨基酸的数目和比例:丙氨酸(Ala,A),13个,7.3%;精氨酸(Arg,R),11个,6.2%;天冬氨酸(Asn,N),8个,4.5%;天冬氨酸(Asp,D),8个,4.5%;半胱氨酸(Cys,C),1个,0.6%;谷氨酰胺(Gln,Q),6个,3.4%;谷氨酸(Glu,E),7个,4.0%;甘氨酸(Gly,G),17个,9.6%;组氨酸(His,H),2个,1.1%;异亮氨酸(Ile,I),9个,5.1%;亮氨酸(Leu,L),14个,7.9%;赖氨酸(Lys,K),3个,1.7%;甲硫氨酸(Met,M),6个,3.4%;苯丙氨酸(Phe,F),14个,7.9%;脯氨酸(Pro,P),8个,4.5%;丝氨酸(Ser,S),15个,8.5%;苏氨酸(Thr,T),10个,5.6%;酪氨酸(Tyr,Y),7个,4.0%;缬氨酸(Val,V),18个,10.2%。带负电残基总数(Asp+Glu)为15个,正电荷残基总数(Arg+Lys)为14个。估计半衰期的排序:30 h(哺乳动物网织红细胞,体外)>20 h(酵母,体内)>10 h(大肠杆菌,体内)。不稳定指数中的失稳指数(Ⅱ)为18.11,因此将蛋白质分类为稳定的蛋白质。

2.3 江西铅山红芽芋植物抗病反应蛋白的亲疏水性分析
图5中的高峰值(正值)区域表示疏水区域,而负值的低谷区域是亲水区域。疏水性分析结果表明,最大疏水值约为2.75,在该多肽中说明该处的疏水性最强;亲水峰最大值约为-2.0,整个蛋白质表现出高度的疏水性,说明该蛋白质为疏水性蛋白质。

2.4 江西铅山红芽芋植物抗病反应蛋白的二级结构分析
江西铅山红芽芋植物抗病反应蛋白的二级结构预测结果:GOR预测结果显示,其二级结构由α螺旋[alphahelix(Hh),15.25%]、β-片层[extendedstrand(Ee),27.68%]、无规则卷曲[randomcoil(Cc),57.06%]构成(图6、图7)。从分布位点上看,C端、N端主要含有α-螺旋、无规则卷曲和β-片层,且无规则卷曲、β-片层和α-螺旋则散布于整个蛋白质中。


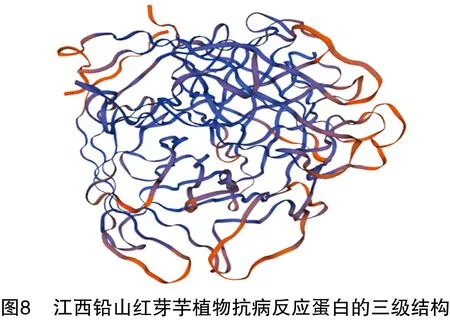
2.5 江西铅山红芽芋植物抗病反应蛋白的三级结构分析
利用SWISS-MODEL软件对江西铅山红芽芋植物抗病反应蛋白基因编码的蛋白质产物进行三级结构预测,并利用Rasmol软件对三级结构进行图形化分析。由图8可知,江西铅山红芽芋植物抗病反应蛋白的三级结构为同源三聚体。
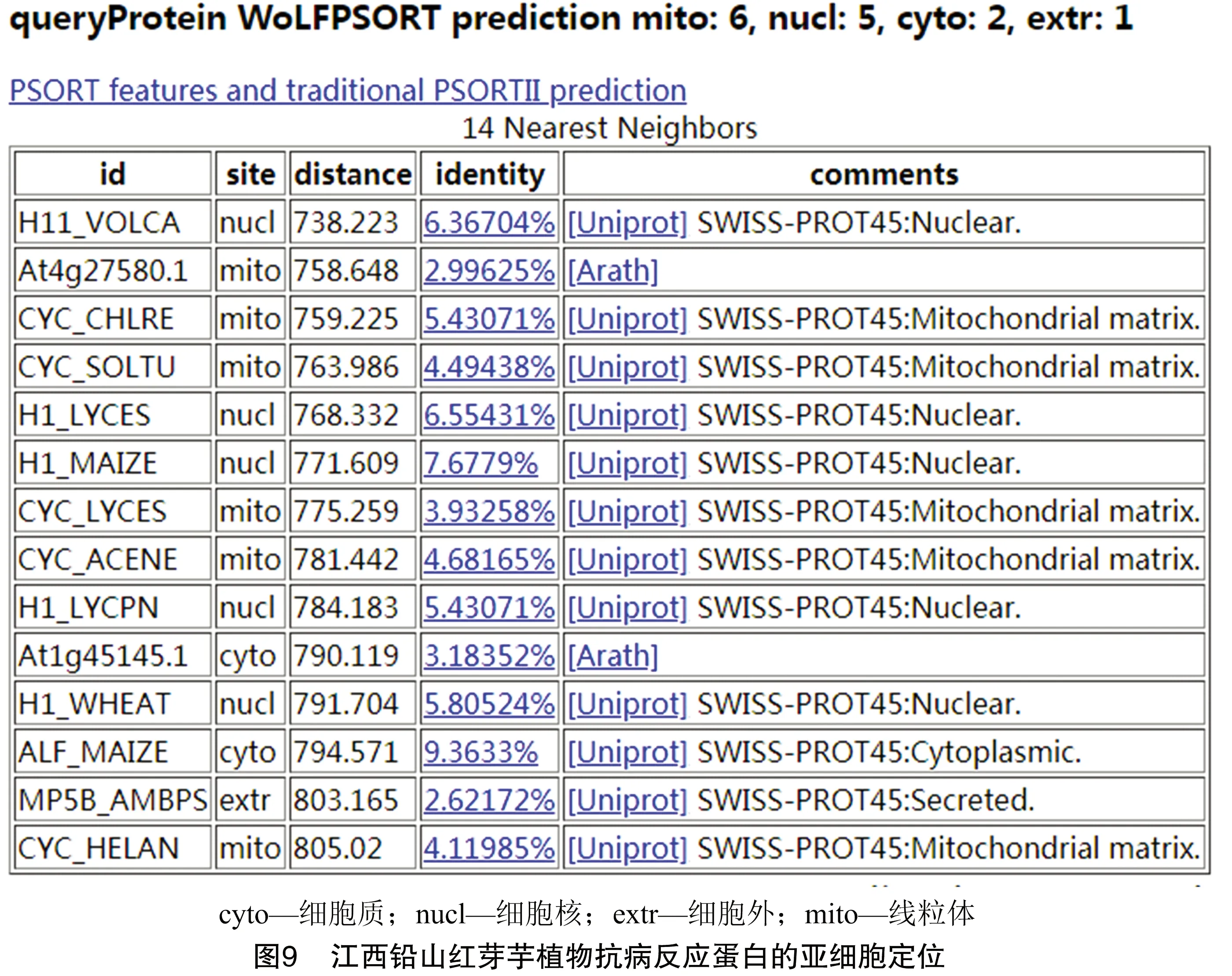
2.6 江西铅山红芽芋植物抗病反应蛋白的亚细胞定位
用WoLFPsort在线软件对江西铅山红芽芋植物抗病反应蛋白编码基因的表达部位进行预测,图9结果显示,定位于线粒体中的抗病反应蛋白数量为6个,细胞核中的数量为5个,细胞质中的数量为2个,细胞外的数量为1个,表明江西铅山红芽芋植物抗病反应蛋白编码基因主要存在于线粒体和细胞核中。
2.7 江西铅山红芽芋植物抗病反应蛋白的系统进化分析
本研究构建的进化树表明,江西铅山红芽芋与芋(Colocasiaesculenta)在一个大分支下,说明江西铅山红芽芋植物抗病反应蛋白在进化上与C.esculenta的亲缘关系较近,尤其是与C.esculentahypothetical peotein Taro_046195(MQM13270.1)在进化上具有最高的亲缘关系。
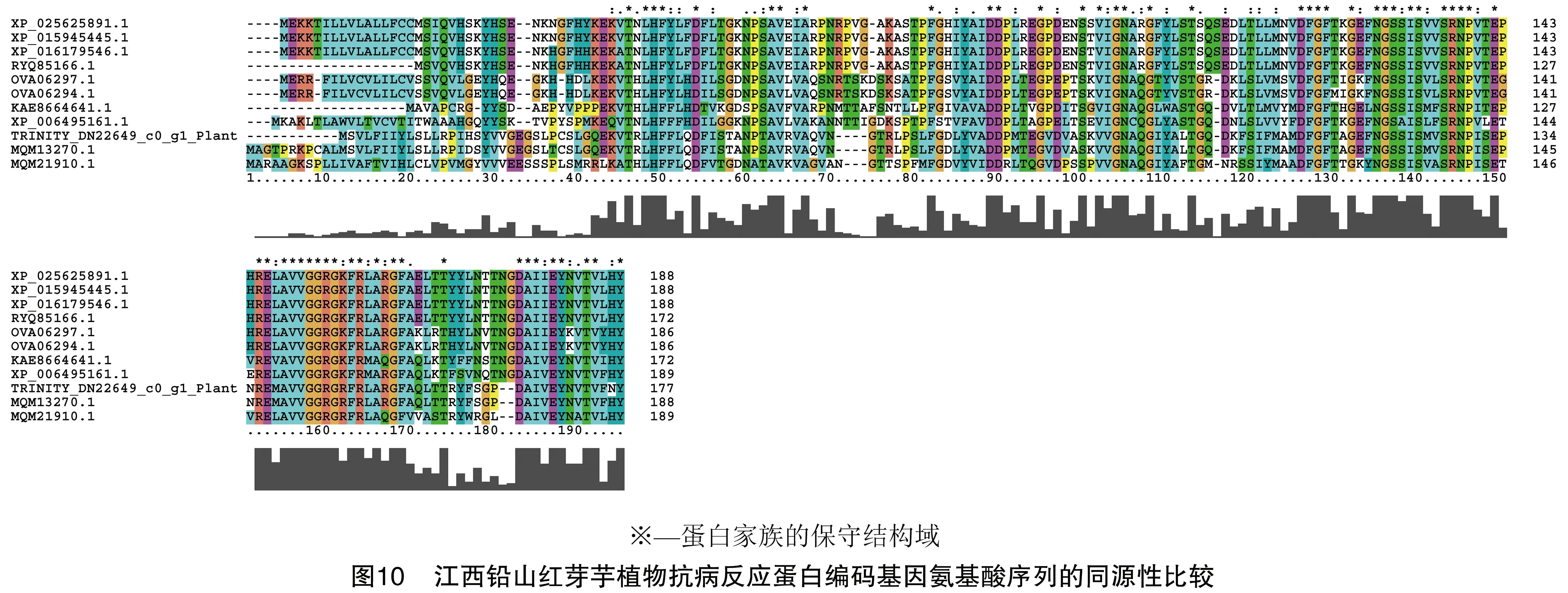
2.8 江西铅山红芽芋植物抗病反应蛋白同源蛋白的序列比对信息
江西铅山红芽芋植物抗病反应蛋白同源蛋白的序列比对信息见图10。可以看出,江西铅山红芽芋与Colocasiaesculenta尤其是与C.esculentahypothetical peotein Taro_046195(MQM13270.1) 的保守结构域较多,这也证实了江西铅山红芽芋与Colocasiaesculenta在进化上与C.esculentahypothetical peotein Taro_046195(MQM13270.1)具有最高的亲缘关系。
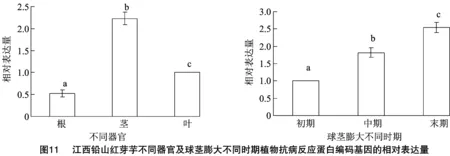
2.9 江西铅山红芽芋不同器官及球茎膨大不同时期植物抗病反应蛋白编码基因的表达分析
以江西铅山红芽芋的GAPDH为内参,用实时荧光定量PCR分析江西铅山红芽芋植物抗病反应蛋白编码基因在江西铅山红芽芋不同器官中的表达情况。结果显示,江西铅山红芽芋植物抗病反应蛋白编码基因在根、茎、叶中均有表达,但在不同组织器官中的表达情况差异显著(图11),其中江西铅山红芽芋植物抗病反应蛋白编码基因在茎、球茎膨大末期的表达量最高。
3 讨论
植物一般通过对病原菌效应蛋白的特异性识别感知病原体的入侵,进而快速、精准激活免疫反应,表达植物的抗病反应蛋白[8]。培育具有广谱而持久抗性的植物品种是育种学家追求的目标。目前,关于植物抗病反应蛋白编码基因介导的抗性等已经取得了大量新的研究成果[9]。研究发现,通过转基因或过表达NBS-LRR(nudeotide-binding site-leucine-rich repeat, 含有核苷酸结合位点和富亮氨酸重复)基因可显著提高植物的抗病性[10-11]。也有研究发现,RPM1蛋白对表达Ⅲ型效应蛋白AvrRpm1或AvrB的丁香假单胞菌pv番茄DC3000产生抗性,RIN13(RIN13s)的异位表达增强了细菌的限制性机制,但矛盾的是却消除了由RPM1控制的正常快速超敏反应(HR);与野生型植物相比,表达RIN13s的叶片在细菌输送AvrRpm1后没有发生电解质渗漏或积累H2O2;RIN13的过度表达也改变了正常HR期间观察到的转录谱。相比之下,RIN13基因敲除植物对DC3000(avrRpm1)的反应具有与野生型植物相同的离子泄漏特征和HR时间,但未能抑制细菌生长;在RIN13s/as植物中观察到的修饰表型对AvrRpm1或AvrB的识别具有特异性,并且在与其他不相容病原体或强毒力DC3000分离物的攻击后观察到野生型[12]。本试验用同源克隆技术成功克隆了江西铅山红芽芋植物抗病反应蛋白编码基因序列,PCR结果表明,江西铅山红芽芋植物抗病反应蛋白编码基因cDNA总长度为 534 bp,G+C含量为58.05%;江西铅山红芽芋植物抗病反应蛋白由177个氨基酸组成,分子量为 19 369.13 u,等电点为6.09,为疏水性蛋白;二级结构由α-螺旋(15.25%)、β-片层(27.68%)、无规则卷曲(57.06%)构成;三级结构为同源三聚体。由此可见,江西铅山红芽芋植物抗病反应蛋白主要存在于细胞质、叶绿体中;江西铅山红芽芋植物抗病反应蛋白在进化上与Colocasiaesculenta的亲缘关系较近,尤其是与C.esculentahypothetical peotein Taro_046195(MQM13270.1)在进化上具有最高的亲缘关系。江西铅山红芽芋植物抗病反应蛋白编码基因与其他物种[博落回(Macleayacordata);蔓花生(Arachisduranensis)]也具有较高的相似性,表明它们在进化上的同源性较高,表明江西铅山红芽芋植物抗病反应蛋白编码基因与这些物种在进化上存在较高程度的氨基酸序列保守结构域。同时本试验也发现,实时定量PCR结果显示植物抗病反应蛋白编码基因在江西铅山红芽芋中的表达存在器官特异性,在茎和球茎膨大末期的表达量最高。因此,江西铅山红芽芋植物抗病反应蛋白编码基因的克隆,不仅为研究该基因在江西铅山红芽芋中的表达调控奠定了基础,而且丰富了植物抗病反应蛋白分子进化和结构功能研究的材料。
