饲粮添加粪肠球菌对蛋鸡生产性能、蛋品质、脂质代谢和肠道微生物数量的影响
2017-01-18董晓芳佟建明鲍延娥王志红
刘 松 董晓芳 佟建明 鲍延娥 王志红
(中国农业科学院北京畜牧兽医研究所,北京100193)
饲粮添加粪肠球菌对蛋鸡生产性能、蛋品质、脂质代谢和肠道微生物数量的影响
刘 松 董晓芳*佟建明 鲍延娥 王志红
(中国农业科学院北京畜牧兽医研究所,北京100193)
本试验旨在研究饲粮添加粪肠球菌对蛋鸡生产性能、蛋品质、脂质代谢和肠道微生物数量的影响。选择137日龄海兰褐壳蛋鸡450只,随机分成5个组,每组6个重复,每个重复15只鸡,分别饲喂在基础饲粮中添加0、1.0×104、1.0×106、1.0×108和1.0×1010CFU/g粪肠球菌(CGMCC1.2135T)的试验饲粮。试验期168 d。结果显示:1)试验第113~140天和第141~168天,1.0×106CFU/g粪肠球菌添加组蛋鸡的产蛋量极显著高于对照组和其他粪肠球菌添加组(P<0.01)。试验第141~168天,1.0×104CFU/g粪肠球菌添加组的料蛋比显著低于1.0×108CFU/g粪肠球菌添加组(P<0.05)。2)试验第56天,各粪肠球菌添加组的蛋壳厚度均显著高于对照组(P<0.05),对照组和1.0×106CFU/g粪肠球菌添加组的蛋白高度显著高于1.0×104和1.0×1010CFU/g粪肠球菌添加组(P<0.05);试验第84天和第140天,1.0×108CFU/g粪肠球菌添加组的蛋白高度显著高于1.0×104CFU/g粪肠球菌添加组(P<0.05)。试验第56天,1.0×106CFU/g粪肠球菌添加组的哈夫单位极显著高于1.0×104和1.0×1010CFU/g粪肠球菌添加组(P<0.01);试验第84天,1.0×106和1.0×108CFU/g粪肠球菌添加组的哈夫单位显著高于1.0×104CFU/g粪肠球菌添加组(P<0.05)。试验第28天,1.0×1010CFU/g粪肠球菌添加组的蛋黄颜色极显著高于对照组和1.0×104CFU/g粪肠球菌添加组(P<0.01);试验第56天,1.0×104、1.0×106和1.0×1010CFU/g粪肠球菌添加组的蛋黄颜色极显著高于对照组(P<0.01);试验第112天,各粪肠球菌添加组的蛋黄颜色均极显著高于对照组(P<0.01),且1.0×108CFU/g粪肠球菌添加组的蛋黄颜色极显著高于1.0×106CFU/g粪肠球菌添加组(P<0.01);试验第140天,1.0×108CFU/g粪肠球菌添加组的蛋黄颜色极显著高于对照组(P<0.01),而1.0×1010CFU/g粪肠球菌添加组蛋黄颜色极显著低于对照组和其他粪肠球菌添加组(P<0.01)。3)试验第56天和第112天,1.0×108CFU/g粪肠球菌添加组蛋鸡的蛋黄总胆固醇含量极显著低于对照组、1.0×104和1.0×106CFU/g粪肠球菌添加组(P<0.01)。与对照组相比,饲粮添加粪肠球菌显著或极显著降低试验第84天的血清总胆固醇(P<0.01)、低密度脂蛋白胆固醇含量(P<0.01)和第168天的血清甘油三酯含量(P<0.05)。4)1.0×106、1.0×108和1.0×1010CFU/g粪肠球菌添加组的回肠大肠杆菌数量显著低于对照组(P<0.05);空肠大肠杆菌数量随粪肠球菌添加水平的增加呈线性降低(P<0.05)。1.0×1010CFU/g粪肠球菌添加组的回肠粪肠球菌数量极显著高于对照组、1.0×104和1.0×108CFU/g粪肠球菌添加组(P<0.01);1.0×108和1.0×1010CFU/g粪肠球菌添加组的盲肠粪肠球菌数量极显著高于对照组(P<0.01)。结果表明,饲粮添加粪肠球菌能提高蛋鸡的产蛋量、蛋白高度和蛋黄颜色,降低血清和蛋黄的总胆固醇含量,调节肠道微生物数量;粪肠球菌在蛋鸡饲粮中的适宜添加量为1.0×106或1.0×108CFU/g。
粪肠球菌;蛋鸡;生产性能;蛋品质;脂质代谢;肠道微生物数量
粪肠球菌(Enterococcusfaecalis)是一种普遍存在于人和动物肠道内的产乳酸革兰氏阳性需氧菌或兼性厌氧菌[1-3],是我国农业部公布的《饲料添加剂品种目录(2013)》中规定的可以直接饲喂动物的饲料级微生物添加剂菌种之一。早在1998年美国食品和药物管理局(FDA)和美国饲料控制官员协会(AAFCO)就将粪肠球菌认定为安全的、可以直接饲喂的微生物菌种。研究发现,饲粮中添加粪肠球菌具有提高动物生产性能、改善营养物质代谢和提高免疫功能等作用[4-8]。史自涛等[4]报道,饲粮中添加粪肠球菌可降低仔猪的腹泻率,提高血液中总蛋白和球蛋白含量,降低白球比和谷丙转氨酶活性,改善机体蛋白质代谢和免疫功能,提高平均日采食量和平均日增重,改善其生长性能。刘辉等[5]在断奶仔猪饲粮中添加粪肠球菌,发现平均日增重提高了8.79%,料重比降低了8.43%。侯璐[6]在断奶仔猪饲粮中添加粪肠球菌,发现平均日增重提高了8.51%,料重比降低了7.57%。Ross等[7]在断奶仔猪饲粮中添加粪肠球菌,发现仔猪采食量显著降低而饲料利用率显著提高。贡筱等[8]报道,饲粮中添加1×108CFU/kg粪肠球菌时育成期蓝狐的营养物质消化率、氮沉积、净蛋白质利用率和蛋白质生物学价值较为理想,且可获得较好的生长性能。然而,目前关于粪肠球菌作为益生菌在蛋鸡上的研究和应用尚无报道。因此,本试验旨在通过饲养试验研究粪肠球菌对蛋鸡生产性能、蛋品质、脂质代谢和肠道微生物数量的影响,为粪肠球菌在蛋鸡上的应用提供试验依据。
1 材料与方法
1.1 试验材料
粪肠球菌菌悬液的制备:取出粪肠球菌(CGMCC1.2135T)冻干粉,接种于胰蛋白胨大豆肉汤(TSB)培养基,在温度37 ℃、转速160 r/min条件下进行活化和扩繁培养。将所得发酵液用生理盐水稀释,取0.2 mL稀释液均匀涂布于胰蛋白胨大豆肉汤琼脂(TSA)培养基平板,37 ℃培养24 h后进行活菌计数,计算总菌体数量。然后4 500 r/min离心15 min,弃去上清液,以无菌生理盐水洗涤菌体,再4 500 r/min离心15 min,弃去上清液,重复2次,获得菌体沉淀。用生理盐水稀释到确定浓度(CFU/mL),得到菌体浓度已知的粪肠球菌菌悬液。将菌悬液均匀喷洒至饲粮中,搅拌均匀即可。粪肠球菌在饲粮中的添加水平、菌悬液浓度和菌悬液添加水平见表1。
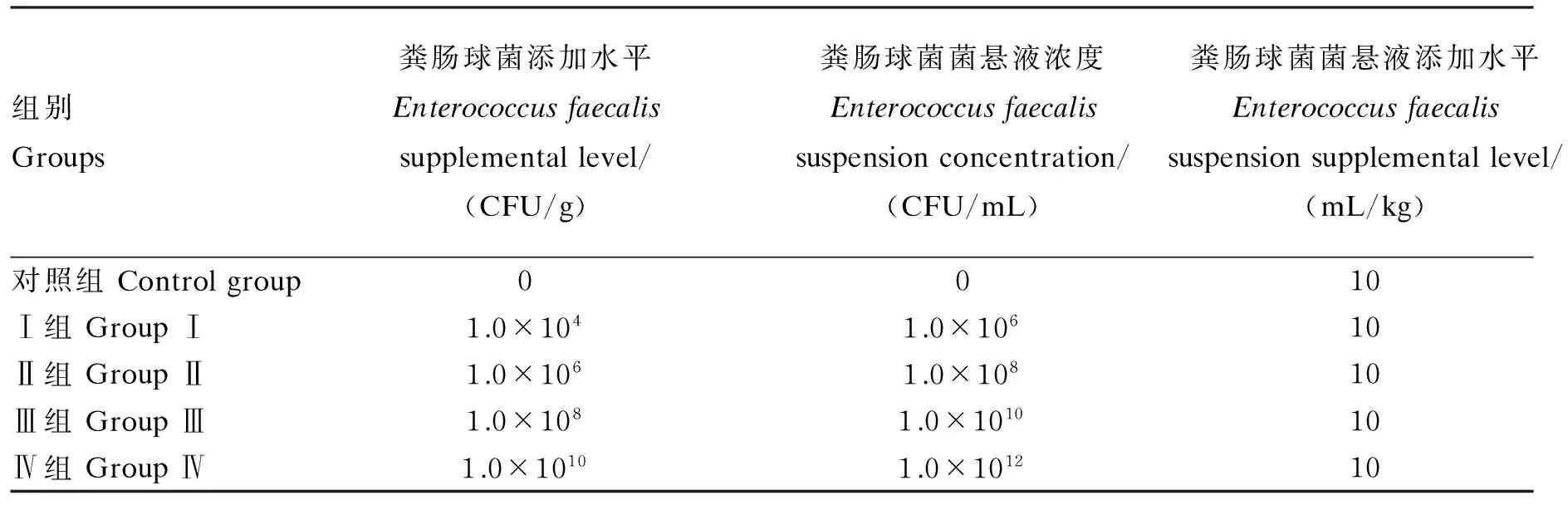
表1 粪肠球菌在饲粮中的添加水平
1.2 试验设计及饲粮
选择137日龄海兰褐壳蛋鸡450只,随机分成5个组,每组6个重复,每个重复15只鸡,各组之间体重和产蛋率无显著差异(P>0.05)。对照组饲喂不添加粪肠球菌的基础饲粮,Ⅰ、Ⅱ、Ⅲ和Ⅳ组分别饲喂在基础饲粮中添加1.0×104、1.0×106、1.0×108和1.0×1010CFU/g粪肠球菌的试验饲粮。基础饲粮参照NRC(1994)[9]蛋鸡营养需要配制,基础饲粮组成及营养水平见表2。

表2 基础饲粮组成及营养水平(风干基础)
1)预混料为每千克饲粮提供 Premix provided the following per kg of the diet:Mn 63.6 mg,Zn 69 mg,Fe 30 mg,Cu 6.25 mg,I 0.4 mg,Se 0.2 mg,VA 8 000 IU,VD33 000 IU,VE 15 IU,VK32 mg,VB12 mg,VB24 mg,VB64 mg,VB120.01 mg,泛酸钙 calcium pantothenate 14 mg,烟酸 nicotinic acid 40 mg,叶酸 folic acid 1 mg,生物素 biotin 0.1 mg,氯化胆碱 choline chloride 250 mg,蛋氨酸 Met 990 mg。
2)粗蛋白质、粗纤维和粗脂肪为实测值,其余均为计算值。CP, CF and EE were measured values, while the others were calculated values.
1.3 饲养管理
试验蛋鸡采用半开放鸡舍3层阶梯式笼养,每笼3只鸡。每日定时饲喂3次(06:00、12:00、18:00),自由采食和饮水。采用自然加人工补光,恒定光照时间为16 h/d(06:00~22:00,自动照明控制系统控制),光照强度为14 lx。用干湿球温度计测定每天鸡舍温度和湿度,及时采取管理措施保证鸡舍温度在(20±3) ℃,相对湿度在60%~80%。试验期168 d。
1.4 测定指标及方法
1.4.1 生产性能
试验期间,每天以重复为单位记录蛋鸡体重、产蛋数、蛋重、死亡鸡数,并计算产蛋率、平均蛋重、产蛋量;每周结料1次,并计算平均日采食量和料蛋比。
1.4.2 蛋品质
试验第28、56、84、112、140和168天,采集当天所有鸡蛋,于12 h内进行蛋品质测定。采用蛋壳强度测定仪(Model-Ⅲ,Robotmation公司,日本)测定蛋壳强度;采用蛋壳厚度测定仪(Model P-1,Ozaki MFG公司,日本)测定蛋壳厚度;采用蛋品质测定仪(EMT-2500,Robotmation公司,日本)测定蛋白高度、哈氏单位和蛋黄颜色。
1.4.3 血清总胆固醇(TCHO)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)含量
试验第1、28、56、84、112、140和168天,每个重复随机选取3只鸡,翅静脉采血,3 000 r/min离心10 min,分离血清,-20 ℃保存。采用总胆固醇测定试剂盒(COD-PAP法)测定血清总胆固醇含量,采用甘油三酯测定试剂盒(GPO-PAP法)测定血清甘油三酯含量,采用低密度脂蛋白胆固醇测定试剂盒(聚乙烯硫酸沉淀法)测定血清低密度脂蛋白胆固醇含量,所用试剂盒均由北京中生北控生物科技股份有限公司提供。吸光度法测定所用的分光光度计为双光束紫外可见光分光光度计(TU-1901,北京普析通用仪器有限责任公司)。
1.4.4 蛋黄总胆固醇含量
试验第28、56、84、112、140和168天,每个重复随机采集8枚鸡蛋,分离蛋黄,混合均匀,-20 ℃保存。采用总胆固醇测定试剂盒(COD-PAP法)测定蛋黄总胆固醇含量,所用试剂盒由北京中生北控生物科技股份有限公司提供。
1.4.5 肠道微生物数量
试验第168天,每个重复随机选取1只鸡,放血处死,在超净台内采集空肠、回肠和盲肠并结扎,迅速转移到微生物实验室进行肠道内容物中大肠杆菌和粪肠球菌的选择培养和平板计数。大肠杆菌的选择培养基为伊红美蓝琼脂培养基(北京路桥技术股份有限公司),粪肠球菌的选择培养基为KF链球菌琼脂培养基(CM0701)(北京路桥技术股份有限公司)。称取0.5 g左右的肠道内容物于10 mL离心管内,加入一定量的生理盐水进行10倍梯度稀释,用旋涡混合器混匀至合适梯度。取0.1 mL稀释后的菌悬液在各培养基上用涂布棒进行涂板,每个梯度3个重复,37 ℃培养24 h后计数。
每克样品中菌落数=lg[(菌落数×
稀释倍数×10 mL/0.1 mL)/0.5 g]。
1.5 数据分析
试验数据采用SAS 9.1统计软件中的GLM程序进行单因素方差分析,差异显著者用Duncan氏法进行多重比较,P<0.05和P<0.01分别作为差异显著和极显著的判断标准。同时,用正交多项式分析饲粮中添加粪肠球菌对蛋鸡生产性能、蛋品质、蛋黄胆固醇含量和血清胆固醇、低密度脂蛋白胆固醇、甘油三酯含量以及肠道微生物数量影响的线性和二次效应。其中产蛋率数据经反正弦转换后进行分析,肠道微生物数量数据经对数转换后进行分析。
2 结 果
2.1 饲粮添加粪肠球菌对蛋鸡生产性能的影响
饲粮添加粪肠球菌对蛋鸡的体重、产蛋率、平均蛋重、平均日采食量均无显著影响(数据未展示)(P>0.05)。由表3可知,与对照组和其他粪肠球菌添加组相比,饲粮添加1.0×106CFU/g粪肠球菌可极显著提高试验第113~140天和第141~168天的产蛋量(P<0.01)。试验第141~168天,各粪肠球菌添加组的料蛋比与对照组无显著差异(P>0.05),但1.0×104CFU/g粪肠球菌添加组的料蛋比显著低于1.0×108CFU/g粪肠球菌添加组(P<0.05);其余阶段各组的料蛋比无显著差异(P>0.05)。

表3 饲粮添加粪肠球菌对蛋鸡生产性能的影响
同行数据肩标相同小写字母或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。下表同。
In the same row, values with the same small letter or no letter superscripts mean no significant difference (P>0.05), and with different small letter superscripts mean significant difference (P<0.05), while with different capital letter superscripts mean significant difference (P<0.01). The same as below.
2.2 饲粮添加粪肠球菌对蛋鸡蛋品质的影响
饲粮添加粪肠球菌对蛋鸡的蛋壳强度无显著影响(数据未展示)(P>0.05)。由表4可知,试验第56天,各粪肠球菌添加组的蛋壳厚度均显著高于对照组(P<0.05),各粪肠球菌添加组间无显著差异(P>0.05);其余阶段各组的蛋壳厚度无显著差异(P>0.05)。试验第56天,对照组和1.0×106CFU/g粪肠球菌添加组的蛋白高度显著高于1.0×104和1.0×1010CFU/g粪肠球菌添加组(P<0.05);试验第84天和第140天,各粪肠球菌添加组的蛋白高度与对照组无显著差异(P>0.05),1.0×108CFU/g粪肠球菌添加组的蛋白高度显著高于1.0×104CFU/g粪肠球菌添加组(P<0.05)。整个试验期间,与对照组相比,各粪肠球菌添加组的哈夫单位无显著差异(P>0.05);试验第56天,1.0×106CFU/g粪肠球菌添加组的哈夫单位最高,且极显著高于1.0×104和1.0×1010CFU/g粪肠球菌添加组(P<0.01);试验第84天,1.0×106和1.0×108CFU/g粪肠球菌添加组的哈夫单位显著高于1.0×104CFU/g粪肠球菌添加组(P<0.05)。试验第28天,1.0×1010CFU/g粪肠球菌添加组的蛋黄颜色极显著高于对照组和1.0×104CFU/g粪肠球菌添加组(P<0.01);试验第56天,1.0×104、1.0×106和1.0×1010CFU/g粪肠球菌添加组的蛋黄颜色极显著高于对照组(P<0.01),各粪肠球菌添加组间无显著差异(P>0.05);试验第112天,各粪肠球菌添加组的蛋黄颜色均极显著高于对照组(P<0.01),且1.0×108CFU/g粪肠球菌添加组的蛋黄颜色极显著高于1.0×106CFU/g粪肠球菌添加组(P<0.01);试验第140天,1.0×108CFU/g粪肠球菌添加组的蛋黄颜色极显著高于对照组(P<0.01),而1.0×1010CFU/g粪肠球菌添加组的蛋黄颜色极显著低于对照组和其他粪肠球菌添加组(P<0.01)。

表4 饲粮添加粪肠球菌对蛋鸡蛋品质的影响
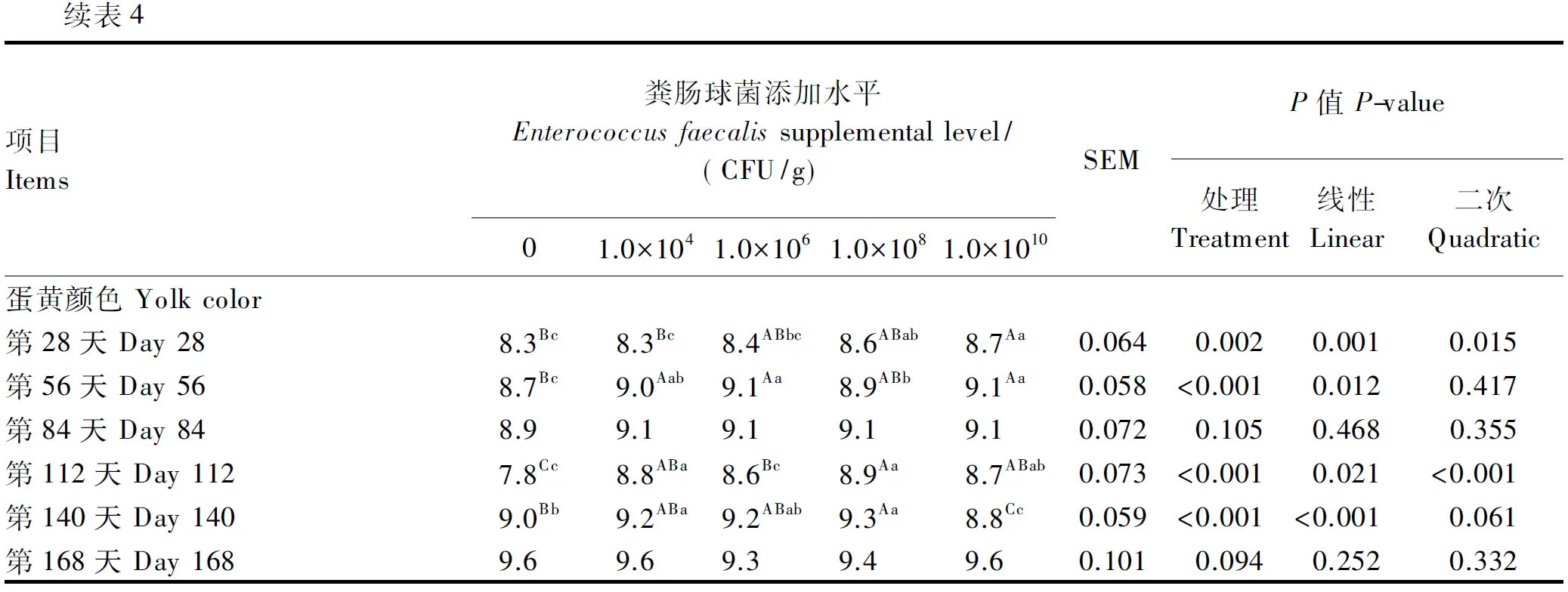
续表4项目Items粪肠球菌添加水平Enterococcusfaecalissupplementallevel/(CFU/g)01.0×1041.0×1061.0×1081.0×1010SEMP值P-value处理Treatment线性Linear二次Quadratic蛋黄颜色Yolkcolor第28天Day288.3Bc8.3Bc8.4ABbc8.6ABab8.7Aa0.0640.0020.0010.015第56天Day568.7Bc9.0Aab9.1Aa8.9ABb9.1Aa0.058<0.0010.0120.417第84天Day848.99.19.19.19.10.0720.1050.4680.355第112天Day1127.8Cc8.8ABa8.6Bc8.9Aa8.7ABab0.073<0.0010.021<0.001第140天Day1409.0Bb9.2ABa9.2ABab9.3Aa8.8Cc0.059<0.001<0.0010.061第168天Day1689.69.69.39.49.60.1010.0940.2520.332
2.3 饲粮添加粪肠球菌对蛋鸡蛋黄总胆固醇含量的影响
由表5可知,试验第56天,1.0×108CFU/g粪肠球菌添加组蛋鸡的蛋黄总胆固醇含量极显著低于对照组、1.0×104和1.0×106CFU/g粪肠球菌添加组(P<0.01);试验第112天,1.0×108和1.0×1010CFU/g粪肠球菌添加组的蛋黄总胆固醇含量极显著低于对照组、1.0×104和1.0×106CFU/g粪肠球菌添加组(P<0.01)。蛋黄总胆固醇含量在1.0×108和1.0×1010CFU/g粪肠球菌添加组间无显著差异(P>0.05)。
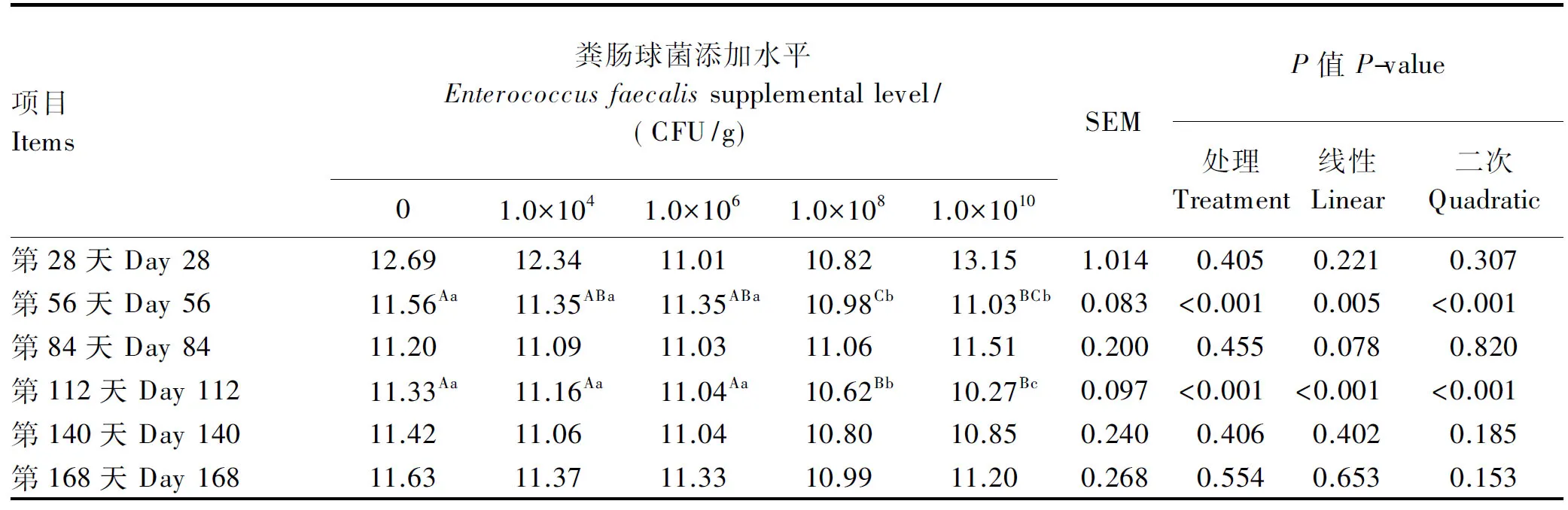
表5 饲粮添加粪肠球菌对蛋鸡蛋黄总胆固醇含量的影响
2.4 饲粮添加粪肠球菌对蛋鸡血清总胆固醇、甘油三酯和低密度脂蛋白胆固醇含量的影响
由表6可知,试验第84天,各粪肠球菌添加组蛋鸡的血清总胆固醇含量均极显著低于对照组(P<0.01),各粪肠球菌添加组间无显著差异(P>0.05);试验第168天,随着粪肠球菌添加水平的增加血清总胆固醇含量呈二次降低(P<0.05)。试验第168天,各粪肠球菌添加组的血清甘油三酯含量均显著低于对照组(P<0.05),各粪肠球菌添加组间无显著差异(P>0.05)。试验第84天,各粪肠球菌添加组的血清低密度脂蛋白胆固醇含量均极显著低于对照组(P<0.01),各粪肠球菌添加组间无显著差异(P>0.05)。
2.5 饲粮添加粪肠球菌对蛋鸡肠道微生物数量的影响
由表7可知,1.0×106、1.0×108和1.0×1010CFU/g粪肠球菌添加组的回肠大肠杆菌数量显著低于对照组(P<0.05),各粪肠球菌添加组间无显著差异(P>0.05);空肠大肠杆菌数量随饲粮粪肠球菌添加水平的增加呈线性降低(P<0.05)。1.0×1010CFU/g粪肠球菌添加组的回肠粪肠球菌数量极显著高于对照组、1.0×104和1.0×108CFU/g粪肠球菌添加组(P<0.01);1.0×108和1.0×1010CFU/g粪肠球菌添加组的盲肠粪肠球菌数量极显著高于对照组(P<0.01),各粪肠球菌添加组间无显著差异(P>0.05)。
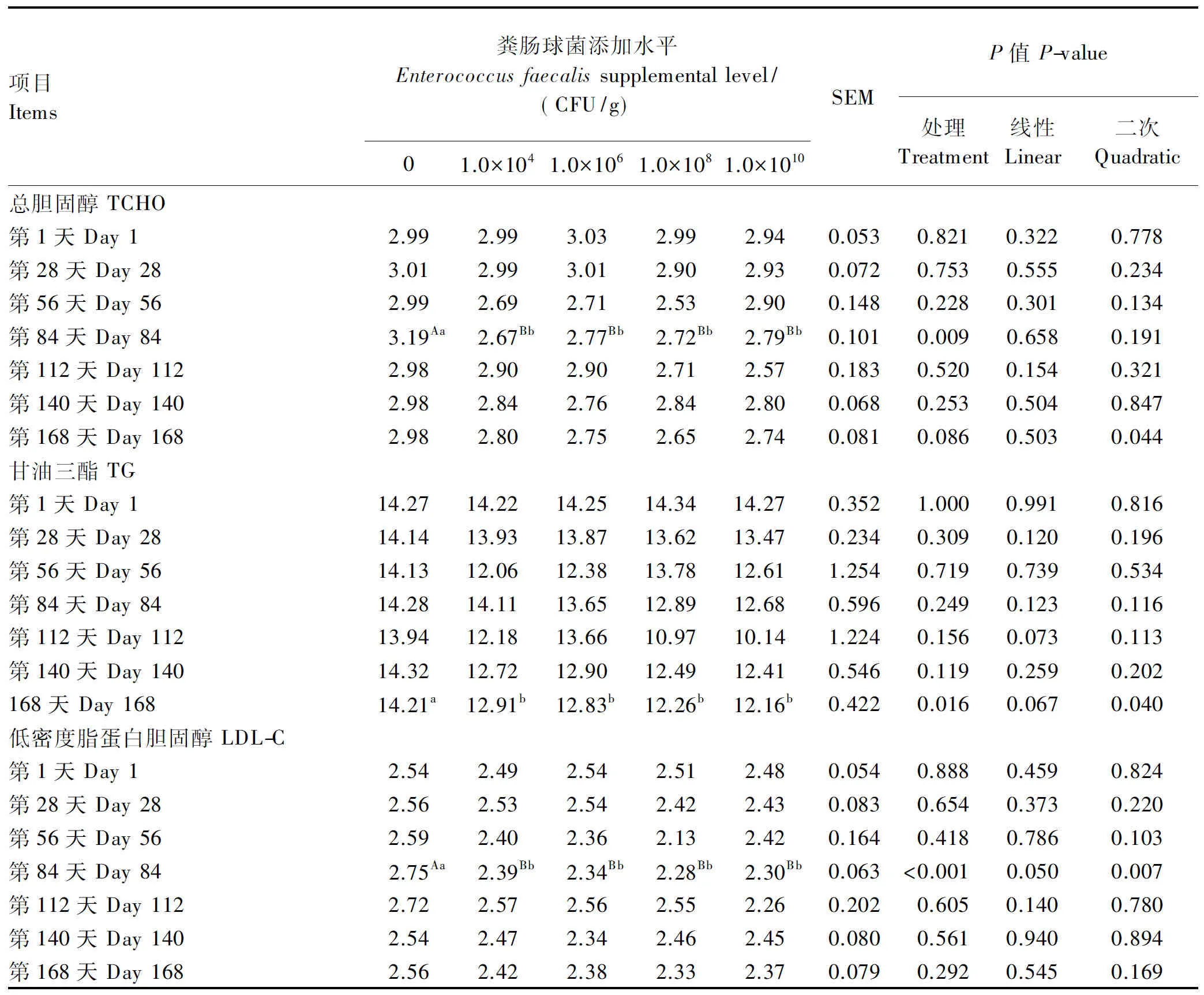
表6 饲粮添加粪肠球菌对蛋鸡血清胆固醇、甘油三酯和低密度脂蛋白胆固醇含量的影响
3 讨 论
粪肠球菌是一种普遍存在于人和动物肠道的产乳酸革兰氏阳性需氧菌或兼性厌氧菌[1-3]。益生菌能发挥作用的关键之一是具有耐酸、耐胆盐特性,从而保证其能到达发挥益生作用的肠道区域。前期研究表明,本试验所用的粪肠球菌CGMCC1.2135T具有良好的耐酸、耐胆盐特性[10]。侯璐[6]研究也表明,粪肠球菌具有耐酸、耐胆盐以及耐高温等特性,能够顺利到达畜禽肠道并存活。研究还发现,粪肠球菌CGMCC1.2135T具有体外抑制沙门氏菌和大肠杆菌的能力[10]。Hugas等[11]研究也发现,粪肠球菌可产生有机酸及细菌素,抑制肠道内病原菌及腐败微生物的生长,降低盲肠及回肠pH,从而优化肠道环境。此外,Pereira等[12]发现粪肠球菌具有很高的胆盐分解酶活性,可将胆盐肝肠循环中的胆盐酶解,从而导致肠道对胆汁的重吸收减少,动物血液中用于补偿性合成胆盐的胆固醇增多。这个生理特性为粪肠球菌作为降胆固醇益生菌提供了理论可能。
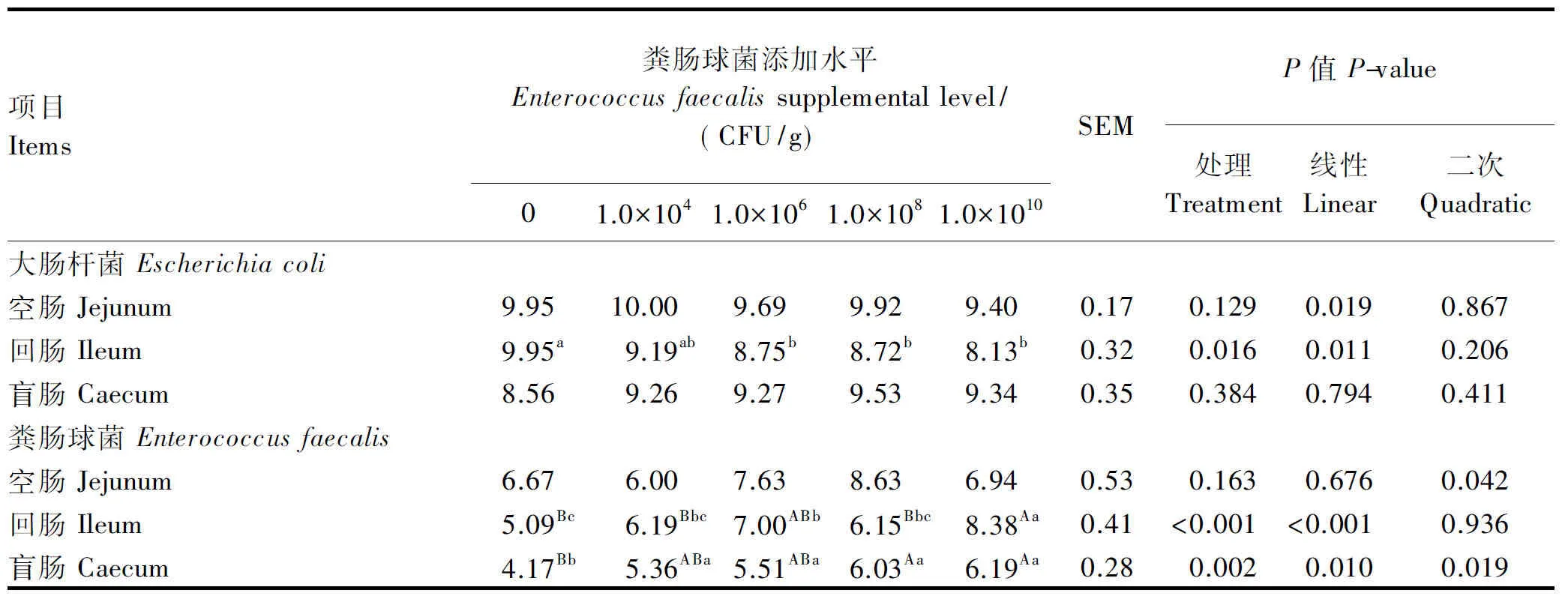
表7 饲粮添加粪肠球菌对蛋鸡肠道微生物数量的影响
本试验中,饲粮中添加粪肠球菌24周对蛋鸡的体重、产蛋率、平均蛋重和平均日采食量均无显著影响。目前,尚无关于粪肠球菌对蛋鸡体重、产蛋率、平均蛋重和平均日采食量影响的研究报道。研究认为,饲粮添加乳酸菌[13-15]、地衣芽孢杆菌和枯草芽孢杆菌[16]和酿酒酵母[17]对蛋鸡的体重均无显著影响;饲粮添加乳酸菌[14]、地衣芽孢杆菌和枯草芽孢杆菌[16,18]能提高蛋鸡的产蛋率。但Nahashon等[15,19]、Balevi等[20]、Salma等[21]和Mikulski等[22]报道乳酸菌、荚膜红细菌、乳酸片球菌等益生菌对蛋鸡的产蛋率无显著影响。Nahashon等[13]、Kurtoglu等[16]、Yousefi等[17]、Goodling等[23]和Mohan等[24]研究发现乳酸菌、地衣芽孢杆菌、枯草芽孢杆菌、酿酒酵母、嗜酸乳杆菌、干酪乳杆菌和双歧杆菌等益生菌对蛋鸡的蛋重无显著影响。本试验研究结果显示,饲粮添加1.0×106CFU/g粪肠球菌可极显著提高试验第113~140天和第141~168天的产蛋量。Nahashon等[19]、Tortuero等[25]和Xu等[26]的研究也发现乳酸菌、粪链球菌和枯草芽孢杆菌能提高蛋鸡的产蛋量。试验第141~168天,饲粮添加1.0×104CFU/g粪肠球菌相比添加1.0×108CFU/g粪肠球菌能显著降低料蛋比,提高饲料转化率。这可能与粪肠球菌能抑制肠道有害微生物,调节肠道pH,从而优化肠道环境,提高肠道酶活性和养分消化率有关[11,27]。蛋壳厚度和蛋壳强度是用来评价蛋壳质量的常用指标。本试验中,试验第56天,饲粮添加粪肠球菌可显著提高蛋壳厚度,推测可能与粪肠球菌可改善肠道环境和功能、提高肠道钙吸收有关。饲粮添加粪肠球菌对蛋壳强度无显著影响,这与Nahashon等[15]和Mahdavi等[18]的报道相一致。哈夫单位和蛋白高度是评价蛋新鲜程度的指标。研究报道,哈夫单位和蛋白高度随存储时间的延长显著降低[28-30]。本试验中,试验第56天,饲粮添加1.0×106CFU/g粪肠球菌相比添加1.0×104和1.0×1010CFU/g粪肠球菌可显著提高蛋白高度和哈夫单位;试验第84天,饲粮添加1.0×108CFU/g粪肠球菌相比添加1.0×104CFU/g粪肠球菌可显著提高蛋白高度和哈夫单位;从而提高鸡蛋新鲜程度,延长商品鸡蛋货架期。对于蛋黄颜色而言,虽然没有明显的剂量效应或规律一致的结果,但试验中观察到试验第28、56、84和112天,各粪肠球菌添加组的蛋黄颜色与对照组相比有所提高,饲粮中添加粪肠球菌对蛋黄颜色的影响作用机理有待进一步研究讨论。
粪肠球菌降低蛋黄和血清胆固醇含量的机理可能与其能产生胆盐分解酶有关。胆盐是以胆固醇为前体在肝脏中合成的水溶性物质。胆盐分解酶为N端亲核水解酶,能特异性地水解结合胆盐的酰胺键,释放出游离胆盐和甘氨酸或牛磺酸的氨基酸残基[31]。粪肠球菌能产生胆盐分解酶[32-34]。经胆盐分解酶分解的游离胆盐与结合胆盐相比,其溶解度较低,不容易被肠道重新吸收[35],从而随粪便排出体外[36-37]。因此,机体为维持正常的肝肠循环,弥补胆盐损失,肝脏会利用血液中的胆固醇重新合成新的胆盐,从而引起血清胆固醇含量的降低[12,37]。除通过胆盐分解酶活性的解离作用降低机体胆固醇含量外,研究者还推测益生菌可通过细胞质同化胞外胆固醇、细胞膜整合胞外胆固醇以及细胞壁吸附胞外胆固醇等途径发挥降低机体胆固醇含量的作用[38-39]。
一些致病性的大肠杆菌可以在慢性无症状携带状态引起局部或全身性感染,因此一直是世界性的公共卫生问题。此外,残留在鸡蛋上的大肠杆菌也是影响食品安全的因素之一。本试验中,1.0×106、1.0×108和1.0×1010CFU/g粪肠球菌添加组的回肠大肠杆菌数量显著低于对照组,空肠大肠杆菌数量随粪肠球菌添加水平的增加呈线性降低。鲍延娥等[10]报道,粪肠球菌CGMCC1.2135T能抑制大肠杆菌O1和O78的生长。研究证实,粪肠球菌产生的细菌素具有广谱抗菌性,不仅包括革兰氏阳性菌,同时也包括诸如李斯特菌(Listeriaspp.)[40-43]、沙门氏菌(Salmonellaspp.)[44]、大肠杆菌(Escherichiacoli)[44]和金黄色葡萄球菌(Staphylococcusaureus)[45]等革兰氏阴性菌。因此,饲粮添加粪肠球菌有助于降低蛋鸡感染大肠杆菌的风险,同时,这或许有助于降低鸡蛋大肠杆菌污染。
4 结 论
① 饲粮添加1.0×106CFU/g粪肠球菌极显著提高试验第113~168天的产蛋量。
② 试验第56天,饲粮添加1.0×106CFU/g粪肠球菌相比添加1.0×104和1.0×1010CFU/g粪肠球菌可显著提高蛋白高度和哈夫单位;试验第84天,饲粮添加1.0×108CFU/g粪肠球菌相比添加1.0×104CFU/g粪肠球菌可显著提高蛋白高度和哈夫单位。试验第28、56、84和112天,各粪肠球菌添加组均能提高蛋黄颜色,但饲粮添加1.0×1010CFU/g粪肠球菌会降低试验第140天的蛋黄颜色。
③ 试验第56天和第112天,1.0×108CFU/g粪肠球菌添加组蛋鸡的蛋黄总胆固醇含量极显著低于对照组、1.0×104和1.0×106CFU/g粪肠球菌添加组。饲粮添加粪肠球菌显著降低了血清总胆固醇(第84天)、甘油三酯(第168天)和低密度脂蛋白胆固醇(第84天)含量。
④ 饲粮添加1.0×106、1.0×108和1.0×1010CFU/g粪肠球菌显著降低回肠大肠杆菌数量;空肠大肠杆菌数量随粪肠球菌添加水平的增加呈线性降低。与对照组、1.0×104和1.0×108CFU/g粪肠球菌添加组相比,饲粮添加1.0×1010CFU/g 粪肠球菌极显著提高回肠粪肠球菌数量,饲粮添加1.0×108和1.0×1010CFU/g粪肠球菌显著提高盲肠粪肠球菌数量。
⑤ 蛋鸡饲粮中粪肠球菌的适宜添加量为1.0×106或1.0×108CFU/g。
[1] BARNES E M,MEAD G C,BARNUML D A,et al.The intestinal flora of the chicken in the period 2 to 6 weeks of age,with particular reference to the anaerobic bacteria[J].British Poultry Science,1972,13(3):311-326.
[2] SALANITRO J P,BLAKE I G,MUIREHEAD P A,et al.Bacteria isolated from the duodenum,ileum,and cecum of young chicks[J].Applied and Environmental Microbiology,1978,35(4):782-790.
[3] MITSUOKA T.Intestinal flora and aging[J].Nutrition Reviews,1992,50(12):438-446.
[4] 史自涛,姚焰础,江山,等.粪肠球菌替代抗生素对断奶仔猪生长性能、腹泻率、血液生化指标和免疫器官的影响[J].动物营养学报,2015,27(6):1832-1840.
[5] 刘辉,季海峰,王四新,等.2种乳酸菌制剂对断奶仔猪生产性能的影响[J].饲料研究,2011(11):49-51.
[6] 侯璐.猪源粪肠球菌的特性及对仔猪生长性能和免疫力影响的研究[D].硕士学位论文.呼和浩特:内蒙古农业大学,2010.
[7] ROSS G R,GUSILS C,OLISZEWSKI R,et al.Effects of probiotic administration in swine[J].Journal of Bioscience and Bioengineering,2010,109(6):545-549.
[8] 贡筱,郭俊刚,吴学壮,等.饲粮中添加枯草芽孢杆菌和粪肠球菌对育成期蓝狐生长性能、营养物质消化率及氮代谢的影响[J].动物营养学报,2014,26(4):1004-1010.
[9] NRC.Nutrient requirements of poultry[S].9th ed.Washington,D.C.:National Academy Press,1994.
[10] 鲍延娥,董晓芳,佟建明,等.粪肠球菌益生特性的体外评价[J].西北农业学报,2013,22(11):202-207.
[11] HUGAS M,GARRIGA M,AYMERICH M T.Functionalty ofEnterococciin meat products[J].International Journal of Food Microbiology,2003,88(2/3):223-233.
[12] PEREIRA D I,MCCARTNEY A L,GIBSON G R.Aninvitrostudy of the probiotic potential of a bile-salt-hydrolyzingLactobacillusfermentumstrain,and determination of its cholesterol-lowering properties[J].Applied and Environmental Microbiology,2003,69(8):4743-4752.
[13] NAHASHON S N,NAKAUE H S,MIROSH L W.Phytaseactivity,phosphorus and calcium retention,and performance of Single Comb White Leghorn layers fed diets containing two levels of available phosphorus and supplemented with direct-fed microbials[J].Poultry Science,1994,73(10):1552-1562.
[14] NAHASHON S N,NAKAUE H S,MIROSH L W.Production variables and nutrient retention in Single Comb White Leghorn laying pullets fed diets supplemented with direct-fed microbials[J].Poultry Science,1994,73(11):1699-1711.
[15] NAHASHON S N,NAKAUE H S,MIROSH L W.Performance of single comb white leghorn fed a diet supplemented with a live microbial during the growth and egg laying phases[J].Animal Feed Science and Technology,1996,57(1/2):25-38.
[16] KURTOGLU V,KURTOGLU F,SEKER E,et al.Effect of probiotic supplementation on laying hen diets on yield performance and serum and egg yolk cholesterol[J].Food Additives & Contaminants,2004,21(9):817-823.
[17] YOUSEFI M,KARKOODI K.Effect of probiotic Thepax andSaccharomycescerevisiaesupplementation on performance and egg quality of laying hens[J].International Journal of Poultry Science,2007,6(1):52-54.
[18] MAHDAVI A H,RAHMANI H R,POURREZA J.Effect of probiotic supplements on egg quality and laying hen’s performance[J].International Journal of Poultry Science,2005,4(7):488-492.
[19] NAHASHON S N,NAKAUE H S,MIROSH L W.Nutrient retention and production parameters of Single Comb White Leghorn layers fed diets with varying crude protein levels and supplemented with direct-fed microbials[J].Animal Feed Science and Technology,1996,61(1/2/3/4):17-26.
[20] BALEVI T,UÇAN U S,COUN B,et al.Effect of dietary probiotic on performance and humoral immune response in layer hens[J].British Poultry Science,2001,42(4):456-461.
[21] SALMA U,MIAH A G,TAREQ K M A,et al.Effect of dietaryRhodobactercapsulatuson egg-yolk cholesterol and laying hen performance[J].Poultry Science,2007,86(4):714-719.
[22] MIKULSKI D,JANKOWSKI J,NACZMANSKI J,et al.Effects of dietary probiotic (Pediococcusacidilactici) supplementation on performance,nutrientdigestibility,eggtraits,egg yolk cholesterol,and fatty acid profile in laying hens[J].Poultry Science,2012,91(10):2691-2700.
[23] GOODLING A C,CERNIGLIA G J,HEBERT J A.Production performance of white leghorn layers fedLactobacillusfermentation products[J].Poultry Science,1987,66(3):480-486.
[24] MAHAN B,KADIRVEL R,BHASKARAN M,et al.Effect of probiotic supplementation on serum/yolk cholesterol and on egg shell thickness in layers[J].British Poultry Science,1995,36(5):799-803.
[25] TORTUERO F,FERNNDEZ E.Effects of inclusion of microbial cultures in barley-based diets fed to laying hens[J].Animal Feed Science and Technology,1995,53(3/4):255-265.
[26] XU C L,JI C,MA Q,et al.Effects of a driedBacillussubtilisculture on egg quality[J].Poultry Science,2006,85(2):364-368.
[27] DIERICK N A.Biotechnology aids to improve feed and feed digestion:enzymes and fermentation[J].Archivfür Tierernaehrung,1989,39(3):241-261.
[28] KAHRAMAN-DOGAN H,BAYINDIRLI L,ÖZILGEN M.Quality control charts for storage of eggs[J].Journal of Food Quality,1994,17(6):495-501.
[29] SILVERSIDES F G,VILLENEUVE P.Is the Haugh unit correction for egg weight valid for eggs stored at room temperature?[J].Poultry Science,1994,73(1):50-55.
[30] JONES D R,THARRINGTON J B,CURTIS P A,et al.Effects of cryogenic cooling of shell eggs on egg quality[J].Poultry Science,2002,81(5):727-733.
[31] BEGLEY M,HILL C,GAHAN C G .Bile salt hydrolase activity in probiotics[J].Applied and Environmental Microbiology,2006,72(3):1729-1738.
[32] FRANZ C M,SPECHT I,HABERER P,et al.Bile salt hydrolase activity of enterococci isolated from food:screening and quantitative determination[J].Journal of Food Protection,2001,64(5):725-729.
[33] KNARREBORG A,ENGBERG R M,JENSEN S K,et al.Quantitative determination of bile salt hydrolase activity in bacteria isolated from the small intestine of chickens[J].Applied and Environmental Microbiology,2002,68(12):6425-6428.
[34] WIJAYA A,HERMANN A,ABRIOUEL H,et al.Cloning of the bile salt hydrolase (bsh) gene fromEnterococcusfaeciumFAIR-E 345 and chromosomal location ofbshgenes in food enterococci[J].Journal of Food Protection,2004,67(12):2772-2778.
[35] REYNIER M O,MONTET J C,GEROLAMI A,et al.Comparative effects of cholic,chenodeoxycholic,and ursodeoxycholic acids on micellar solubilization and intestinal absorption of cholesterol[J].Journal of Lipid Research,1981,22(3):467-473.
[36] DE SMET I,VAN HOORDE L,DE SAEYER N,et al.Invitrostudy of bile salt hydrolase (BSH) activity of BSH isogenicLactobacillusplantarum80 strains and estimation of cholesterol lowering through enhanced BSH activity[J].Microbial Ecology in Health and Disease,1994,7(6):315-329.
[37] DE RODAS B Z,GILLILAND S E,MAXWELL C V.Hypocholesterolemic action ofLactobacillusacidophilusATCC 43121 and calcium in swine with hypercholesterolemia induced by diet[J].Journal of Dairy Science,1996,79(12):2121-2128.
[38] PIGEON R M,CUESTA E P,GILLILAND S E.Binding of free bile acids by cells of yogurt starter culture bacteria[J].Journal of Dairy Science,2002,85(11):2705-2710.
[39] LIONG M T,SHAH N P.Acid and bile tolerance and cholesterol removal ability ofLactobacillistrains[J].Journal of Dairy Science,2005,88(1):55-66.
[40] MCKAY A M.Antimicrobial activity ofEnterococcusfaeciumagainstListeriaspp.[J].Letters in Applied Microbiology,1990,11(1):15-17.
[41] ARIHARA K,OGIHARA S,SAKATA J,et al.Antimicrobial activity ofEnterococcusfaecalisagainstListeriamonocytogenes[J].Letters in Applied Microbiology,1991,13(4):190-192.
[42] PARENTE E,HILL C.Characterization of enterocin 1146,a bacteriocin fromEnterococcusfaeciuminhibitory to Listeria monocytogenes[J].Journal of Food Protection,1992,55:497-502.
[43] VILLANI F,SALZANO G,SORRENTINO E,et al.Enterocin 226NWC,a bacteriocin produced byEnterococcusfaecalis226,active againstListeriamonocytogenes[J].Journal of Applied Bacteriology,1993,74(4):380-387.
[44] LINE J E,SVETOCH E A,ERUSLANOV B V,et al.Isolation and purification of enterocin E-760 with broad antimicrobial activity against gram-positive and gram-negative bacteria[J].Antimicrobial Agents and Chemotherapy,2008,52(3):1094-1100.
[45] FRANZ C M A P,VAN BELKUM M J,HOLZAPFEL W H,et al.Diversity of enterococcal bacteriocins and their grouping in a new classification scheme[J].FEMS Microbiology Reviews,2007,31(3):293-310.
*Corresponding author, associate professor, E-mail: xiaofangd1124@sina.com
(责任编辑 李慧英)
Effects of Dietary Enterococcus faecalis on Performance, Egg Quality, Lipid Metabolism and Intestinal Microflora Numbers of Laying Hens
LIU Song DONG Xiaofang*TONG Jianming BAO Yan’e WANG Zhihong
(InstituteofAnimalSciences,ChineseAcademyofAgriculturalSciences,Beijing100193,China)
This experiment was conducted to investigate the effects of dietaryEnterococcusfaecalison performance, egg quality, lipid metabolism and intestinal microflora numbers of laying hens. Four hundred and fifty 137-day-old Hy-Line brown laying hens were randomly allocated to 5 groups with 6 replicates per group and 15 hens per replicate. Hens were fed the basal diet supplemented with 0, 1.0×104, 1.0×106, 1.0×108and 1.0×1010CFU/gEnterococcusfaecalis(CGMCC1.2135T), respectively. The experiment lasted for 168 days. The results showed as follows: 1) egg mass of laying hens in 1.0×106CFU/gEnterococcusfaecalissupplemental group was significantly higher than that in the control group and the otherEnterococcusfaecalissupplemental groups during day 113 to 140 and day 141 to 168 (P<0.01). During day 141 to 168, the ratio of feed to egg in 1.0×104CFU/gEnterococcusfaecalissupplemental group was significantly lower than that in the 1.0×108CFU/gEnterococcusfaecalissupplemental group (P<0.05). 2) On day 56, eggshell thickness in allEnterococcusfaecalissupplemental groups was significantly higher than that in the control group (P<0.05), and albumen height in the control group and 1.0×106CFU/gEnterococcusfaecalissupplemental group was significantly higher than that in the 1.0×104and 1.0×1010CFU/gEnterococcusfaecalissupplemental groups (P<0.05). On days 84 and 140, albumen height in the 1.0×108CFU/gEnterococcusfaecalissupplemental group was significantly higher than that in the 1.0×104CFU/gEnterococcusfaecalissupplemental group (P<0.05). On day 56, Haugh unit in 1.0×106CFU/gEnterococcusfaecalissupplemental group was significantly higher than that in 1.0×104and 1.0×1010CFU/gEnterococcusfaecalissupplemental groups (P<0.01); On day 84, Haugh unit in 1.0×106and 1.0×108CFU/gEnterococcusfaecalissupplemental groups was significantly higher than that in 1.0×104CFU/gEnterococcusfaecalissupplemental group (P<0.05). On day 28, yolk color in 1.0×1010CFU/gEnterococcusfaecalissupplemental group was significantly higher than that in the control group and 1.0×104CFU/gEnterococcusfaecalissupplemental group (P<0.01). On day 56, yolk color in 1.0×104, 1.0×106and 1.0×1010CFU/gEnterococcusfaecalissupplemental groups was significantly higher than that in the control group (P<0.01). On day 112, yolk color in allEnterococcusfaecalissupplemental groups was significantly higher than that in the control group (P<0.01), moreover, yolk color in the 1.0×108CFU/gEnterococcusfaecalissupplemental group was significantly higher than that in 1.0×106CFU/gEnterococcusfaecalissupplemental group (P<0.01). On day 140, yolk color in 1.0×108CFU/gEnterococcusfaecalissupplemental group was significantly higher than that in the control group (P<0.01), however, yolk color in the 1.0×1010CFU/gEnterococcusfaecalissupplemental group was significantly lower than that in the control group and the otherEnterococcusfaecalissupplemental groups (P<0.01). 3) The content of total cholesterol (TCHO) in egg yolk of laying hens in 1.0×108CFU/gEnterococcusfaecalissupplemental group was significantly lower than that in the control group and 1.0×104and 1.0×106CFU/gEnterococcusfaecalissupplemental groups on days 56 and 112 (P<0.01). Compared with the control group, dietaryEnterococcusfaecalissignificantly decreased the contents of TCHO and low-density lipoprotein cholesterol (LDL-C) in serum on day 84 (P<0.01) and the content of triglyceride (TG) in serum on day 168 (P<0.05). 4) The number ofEscherichiacoliin ileum in 1.0×106, 1.0×108and 1.0×1010CFU/gEnterococcusfaecalissupplemental groups was significantly lower than that in the control group (P<0.05), and the number ofEscherichiacoliin jejunum had a linear decrease with the increasingEnterococcusfaecalissupplemental level (P<0.05). The number ofEnterococcusfaecalisin ileum in 1.0×1010CFU/gEnterococcusfaecalissupplemental group was significantly higher than that in the control group and 1.0×104and 1.0×108CFU/gEnterococcusfaecalissupplemental groups (P<0.01), and the number ofEnterococcusfaecalisin caecum in 1.0×108and 1.0×1010CFU/gEnterococcusfaecalissupplemental groups was significantly higher than that in the control group (P<0.01). This study indicates that dietaryEnterococcusfaecaliscan increase egg mass, albumen height and yolk color, decrease the content of TCHO in serum and egg yolk and regulate intestinal microflora numbers of laying hens, and the appropriate supplemental amount ofEnterococcusfaecalisin diets of laying hens is 1.0×106or 1.0×108CFU/g.[ChineseJournalofAnimalNutrition, 2017, 29(1):202-213]
Enterococcusfaecalis; laying hen; performance; egg quality; lipid metabolism; intestinal microflora numbers
10.3969/j.issn.1006-267x.2017.01.023
2016-07-14
国家蛋鸡产业技术体系建设专项经费(CARS-41-K16);中国农业科学院科技创新工程(ASTIP-IAS08)
刘 松(1991—),男,山东日照人,硕士研究生,动物营养与饲料科学专业。E-mail: liusong7@yeah.net
*通信作者:董晓芳,副研究员,硕士生导师,E-mail: xiaofangd1124@sina.com
S831
A
1006-267X(2017)01-0202-12
