基于16S rRNA测序探究葛根芩连汤对抗生素相关性腹泻肠道菌群结构的影响
2023-02-13苏钢杨光勇张庚鑫杜海洋田维毅王文佳王平涂小华何光志
苏钢,杨光勇,张庚鑫,杜海洋,田维毅,王文佳,王平,涂小华,何光志
(贵州中医药大学基础医学院,贵州贵阳 550025)
抗生素相关性腹泻(Antibiotic-Associated Diarrhea,AAD)是使用抗生素的过程中引起肠道内环境稳态被破坏,致病菌过度增殖而导致的腹泻,其发病率达到5%~39%,严重时可导致休克甚至死亡[1,2]。部分临床医生对AAD的治疗未重视药物对肠道微生态的影响,致使疾病迁延不愈,加重患者的生活负担[3,4]。
中医学注重辨证论治、整体合参的治疗理念,中医药对疾病发展的阶段性治疗有其内在独特优势。葛根芩连汤(Gegen Qinlian Decoction,GQD)出自东晋医圣张仲景所著的《伤寒杂病论》,其方含有葛根、黄芩、黄连、炙甘草四味药,具有清热止泻的主治功效,主治因表证误用下法,致表邪内陷,利遂不止的病症。葛根、甘草等是国家认证的“药食同源”物种,具有止痛、抗炎、止泻、抗菌、降血糖、降血脂、抗病毒和调节胃肠功能的作用[5-8]。近年来大量研究证实GQD治疗AAD临床效果明显[9-13],但其作用机制仍尚不清楚。
中医药多靶点、多成分等特性与肠道微生态多样性具有相似之处[14]。肠道菌群决定着宿主的健康状况,其数量庞大、种类繁多,被称为机体内“第二器官”[15],具有消化吸收、免疫调节、能量代谢等作用。相关研究报道,肠道菌群与AAD的发生发展紧密相关[16]。随着16S rRNA测序技术的不断成熟,第二代基因测序已被广泛运用到各项科研中,为中医药现代化发展提供新的策略[17]。故本研究基于16S rRNA测序技术探究GQD对AAD的肠道菌群结构的影响,以期从肠道菌群角度阐释GQD对AAD的部分作用机制,为课题前期研究提供一定的实验基础。
1 材料与方法
1.1 实验动物
SPF级SD大鼠60只,雌雄各半,体重(200±20)g,周龄6~8周,购自重庆腾鑫华阜实验动物销售有限公司(许可证号:SCXK(京)2019-0008),实验动物的操作和喂养严格遵照中国实验动物伦理协会所规定的有关动物伦理福利条款进行。
1.2 主要药物与试剂
克林霉素磷酸酯,广州白云山天心制药股份有限公司(批号:210202);双歧杆菌活性菌,丽珠医药集团股份有限公司(批号 S10960040)。葛根(批号201201);黄芩(批号200701);黄连(批号200301);炙甘草(批号 201202),均购自同仁堂贵阳分店;水合氯醛,天津科密欧化学试剂有限公司(批号Q/12HB4218-2017);粪便基因组DNA提取试剂盒,上海索莱宝生物科技有限公司(批号021-54100800)。
1.3 主要仪器
紫外分光光度计,Eppendorf;TBS380荧光计,PROMEGA;琼脂糖电泳仪,北京六仪;2100生物分析仪,Agilent;PCR扩增仪,ABI;MiSeq Sequencing Platform测序平台,Illumina。
1.4 葛根芩连汤制备
中药饮片按照药物比例8:3:2:3,其中葛根24 g,黄芩9 g,炙甘草6 g,黄连9 g,本方参照《实用方剂学》[18]。将所有中药饮片加9倍量纯水浸泡30 min,大火煮沸后调至小火煎煮2 h,用四层纱布过滤药液后,再次将中药中加入9倍纯水煎煮方法同上,最后将两次滤液浓缩至生药质量浓度1 g/mL,将所得中药汤剂冷却后保存在4 ℃冰箱备用,煎煮方法参照文献[19,20]。
1.5 模型制备及分组给药
1.5.1 模型制备
抗生素相关性腹泻大鼠模型的制备参照文献[21]。将60只SD大鼠按性别分笼适应性喂养1周后,随机分成空白组(C)10只、造模组(M)50只,各组大鼠均雌雄各半。造模组SD大鼠每日按剂量进行克林霉素250 mg/kg灌胃进行造模,空白组给予等量生理盐水灌胃,两组均1次/d,连续7 d。观察大鼠饮食、精神等一般情况,将粪便形态分为褐色成形粪便(0分)、淡黄色或淡褐色不成形样便(2分)、稀水样便(4分)进行粪便评分,粪便评分参照文献[22],根据大鼠一般情况及粪便状态判断建模是否成功。
1.5.2 分组及给药
造模成功后,于第8天早晨9:00将造模组大鼠随机分为5组:丽珠肠乐组(P)、模型组(M)、葛根芩连汤高、中、低剂量组(GQD-H、GQD-M、GQD-L),10只/组(雌雄各5只)。随后空白组及模型组灌胃等体积生理盐水,GQD-H、GQD-M、GQD-L组、丽珠肠乐组分别给予对应药物,根据魏教授主编的《药理实验方法学》[23],大鼠给药剂量为60 kg成年人的6.3倍换算,灌胃体积1 mL/100 g。
1.6 结肠HE染色
应用m=4%的多聚甲醛溶液浸泡SD大鼠部分结肠组织数天后取出,进行石蜡切片、脱蜡至水,依次将切片放入二甲苯2次,每次20 min;无水乙醇2次,每次5 min;φ=75%酒精中浸泡5 min,自来水冲洗切片,直至其干净透明;切片放入苏木素染色3~5 min,自来水洗,经分化液分化,返蓝液返蓝,流水冲洗;入伊红染色,切片依次入φ=85%、φ=95%的梯度酒精脱水各5 min,入伊红染液中染色5 min;无水乙醇I、II、Ⅲ中各脱水5 min,二甲苯Ⅰ、Ⅱ中各透明5 min;中性树胶封片,采用光学显微镜观察其病理改变。
1.7 16S rRNA扩增及测序
从每组中随机取6个SD大鼠结肠内粪便采用Mag-Bind Soil DNA Kit试剂盒进行总DNA提取作为模板;采用Q5® High-Fidelity DNA Polymerase对16S rRNA的 V3-V4区引物进行 PCR扩增,338 F(5'-ACTCCTACGGGAGCAGCA-3')和 806 R(5'-GGACTACHVGGGTWTCTAAT-3')。对扩增产物运用文库2100检测质控,运用TruSeq Nano DNA LT Library Prep Kit试剂盒建库,通过Illumina MiSeq平台上利用双末端测序(PairedEnd)方法进行高通量测序。
1.8 生物信息学分析
应用QIIME2软件里DADA2(版本1.12)在质控、去噪、连接、嵌合体去除序列后,以完全一样聚类产生的序列命名为ASVs(Amplicon Sequence Variants)。采用标准的序列号与最少序列相对应,将得到去singleton后的ASV序列量[24-26]。然后利用稀疏曲线图分析、距离矩阵与PcoA分析、物种组成分析、LEfSe(LDA Effect Size)分析寻找有差异的生物标志物[27,28]。
1.9 统计学方法
SPSS 26.00软件对实验数据进行处理分析,多组间比较采用单因素方差分析(Analysis of Variance,ANOVA)、非参数秩和检验采用 Kruskal-Wallis(H)检验、Wilcoxon检验;以p<0.05有统计学意义,p<0.01有显著统计学意义。
2 结果与讨论
2.1 一般情况及粪便状态
空白组粪便呈褐色成形硬便、被毛整齐光泽、精神及饮食正常;造模组在3 d后上出现淡黄色不成形软便、被毛粗乱欠光泽、畏寒蜷缩、饮食稍差;7 d后粪便呈淡黄色稀水样便、被毛暗淡无光泽、精神萎靡不振、饮食下降明显(见图1)。通过粪便评分发现,与空白组相比,造模组 SD大鼠粪便出现明显稀便(p<0.01),提示造模成功(见表1)。

图1 临床症状及粪便状态Fig.1 Clinical symptoms and fecal status

表1 大鼠粪便状态评分Table 1 Rat fecal status score (x¯±s)
空白组造模组3 d造模组7 d。
2.2 结肠组织病理变化
空白组结肠结构清晰,黏膜层上皮完整,细胞形态正常,肠腺数量丰富、形态正常、排列紧密,未见明显病理损伤。模型组肠管各层结构欠清晰,黏膜层可见上皮细胞脱落,肠腺之间固有层水肿变宽,并伴有大量炎症细胞浸润,黏膜下层组织排列疏松,隐窝基底部间距增宽,存在少许炎症细胞浸润。与模型组比,丽珠肠乐组及GQD组结构清晰,单层柱状上皮完好,组织结构排列整齐,均未见炎症细胞浸润(见图2)。提示经过GQD治疗后,大鼠结肠病理变化明显好转。

图2 结肠HE染色Fig.2 Colonic HE staining
2.3 测序结果
本次试验共使用36个粪便样本进行测序,序列经过双端拼接去冗余后共获得3 275 140对序列,经DADA2去噪后各样本平均含有有效序列64 316条。使用gg_13数据库对序列进行注释,其序列范围为50~434 bp,序列平均含有423 bp符合16S rDNA V3~V4区。
2.4 稀疏曲线分析
ASV表的抽平深度反映Alpha多样性指数的大小,通过绘制稀疏曲线,比较各组样本在相同的测序深度下中 ASV数量多少,从而展示各组的多样性高低。当曲线随着横坐标测序列数目的增加趋于平坦时,纵坐标的 ASV数目不会随着测序深度的增加而升高。提示目前测序深度已经足以反映出样本生境内的物种数量(见图3)。

图3 稀疏曲线图Fig.3 Sparse graph
2.5 肠道菌群多样性分析
韦恩图(Venn)被用于计算各组样品中所共有和独有的ASV数目,可以量化表现各组样品中ASV数目组成相似及不同的情况。本试验以在样品中 100%出现的ASV为过滤值绘制花瓣图。各组共含有ASV数目分别为C组125个,M组16个,P组6个,GQD-H组22个、GQD-M组25个、GQD-L组50个。六个组中始终存在10个ASV作为核心物种,独有ASV数目分别为C组115个,M组6个,P组26个,GQD-H组12个,GQD-M组15个,GQD-L组40个。(见图4)。提示各组间 ASV物种差异巨大,GQD-H组与GQD-M组对肠道菌种影响相似,GQD-L组对菌种的影响优于丽珠肠乐。
Alpha多样性常用Chao1指数是生境内的观察指标,其指数越高代表菌群数量越丰富。与C组比,M组物种数量具有显著性差异(p<0.05);结合花瓣图发现,经GQD治疗后菌群结构存在明显差异,在物种数量方面,与C组比较,M组相对减少ASV数目;与M组相比,各治疗组独有物种均相对较多(见图4、5)。提示GQD改善肠道菌群多样性。

图4 肠道微生物维恩图Fig.4 Venn of intestinal microflora

图5 Alpha多样性分析Fig.5 Alpha diversity analysis
Beta多样性指数聚焦于不同生境间多样性的比较。应用距离矩阵与 PcoA(Principal Coordinate Analysis)分析,Jaccard距离算法降维,绘制95%的置信椭圆。每个彩色的点代表一个样本,当样本距离越近证明其菌群结构相似度越高。当样本投射到纵坐标PCo2对其组间菌群解释度是6.4%,当样本投射到横坐标PCo1对其距离解释度为8.8%。与C组比,M组与其距离较远,提示M组与C组间肠道菌群存在明显差异。与M组比,GQD-M组、GQD-L组与其距离较远,以纵轴为参照且有向C组靠近的趋势,说明经GQD治疗AAD后肠道菌群结构改善。组间差异分析通过R语言调用Adonis分析得出,组间相关差异R2=0.436,p=0.001说明该方案分组成立,组间差异优于组内差异。结果提示,GQD改善AAD大鼠肠道中菌群结构(见图6)。因此,可以假设GQD通过对肠道菌群结构的影响来维持AAD大鼠肠道菌群的平衡。

图6 Beta多样性Fig.6 Beta diversity analysis
2.6 物种组成分析
在门水平,各组大鼠肠道粪便主要含有厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes),变形菌门(Proteobacteria)、放线菌门(Actinobacteria)且占总菌群的95%。各组中厚壁菌门相对丰度从高到低依次为 P(96.73%)、GQD-H(93.57%)、GQD-L(89.02%),M(83.46%)、GQD-M(80.69%)、C(61.36%)。拟杆菌门相对丰度从高到低依次为C(16.53%)、GQD-M(13.62%)、M(8.01%)、GQD-L(7.87%)、GQD-H(4.72%)、P(2.10%)。放线菌门相对丰度从高到低依次为C(14.72%)、M(1.75%)、GQD-H(0.52%)、GQD-M(0.47%)、GQD-L(0.47%)、P(0.36%)。变形菌门相对丰度从高到低依次为M(6.36%)、GQD-M(4.77%)、C(2.60%)、GQD-L(2.06%)、GQD-H(0.80%)、P(0.32%)。拟杆菌门与厚壁菌门相对丰度比值(B/F)从高到低依次排序:C(26.94%)、GQD-M(16.87%)、M(9.59%)、GQD-L(8.85%)、GQD-H(5.04%)、P(2.18%)。运用Kruskal-Wallis检验发现厚壁菌门、拟杆菌门、变形菌门、放线菌门、疣微菌门(Verrucomicrobia)、软壁菌门(Tenericutes)、蓝藻菌门(Cyanobacteria)、TM7均具有显著性差异(p<0.01),绿弯菌门(Chloroflexi)具有统计学意义(p<0.05),梭杆菌门(Fusobacteria)无统计学差异(p>0.05),见图7a。综上所述,GQD能够增加肠道内厚壁菌门、拟杆菌门相对丰度,同时改善拟杆菌门与厚壁菌门的比值(B/F),降低变形菌门、放线菌门相对丰度。
变形菌门以革兰氏阴性菌为主,该菌门下细菌形状多样,其中包含大量病原菌。多项研究发现,炎性肠病的肠道微生物多样性具有相似性,均伴有肠道菌群多样性降低,其内在原因与变形菌门的相对增加密切相关[29,30]。当肠道发生炎症时,使用抗生素治疗会引起肠道内菌群失调,导致肠上皮细胞氧化,促使变形菌门数量大量增多[31]。厚壁菌门与拟杆菌门作为肠道微生物中优势菌门,两者相对比例较为稳定,当它们比例失衡时可能会导致糖尿病、肥胖、胃肠道等疾病的发生[32]。近年来拟杆菌门与厚壁菌门的比值(B/F)常被作为肠道菌群平衡的基准[33],其比值(B/F)高低与肠道菌群多样性存在强相关性[34]。提示GQD可能通过改善厚壁菌门与拟杆菌门的比例,调节肠道微生态平衡。
在属水平,乳酸杆菌属(Lactobacillus)相对丰度含量从高到低依次为P(78.36%),GQD-H(63.73%),GQD-L(55.31%),GQD-M(50.30%),M(33.68%),C(25.21%)。异芽孢杆菌(Allobaculum)相对丰度含量从高到低依次为C(17.73%),M(6.98%),GQD-H(2.55%),GQD-M(1.24%),GQD-L(0.64%),P(0.55%)。布劳特氏菌(Blautia)相对丰度含量从高到低依次为 M(7.30%),GQD-H(5.79%),GQD-L(3.86%),GQD-M(2.40%),P1.21%),C0.05%)。拟杆菌属(Bacteroides)相对丰度含量从高到低依次为 GQD-M(7.91%),GQD-L(2.94%),GQD-H(2.85%),C(1.25%),P(0.61%),M(0.35%)。双歧杆菌属(Bifidobacterium)相对丰度含量从高到低依次为 C(13.44%),M(0.34%),P(0.06%),GQD-L(0.05%),GQD-M(0.03%),GQD-H(0.01%)。颤螺菌属(Oscillospira)相对丰度含量从高到低依次为GQD-L(2.20%),P(2.17%),C(1.87%),M(1.56%),GQD-H(1.38%),GQD-M(1.08%)。志贺氏杆菌(Shigella)相对丰度含量从高到低依次为 GQD-M(4.28%),M(1.77%),GQD-L(1.59%),C(1.40%),GQD-H(0.47%),P(0.23%)。瘤胃球菌(Ruminococcus)相对丰度含量从高到低依次为 M(4.28%),GQD-M(2.62%),GQD-H(1.17%),P(0.65%),GQD-L(0.56%),C(0.16%)。嗜冷杆菌属(Psychrobacter)相对丰度含量从高到低依次为M(4.19%),C(0.64%),GQD-H(0.24%),GQD-L(0.15%),GQD-M(0.04%),P(0.00%)。多尔氏菌属(Dorea)相对丰度含量从高到低依次为M(2.35%),GQD-M(1.68%),GQD-H(1.64%),P(0.92%),GQD-L(0.68%),C(0.09%)。运用Kruskal-Wallis检验发现乳酸杆菌属、异芽孢杆菌、布劳特氏菌、拟杆菌属、双歧杆菌属、嗜冷杆菌属、多尔氏菌属具有显著性差异(p<0.01),瘤胃球菌属具有统计学意义(p<0.05),颤螺菌属、志贺氏杆菌均(p>0.05)无显著性差异,见图7b。提示:GQD显著增加乳酸杆菌属和拟杆菌属相对丰度(p<0.01),减少异芽孢杆菌、双歧杆菌属、嗜冷杆菌属、布劳特氏菌属、多尔氏菌属相对丰度含(p<0.01)及瘤胃球菌属相对丰度(p<0.05),见图7b。

图7 葛根芩连汤在门属水平对AAD肠道菌群物种组成分析Fig.7 Analysis of species composition of AAD intestinal flora in GegenQinlian decoction at phylum and genus level
肠道菌群寄于宿主体内参与机体生理病理的整个过程。乳酸杆菌及拟杆菌是肠道常见益生菌,具有保护肠道黏膜、防治腹泻、调节肠道菌群等作用。据报道,GQD能促进肠道湿热综合征腹泻小鼠肠道中乳酸杆菌的增殖,而乳酸杆菌属形成生物膜抑制致病菌繁殖[35]。多尔氏菌通过发酵碳水化合物产生丁酸修复肠道黏膜,在炎性肠病患者肠道菌群中发现多尔氏菌显著降低[36]。瘤胃球菌和布劳氏菌作为AAD的潜在生物标志物已被报道[37]。故推测GQD通过增加肠道菌群中优势菌种的相对数量,减少致病菌的增殖而发挥对AAD治疗的作用。虽然能通过物种百分比堆积图发现有统计学差异的菌种,但是仍不能清楚各组间菌种标志物。
2.7 LEfSe分析
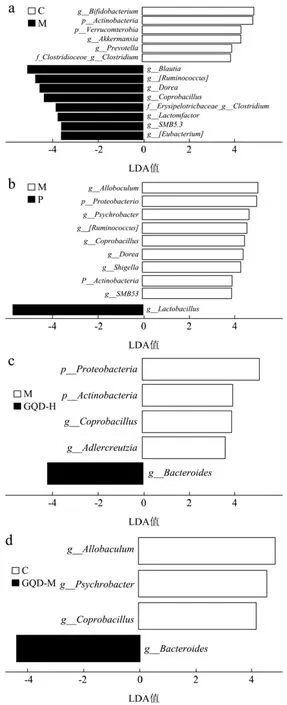
通过Lefse分析,设置LAD值>3,差异物种过滤阈值=0.001,运用Wilcoxon检验分析找到各组间有显著差异的生物标记物。
在门水平与C对比,M中变形菌门、疣微菌门丰度降低,见图8a;与M比,GQD-H和P中放线菌门、变形菌门丰度降低,见图8c;其余各组未见差异变化。放线菌门是细菌结构域中四大类群之一,在肠道菌群稳定中发挥重要作用[38]。但放线菌门中也含有大量腐生菌,多导致肺结核、脓肿及麻风病等[39]。变形菌门除了与炎性肠病有关,据报道还参与慢性胃炎、十二指肠炎和胃癌的发生与发展[40]。提示GQD能降低肠道中致病菌丰度。

图8 LEfSe分析葛根芩连汤对AAD肠道菌群的影响Fig.8 LEfSe analysis of the effect of GegenQinlian decoction on intestinal flora of AAD
在属水平与C对比,M中共有12个菌种发生改变,丰度升高的是布劳特氏菌属(Blautia)、瘤胃球菌属(Ruminococcus)、多尔氏菌属(Dorea)、SMB53、粪芽孢菌属(Coprobacillus)、Lactonifactor、真杆菌属(Eubacterium)、丹毒菌科梭菌属(Erysipelotrichaceae Clostridium)。丰度降低的为双歧杆菌属(Bifidobacterium)、阿克曼菌属(Akkermansia)、普雷沃氏菌属(Prevotella)、梭菌科梭菌属(Clostridiaceae Clostridium),见图8a。与M相比,P中菌种丰度增多的为乳酸菌属(Lactobacillus),减少的菌种为异芽孢杆菌属(Allobaculum)、多尔氏菌属(Dorea)、嗜冷杆菌属(Psychrobacter)、瘤胃球菌属(Ruminococcus)、志贺氏菌属(Shigella),见图8b;GQD-H中拟杆菌属(Bacteroides)丰度上调,嗜冷杆菌属(Psychrobacter)丰度下调,见图8c;GQD-M中菌种丰度增多的是拟杆菌属(Bacteroides),丰度减少的菌种是异芽孢杆菌属(Allobaculum)、嗜冷杆菌属(Psychrobacter),见图8d;GQD-L中乳酸杆菌属(Lactobacillus)、拟杆菌属(Bacteroides)丰度上调,芽孢杆菌属(Allobaculum)、瘤胃球菌属(Ruminococcus)、多尔氏菌属(Dorea)丰度下调,见图8e。提示在属水平GQD能增加肠道中乳酸杆菌、拟杆菌丰度,减少瘤胃球菌、多尔氏菌等丰度。
实验发现,经GQD干预后乳酸杆菌属与拟杆菌属相对丰度增多,然而经丽珠肠乐治疗后仅有乳酸杆菌属增加。研究报道,乳酸杆菌形成的生物膜具有抵抗温度、胃酸及胆汁等因素的作用,但双歧杆菌对酸碱环境、温度等因素的抵抗力差[41]。不同菌株在肠道中定植结果表现出不同,大部分益生菌在成人体内的定植是短期的,只有少数菌种例外[42]。其次,菌株是自身携带还是外来摄入,是决定其定植的关键因素,菌株可以通过代谢产物加速肠道对竞争对手的定植抵抗[43]。肠道菌群之间为了适应肠道微环境进行交叉喂养相互依赖,双歧杆菌通过发酵食物产生乳酸,为乳酸杆菌的定植提供生存环境[44]。这些都可能是丽珠肠乐组中乳酸杆菌丰度增多的原因,但仍有待进一步验证。Lv等[45]发现GQD与细胞死亡蛋白PD-1进行联合治疗,可作为治疗结直肠癌的一种新策略。Shao等[46]报道肠道中脆弱拟杆菌可改善炎症引起的肠上皮损伤,预防结直肠癌的发展。综其所述表明GQD可能具有抗结直肠癌的作用,且GQD对肠道优势菌种的恢复能力明显好于丽珠肠乐。该结果为本试验进一步个性化研究标记菌种指明了方向,以及为微生物制剂研发提供新思路。
3 结论
本试验通过病理学及16S rRNA测序探讨GQD治疗 AAD的作用机制,通过肠道组织病理观察发现GQD干预后结肠黏膜损伤好转,表明GQD对AAD有明显的疗效。结合肠道菌群多样性分析发现 GQD能影响肠道菌群结构,在门水平,GQD可以改善厚壁菌门与拟杆菌门比例,显著降低AAD大鼠肠道变形菌门相对丰度p<0.01),在属水平显著增加肠道中乳酸杆菌、拟杆菌相对丰度(p<0.01),提示GQD可能通过促进肠道中优势菌种定植而抑制致病菌的繁殖,而该微生物区系结构的变化可能是GQD治疗AAD的部分机制,其结果为该复方在临床的合理应用提供了科学依据,也为进一步探索基于“中医药-肠道菌群”途径治疗疾病积累研究基础。
