辣椒素缓解低温低湿条件下小鼠胃肠道炎症
2023-02-13罗鑫牛素敏董轶群谢定源
罗鑫,牛素敏,董轶群,谢定源
(华中农业大学食品科技学院,环境食品学教育部重点实验室,湖北武汉 430070)
辣椒(Chili peppers)作为一种茄科辣椒属植物,在全世界范围内被广泛消费,在食用辣椒过程中产生辛辣刺激的便是辣椒果实中的辣椒素(Capsaicin,CAP)。人们普遍认为食用辣椒后会“上火”,在现代医学认为“上火”是一种炎症反应过程。从“上火”到形成疾病是一种包括中枢、内分泌及免疫系统的应激负荷反应过程[1]。炎症发生时,致炎因子对自身组织攻击导致体内免疫系统紊乱,因生理功能失调而使机体产生病理变化[2]。通过研究,辣椒素能增高呼吸道和血管渗透性进而诱发神经源性炎症[3]。参考Tang等[4]构建的辣椒素(20 mg/kg)消化道损伤模型,探究在低温低湿条件下不同剂量的辣椒素与小鼠消化道炎症的相关性。有学者[5]发现猪在30 ℃高温环境下正常饮食21 d后,肠道会出现绒毛断裂、肿胀的现象,相对适温组绒毛高度显著降低。不适宜的温度和湿度会造成昆明小鼠肝功能损害,在高温30 ℃、低温10 ℃、高湿80%、低湿30%条件下,昆明小鼠会出现烦躁或兴奋过度,最终出现消化不良、血糖水平降低等症状[6]。
环境的温湿度对人体或者动物的饮食健康都有着不同程度的影响,如西方化饮食模式摄入较多的高精致糖以及较少摄入蔬菜和水果,患炎症性肠病(Inflammatory Bowel Disease,IBD)风险大大增加[7],而地中海饮食却能够降低肠道炎症,减少克罗恩病(Crohn's Disease,CD)的发病风险[8]。环境不论是对人类还是动物的健康都有着影响,目前探究环境中的温湿度与人体疾病相关的研究及其缺乏,国内外对炎症的研究更侧重炎症性肠病(IBD)、口腔粘膜疾病等,缺乏探究多种炎症的致病因及其作用机理,而对辣椒素研究重点在于小剂量辣椒素的有利作用,忽视了过量食用辣椒会对人体造成的损害,并且也未考虑环境对辣椒诱发疾病的影响。在饮食多元化的大环境下,基于团队对中国地区食用辣椒绘制的辣味地图[9],进一步探究食辣地域性差异与地理气候的相关性,为在低温低湿环境下健康食用辣椒提供理论支撑。
1 材料与方法
1.1 材料
1.1.1 动物
SPF级C57BL/6雄性小鼠,重量为19~21 g,60只,购于华中农业大学实验动物中心,合格证号SCXK(鄂)2020-0019,饲养于华中农业大学动物实验中心(许可证号 SYXK(鄂)2020-0084),动物伦理编号HZAUMO-2022-0042。
1.1.2 材料与试剂
天然食品级辣椒碱(纯度 99%),购于宁波延宇生物科技有限公司;吐温80(食品添加剂级)购于广东润华化工有限公司;BCA蛋白测定试剂盒、RIPA裂解液、磷酸化蛋白酶抑制剂、SDS-PAGE凝胶制备试剂盒、HRP-labeled goat anti-rabbit IgG、Servicebio®RT First Strand cDNA Synthesis Kit、RNA提取液、反转录试剂盒、荧光定量PCR试剂盒、脱脂奶粉、蛋白免疫抗体(β-action、NF-κBp65、IκB-α、IL-1β、TNF-α)、ECL化学发光液,均购自武汉赛维尔生物科技有限公司;TNF-α、IL-6、IL-1β、IIFN-γ试剂盒,均购自武汉贝茵莱生物科技有限公司;4%多聚甲醛通用型组织固定液,购自赛国生物科技有限责任公司;PBS缓冲液,购自美国丹纳赫集团思拓凡;qPCR引物,由武汉赛维尔生物科技有限公司合成;所有有机溶剂均为国产分析纯。
1.1.3 主要仪器设备
CFX荧光定量 PCR仪,美国 Bio-Rad公司;PRX-350A智能人工气候箱,江苏天翎仪器有限公司;ME104电子天平,美国梅特勒-托利多仪器有限公司;超净工作台,上海博讯医疗生物仪器股份有限公司;KZ-II高速组织研磨仪,武汉赛维尔生物科技有限公司。
1.2 方法
1.2.1 辣椒素溶液的配制
参考 GB/T 21265-2007辣椒辣度的感官评价方法[10]中配制标准辣度稀释液。
a.称取0.6 g(精确到0.01 g)食品级天然辣椒碱和20 g食品级吐温-80于50 mL的小烧杯中,50 ℃水浴加热10 min左右使辣椒碱溶解,用70 ℃蒸馏水定量转移到1 000 mL容量瓶中,冷却至室温,用室温(20 ℃)蒸馏水定容至刻度。此为600 mg/L的母液。
b.量取母液414.079 g(精确到0.001 g)用蒸馏水稀释定容至另一个1 000 mL容量瓶中,盖上塞子冷藏,此为 248.447 mg/L的辣度稀释液,即斯科维尔指数SHU(Scoville Heat Units)值为4 000。
c.依照表1中取量,依次量取b中溶液(精确到0.001 g),用蒸馏水稀释定容至另一个50 mL容量瓶中,盖上塞子于-4 ℃冰箱保藏,配制成相应浓度的辣椒素溶液。

表1 辣椒素溶液配制Table 1 Capsaicin solution formulation
1.2.2 脂多糖溶液的配制
参考王小丽[11]的方法:分析天平称取7.5 mg(精确0.01 mg)脂多糖溶于5 mL PBS溶液中,配制浓度为1.5 mg/mL LPS溶液,并过滤灭菌,保存于-4 ℃冰箱备用。
1.2.3 低温低湿动物模型构建与分组
60只6周龄C57BL/6雄性小鼠,饲养于华中农业大学实验动物研究中心。适宜环境条件:温度为(24±2)℃,湿度为60%~70%,正常光照(12 h/12 h);低温低湿模型组:人工气候箱温度为 10 ℃,湿度为30%,人工光照(12 h/12 h)。将小鼠随机分成适宜温度空白组(NC)、低温低湿空白组(LC)、辣椒素处理组(CAP10、CAP15、CAP20)、阳性对照组(LPS)六组,每组10只。小鼠适应一周后开始实验。参照李德建等[12]测出的麻辣火锅底料中辣椒素的含量,以及Tang等[4]构建的辣椒素(20 mg/kg)消化道损伤模型,确定小鼠辣椒素灌胃最高剂量为20 mg/kg,其余两组依次递减,灌胃试验期为7 d,阳性对照组(LPS)采用腹腔注射[11],试验期为10 h。各组动物均自由饮水。具体操作方法如表2。

表2 低温低湿模型动物分组Table 2 Grouping of animals for low temperature and humidity models
实验期间每天灌胃前称一次体重,根据体重调整灌胃量。一周末,所有小鼠禁食不禁水18 h,小鼠麻醉后摘眼球取全血,静置 30 min后,于 4 ℃、4 000 r/min离心10 min收集血清,-20 ℃保存备用;取血后脱颈处死,解剖取出胃组织及十二指肠组织;将胃组织沿胃大弯剪开铺平,迅速拍照;剪取适量大小胃组织、十二指肠组织,立即放入 4%多聚甲醛固定液中固定;最后将所有组织置于液氮中冷冻,最终放入-80 ℃保存。
1.2.4 苏木素-伊红(H&E)染色切片
将新鲜的胃切开,然后用相机拍摄胃的形态之后,将新鲜的胃和十二指肠组织固定在10%的福尔马林溶液中,通过苏木精和伊红(Hematoxylin and Eosin,HE)染色评估胃和十二指肠病理组织学损伤。
1.2.5 血清炎症因子的测定
参考梅泽文[13]的操作方法。采用酶联免疫吸附法(Enzyme Linked Immunosorbent Assay,ELISA)测定小鼠血清中炎症因子TNF-α、IL-1β、IL-6、IFN-γ的含量。
1.2.6 实时荧光定量(qRT-PCR)法检测组织中炎症基因的表达
取小鼠胃和十二指肠组织样本用于抽取总RNA,参照之前的报道[14],使用三唑醇(Servicebio,中国武汉)来提取胃和十二指肠组织的总 RNA。使用Servicebio®RT First Strand cDNA Synthesis Kit(Servicebio,武汉,中国)进行cDNA合成,然后将cDNA的浓度调整为1 μg/μL。使用CFX96实时系统(Bio-Rad,USA)对cDNA样本进行实时定量PCR。用 2-ΔΔCT法分析目的基因的相对表达(GAPDH 为内参)。用于qRT-PCR分析的引物序列见表3。

表3 引物序列Table 3 Primer sequences
1.2.7 蛋白免疫印迹法(Western Blot)法测定组织中蛋白的表达
总蛋白通过 10% SDS-30%丙烯酰胺凝胶电泳分离,然后转移到甲醇活化的PVDF膜上。随后将转印完的PVDF膜与脱脂牛奶封闭30 min,然后和配置好的一抗在4 ℃孵育摇床过夜。洗涤后,将膜与稀释后的二抗在室温下孵育30 min。最后该印迹使用增强型化学发光,并使用Alpha Innotech进行定量。
1.2.8 数据处理
使用SPSS软件中的one-way ANOVA方法评估数据间是否具有显著性差异(p<0.05),作图软件为Origin 2019b,数据均以平均值±标准差(±s)表示。
2 结果与讨论
2.1 辣椒素对低温低湿条件下小鼠体重的影响
参考一般炎症的发病伴随局部的大量炎症浸润从而造成胃组织的水肿、出血等现象[15],在不适宜的环境中,对小鼠的食欲、排便等都会造成影响,因此可以通过体重来直观反映小鼠的健康状况。如图1所示,在低温低湿条件下,在7 d的试验周期内,小鼠的体重先短暂上升后立马下降,整体呈现体重下降的趋势,CAP15组与NC组体重变化曲线趋于一致,体重下降后几天出现体重上升的趋势;在第7天末,与NC组相比,LC组、CAP10组及CAP20组体重显著下降(p<0.05),与LC组相比CAP15组体重极显著上升(p<0.05)。上述结果表明,在低温低湿条件下饮食会导致小鼠体重显著下降,但是食用15 mg/kg的辣椒素会极显著恢复小鼠体重,改善低温低湿环境对体重所带来的影响。

图1 辣椒素对低温低湿条件下小鼠体重的影响Fig.1 Effect of capsaicin on body weight of mice under low temperature and humidity
2.2 辣椒素对低温低湿条件下小鼠胃组织形态的影响
通过胃组织照片可以直观的观察到胃部炎症的程度。如图2所示,NC组小鼠胃部颜色红润且具有光泽,胃黏膜表观良好,无黏膜糜烂、出血、水肿等现象,LC组小鼠胃部无血色,体积变大呈现水肿状态;CAP10组胃部颜色加深,但体积缩小恢复正常大小,而CAP15组颜色红润,体积正常,胃黏膜表观良好,但CAP20组胃粘膜表面呈现出血状态,体积变大,胃部颜色暗沉,LPS组则胃黏膜表面出现炎症浸润。以上表明,在低温低湿条件下小鼠的胃组织会出现炎症,可能影响小鼠的进食及消化,进而导致小鼠体重下降,在辣椒素剂量10 mg/kg及20 mg/kg的干预下,胃组织水肿减轻,胃部恢复血色,但小鼠体重并无明显改善,而辣椒素剂量15 mg/kg在保护胃组织的基础上,还能恢复小鼠体重并有所增加,脂多糖在此条件下并未对胃组织造成严重的损伤。
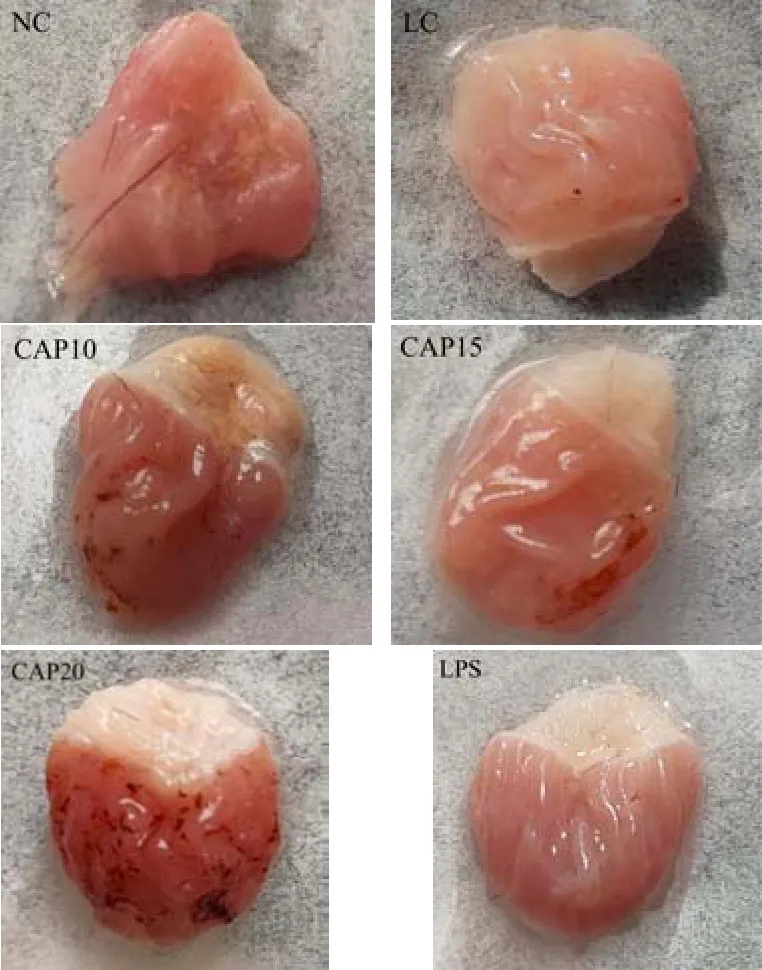
图2 低温低湿条件下胃组织形态观察Fig.2 Observation of stomach tissue morphology under low tempreture and humidty conditions
2.3 辣椒素对低温低湿条件下小鼠胃组织和十二指肠组织病理学的影响
2.3.1 辣椒素对小鼠胃组织病理学的影响
正常的胃切片显示了明显的胃的分层结构(从内至外为黏膜层-黏膜下层-肌层-浆膜层)。如图3所示,NC组小鼠胃壁结构完整,腺体排列整齐有序,低温低湿条件下空白组LC组胃黏膜下层出现严重炎症浸润,导致腺体与肌层分离;在辣椒素处理后,CAP10组减轻炎症浸润的程度,而CAP20组炎症浸润未受到缓解并且腺体受到严重破坏,CAP15组的小鼠胃黏膜损伤得到极大的缓解,腺体排列规整;LPS组相对于高温高湿模型来说,炎症程度有所减轻,但是炎症作用点发生了改变,转变成胃黏膜层微血管轻微充血,腺体则影响不大。由此表明,在低温低湿环境下,小鼠胃黏膜下层会产生炎症,进而引起胃体积变大,呈现水肿的现象,辣椒素处理组CAP15可以明显改善小鼠胃组织炎性水肿的情况,脂多糖在此环境中致炎作用也会受到影响,炎症程度有所降低。
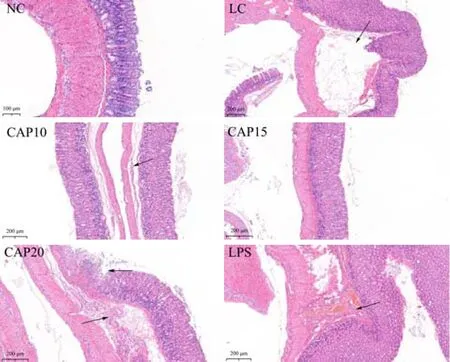
图3 低温低湿条件下胃组织H&E染色切片(20×)Fig.3 H&E stained sections of gastric tissue under low temperature and low humidity conditions (20×)
2.3.2 辣椒素对小鼠十二指肠组织病理学的影响
十二指肠位于胃和空肠之间,小肠吸收营养物质需先经过十二指肠,因此十二指肠在整个消化道具有特殊性。如图4所示,NC组的十二指肠绒毛连续且完整有序,无炎症浸润现象,中央乳糜管清晰可见;LC组绒毛数量减少,长度缩短,腺体暴露;辣椒素处理后,CAP10组绒毛长度增长,绒毛出现轻微水肿,上皮脱落,CAP15组肠绒毛增长结构完整,未出现炎性浸润问题,CAP20组的干预,使得肠绒毛结构完整,但是绒毛水肿明显,固有层结缔组织有炎性细胞浸润,对低温低湿引起的损伤作用缓解但是引起了新的损伤;LPS组则大量肠绒毛断裂在肠腔内部,腺体增多,肠壁变薄。以上结果表明,低温低湿条件会诱导小鼠的十二指肠组织产生轻微炎症反应,辣椒素处理CAP15组能在一定程度上缓解低温低湿所引起的十二指肠损伤,辣椒素CAP15组和CAP20组会促进十二指肠组织肠绒毛增长。

图4 低温低湿条件下十二指肠组织H&E染色切片(20×)Fig.4 H&E stained sections of duodenal tissue under low temperature and low humidity conditions (20×)
2.4 辣椒素对低温低湿条件下小鼠血清中促炎因子的影响
测定血清中炎症标志物以评价在低温低湿条件下,辣椒素处理后对小鼠体内炎症的干预效果,通过酶联免疫吸附法检测了血清中IL-1β、IL-6、TNF-α、IFN-γ的含量(图5)。由图5a可知,辣椒素处理存在显著的剂量效应,随着辣椒素剂量的增加,在低温低湿条件下IL-1β含量先增加后下降再增加,但是对血清中IL-1β的含量均无显著性差异(p>0.05)。由图5b可知,低温低湿条件会使血清中IL-6的含量极显著升高(p<0.01),在辣椒素CAP15组与LPS组的处理下,血清中IL-6的含量有极显著的降低(p<0.01),CAP20组与CAP10组的缓解作用不及 CAP15组。由图5c可知,低温低湿条件会显著增加血清中TNF-α的含量(p<0.05),CAP15组能显著降低中 TNF-α含量(p<0.05),由图5d可知,低温低湿条件会一定程度上降低小鼠血清中IFN-γ的含量,辣椒素处理组则均能缓解IFN-γ含量的减少。因此,辣椒素剂量15 mg/kg可以缓解低温低湿条件引起的全身性炎症,脂多糖在低温低湿条件下对小鼠的致炎作用不明显。

图5 低温低湿条件下小鼠血清中炎症因子的含量Fig.5 Serum levels of inflammatory factors in mice under specific temperature and humidity conditions
辣椒素通过激活辣椒素受体(Transient Recrptor Potential Vanilloid,TRPV)或者其他信号通路刺激多种肿瘤细胞产生抗肿瘤活性,例如肝癌[16]、胃癌[17]、前列腺癌[18]、结直肠癌[19]等,同时辣椒素也可以通过激活 T细胞介导的抗肿瘤免疫[20]。但是也有相关研究表明大剂量辣椒会使动物永久性痛觉丧失[21],食用不当辣椒还会造成胃中有灼烧感和消化不良,从而降低睡眠质量[22]。通过本实验发现辣椒素剂量在10~20 mg/kg范围时,越靠近15 mg/kg对小鼠全身性炎症的缓解作用越好。
2.5 辣椒素对低温低湿条件下小鼠胃组织和十二指肠组织炎症因子 mRNA和蛋白表达的影响
2.5.1 辣椒素对低温低湿条件下小鼠胃组织炎症因子mRNA和蛋白表达的影响
图6显示了在低温低湿条件下辣椒素干预对小鼠胃组织中炎症关键通路NF-κBp65、核因子κB抑制蛋白 IκB-α、炎症因子 IL-1β与 TNF-α的影响。与 NC组相比,LC组对四种蛋白的基因表达均有所上调,胃组织炎症反应明显。由图6a、6b可知,与LC组相比,辣椒素干预组和LPS组显著下调了NF-κBp65基因的表达(p<0.05),其中CAP10组上调了IκB-α基因表达,其余干预组包括LPS组则是下调,但都没有统计学差异(p>0.05)。表明辣椒素处理可以显著调节低温低湿条件下胃组织关键炎症通路蛋白NF-κBp65的基因表达。由图6c、6d可知,辣椒素和LPS干预后,胃组织中 IL-1β的表达显著下降(p<0.05),其中 CAP15组的效果不及其余干预组(p>0.05),所有干预组对TNF-α基因的表达量有所上调但均无明显差异(p>0.05)。以上结果说明,在低温低湿条件下,辣椒素可以通过下调NF-κBp65的基因表达来下调IL-1β的表达量,从而缓解胃组织炎症。
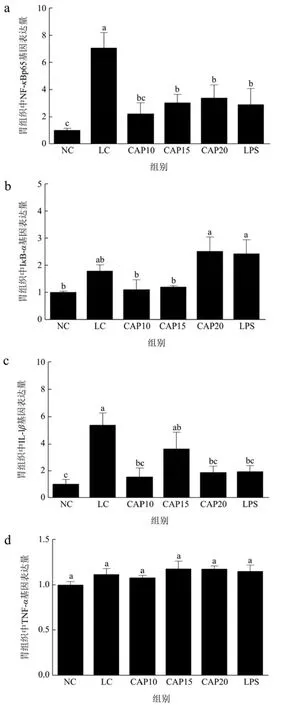
图6 低温低湿条件下小鼠胃组织炎症通路相关蛋白及炎症因子mRNA的表达量Fig.6 Expression of mRNA of inflammatory pathway-related proteins and inflammatory factors in mice gastric tissues under low temperature and low humidity conditions
图7显示了低温低湿条件下小鼠胃组织中关键炎症通路蛋白NF-κBp65和IκB-α的蛋白表达量。与NC组相比,LC组NF-κBp65和IκB-α的基因表达均有所上调,但都没有显著性差异(p>0.05),与 LC组相比,CAP15组显著上调了p65的基因表达(p<0.05),下调了 IκB-α基因的表达,其余干预组均上调了NF-κBp65和 IκB-α的基因表达,均无显著性差异(p>0.05)。以上结果出现CAP10组IκB-α基因表达下调蛋白表达却上升,可能CAP10组对IκB-α的基因以及蛋白表达不受温湿度的影响,并且在低温低湿条件下出现了辣椒素干预组下调p65的基因表达却上调了p65的蛋白表达,意味着辣椒素对炎症蛋白基因的影响比对蛋白的影响更大,就算辣椒素抑制了相关炎症蛋白的基因表达,但是其蛋白表达量还是在上升,解释了辣椒素可以缓解低温低湿所造成的胃组织炎症损伤,但是会出现新的胃组织损伤。
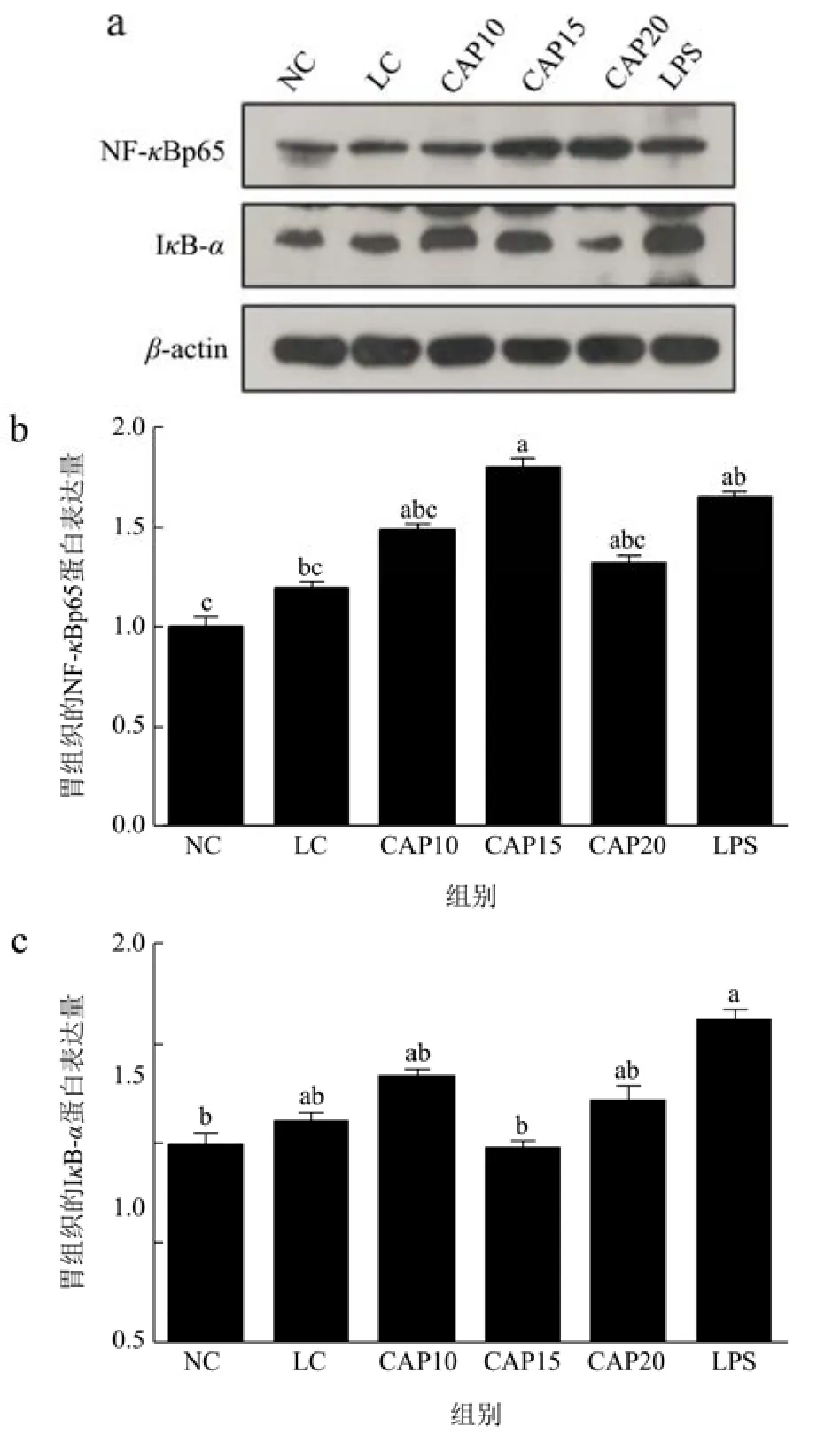
图7 低温低湿条件下小鼠胃组织炎症通路相关蛋白的表达量Fig.7 Expression of inflammatory pathway-related proteins in mice gastric tissues under low temperature and low humidity conditions
Johnson[23]的研究发现连续30 d灌胃80 mg/kg辣椒素会引起大鼠小肠以及大肠肿瘤。张琴[15]通过对内脏高敏大鼠连续2周灌胃20 mg/kg的辣椒素发现会造成胃黏膜充血,水肿等损伤。徐劲等[24]报道了辣椒素具有抑制大鼠胃排空的作用,且剂量越大抑制效果越好,但随着作用时间延长,辣椒素剂量越大抑制效果减弱越明显。Tang等[4]通过灌胃昆明小鼠20 mg/kg的辣椒素诱导28 d建立了辣椒素消化道损伤模型,此模型发现长时间灌胃辣椒素会激活胃组织p65通道,造成胃肠等脏器出现炎性水肿。本实验研究表明,在低温低湿的条件下,环境本身会引起小鼠胃黏膜损伤,辣椒素剂量15 mg/kg显著下调NF-κBp65蛋白的基因表达,从而降低炎症因子的基因表达,达到缓解胃组织炎症损伤的目的。
2.5.2 辣椒素对低温低湿条件下小鼠十二指肠组织炎症因子mRNA和蛋白表达的影响
图8显示了辣椒素对低温低湿条件下小鼠十二指肠关键通路NF-κBp65、核因子κB 抑制蛋白IκB-α、炎症因子IL-1β与TNF-α的影响。由图8a、8b可知,LC组上调了十二指肠组织中p65基因的表达量,下调了 IκB-α基因的表达量,但都没有显著性差异(p>0.05)。辣椒素处理组CAP10和CAP15显著上调了p65基因的表达(p<0.05),CAP20组的效果不及前两组,对IκB-a基因的影响趋势与p65类似,但都没有显著性差异(p>0.05)。由图8c、8d可知,LC组下调了炎症因子IL-1β与TNF-α基因表达,但没有显著性差异(p>0.05),与LC组相比,辣椒素处理组对IL-1β与TNF-α的基因表达呈现随剂量增加,两种因子的基因表达先下降后上升再下降的现象,CAP15组相对其余两组干预会上调IL-1β与TNF-α的基因表达,缩小与正常组基因表达量的差异(p>0.05),LPS组则是下调IL-1β的基因表达上调TNF-α的基因表达,但都没有统计学差异(p>0.05)。
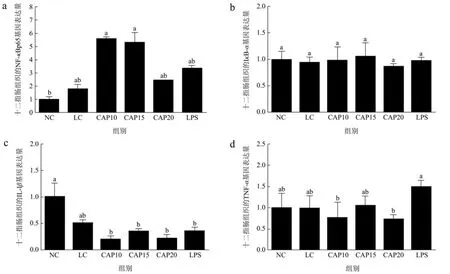
图8 低温低湿条件下小鼠十二指肠组织炎症通路相关蛋白及炎症因子mRNA表达量Fig.8 Expression of mRNA of inflammatory pathway-related proteins and inflammatory factors in mice duodenal tissues under low temperature and low humidity conditions
图9显示了辣椒素对低温低湿条件下小鼠十二指肠组织中炎症通路蛋白NF-κBp65和IκB-α的蛋白表达量。由图9b、9c可知,与NC组相比,LC组极显著下调了p65蛋白的表达量(p<0.05),一定程度上调了IκB-α的蛋白表达量但没有显著性差异(p>0.05)。与LC组相比,CAP15组显著上调了p65蛋白的蛋白表达(p<0.05),其余干预组包括LPS组也在一定程度上调了 p65蛋白的表达量但都没有达到正常组的p65蛋白表达水平,并且没有显著性差异(p>0.05),对于IκB-α的蛋白表达,辣椒素干预组呈现随剂量增加IκB-α蛋白表达量降低的现象,但都没有统计学差异(p>0.05),LPS组显著性降低了 IκB-α蛋白的表达量(p<0.05)。结合NF-κBp65、IκB-α还有炎症因子的基因表达整体看来,低温低湿条件不会引起小鼠十二指肠组织的炎症反应,在辣椒素处理后,炎症通路蛋白p65表达量增加,κB抑制蛋白IκB-α蛋白减少,炎症因子 TNF-α基因表达增加,但均没有显著差异,因此辣椒素也不会对小鼠十二指肠组织肠绒毛造成损伤。
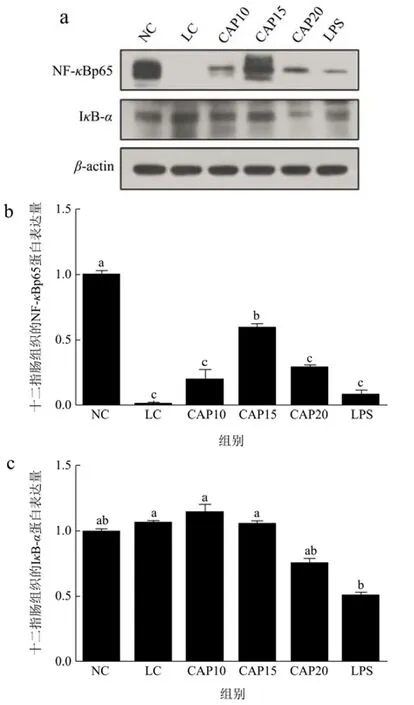
图9 低温低湿条件下小鼠十二指肠组织炎症通路相关蛋白的表达量Fig.9 Expression of inflammatory pathway-related proteins in mice duodenal tissues under low temperature and low humidity conditions
Prakash等[25]提出对大鼠喂养含 0.01%辣椒素的红辣椒8周可以使肠道微绒毛长度变长、周边增多。钟金凤等[26]研究报道在雏鸡饲料中添加 10 mg/kg辣椒素可以显著促进雏鸡空肠和回肠的绒毛生长,添加20 mg/kg或30 mg/kg辣椒素促进效果不及10 mg/kg。但是本实验发现在低温低湿环境下,10~20 mg/kg的辣椒素剂量会增加十二指肠组织中炎症关键通路NF-κBp65的蛋白表达,使其接近正常组 p65蛋白含量,从而恢复小鼠十二指肠肠绒毛的健康,并且这个剂量范围在人体感官评定范围属于一级微辣[27],在多数地区都是属于能接受的辣度。
3 结论
大量研究表明不同剂量辣椒素以及食用时间对胃黏膜、肠道的影响不同,并且存在一定的正相关。通过本实验表明在低温低湿(10 ℃,30%)条件下食用辣椒素剂量在 10~20 mg/kg之间(斯科维尔指数SHU161-SHU322)会对胃组织起到一定的保护作用,越接近15 mg/kg效果越好,并且能恢复十二指肠组织的肠绒毛长度及数量。因此,在低温环境下,可以选择食用辣椒来保护胃组织不受低温的环境影响而受到损伤,并且感官上也是微辣的水平,多数人都能接受。在此基础上,还可以探究在高温高湿、高温低湿、低温高湿等温湿度条件下食用不同剂量的辣椒素对小鼠消化道的影响,对在不同环境条件下食用辣椒提供科学指导意见。
