海洋菌株Mitsuaria sp.SH-50产嗜热性壳聚糖酶CsnSH50的酶学性质表征及其应用
2023-02-13卢波斯崔丹丹沈宏
卢波斯,崔丹丹,沈宏
(华南农业大学资源环境学院,广东广州 510642)
甲壳素是世界上第二大天然可再生资源,广泛存在于节肢类动物如贝壳、虾、蟹和昆虫壳、真菌及藻类细胞壁中[1]。壳聚糖是甲壳素脱去部分乙酰基后的产物,是由少量N-乙酰氨基葡萄糖和氨基葡萄糖之间通过β-1,4-糖苷键连接而成的大分子多糖[2]。壳聚糖因其具有抑菌、抗病毒、抗癌等良好的生物活性及其优良的生物相容性,已经被广泛应用在医药和食品等领域[3],壳聚糖同时也被认为是继软磷脂和螺旋藻之后的第三代保健品[4]。然而,壳聚糖因C2位连接有氨基基团导致其只能溶解于部分酸溶液中,如醋酸、盐酸、乳酸和柠檬酸等[5],且其分子量较大不易被生物所吸收,极大的限制了其应用范围[6]。
壳寡糖(Chitosan Oligosaccharide,COS)是壳聚糖的水解产物,一般聚合度为2~10[7],也是目前自然界中唯一带正电荷的低聚糖[8],与壳聚糖相比,壳寡糖具有更好的水溶性及生物活性。谷新晰等[9]发现在泡菜发酵时添加适宜浓度的壳寡糖有利于泡菜中总酸和氨基酸提高,同时,对泡菜中的菌群结构和多样性均具有显著改变。王晓杰等[10]发现壳寡糖-糖基化的玉米醇溶蛋白具有更好的抗氧化性能,还可以显著促进小鼠体内酒精代谢[11]。庄林等[12]发现添加壳寡糖的复合固体饮料能显著降低小鼠高尿酸血症。壳寡糖在动物饲料领域也具有应用价值,何孟莲等[13]发现在泌乳中期奶牛的饲料中添加200 mg/kg的壳寡糖可以显著降低奶牛血清中一氧化氮浓度。壳寡糖同样具有良好的抗氧化和抑菌活性,因其水溶液具有成膜性[14],将其喷洒在水果或者食品上形成透明的保鲜薄膜可以有效延长食品贮藏期,赵倩等[15]发现低浓度的壳寡糖与乳酸菌共发酵的产物表现出对大肠杆菌和沙门氏菌显著的抑制效果。因壳寡糖在食品领域的应用潜力巨大,美国食品药品监督局和我国已经相继批准壳寡糖安全无毒,可以作为食品添加剂使用。
壳聚糖酶(EC.3.2.1.132)可以专一高效的催化水解壳聚糖的β-1,4-糖苷键[16],其主要来源于真菌和部分细菌,在某些病毒及植物中也能检测到壳聚糖酶活性[17]。化学法、物理法、生物酶解法均能制备壳寡糖,但酶法制备壳寡糖具有反应效率高、条件可控、无环境污染等优势[18]。此外,壳聚糖酶还可以直接应用于病原真菌的生物防治[19-21],是一种多功能酶制剂,但目前市面上的壳聚糖酶存在价格昂贵、酶活性不稳定、酸性条件下半衰期短[22]等问题。本实验室从海洋高盐极端环境中筛选到一株高产壳聚糖酶菌株Mitsuariasp.SH-50,该菌株产酶速度远高于其他壳聚糖酶产生菌,且酶活性相对较高,因此本文对其壳聚糖酶进行分离纯化和酶学性质表征,旨在为壳聚糖酶的相关研究提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
Mitsuariasp.SH-50菌株,本实验室前期分离得到,保存于华南农业大学根层调控实验室-80 ℃冰箱;胶体壳聚糖(脱乙酰度≥85%),青岛博智汇力生物科技有限公司;酵母提取物,赛默飞世尔科技公司;氨基葡萄糖盐酸盐(分析纯),上海阿拉丁生化科技股份公司;蛋白 Marker,生工生物工程股份有限公司;DEAE-Sepharose Fast Flow、Sephadex G-75,REBIO有限公司;透析袋70 mm(MD77)[Mw:14 000],广州市丛源仪器有限公司。其余试剂均为国产分析纯。
活化培养基(g/L):胶体壳聚糖5.0,硫酸镁1.0,磷酸二氢钾0.5,磷酸氢二钾0.5,酵母提取物0.5,氯化钠5.0,pH值6.5。
发酵培养基(g/L):胶体壳聚糖10.0,硫酸镁1.0,磷酸二氢钾1.0,磷酸氢二钾1.0,酵母提取物0.5,氯化钠5.0,pH值6.5。
1.2 仪器与设备
UV-2450紫外分光光度计,日本Shimadzu有限公司;Basic 200凝胶电泳仪,广州四亿科学仪器有限公司;BJ-1CD超净工作台,上海博迅实业公司;AKTA FPLC,美国GE Healthcare Life Science公司;NDJ-1型粘度计,上海精米科学仪器有限公司;HC-3618R高速离心机,中科中佳科学仪器有限公司;TH-300梯度混合仪,上海青浦沪西有限公司;HWS-5A恒温水浴锅,上海百典仪器设备有限公司;Biotech-5JGH发酵罐,上海保兴生物设备工程有限公司。
1.3 粗酶液的制备
取-80 ℃保藏的SH-50菌液1 mL接种于含活化培养基50/150 mL的三角瓶中,30 ℃,200 r/min条件下培养24 h。向发酵培养基中添加0.5 mL的上述活化菌液,100/250 mL 三角瓶发酵12 h,在10 000 r/min、4 ℃条件下离心10 min。上清液即为粗酶液。
1.4 壳聚糖酶活力的测定
采用 3,5-二硝基水杨酸(DNS)法测定粗酶液的酶活[23]。取900 μL 1%(m/m)胶体壳聚糖溶液和1 mL乙酸-乙酸钠缓冲液(0.2 mol/L,pH值5.0)于25 mL比色管中,混匀后加入100 μL酶液,在75 ℃下恒温反应10 min后迅速加入1.5 mL DNS溶液,冷却至室温后沸水浴5 min,加蒸馏水定容至25 mL;8 000 r/min,4 ℃离心10 min,取上清液在540 nm处比色测定酶活。
壳聚糖酶活定义[24]:最适条件下,1 mL酶液在1 min内反应产生1 μmol还原糖所需的酶量为1个酶活单位(U/mL)。
1.5 CsnSH50的分离纯化
1.5.1 硫酸铵分级沉淀
在磁力搅拌条件下,向粗酶液中缓慢添加硫酸铵晶体,待其完全溶解,使硫酸铵饱和浓度分别在0~30%、30%~50%、50%~70%、70%~90%时,8 000 r/min,4 ℃条件下离心10 min,收集沉淀。将收集到的沉淀置于pH值7.0、20 mmol/L的磷酸缓冲溶液中完全溶解,使用透析袋在4 ℃透析36 h,并测定酶活。
1.5.2 DEAE-Sepharose Fast Flow离子交换柱层析
将硫酸铵沉淀分离出来的壳聚糖酶通过阴离子交换柱层析进一步纯化,选用DEAE-Sepharose Fast Flow离子交换层析柱(2.6 cm×20 cm),用20 mmol/L的pH值7.5 Tris-HCl缓冲液充分平衡,过夜,取8 mL经硫酸铵纯化后的CsnSH50酶液入柱,使用同样的pH值7.5 Tris-HCl缓冲液洗脱至曲线平缓,再用0~1.0 mol/L氯化钠的缓冲溶液进行洗脱,流速为1 mL/min,每管收集5 mL,收集每个洗脱峰,在280 nm处用紫外分光光度计检测波长并测定酶活,绘制洗脱曲线。
1.5.3 Sephadex G-75凝胶过滤层析
准确称取20 g Sephadex G-75,加400 mL双蒸水100 ℃煮沸3 h,冷却至室温后抽真空20 min排除气泡,沉降后以倾斜法除去上层颗粒,装柱(1.6 cm×60 cm)后用20 mmol/L的磷酸缓冲液(pH值7.5)平衡过夜。上样1.0~1.5 mL,流速0.8 mL/min,每管收集2 mL。根据每管的壳聚糖酶活力和蛋白质曲线,选择纯度高的收集液于-20 ℃储存。
1.5.4 聚丙烯酰胺凝胶电泳(SDS-PAGE)
通过SDS-PAGE对收集的酶液纯度进行分析,采用m=4%的浓缩胶和m=12%的分离胶测定其分子量[25]。
1.6 壳聚糖酶学性质研究
1.6.1 壳聚糖酶的最适反应温度
取纯化后的壳聚糖酶液用20 mmol/L,用pH值7.0的磷酸缓冲溶液稀释一定倍数后,在(20、25、30、35、40、45、50、55、60、65、70、75、80、85、90 ℃)条件下测定壳聚糖酶活性,以最高活力为 100%计算相对酶活性,确定壳聚糖酶的最适反应温度。
1.6.2 壳聚糖酶的最适反应pH
取纯化后的壳聚糖酶液用20 mmol/L,用pH值7.0的磷酸缓冲溶液稀释一定倍数后,取少量酶液与不同 pH 值(1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0)的胶体壳聚糖反应,以测定酶活力,以最高活力为 100%计算相对酶活性,确定壳聚糖酶的最适反应pH。
1.6.3 壳聚糖酶的温度及pH稳定性
取纯化后的壳聚糖酶液用20 mmol/L,用pH值7.0的磷酸缓冲溶液稀释一定倍数后,将其置于不同温度(30、40、50、60 ℃)恒温水浴锅中保温一定时间后,测定剩余酶活性。取少量纯化的壳聚糖酶液,用不同pH值(2.5、4.5、6.5、8.5、10.0)的缓冲溶液稀释一定倍数酶液,冰水浴一定时间,测定剩余酶活性。
1.6.4 CsnSH50的动力学参数测定
用pH值5.0,20 mmol/L的磷酸缓冲溶液溶解胶体壳聚糖,配制成终浓度为1、2、4、6、8、10 mg/mL的壳聚糖溶液,取上述壳聚糖溶液900 μL,75 ℃恒温水浴,加入100 μL稀释200倍的CsnSH50酶液,反应2 min后加入1.5 mL DNS终止反应。测定不同底物浓度的反应速度。用 Lineweaver-Burk制图法绘制双倒数曲线,求出CsnSH50的Vmax和Km值。
1.6.5 金属离子对CsnSH50酶活性的影响
分别向壳聚糖酶液中添加不同终浓度(1、5、10 mmol/L)的金属盐 ZnCl2、MgCl2、FeCl3、AlCl3、CaCl2、CuCl2、KCl、NaCl、BaCl2、MnCl2、CoCl2、AgNO3,冰水浴条件下搅拌至金属盐完全溶解,静置30 min后,在pH值4.5,75 ℃条件下,测定酶活力,以不添加金属盐的反应体系为对照,计算相对酶活性。
1.7 CsnSH50水解壳聚糖产物的薄层层析(TLC)分析
采用硅胶薄层层析(TLC)分析CsnSH50水解壳聚糖的产物组成。将1%(m/m)的胶体壳聚糖底物缓慢升温至 75 ℃恒温搅拌,后加入少量壳聚糖酶CsnSH50,分别于30、60、90、180 min时取样,沸水浴5 min后,8 000 r/min离心10 min。用毛细管取样滴于硅胶板上,吹干后置于展开剂(异丙醇:氨水=2:1,V/V)中缓慢展开。待展开剂铺满硅胶板后,取出吹干,均匀喷洒1%(m/m)的茚三酮溶液,于110 ℃放置5 min显色。
1.8 CsnSH50水解壳聚糖产物质谱(ESI-MS)分析
采用电喷雾串联质谱(ESI-MS)进一步分析CsnSH50水解壳聚糖的产物分布,将1%(m/m)胶体壳聚糖水解后的产物进行测定,条件设置为:正离子模式,分子量范围为50~2 000 (m/z),电压3.5 kV,温度180 ℃。
1.9 CsnSH50制备壳寡糖
1.9.1 小试放大试验制备壳寡糖
向5 L发酵罐中添加胶体壳聚糖粉末200 g,补水至4 L,边搅拌边加入冰醋酸调节初始pH值(3.0、3.5、4.0、4.5),逐步升温至75 ℃待底物完全溶胀,添加CsnSH50酶液,反应120 min,CsnSH50的添加量为12.5 U/g,持续反应90 min后每10 min取少量反应液滴加2 mol/L的NaOH溶液,观察是否有白色悬浮物,无沉淀即为反应终点。
1.9.2 壳寡糖含量及平均聚合度的测定
配置0.1、0.2、0.3、0.4、0.5、0.6 mg/mL的氨基葡萄糖盐酸盐标准溶液,540 nm下测定吸光度值,绘制标准曲线,采用DNS法测定降解产物中壳寡糖的浓度并计算产率。取1 mL壳寡糖溶液于具塞试管中,置于冰水浴中,缓慢加入4 mL浓硫酸,摇匀,在90 ℃反应2 h,冷却后定容至100 mL,用10 mol/L的NaOH溶液中和至中性,定容至25 mL,取2 mL壳寡糖溶液加入 1.5 mL DNS试剂,沸水浴中加热5 min,冷却后定容至25 mL,540 nm下测定吸光度值。结果计算:
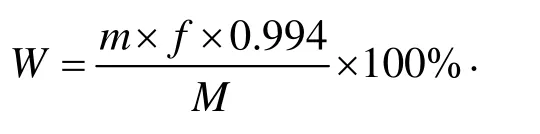
式中:
W——壳寡糖含量的质量百分数,%;
m——由标准曲线查得的盐酸氨基葡萄糖的质量,mg;
f——测定过程中样品溶液稀释倍数;
M——每毫升壳寡糖溶液中壳寡糖样品的质量,mg;
0.994 ——单糖折成多糖的系数。
平均聚合度采用乙酰丙酮分光光度法[26]。
1.10 数据处理及统计学分析
所有试验均在自然条件下重复3次,采用 SPSS 19.0进行数据分析,采用Duncan's检验计算差异显著性,p<0.05为显著。
2 结果与讨论
2.1 CsnSH50的分离纯化
2.1.1 硫酸铵分级沉淀
微生物在生长过程中会分泌大量胞外蛋白,硫酸铵分级沉淀可以去除粗酶液中的一些杂蛋白[27],实现目标蛋白的初步纯化。硫酸铵分级沉淀提取CsnSH50的结果见表1,当硫酸铵饱和浓度低于30%时,沉淀中有少量蛋白析出,但几乎检测不到壳聚糖酶活性。在30%~50%硫酸铵浓度范围内,沉淀中有少量壳聚糖酶析出,在硫酸铵饱和浓度50%~70%之间,存在大量壳聚糖酶析出,且杂蛋白相对较少。经透析后测定,比酶活力为2 833.40 U/mg。因此,选用硫酸铵饱和浓度在50%~70%范围沉淀粗酶液,此条件下的目标蛋白纯化倍数为2.27倍。
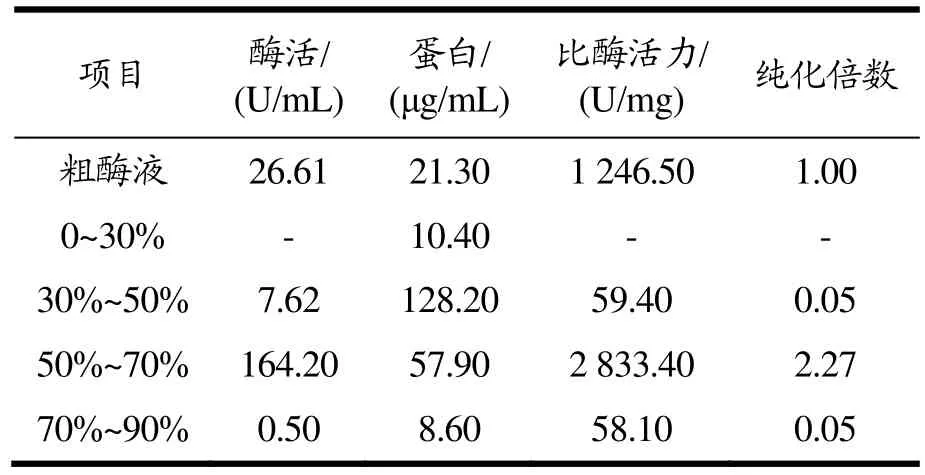
表1 不同硫酸铵饱和浓度对CsnSH50盐析影响Table 1 Influence of different saturation concentrations of ammonium sulfate on salting out of CsnSH50
2.1.2 DEAE-Sepharose Fast Flow离子交换层析柱
用硫酸铵沉淀透析初步提纯粗酶液中的目标蛋白后,采用DEAE-Sepharose Fast Flow阴离子交换层析进一步进行分离,洗脱曲线如图1所示。在NaCl浓度为0.37 mol/L和0.68 mol/L时有两个峰被洗脱,第一个洗脱峰的壳聚糖酶活性可忽略不计,第二个洗脱峰表现出明显的壳聚糖酶活性,对应的29~38号管壳聚糖酶活性较高。因此,将活性组分进行 Sephadex G-75凝胶过滤层析。为336.20 U/mg的重组酶;王杉杉[31]通过基因克隆得到产酶活性为1 500 U/mL的工程菌。表2为CsnSH50提纯工艺概要,与粗酶液相比,通过硫酸铵分级沉淀、DEAE-Fast Flow、Sephadex G-75层析纯化后的CsnSH50比酶活力为7 462.50 U/mg,回收率为6.62%,纯化倍数为5.99。
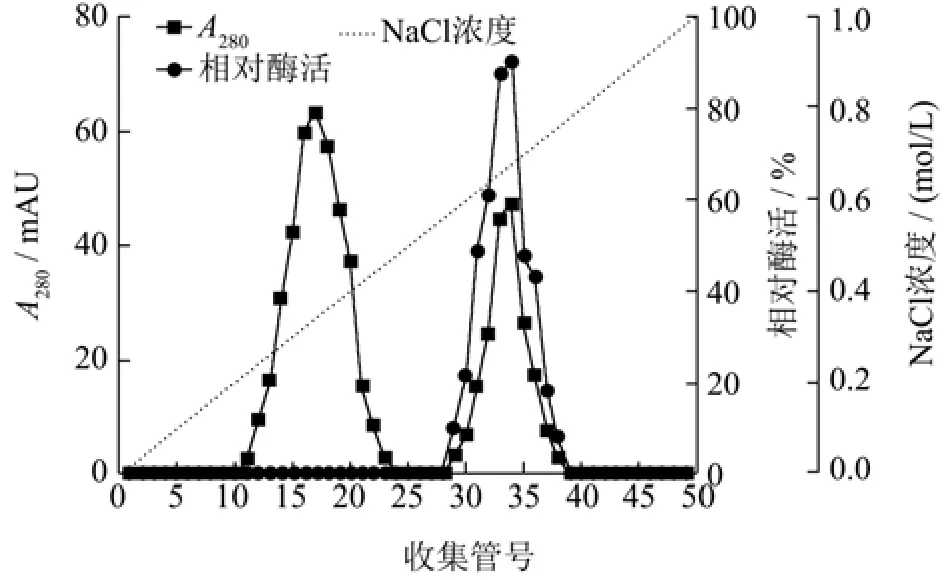
图1 CsnSH50的离子交换柱层析Fig.1 Ion exchange column chromatography of CsnSH50
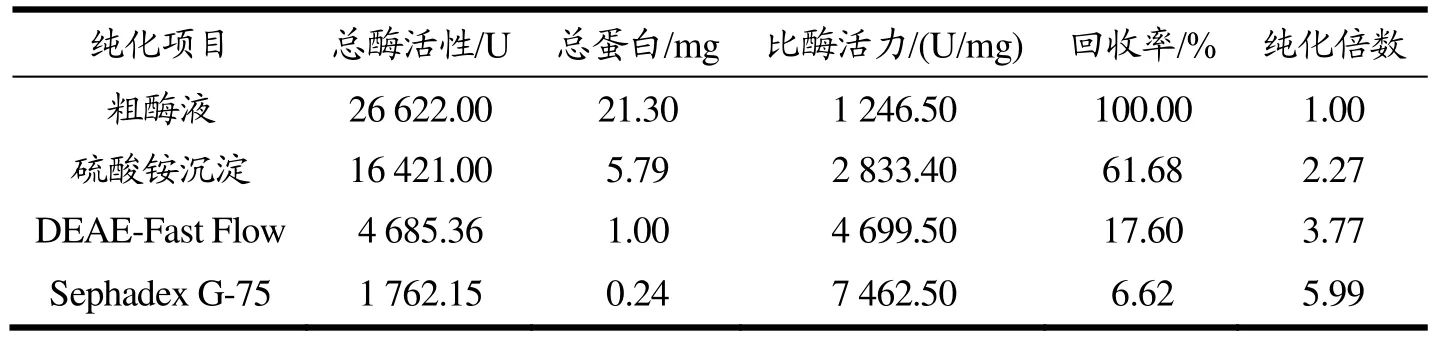
表2 CsnSH50纯化结果Table 2 Purification results of CsnSH50
2.1.3 Sephadex G-75凝胶过滤层析
将离子交换柱层析的壳聚糖酶样品收集后,使用Sephadex G-75凝胶过滤层析进一步纯化,结果如图2所示。样品分离后得到两个较为明显的洗脱峰,第一个洗脱峰检测不到明显的壳聚糖酶活性,第二个洗脱峰具有较高的壳聚糖酶活性,将收集纯化的壳聚糖酶命名为CsnSH50。
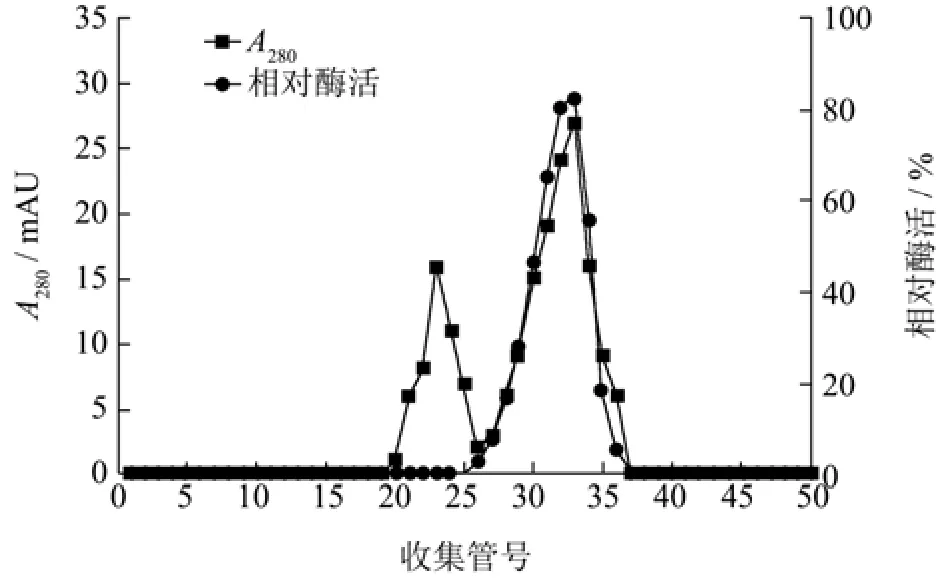
图2 CsnSH50的凝胶过滤层析Fig.2 Gel filtration chromatography of CsnSH50
已有报道的高产壳聚糖酶菌株有Renibacteriumsp.QD1,Bacillussp.KCTC0377BP,比酶活力分别为1 575 U/mg[28]和1 700 U/mg[29]。重组壳聚糖酶中,Guo等[30]通过大肠杆菌超表达壳聚糖酶基因得到了酶活
2.2 SDS-PAGE
大多数细菌产的壳聚糖酶分子量范围在20~75 ku,只有少数高分子量壳聚糖酶,来自Penicilliumsp.ZD-Z1的壳聚糖酶的分子量为115 ku[32]。将经过硫酸铵分级沉淀,DEAE-Sepharose Fast Flow离子交换层析柱和Sephadex G-75凝胶过滤层析收集到的壳聚糖酶溶液,进行SDS-PAGE电泳分析,分析结果如图3所示。经过硫酸铵分级沉淀后的凝胶电泳条带明显得到了初步纯化,但目标蛋白颜色较淡,有少许杂蛋白条带,经过离子交换层析和凝胶过滤层析收集到的酶液显示为明亮单一蛋白条带,与Marker中相对应蛋白分子量进行比较,CsnSH50的分子量在41 ku左右。

图3 CsnSH50的SDS-PAGE电泳图谱Fig.3 SDS-PAGE of CsnSH50
2.3 温度对CsnSH50的影响及温度稳定性
温度是酶活性最重要的指标之一,大多数报道的壳聚糖酶是不耐热的,热稳定较好的壳聚糖酶较少,高温条件下,反应进程加快,壳聚糖溶液的粘度下降,杂菌污染率低,产品纯度更高[33]。已有报道中,反应温度相对较高的有Streptomyces roseolusDH[34]和Penicilliumsp.D-1[35]来源的壳聚糖酶,最适反应温度分别为50 ℃和48 ℃。由图4a可知,CsnSH50的酶活性在一定范围内随着温度升高逐渐升高,酶活性在75 ℃时达到峰值,之后随温度继续升高,酶活性迅速下降,这可能与温度过高酶蛋白变性有关。由图4b可知,CsnSH50在50 ℃以下具有较好的温度稳定性,50 ℃时CsnSH50的酶活性开始随着时间逐步下降。CsnSH50最适温度为75 ℃,证明其是一种嗜热性壳聚糖酶,且CsnSH50具备良好的热稳定性,更易储存。
2.4 pH值对CsnSH50的影响及pH值稳定性
pH值不仅影响蛋白的溶解性,还会影响酶活性中心必需基团的解离状态,过酸或过碱均会改变酶的空间结构从而改变酶蛋白的构象[36]。壳聚糖酶在水解壳聚糖时的解离pH值在3.5左右,但大多数壳聚糖酶在酸性条件下半衰期较短。由图5a可知,CsnSH50在pH值3.0~7.0范围内具有较好的酶活性,pH值>7.0时,随pH值升高,CsnSH50的酶活性逐渐下降,这可能是因为pH值较高时壳聚糖的溶解性下降导致的。由图5b可知,CsnSH50在pH值2.5~8.5之间较稳定,120 min后相对酶活性依然在80%以上。这些结果表明,CsnSH50能较长时间适应宽范围的pH值变动,且活性不受太大影响,具有很好的工业化应用能力。
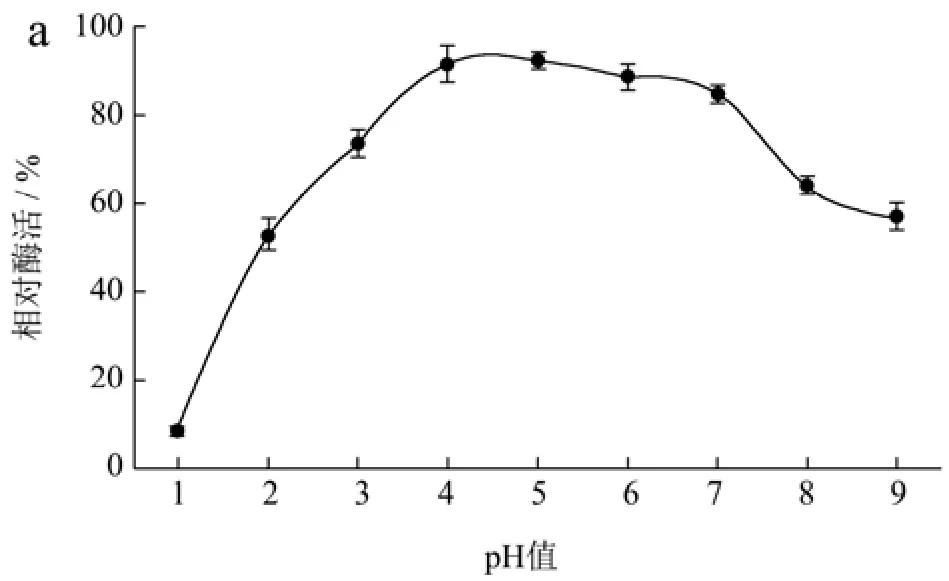
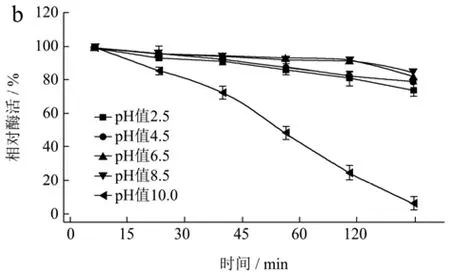
图5 CsnSH50的最适pH(a)及pH稳定性(b)Fig.5 Optimum pH (a) and pH stability (b) of CsnSH50
2.5 CsnSH50的动力学参数
将纯化后的CsnSH50稀释200倍,在75 ℃和pH值4.5条件下,以1、2、4、6、8、10 mg/mL的胶体壳聚糖(脱乙酰度≥85)作为反应底物,分别测定CsnSH50的酶活性,以底物浓度的倒数和反应速率的倒数为X、Y轴绘制Lineweaver-Burk双倒数曲线。线性回归方程为y=0.058x+0.034(R2=0.999 2),该曲线拟合较好,经过计算得到CsnSH50的Vmax=29.41 U/mL,Km=1.71 mg/mL。不同酶的Km存在一定差异,同时Km值越小表明酶与底物的亲和度越高。
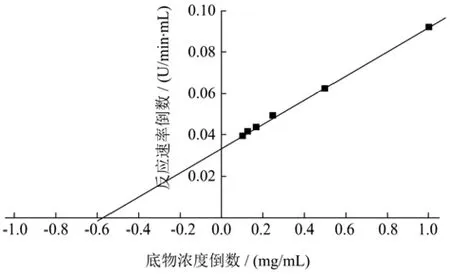
图6 CsnSH50的酶反应动力学参数Fig.6 Kinetic parameters of CsnSH50
2.6 不同金属离子对CsnSH50的影响
不同的金属离子可能会影响酶蛋白的中心构象,从而影响酶活性。已有报道中,大多数壳聚糖酶受到Cu2+和Fe3+的抑制,受到Mn2+的正向激活作用[37]。本文分别比较了 1、5、10 mmol/L的不同金属离子对CsnSH50酶活性的影响,结果如图7所示。Ca2+、Cu2+、Fe3+、K+、Mn2+表现出较强的正向激活作用,Zn2+、Mg2+、Ba2+、Ag+对CsnSH50酶活性影响不大,Al3+、Co2+则表现出抑制作用。1 mmol/L的K+表现出正向激活作用,但随着K+浓度的逐渐升高,反而会逐渐抑制酶活性。值得注意的是,尚未见到10 mmol/L的Mn2+对壳聚糖酶正向激活作用达到412%的相关文献报道。这些结果表明,CsnSH50的酶活性容易受到金属离子的影响,且其效果与金属离子的浓度密不可分,同时也说明CsnSH50极有可能是一种新型壳聚糖酶。
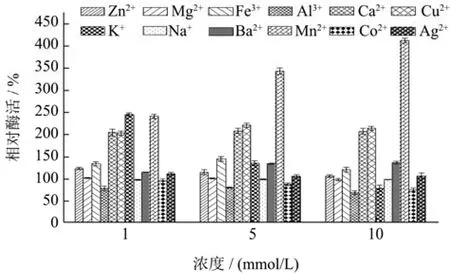
图7 不同金属离子对CsnSH50活性的影响Fig.7 Effects of different metal ions on the activity of CsnSH50
2.7 CsnSH50水解壳聚糖的产物分析
利用薄层层析色谱法(TLC)和电喷雾串联质谱(ESI-MS)分析CsnSH50水解壳聚糖产物中的寡糖分布,结果如图8所示。由图8a可知,降解30 min时,产物中主要是二糖、三糖、四糖和五糖,随着降解时间延长,五糖逐渐增加,随后被降解成二糖和三糖;当降解时间为180 min时,主要产物是二糖、三糖、四糖,无单糖产生。电喷雾质谱(ESI-MS)结果显示,361m/z、521m/z、682m/z处分别代表不饱和二糖、三糖、四糖(图8b),这与薄层层析结果一致。由此可以看出,CsnSH50通过内切的方式作用于底物,是一种内切酶。
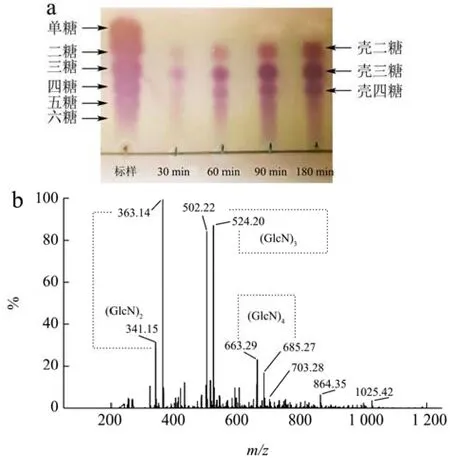
图8 CsnSH50水解胶体壳聚糖的产物分析Fig.8 Product analysis of CsnSH50 hydrolyzed colloidal chitosan
2.8 CsnSH50制备壳寡糖
当壳聚糖质量分数超过 5%时,其粘度往往超过800 mPa·s,因此利用壳聚糖酶工业化制备壳寡糖时应不高于该值。壳聚糖在水解时会导致体系的pH值逐渐升高,不利于反应,且反应时间过长也会导致壳聚糖酶逐渐失活。因此根据CsnSH50的最适反应pH值范围调节反应底物的初始pH值,选用120 min作为反应时间。小试放大试验结果如表3所示,处理2的反应初始pH值为3.5,反应120 min,产物最终pH值为5.5,壳寡糖产率达到92.1%,较其他处理具有显著性差异,产物中的灰分率较处理1无显著差异,但产物的平均聚合度为10.20,达到显著性差异。因此,利用CsnSH50规模化制备壳寡糖时应调节初始pH值为3.5左右。
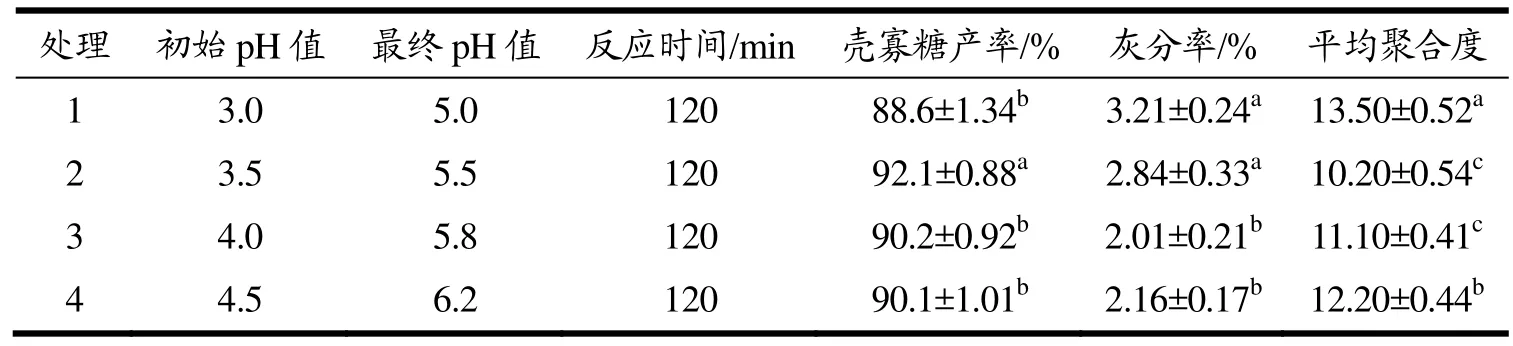
表3 不同初始pH值对壳寡糖产物的影响Table 3 Effects of different initial pH on chitosan oligosaccharide products
3 结论
本研究结果表明,Mitsuariasp.SH-50所产的壳聚糖酶粗酶液,经 50%~70%硫酸铵沉淀、DEAE-Sepharose Fast Flow离子交换层析和Sephadex G-75凝胶过滤层析,纯化后的CsnSH50比酶活力为7 462.50 U/mg,纯化倍数达到5.99,回收率6.62%。壳聚糖酶CsnSH50的分子量约为41 ku,最适反应温度为75 ℃,最适pH值为4.5,在pH值2.5~8.5及50 ℃下稳定性较好。最适条件下,稀释200倍后的CsnSH50的Vmax=29.41 U/mL,米式常数Km=1.71 mg/mL。Ca2+、K+、Cu2+、Fe3+、Mn2+均表现出对CsnSH50的较强正向激活作用,10 mmol/L的Mn2+对CsnSH50酶活性的增强作用达到412%。CsnSH50水解壳聚糖产物中无单糖产生,表明CsnSH50是一种内切型壳聚糖酶。制备4 L含5%壳寡糖溶液时,用冰醋酸调节初始pH值为3.5,CsnSH50添加量为12.5 U/g,水解120 min,寡糖产率可达90%以上,产物平均聚合度为10.2。
