铜及其化合物的几个教学疑难问题分析
2023-01-26文吉槐杨志义
文吉槐 黄 易 杨志义 谭 文
(1.自贡市蜀光中学 四川自贡 643000;2.聊城市第一实验学校 山东聊城 252000;3.成都市双流区立格实验学校 四川成都 610218)
高中化学虽然没有安排铜及其化合物作为单独章节进行系统介绍,但以铜元素为载体的相关化学知识广泛分散在各个模块,其地位不容忽视。如人教版《高中化学必修(第二册)》“氮及其化合物”一节,介绍硝酸的化学性质,便是用铜与浓/稀硝酸的反应进行分析。[1]在《物质结构与性质》模块,将铜的3d104s1电子排布作为不符合构造元原理的案例,以说明学科理想化建模的特点。[2]同样,在《物质结构与性质》模块,用四水合铜离子作为“配合物”一节的引入,并详细分析了四氨合铜离子的形成。[2]在《化学反应原理》模块,用Zn-Cu原电池分析原电池工作原理;通过电解氯化铜溶液分析电解原理。[3]
在铜及其化合物的教学中,师生常常会遇到一些和现有知识理论“反常”的情形。如铜的价电子为3d104s1,形成亚铜离子后3d10处于全满状态,已经稳定,为什么还有+2价的铜?如何解释水溶液中有稳定存在的Cu2+,却无稳定的Cu+?铜的活动性顺序排在氢之后,为什铜还可以和浓盐酸反应生成氢气?[Cu(H2O)4]2+为什么不是四面体结构而是平面四边形?Cu、Ag、Au属于同一族,为什么从上往下活泼性减弱?本文试图通过物质结构和化学反应原理等相关理论解释上述高中化学教学上的疑惑。
一、铜元素的价态问题
过渡元素存在多种氧化态,这与它们有未饱和的价电子层结构和(n-1)d与ns能量相近有关。如,铜的化合价有+1、+2、+3,这是由于铜元素3 d和4 s轨道能量相近造成的。我们来看一组数据,见表1。Na的第一电离能为496 kJ·mol-1,第二电离能为4562 kJ·mol-1,3 s与2 p能量相差很大,通常情况下,很难失去次外层电子,所以显+1价。同样,Mg的3 s与2 p能量相差很大,第三电离能远大于第二电离能,因此显+2价,2 p电子不参与成键。从Cu的第二电离能和第三电离能来看,3 d轨道能量与4 s能量相差不大,所以部分电子可以参与成键。如,在高铜酸钾KCuO2、高铜酸钠NaCuO2中的铜便有3 d电子参与成键。

表1 Na、Mg、Cu电离能
二、Cu(Ⅰ)和Cu(Ⅱ)稳定性问题
从电子排布来看,Cu(Ⅰ)为3d10结构,Cu(Ⅱ)为3d9结构,理论上Cu(Ⅰ)应该更稳定。这一结构用于解释气态和固态的铜与实际是吻合的,但水溶液还要考虑其他因素。
1.气态
气态时,存在如下反应:
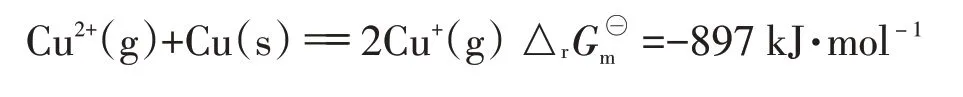
△rGm⊝<0,可以看出在标准状态下,Cu(+g)能稳定存在。
2.固态
固态时,高温状况下有如下自发的反应:

说明Cu(Ⅰ)的化合物比Cu(Ⅱ)更稳定。上述两种情况均可用Cu(Ⅰ)为3d10的全满结构解释。这是由于气态和固态状况下,物质所处环境较为单一,受外界影响因素小,因此仅用原子结构解释Cu(Ⅰ)和Cu(Ⅱ)稳定性是比较成功的。而溶液环境,离子的稳定性除了与结构有关,还要受到溶剂分子等因素的影响。
3.水溶液
水溶液中,简单的Cu+不稳定,易发生歧化,生成Cu2+和Cu。例如,将Cu2O溶于稀硫酸中,发生的反应为:

这与Cu2+的水合热有关,Cu2+的水合热为-2121 kJ·mol-1,其数值远高于Cu+的水合热(-582 kJ·mol-1)。原因可能有两个,一是由于Cu2+的电荷更高,半径更小,正电荷密度更大,导致极化能力更强,容易形成水合物;二是由于Cu2+的d9结构,在水分子的配位场作用下,发生d轨道能级分裂,得到了配位场稳定化能和姜-泰勒畸变稳定化能。[4]Cu2+的水合热可以弥补消耗的第二电离能(1970 kJ·mol-1),所以在水溶液中可以稳定存在。相反,Cu+的水合能抵消不了它的第一电离能(746 kJ/mol),Cu+在水溶液中不能稳定存在。用铜元素的电势图也可以加以解释:

在298K时,此反应的标准平衡常数为:
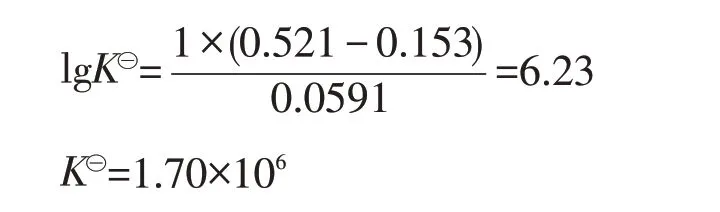
此反应的K⊝很大,说明歧化反应进行得很完全,Cu2+能稳定存在。[5]
4.配合物
Cu(Ⅱ)的简单配合物大都不如相应的Cu(Ⅰ)的配合物稳定。Cu2+属于交界酸,它与软碱和硬碱都难形成稳定的配合物。例如[CuCl2]-是比较稳定的(lgK⊝=4.84),而[CuCl4]2-的稳定性较差(lgK⊝=-4.6),在很浓的Cl-溶液中才会有黄色的[CuCl4]2-存在。而Cu+属于软酸,它与下列离子或分子都能形成稳定的配合物,其稳定性按下列顺序增强:

这一顺序基本上与碱的软度顺序相符合。[6]
综上所述,一般来说,在气态、固态和溶剂极性小时,Cu(Ⅰ)稳定;在强极性溶剂中由于Cu(Ⅱ)的溶剂化能高,Cu(Ⅱ)稳定。在水溶液中,当有还原剂和能使Cu+浓度大大降低的沉淀剂或配位剂存在时,则Cu(Ⅰ)以难溶物或稳定性较大的配合物形式稳定存在。[5]
三、铜与盐酸反应问题
按金属活动性顺序表,铜排在氢之后,铜不能将酸中的氢置换出来,生成氢气。但是,金属活动性顺序指的是25℃、p⊝(100kPa)、[H+]=1 mol·L-1条件下Cu不能置换出氢气。而实际上,铜与浓盐酸是可以反应生成氢气的,相关反应如下:
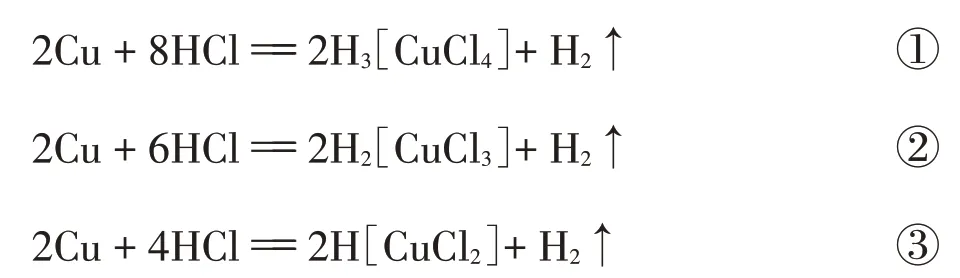
在反应中由于生成[CuCl2]-、[CuCl3]2-、[CuCl4]3-等SGNN离子,使体系Cu+浓度降低,促进反应的正向进行。以反应②为例,根据标准电极电势E⊝(Cu+/Cu)=0.521 V和稳定常数K⊝(CuCl)=4.55×105,可用Nernst方程分别计算常温下铜与不同浓度盐酸的反应情况,计算方法如下:

代入电极反应Cu+(aq)+e-====Cu(s)的Nernst方程中:


由于E>E⊝(H+/H2)=0,因此铜与1 mol·L-1的稀盐酸不反应。
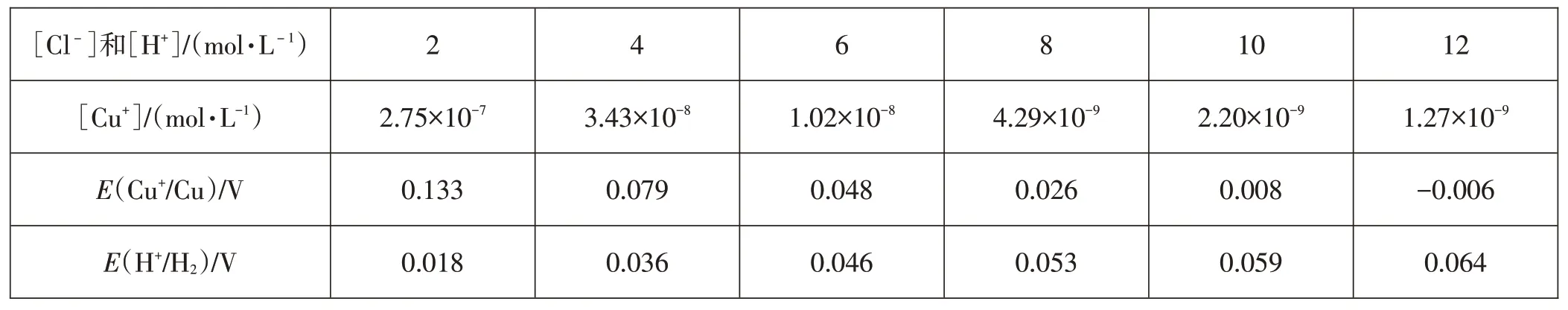
表2 不同浓度Cl-和H+所对应的[Cu+]、E(Cu+/Cu)和E(H+/H2)
从理论数据可以看出,当Cl-和H+浓度达到到8 mol·L-1时(实为6-8 mol·L-1之间),E(H+/H2)-E(Cu+/Cu)数值已大于0,反应能够进行。若升高反应温度,由公式:
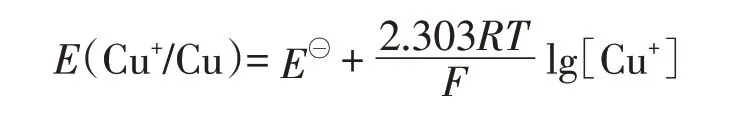
可知,E(Cu+/Cu)的数值将进一步减小。实验研究发现,在沸水浴加热条件下,盐酸与铜反应的临界浓度为仅为14%-16%(约4-5mol·L-1)。[7]
四、四氨合铜离子空间构型问题
[Cu(H2O)4]2+和[Cu(NH3)4]2+按照传统的价键理论分析,它们的空间构型应该是正四面体,但实际为平面正方形(见图1),这可以用晶体场理论解释。晶体场理论把中心离子与配位体的相互作用,看作类似于晶体中正负离子间的相互作用,着眼点是中心离子d轨道在周围配体影响下的能级分裂,电子在分裂了的轨道上的排布状态,决定了配位场的光谱、磁性、稳定性、几何构型等性质。Cu2+在平面正方形场中获得的晶体场稳定化能最大(12.28 Dq),大于其在八面体场中的6 Dq和四面体场中的1.78 Dq。因此Cu2+配合物的空间构型大多呈平面正方形。
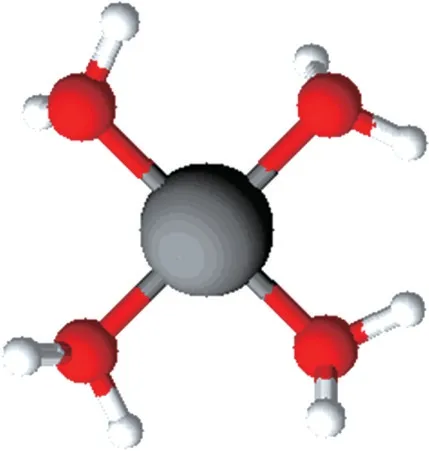
图1[Cu(H2O)4]2+结构
五、铜银金活泼性问题
按照元素周期律,同属一族的铜、银、金从上往下,金属性应该逐渐增强,这与我们通常认为的铜、银、金的活泼性顺序刚好相反。
在此,有必要明确一下“金属性”和“金属活动性”两个概念的区别。金属性是元素的原子失电子的趋势,可以用第一电离能定量标度,其对象是单个独立的原子,影响因素较为单一。有时,我们可以借助元素在周期表中的位置、标准电极电势、最高价氧化物对应水化物的碱性与水或酸反应的剧烈程度等作为金属性的辅助判断。金属的活动性是按金属在水溶液中形成简单离子的电极电势为依据,其对象是由金属键结合而成的单质,所处环境为水溶液,因此影响因素较为复杂,包括金属的电离能、金属原子升华热、金属离子的水合热等因素。现在我们用一些数据来分析,见表3。[8]
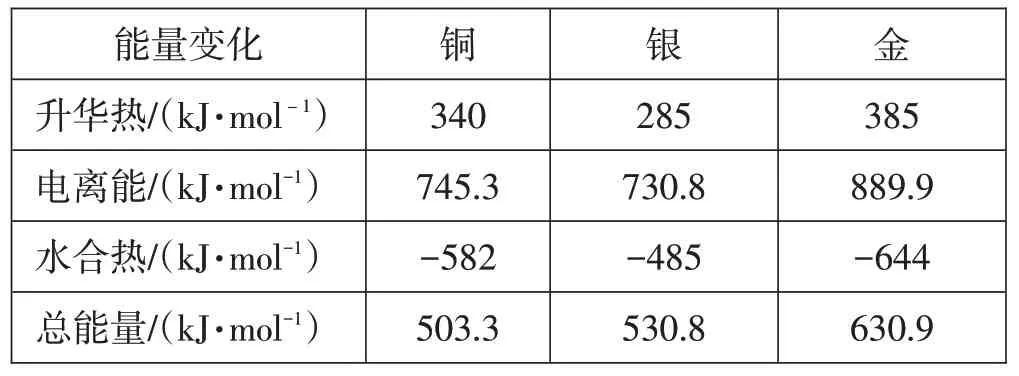
表3 铜族原子转化为M+(aq)时的能量变化
如果仅从第一电离能的数据看,铜、银、金分别为745.3 kJ·mol-1,730.8 kJ·mol-1,889.9 kJ·mol-1,银应比铜“活泼”。若考虑在水溶液中的整个过程,加上金属的升华热和离子的水合热,银需要的能量大于铜,银不如铜活泼。同理,金的总能量最大,最不活泼。因此,可以看出电离能只是影响一个化学反应的局部因素,分析一个具体的化学反应,还要结合反应所处环境综合考虑各个方面的影响。
再从结构分析Cu到Au第一电离能数据特点。按照元素周期律,同族元素,从上往下,通常半径逐渐增大,核对外层电子的引力逐渐减小,第一电离逐渐减小。银和铜是符合这一递变规律的,但金却“异常”增大。三种金属的半径依次为128 pm,144 pm,144 pm,为什么第六周期金原子半径与第五周期同族的铜半径几乎相等?其实第六周期镧系后面的过渡元素均存在这种情况,其半径和同族的第五周期元素接近,这一现象可用镧系收缩效应来解释。镧系元素,电子填入4f能级,f电子对核的屏蔽作用,致使有效核电荷数增加较小,相邻元素原子半径的减小幅度收窄,但当这种效应扩大到从镧到镥15种元素时,原子半径累计减少却不能忽略,达到了11 pm,这样就造成了第三过渡系和第二过渡系同族元素半径相近的现象。[9]在半径接近的情况下,由于金的核电荷数大于银,因此金原子核对外层电子的吸引力更大,电离更困难。
