例谈基于证据推理的项目式教学设计与实施*
——以“新制氯水成分的探究”为例
2023-01-26黄金泉
黄金泉
(张家港市崇真中学 江苏苏州 215631)
2021年,张家港市第二十三届中小学课堂教学改革有效教学研究经验交流会在我校举行,笔者上了一节题为“新制氯水成分的探究”的公开课,上课对象是高一新生。现将教学设计和思考整理成文,以求抛砖之引玉。
一、设计思路
重点围绕“氯气溶于水是否发生了化学反应?”“往石蕊试液中滴加新制氯水时没能观察到预期的红色”这一“意外”现象和“使石蕊试液褪色的是什么物质?”等一系列真实问题展开教学,引导学生进行实验探究,培养学生证据意识。为此,笔者将课堂教学思路设计为:从生活中找到与氯气相关的一些真实情境→提出问题,引发思考→学生实验→引发问题探究→提出猜想→设计方案→实验再探究→得出结论→产生新问题→提出新猜想→……
二、教学过程
刚拿到该课题时,笔者想通过让学生观看氯气泄露事件为背景的视频,然后提出消防员为何用水枪喷水来稀释泄露在空气中的氯气?氯气与水相遇后会不会发生反应?引出氯气溶于水是否发生化学反应的实验探究。后来细细一想,这样引入学生固然会感兴趣,但也会带来一定的负面影响,如氯气对环境破坏性强、对人体有害等等,其结果可能会导致学生害怕接触氯气,甚至蒙上心理的阴影。因此,笔者决定从生活中的事例出发,找到与氯水相关的真实情境,提出问题引入新课。如“清晨,当你刷牙打开水龙头的时候,会闻到一股刺激性气味,你知道它是由什么物质产生的吗?”。学生回答可能是氯气。然后提出氯气和水的性质同学们都有了一定了解,那么它们相遇之后,会溶解吗?如果溶解了,你的证据是什么?仅仅是简单的溶解吗?是否会发生化学反应呢?如果发生反应,你的证据又是什么?从而激发学生的好奇心,自然而然地进入到氯气溶于水的一系列实验探究中去。
1.教学环节1:制备氯水
实验1:用注射器从烧杯中抽取大约10 mL的水,注入到装有氯气的无色试剂瓶(带有硅胶塞。注:不可用橡胶塞,太硬,注射器的针头不易穿透)中,如图1所示,小心振荡,观察颜色变化(留着待用)。现象:溶液呈现黄绿色,气体颜色逐渐变浅。结论:氯气能溶于水中。

图1 制备氯水
氯气溶于水中形成的这种浅黄绿色溶液叫氯水,如图2所示。新制氯水中的氯气与水仅仅是简单的溶解吗?如果不是,你有什么证据?

图2 氯水
2.教学环节2:逐步推进氯水成分的探究
问题1:氯气溶于水后,氯气与水是否会发生化学反应?如何证实?如果不反应,从微观角度看它的成分可能是什么?如果发生反应,从氯水成分的组成元素角度,你认为最可能产生何种阴离子和阳离子?请大家交流讨论并提出合理假设。
学生各抒己见,讨论积极,逐渐形成了以下两种假设:
假设1:如果不反应,氯水成分可能只有Cl2分子和H2O分子;
假设2:如果反应,氯水成分可能有Cl2分子、H2O分子、Cl-、H+等。
问题2:假设氯气与水发生了化学反应,如何证明氯水中可能存在的Cl2分子、Cl-和H+?请大家再次交流讨论并设计出检验这些微粒的实验方案。
投影总结学生设计的验证新制氯水中的相关微粒的实验方案:
Cl2:看颜色、闻气味等;
Cl-:滴加硝酸银溶液和稀硝酸,观察是否生成白色沉淀。
H+:①使用紫色石蕊试液,观察溶液是否变红。②加入少量NaHCO3粉末,观察是否产生气泡?……
接着要求学生进行实验验证。提示今天的实验都在点滴板上进行操作,实验完成以后立即用表面皿盖在点滴板上,以减少氯气挥发对污染的环境。
实验2:根据下列提供的试剂和用品,完成上述预测微粒的实验验证。
提供的试剂和用品:硝酸酸化的AgNO3溶液、紫色石蕊试液、NaHCO3粉末、点滴板、药匙、胶头滴管等。
设计意图:如何证实氯气能否与水的反应是本节课的重点也是难点。如何进行突破?考虑到我校学生普遍缺乏自主探究的意识,实验能力欠佳,实验操作时有的同学还会畏畏缩缩等原因。因此,笔者先让学生汇报设计的实验方案,并对学生设计的方案进行了修正和总结,然后才让学生动手操作,以克服学生实验的盲目性,保障后续教学环节顺利进行。事实表明,采用这种“协助探究”的教学方式更适合我校学生。
学生汇报实验结果。
学生:在氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,证明氯水中含有Cl-。但在新制氯水中滴加石蕊试液没看到预期的红色。
学生用自己设计的实验验证了自己的猜想,并得出合理结论,精神大振,增强了探究的信心和热情。但在新制氯水中滴加石蕊试液,实验的结果,出乎学生意料之外:没有出现预期的红色。这样的设计,打破了学生的思维定势,从而唤起了强烈的探究欲。
教师:难道是氯水中不存在H+?话音刚落,一学生马上站起来说,不可能!我在NaHCO3粉末中滴加新制氯水后,观察到有气泡产生。证明氯水中存在H+的!
教师:既然含有H+,为什么滴加石蕊试液后却没能观察到预期的红色现象呢?
顿时,教室里鸦雀无声,同学们满脸疑惑。
此时一位学生很小心地问:老师,会不会是紫色石磊试液有问题呀?
教师:我们用实验验证一下吧。
实验:在一点滴板上滴加3滴稀盐酸,然后再滴加2滴紫色石蕊试液,溶液变红。
结论:紫色石蕊试液没问题。
那是怎么回事呢?学生把求助的目光投向了教师。
教师:会不会是氯水中其他什么成分使石蕊试液失效了或者干扰了H+的检验?如果是这样,那怎样消除可能存在的成分对石蕊的影响呢?
个别同学很快受到启示,想到并建议把氯水和石蕊试液这两种试剂加入的顺序颠倒一下,观察可能会有什么样的现象发生?
演示:取三支相同的试管各滴加1mL紫色石蕊试液,然后向其中两支试管(另一支试管作对比)中各滴加1滴刚制备的新制氯水。观察实验现象,由此得出什么结论?
结论:溶液变红。说明新制氯水中确实存在H+!由此,假设1不成立,假设2成立!
设计意图:向1 mL紫色石蕊试液中各滴加1滴氯水,笔者是采用演示实验,没有让学生做分组实验。一方面是考虑到课堂时间的关系;另一方面如果让学生分组来操作该实验,有学生不太会注意控制氯水的用量,可能会多滴加氯水,很容易导致实验失败。因为在教学环节3中还要向变红后的溶液中继续滴加氯水直至过量来观察溶液颜色是否褪去。
3.教学环节3:探究真正具有漂白作用的物质
设问:如果继续向其中一支变红的试管中滴加氯水,结果会怎样呢?
演示:向其中一支变红了的试管中继续滴加2滴氯水。观察实验现象。
学生:溶液褪色了(与另一支变红的试管作对照)。
追问:为什么会褪色了呢?说明了什么?
学生:说明氯水中还存在着未知的具有漂白作用的物质。
“漂白”一词,大多数学生还比较陌生,为让学生更好地了解这个词的含义,我特地将《辞海》中的解释投影出来:用水加化学药品(氧化剂或还原剂)使东西退去颜色或变白。
问题3:这种起漂白作用的物质会是什么呢?请大家继续交流讨论并提出猜想。
教学中刻意引发学生猜想,激发学生研究问题、解决问题的热情,培养创新意识,应该是值得提倡的。通过讨论,学生主要形成了以下两种猜想:
猜想1:氯水中有盐酸存在,会不会是盐酸具有漂白性?
猜想2:氯水中有氯气存在,会不会是氯气具有漂白作用?或许是氯水中其他成分具有漂白作用?
教师:如何设计实验加以证实?
对猜想1很快就被学生否定了。一位学生站起来说:怎么可能呢?刚才不是做过了实验吗?如果盐酸具有漂白性,那变红的石蕊肯定就会褪色。但事实上它没有褪色呀。大家一致都认同了他的观点,因为盐酸的性质在初中学习时就了然于心。
对猜想2某学生提出要设计对比实验才可证实,否则没有说服力。该学生提出:在一个装有干燥的有色布条和一个装有潮湿的有色布条的洗气瓶中分别通入干燥的氯气,观察究竟哪一个会褪色。
顺着该学生设计的思路,投影出一套预设的实验装置图(见图3)并加以评价。

图3 预设的实验装置
教师:用这样的对比实验装置固然是好,但课堂上操作起来有一定的困难。现在我们就采用一套较为简单的易操作的对比实验装置来进行演示,装置如图4、图5。盐水瓶内收集的是干燥的氯气(收集时在盐水瓶内预先放好无水CaCl2固体和少量无水CuSO4粉末,以证明Cl2是干燥的),而试管架上的2支试管中分别装有干燥的红纸和潮湿的红纸,分别用硅胶塞塞紧待用。

图4 干燥的氯气

图5 对照实验
演示:用注射器抽取盐水瓶中干燥的氯气,通过硅胶塞分别注入到干燥的红纸和湿润的红纸的试管中。观察实验现象。
学生:干燥的红纸不褪色;湿润的红纸褪色。
结论:干燥的氯气没有漂白性,潮湿的氯气具有漂白性。
教师:潮湿的氯气具有漂白性,应该是氯气和水共同作用的结果。因为水没有漂白性,氯气也没有漂白性,一定是两者发生反应生成的新物质具有漂白性。这种物质会是谁呢?
4.教学环节4:HClO(次氯酸)“闪亮登场”
问题4:氯气和水反应除了生成HCl外,还会生成什么物质?
讲述:1875年,法国科学家贝托雷在研究氯水的漂白性时,也产生过相同的疑惑。为了研究这个问题,他将氯水露置在较强的灯光下,结果发现氯水中产生了一些奇妙的变化。我们来看这方面的文献资料。
【资料1】将氧气浓度传感器、数据采集器、计算机三者相连接。在烧杯中加入浓度约为0.0921 mol·L-1新制氯水,插入氧气浓度传感器,打开台灯光照氯水,对氯水中氧气浓度变化进行测定。实验数据粗略记录如图6所示。[1](注:原文献中的氧气浓度的数据不详,故纵坐标数据改用c1、c2、c3、c4、c5表示,浓度单位是ppm)

图6 反应过程中氧气浓度变化示意图
【资料2】将pH传感器、数据采集器、计算机三者相连接。在烧杯中加入浓度约为0.0 921 mol·L-1新制氯水,插入pH传感器,打开台灯光照氯水,对氯水的pH变化进行测定。实验数据记录如下表:[1]
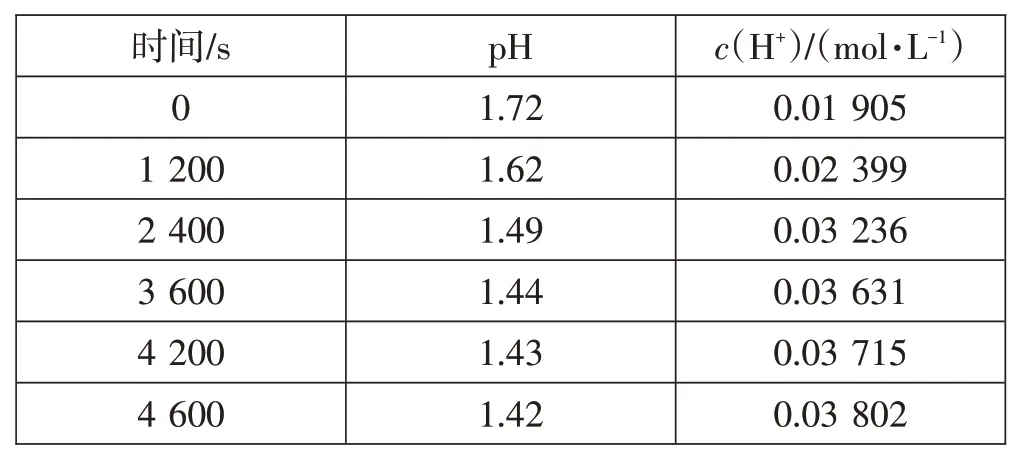
表1 实验数据
问题5:在光照条件下,氯水中pH值和氧气浓度是如何变化的?据此,你能得出什么结论?
学生:在光照条件下,氯水的pH值逐渐变小,酸性逐渐变强。说明光照氯水时会产生HCl。
学生:在光照条件下,氧气的浓度呈增大趋势。说明光照氯水时还会产生O2。
总结:上述文献资料表明,氯水在光照时会产生HCl和O2!
问题6:氯水光照时,产生的HCl和O2是哪里来的?
学生:应该是氯气与水反应生成的。
学生:如果氯气与水反应仅仅只生成HCl和O2的话,那么,氯水具有漂白的性质我们还是无法解释呀。因为HCl和O2都没有漂白作用。
学生……
设计意图:次氯酸什么时候“登场”,其不稳定的性质如何向学生解释?起初笔者的设计是想在课堂上直接演示氯水在持续光照时溶液的pH值变化和氧气浓度变化的测定,但顾忌到实验花费的时间较长,操作也有困难,况且,在现有条件下即使演示,实验效果也不一定明显。因此,笔者改变了设计初衷,通过查阅相关文献,直接引用文献中的实验数据记录,并将这些实验数据记录投影出来让学生进行分析,得出相关结论。为HClO的“出场”和HClO的不稳定性埋下伏笔。
课上到这,实验探究正在一步步逼近问题的实质,但总感觉就差那么一点点“火候”。如何点燃最后一把“火”?引导学生揭开问题的“真相”?
教师:我们重新来审视氯气与水这个反应。氯气与水反应生成了HCl,假设氯气与水按1∶1进行,从原子守恒的角度能否推测出这种未知物质的化学式?
学生:HClO或HOCl。
教师:HClO或HOCl的名称叫次氯酸。会不会氯气与水反应生成的新物质就是它呢?这种物质真的具有漂白作用吗?
教师:日常生活中我们会接触到的一些物质,比如漂白粉它具有杀菌消毒作用,它的有效成分是次氯酸钙,同时展示漂白粉、84消毒液实物(如图7)。有谁知道84消毒液的主要成分?请一位学生读一读84消毒液的说明书中涉及的成分内容“84消毒液的有效成分是次氯酸钠等”。

图7 漂白粉和84消毒液
教师:这些物质都跟什么有关?
学生:次氯酸盐。
教师:可以初步断定应该是次氯酸具有漂白性。当然,我们也可以站在前人的肩膀上,寻求教材的帮助。请同学们打开课本第43页,[2]自学氯气与水反应的相关原理,寻找真正起漂白作用的物质是什么成分?学生自学课本,寻找真相。确定氯水中真正起漂白作用的物质就是次氯酸。
5.教学环节5:学以致用
问题7:刚制备的新制氯水如何进行保存?为什么?
学生:棕色细口瓶,避光保存。因为HClO见光易分解,氯气易挥发。
教师:这是一个金鱼缸,你们看鱼儿游得多欢快呀,大家想过没有?在放入金鱼之前,往往要先把养鱼的自来水进行怎样的处理呀?
学生:这个我知道,我妈在养金鱼时,先要将自来水放在太阳下晒一晒,目的是去除水中溶解的少量氯气和生成的次氯酸。
教师:赞赏、表扬并进行课堂小结。
三、教学反思
虽说是在本校展示的公开课,有着天时地利之便,但在探究氯气与水是否发生化学反应时,笔者起初是想让学生就氯气与水是否发生反应展开讨论,然后要求学生自己设计实验来验证氯水中的可能成分,即完全开放探究。如果这样进行教学的话,对我校学生而言可能会导致问题探究过于开放、实验目的不够明确,探究时间不易把控,后续教学环节可能难以完成等诸多问题。因此,没能完全放开让学生自主进行探讨、设计实验方案并进行实验验证,有点美中不足。同时,笔者还深深体会到,在实验探究过程中要尽可能多地给学生独立思考和探讨的时间,学生汇报时不能随意打断学生的回答,要让学生把话说完整,即便出现错误,也不要急于纠正,学生能解决的就让学生自己解决,使课堂真正成为学生自主活动和探索的乐园。
实验探究中为防止氯气挥发污染环境,笔者在教学中两次使用了注射器,一是向装有氯气的试剂瓶中注入10 mL水制备氯水;二是学生在点滴板上操作与氯水有关的实验时,要求学生在实验完成后及时用表面皿进行覆盖,这样做的目的是增强学生的环保意识。最后学以致用,引导学生从化学走进生活,提出“新制的氯水如何保存?”“用自来水养金鱼之前为什么要将自来水先在太阳下晒一晒”等实际问题,让学生开展探讨,加深对所学知识的理解,也前后呼应了从身边的化学开始到身边的化学结束的教学理念。
