13种苯丙烷代谢物对6种炭疽菌的抑菌活性研究
2023-01-16吴朋朋许云凤罗丽娟蒋凌雁
吴朋朋,安 尉,许云凤,罗丽娟,蒋凌雁*
13种苯丙烷代谢物对6种炭疽菌的抑菌活性研究
吴朋朋1,安 尉2,许云凤1,罗丽娟1,蒋凌雁1*
1. 海南大学热带作物学院/海南省热带生物资源可持续利用重点实验室,海南海口 570228;2. 海南大学生命科学学院,海南海口 570228
炭疽病是广泛影响热带、亚热带植物的真菌性病害。开发绿色农药是有效防治炭疽病的重要手段。热带牧草柱花草的转录组和代谢组研究表明,苯丙烷代谢通路在响应炭疽菌侵染过程中显著上调。为评价苯丙烷代谢物的抑菌活性,本研究采用体外抑菌试验,测定了13种苯丙烷代谢物对柱花草胶孢炭疽菌、橡胶胶孢炭疽菌、大薯胶孢炭疽菌、芒果胶孢炭疽菌、番木瓜胶孢炭疽菌和橡胶尖孢炭疽菌等6种炭疽菌的菌丝生长抑制作用;进一步测定了活性较好的代谢物及其两两组合对6种炭疽菌菌丝生长和5种炭疽菌孢子萌发的抑制作用。结果表明,13种代谢物对6种炭疽菌的抑制效果不同,在500 μmol/L和1000 μmol/L的浓度下,紫檀芪对6种炭疽菌菌丝生长的抑制效果最好,高浓度时平均抑制率可达47.47%~80.74%;在1000 μmol/L的浓度下,根皮素和香豆素对6种炭疽菌菌丝生长也有一定的抑制效果,而其他9种代谢物对6种炭疽菌抑制作用较弱或者无明显抑制作用。代谢物两两组合时,含紫檀芪的代谢物组合对6种炭疽菌菌丝生长有显著的抑制作用,平均抑制率为31.07%~89.05%;紫檀芪及含紫檀芪的代谢物组合对5种炭疽菌孢子萌发有显著的抑制作用,对柱花草胶孢炭疽菌、橡胶胶孢炭疽菌、橡胶尖孢炭疽菌、芒果胶孢炭疽菌和番木瓜胶孢炭疽菌毒力最强的代谢物或组合分别为紫檀芪+根皮素、紫檀芪+阿魏酸、紫檀芪+阿魏酸、紫檀芪+根皮素、紫檀芪,IC50值分别为293.475、67.660、184.764、108.671、68.417 μmol/L。本文所发掘的代谢物及其组合可为进一步研究防治炭疽病的绿色农药提供理论基础。
苯丙烷代谢物;炭疽菌;抑菌活性
炭疽菌属()真菌广泛分布于热带和亚热带植物[1],其寄主广泛,可引发荔枝[2]、芒果[3]、橡胶[4]和柱花草[5]等重要热带和亚热带作物的炭疽病危害,造成巨大经济损失。炭疽菌不仅在植株生长发育过程中引起炭疽病病害,也在水果采后储存过程中引发病害[6]。目前,植物炭疽病的防治主要采用化学杀菌剂[7]。但是,化学杀菌剂的长期使用会在土壤中残留大量农药,造成环境污染,危害人类健康,且会使炭疽菌产生抗药性[8]。因此,开发绿色生物防治技术极为重要。
生物防治是指利用有益生物或者生物代谢产物来防治植物病害的各种措施,其中生物农药是近几年的研究热点[7]。目前我国已有一些植物源农药被登记,如丁子香酚、藜芦碱、香芹酚和蛇床子素等[9]。王忠兴等[10]研究发现丁子香芹酚对葡萄灰霉病防治效果明显,能有效控制灰霉病发生危害;石洁等[11]研究表明丁子香酚、苦参碱对葡萄炭疽病防治效果显著,防治效果均高于80%。苯丙烷代谢途径是植物重要的代谢途径,产生的代谢物超过8000种[12],在抵御病原菌侵袭方面发挥着重要作用[13]。苯丙烷代谢物的植物抗病研究已取得一定进展。BEYER等[14]研究发现,东莨菪碱可保护大豆免受侵害。LIU等[15]研究了木犀草素的抑菌活性,发现100 mg/L或200 mg/L的木犀草素可抑制灰葡萄孢和青霉菌的生长,保持樱桃果实采后的品质。ZHANG等[16]探究了咖啡酸对苹果灰霉病的防治效果和机制,发现注射300 mg/L的咖啡酸可有效降低苹果发病率和病斑直径;同时,咖啡酸处理也有效促进了木质素的积累,从而抑制苹果灰霉病。YANG等[17-18]研究了瑞香素和6-甲基香豆素对青枯菌的抑制活性,瑞香素在10 mg/L和25 mg/L时,可显著抑制青枯菌生物膜形成;在100 mg/L时,6-甲基香豆素对青枯菌的抑制率为74.28%。ROY等[19]研究了咖啡酸、阿魏酸、4-香豆酸、柚皮素和槲皮素等对10种炭疽菌的抑制活性,发现只有阿魏酸和4-香豆酸可抑制真菌生长,且抑制作用呈现浓度依赖性。因此,利用苯丙烷代谢物开发植物源农药具有良好的前景。
本研究基于前期转录组和代谢组研究[20],挑选出根皮素、柚皮素、芹菜素、大豆苷元、紫檀芪、阿魏酸、香豆素、芒柄花黄素、白藜芦醇、芥子酸、咖啡酸、木犀草素和4-香豆酸等13种苯丙烷代谢途径中的代谢物,购买其商业化的产品,检测对6种从热带作物中分离出来的炭疽菌菌丝生长和孢子萌发的抑制作用,筛选出具有较好抑菌活性的代谢物,为后续开发外源绿色抑菌剂提供依据。
1 材料与方法
1.1 材料
13种苯丙烷代谢物:芒柄花黄素(纯度≥98%)、白藜芦醇(纯度≥98%)、芥子酸(纯度≥97%)、咖啡酸(纯度≥98%)、柚皮素(纯度≥98%)购于上海源叶生物科技有限公司),4-香豆酸(纯度≥98%)、紫檀芪(纯度≥97%)、木犀草素(纯度≥98%)、大豆苷元(纯度≥97%)、芹菜素(纯度≥97%)购于上海麦克林生化科技有限公司,香豆素(纯度≥99%)、阿魏酸(纯度≥99%)、根皮素(纯度≥98%)购于上海阿拉丁生化科技股份有限公司。
6种供试菌株:柱花草胶孢炭疽菌()、橡胶胶孢炭疽菌()、橡胶尖孢炭疽菌()、大薯胶孢炭疽菌()、番木瓜胶孢炭疽菌()和芒果胶孢炭疽菌(),均为本实验室前期分离纯化保存的菌株。
1.2 方法
1.2.1 体外抑菌试验 采用生长速率法[21]测定13种苯丙烷代谢物对炭疽菌的抑制作用,并与乙醇或二甲基亚砜(DMSO)溶剂对照,其中香豆素、紫檀芪、阿魏酸、根皮素溶剂为乙醇,其余代谢物溶剂为DMSO。将不同浓度的代谢物分别加入PDA培养基中,倒入9 mm的培养皿中,待平板冷却后在中间放置直径一致的炭疽菌菌块,28℃倒置培养。采用十字交叉法测量6 d菌落直径,每次试验重复3次。根据菌落直径计算菌丝生长抑制率:

根据单一代谢物抑制率,选取抑制效果好的代谢物进行两两组合体外抑菌试验,方法同上。
1.2.2 孢子萌发试验 采用水琼脂玻片法[22]测定苯丙烷代谢物对炭疽菌孢子萌发的抑制作用。孢子悬浮液的制备:将炭疽菌菌丝于CM培养基(配方同TALBOT等[23])中,培养3 d后,用两层纱布过滤,将得到的孢子悬浮液离心,用无菌水重悬,并将孢子悬浮液浓度调整为106个/mL。孢子萌发试验:将不同浓度(0、100、250、500、1000 μmol/L)的代谢物分别加入到孢子悬浮液中,吸取40 μL混合液滴加到水琼脂玻片上,以溶剂作为对照,28℃培养3 h后镜检,随机选取5个视野,每个视野中孢子数约为80~100个,统计孢子萌发数。根据以下公式计算孢子萌发率和孢子萌发抑制率:


参照周子骞等[24]的方法,以代谢物浓度的对数值()和抑制率的几率值()构建毒力回归方程,并计算相关系数和半抑制浓度(IC50)。
1.3 数据处理
试验数据利用SPSS 20软件和Microsoft Excel 2016软件进行处理,采用Duncan法对数据进行单因素方差分析(<0.05);采用probit回归模型构建不同代谢物对5种炭疽菌孢子萌发抑制率的毒力回归方程,并计算IC50值。试验数据用平均值±标准误(SE)表示。
2 结果与分析
2.1 13种苯丙烷代谢物对6种炭疽菌菌丝生长的抑制作用
从表1可见,13种苯丙烷代谢物对6种炭疽菌菌丝生长的抑制效果差异较大,且代谢物浓度对抑菌效果有影响。500 μmol/L处理后,紫檀芪对6种炭疽菌的平均抑制率均大于45%,最高为对橡胶尖孢炭疽菌,达到77.71%;根皮素对橡胶尖孢炭疽菌和大薯胶孢炭疽菌的平均抑制率分别大于42%和23%;柚皮素对大薯胶孢炭疽菌、芒果胶孢炭疽菌和番木瓜胶孢炭疽的平均抑制率大于或接近20%,分别为28.82%、20.68%和19.95%;白藜芦醇对大薯胶孢炭疽菌的平均抑制率大于24%;阿魏酸对橡胶尖孢炭疽菌的平均抑制率大于21%;其余情况的平均抑菌率均低于20%。1000 μmol/L处理后,紫檀芪和根皮素对6种炭疽菌的抑制率均高于500 μmol/L处理,其中紫檀芪的平均抑制率均大于47%,最高为80.74%;根皮素对柱花草胶孢炭疽菌、橡胶胶孢炭疽菌、大薯胶孢炭疽菌和橡胶尖孢炭疽菌的平均抑制率均大于20%,对橡胶尖孢炭疽菌的平均抑制率最高为47.52%。其余情况与500 μmol/L处理相比,对6种炭疽菌的抑制率有的提高、有的降低或变化不大,其中香豆素的抑制率明显提高,对橡胶胶孢炭疽菌、大薯胶孢炭疽菌和番木瓜胶孢炭疽菌的平均抑制率均超过20%;阿魏酸对柱花草胶孢炭疽菌、橡胶尖孢炭疽菌和白藜芦醇对大薯胶孢炭疽菌的抑制率也明显提高,平均抑制率分别大于24%、30%和35%;但柚皮素对大薯胶孢炭疽菌和番木瓜胶孢炭疽菌的抑制率变化不大。紫檀芪、根皮素、香豆素、柚皮素、阿魏酸和白藜芦醇等6种代谢物对全部或部分炭疽菌菌丝生长具有较好的抑制效果,其中紫檀芪对菌丝生长的抑制效果最好。图1为菌丝抑制效果较好的4种代谢物1000 μmol/L处理6 d的菌丝图片。

2.2 代谢物组合对6种炭疽菌的抑制效果
以对菌丝抑制效果较好的紫檀芪、香豆素、阿魏酸、根皮素、柚皮素和白藜芦醇等6种代谢物为供试材料,进一步测定其两两组合对6种炭疽菌的抑制效果。由表2可知,7种组合对6种炭疽菌菌丝都有一定的抑制效果,且与浓度成正相关,表现出浓度依赖性。其中紫檀芪+阿魏酸组合的抑制效果最好,对6种炭疽菌菌丝的抑制率都达到了50%以上。3种含紫檀芪的组合(紫檀芪+根皮素、紫檀芪+阿魏酸、紫檀芪+香豆素)对6种炭疽菌的抑制效果较好,平均抑制率为31.07%~89.05%;除紫檀芪+根皮素对大薯胶孢炭疽菌,以及紫檀芪+香豆素对柱花草胶孢炭疽菌、大薯胶孢炭疽菌外,其余的抑制作用均等于或优于单独一种代谢物使用。4种不含紫檀芪的组合对炭疽菌菌丝抑制效果差异较大,有的优于单一代谢物,有的没有单一代谢物的抑制效果明显。
2.3 代谢物及其两两组合对5种炭疽菌孢子萌发的抑制作用
代谢物及其两两组合处理3 h后的炭疽菌孢子萌发结果显示(表3),代谢物单独使用时,6种代谢物对不同炭疽菌孢子萌发具有不同的抑制效果。其中紫檀芪抑制效果最为明显,与空白对照相比,对5种炭疽菌孢子萌发的平均抑制率均大于98%;其余5种代谢物,除了根皮素和香豆素对番木瓜胶孢炭疽菌孢子萌发平均抑制率达到50%以上,以及白藜芦醇对柱花草胶孢炭疽菌孢子萌发平均抑制率为47.50%接近50%之外,其余的抑制效果相对较差,平均抑制率均小于36%。代谢物两两组合时,含紫檀芪的3种组合(紫檀芪+阿魏酸、紫檀芪+根皮素、紫檀芪+香豆素)对5种炭疽菌孢子萌发抑制效果显著,除紫檀芪+阿魏酸对橡胶尖孢炭疽菌抑制率为89.52%,其余的平均抑制率均达到90%以上;不含紫檀芪的4种组合(根皮素+阿魏酸、根皮素+香豆素、香豆素+阿魏酸、白藜芦醇+柚皮素)对5种炭疽菌孢子萌发的抑制效果差异较大,其中对番木瓜胶孢炭疽菌孢子萌发有一定抑制效果,抑制率均在40%以上,而对橡胶胶孢炭疽菌、橡胶尖孢炭疽菌和芒果胶孢炭疽菌的抑制效果较差,抑制率小于或等于20%。

图1 4种代谢物(1000 μmol/L)处理6 d后不同炭疽菌菌丝生长状态
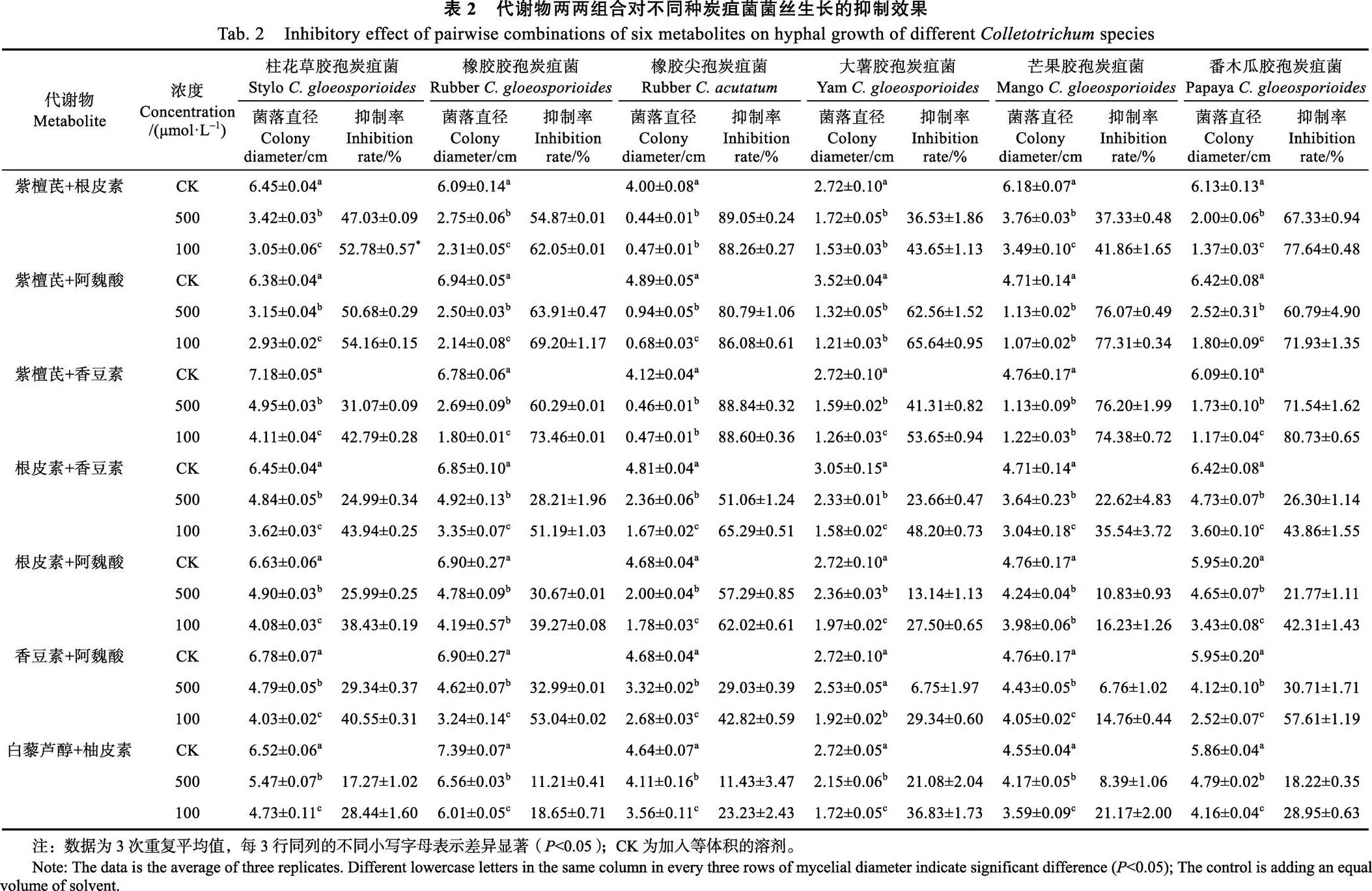
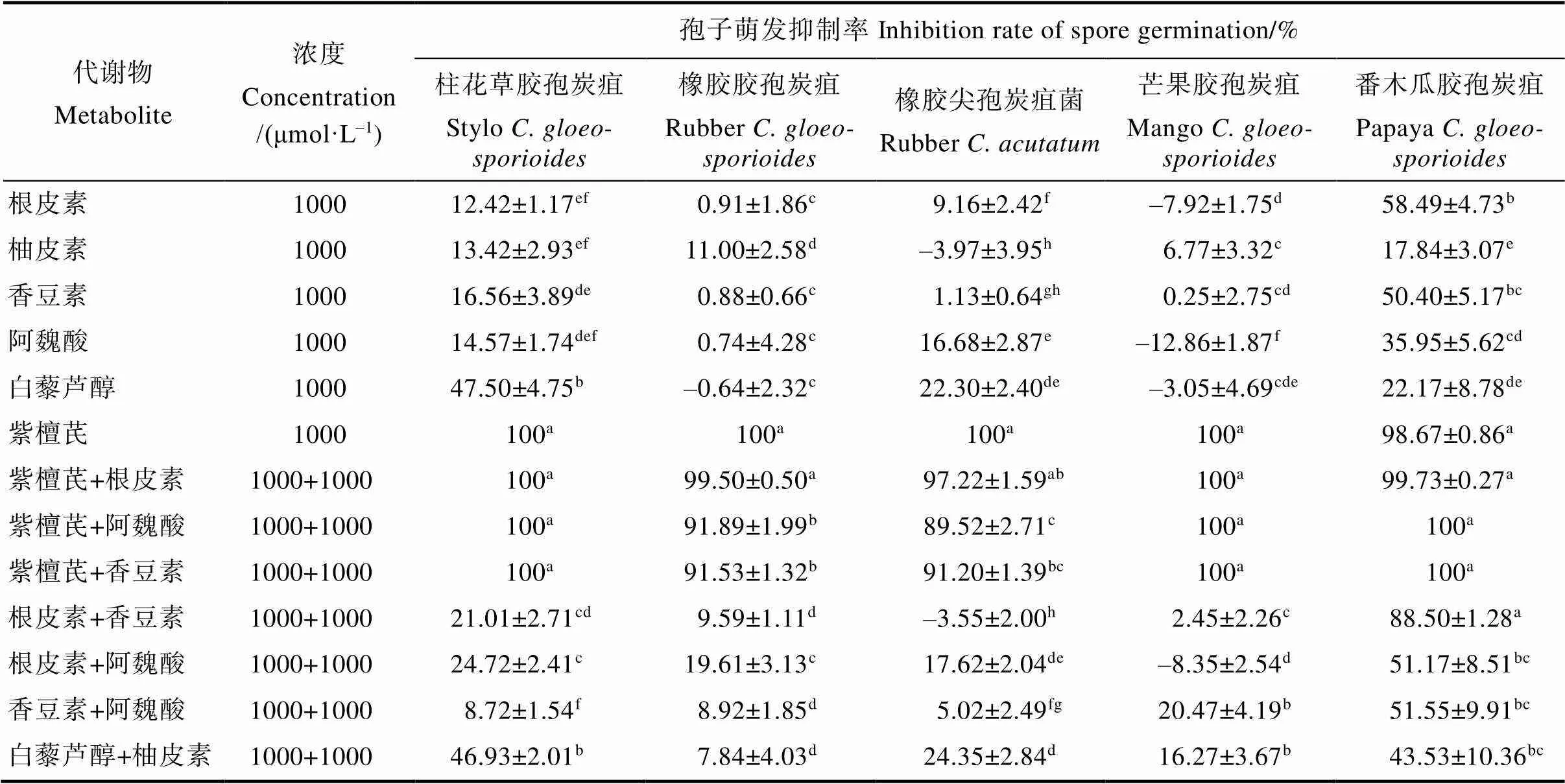
表3 6种代谢物及其两两组合对5种炭疽菌孢子萌发抑制率
注:数据为平均值±标准误,归一化为溶剂对照组的抑制率为0;同列不同小写字母表示差异显著(<0.05)。
Note: The data is the mean±, normalized to the inhibition rate of the solvent control group is 0; Different lowercase letters in the same column indicate significant difference (<0.05).
2.4 紫檀芪及其组合对5种炭疽菌孢子萌发的毒力测定
根据以上结果,测定了紫檀芪及含紫檀芪的3种组合对5种炭疽菌孢子萌发的毒力方程,结果表明(表4),4种代谢物组合的摩尔浓度对数()与孢子萌发抑制率的几率值()近似呈线性正相关,相关系数除紫檀芪+阿魏酸组合对橡胶尖孢炭疽菌和芒果胶孢炭疽菌分别为0.868和0.850之外,其余均大于0.9,即相关性较好。对柱花草胶孢炭疽菌,紫檀芪+根皮素组合毒力最强,IC50值最小,为293.475 μmol/L,而紫檀芪、紫檀芪+阿魏酸和紫檀芪+香豆素组合毒力较弱,IC50值分别为422.046 μmol/L、536.712 μmol/L和500.808 μmol/L。对橡胶胶孢炭疽菌和橡胶尖孢炭疽菌,紫檀芪+阿魏酸组合毒力最强,IC50值分别为67.660 μmol/L和184.764 μmol/L;紫檀芪+香豆素组合对橡胶尖孢炭疽菌的毒力最弱,IC50值为364.661 μmol/L。对芒果胶孢炭疽菌,紫檀芪+根皮素组合毒力最强,IC50值为108.671 μmol/L;紫檀芪+阿魏酸组合毒力最弱,IC50值为418.270 μmol/L;紫檀芪和紫檀芪+香豆素组合毒力相近,IC50值分别为132.884 μmol/L和162.851 μmol/L。对番木瓜胶孢炭疽菌,紫檀芪毒力最强,IC50值为68.417 μmol/L;紫檀芪+阿魏酸组合毒力最弱,IC50值约为213.844 μmol/L;紫檀芪+根皮素和紫檀芪+香豆素组合毒力相当,IC50值分别为84.905 μmol/L和86.662 μmol/L。
综上所述,紫檀芪及3种含紫檀芪代谢物组合对不同的炭疽菌的毒力不同。对柱花草胶孢炭疽菌、橡胶胶孢炭疽菌、橡胶尖孢炭疽菌、芒果胶孢炭疽菌和番木瓜胶孢炭疽菌毒力最强的代谢物或组合分别为紫檀芪+根皮素、紫檀芪+阿魏酸、紫檀芪+阿魏酸、紫檀芪+根皮素和紫檀芪。
3 讨论
炭疽病是危害热带作物的重要病害,可侵染橡胶、芒果、番木瓜、大薯和柱花草等热带作物,造成巨大经济损失[5, 25-28]。目前,炭疽病的防治主要采用化学杀菌剂[24, 29-30],长期使用化学杀菌剂会造成环境污染,危害人类健康,因此急需开发绿色生物抑菌剂。本文以6种从重要热带经济作物上分离的炭疽菌为供试菌株,研究了13种苯丙烷代谢物的抑菌效果。体外抑菌试验和孢子萌发试验结果表明,根皮素、香豆素、阿魏酸、紫檀芪及其两两组合对6种炭疽菌菌丝生长和孢子萌发均有不同程度的抑制效果,其中紫檀芪及其组合表现出最好的抑菌活性。
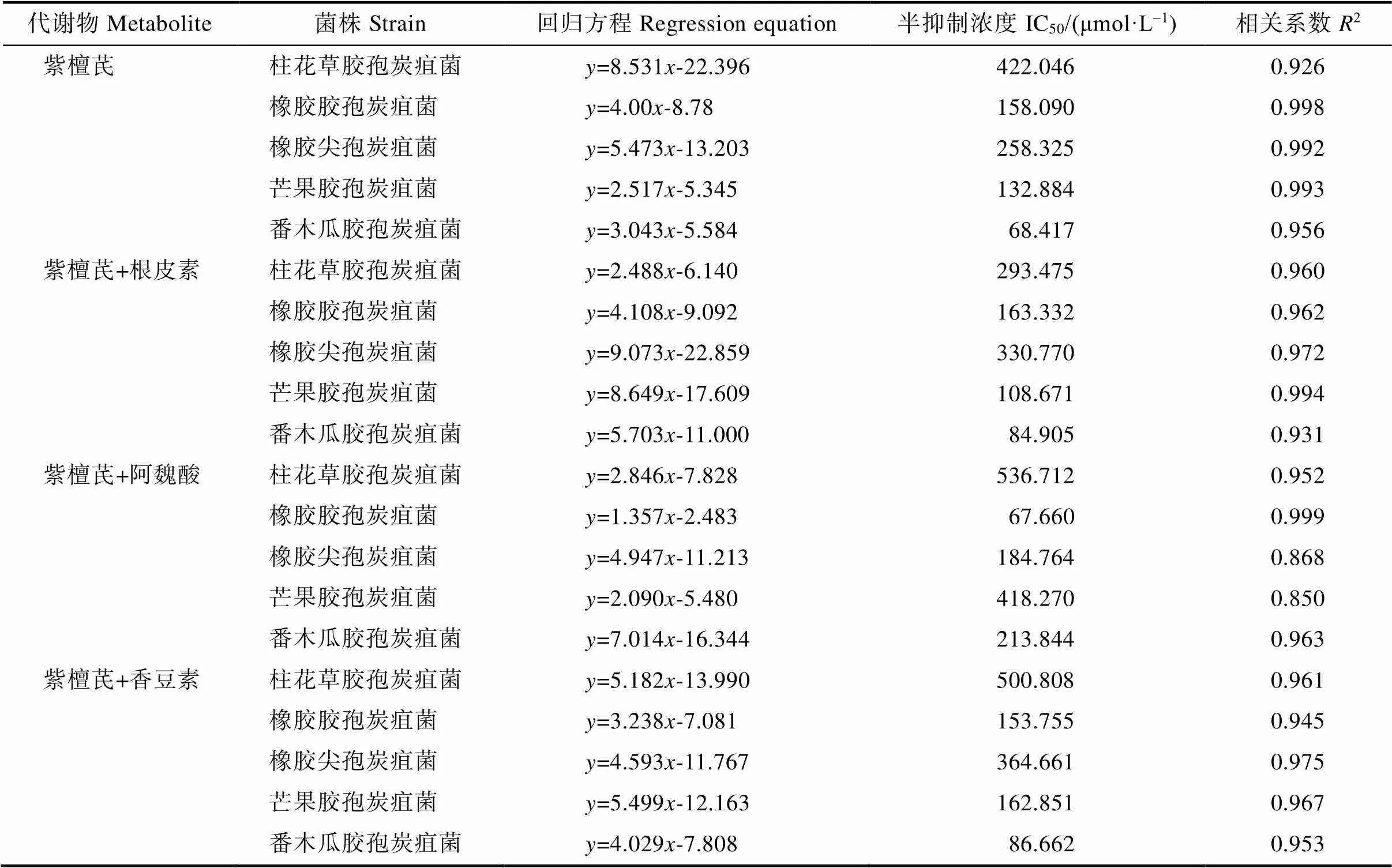
表4 4种处理对5种炭疽菌孢子萌发的毒力
目前,尚无关于紫檀芪对炭疽菌抑制作用的报道,但已有紫檀芪对其他病原菌抑制作用的研究。LYGIN等[31]研究表明,25 μg/mL紫檀芪对菜豆壳球孢菌、立枯丝核菌和核盘菌抑制效果显著,对菌落生长面积抑制效果超过50%;XU等[32]研究发现,紫檀芪对荔枝假单胞菌孢子IC50约为6.8 mg/L;ROY等[19]研究结果表明,50 μmol/L的反式肉桂醛可以抑制炭疽菌菌丝生长;黄小兰等[33]的研究显示,2 mg/mL对羟基苯甲酸对胶孢炭疽菌的抑制效果较好,达到了98%。对于已经被登记的植物源农药香芹酚和丁香酚[9],杨婷等[34]的研究结果表明,400 μg/mL的香芹酚和异丁香酚对炭疽菌具有较好的抑菌活性,且2种化合物对胶孢炭疽菌的IC50分别为40.89 μg/mL和42.95 μg/mL;周丹丹等[35]研究了丁香酚对尖孢炭疽菌孢子萌发的抑制作用,结果显示当丁香酚含量≥5 μL/L,对孢子萌发的抑制效果达到70%以上。在本研究中,500 μmol/L紫檀芪处理后,对6种炭疽菌菌丝生长的抑制作用均达到45%以上,其中对橡胶尖孢炭疽菌的抑制率达到77%;1000 μmol/L处理后,对6种炭疽菌孢子萌发的抑制率达到98%以上。毒力方程结果显示,紫檀芪对供试的5种炭疽菌孢子萌发抑制率IC50值为68.417~422.046 μmol/L。说明紫檀芪在抑制炭疽菌生长和孢子萌发上具有一定优势。
紫檀芪具有抗氧化、抗细胞增殖和抗真菌等作用[36],但关于紫檀芪如何抗炭疽病的机制尚无相关报道。XU等[32]通过Sytox green染色进行膜透化发现,的孢子和菌丝细胞在紫檀芪处理后显示出强荧光,说明紫檀芪通过破坏生物膜从而对荔枝霜霉病病原菌起到抑制作用。KOLOUCHOVÁ等[37]的研究也表明,紫檀芪通过抑制生物膜代谢活性从而抑制表皮葡萄球菌、白色念珠菌和大肠杆菌。PEZET等[38]通过显微观察发现紫檀芪可以破坏灰霉菌分生孢子的胞体、内质网、线粒体膜和核膜,从而抑制灰霉菌孢子萌发。因此,推测紫檀芪也可能通过破坏炭疽菌细胞膜、线粒体膜和核膜来抑制孢子萌发,从而抑制菌丝生长。后续可以通过荧光染色、显微观察等生物学手段作进一步研究,以更深入了解紫檀芪对炭疽菌的作用机制。
4 结论
本研究通过体外抑菌试验和孢子萌发试验探究了13种苯丙烷代谢物的抑菌活性。结果表明,紫檀芪及3种含紫檀芪的组合(紫檀芪+根皮素、紫檀芪+阿魏酸、紫檀芪+香豆素)对6种炭疽菌菌丝生长和5种孢子萌发均有较好的抑制活性。紫檀芪在防治植物炭疽病中具有潜在价值,可对其抑菌机制进行更深入的研究,为开发植物源农药提供理论基础。
[1] CANNON P F, DAMM U, JOHNSTON P R, WEIR B S. Colletotrichum-current status and future directions[J]. Studies in Mycology, 2012, 73: 181-213.
[2] 李少卡, 赵 亚, 王祥和, 胡福初, 陈 哲, 范鸿雁. 海南荔枝炭疽病病原菌鉴定及遗传多样性分析[J]. 农业生物技术学报, 2021, 29(4): 673-687.
LI S K, ZHAO Y, WANG X H, HU F C, CHEN Z, FAN H Y. Identification and genetic diversity analysis ofspp. in Hainan[J]. Journal of Agricultural Biotechnology, 2021, 29(4): 673-687. (in Chinese)
[3] 李其利, 卜俊燕, 唐利华, 黄穗萍, 郭堂勋, 莫贱友. 芒果炭疽菌研究进展[J]. 微生物学杂志, 2020, 40(1): 117-124.
LI Q L, BU J Y, TANG L H, HUANG S P, GUO T X, MO J Y. Advances in mango anthracnose ()[J]. Journal of Microbiology, 2020, 40(1): 117-124. (in Chinese)
[4] 蔡志英, 李加智, 王进强, 张春霞, 何明霞, 贺丽琼. 橡胶胶孢炭疽菌和尖孢炭疽菌对杀菌剂的敏感性测定[J]. 云南农业大学学报, 2008, 23(6): 787-790.
CAI Z Y, LI J Z, WANG J Q, ZHANG C X, HE M X, HE L Q. Sensitivity test ofandisolated from rubber to the fungicides[J]. Journal of Yunnan Agricultural University, 2008, 23(6): 787-790. (in Chinese)
[5] 易克贤. 柱花草炭疽病及其抗病育种进展[J]. 中国草地, 2001, 23(4): 59-65.
YI K X. Stylo anthracnose and current research progresses on anthracnose resistance breeding[J]. Grassland China, 2001, 23(4): 59-65. (in Chinese)
[6] DEAN R, KAN J, PRETORIUS Z A, HAMMOND- KOSACK K E, PIETRO A D, SPANU P D, RUDD J J, DICKMAN M, KAHMANN R, ELLIS J. The Top 10 fungal pathogens in molecular plant pathology[J]. Molecular Plant Pathology, 2012, 13(7): 804.
[7] 刘丽萍, 高 洁, 李 玉. 植物炭疽菌属真菌研究进展[J]. 菌物研究, 2020, 18(4): 266-281.
LIU L P, GAO J, LI Y. Advances in knowledge of the fungi referred to the genus[J]. Journal of Fungal Research, 2020, 18(4): 266-281. (in Chinese)
[8] 李 河, 李司政, 王悦辰, 刘君昂, 徐建平, 周国英. 油茶苗圃炭疽病原菌鉴定及抗药性[J]. 林业科学, 2019, 55(5): 85-94.
LI H, LI S Z, WANG Y C, LIU J A, XU J P, ZHOU G Y. Identification of the pathogens causing anthracnose ofin nursery and their resistence to fungicides[J]. Scienta Silve Sinicae, 2019, 55(5): 85-94. (in Chinese)
[9] 张正炜, 郗厚诚, 常文程, 黄璐璐, 陈 秀. 我国植物源农药商品化应用现状及产业发展建议[J]. 世界农药, 2020, 42(12): 6-15.
ZHANG Z W, XI H C, CHANG W C, HUANG L L, CHEN X. Current situation of commercialized application of plant-derived pesticides in China and suggestions for industrial development[J]. World Pesticides, 2020, 42(12): 6-15. (in Chinese)
[10] 王忠兴, 魏芸娜, 顾沛雯. 几种植物源和微生物源药剂对葡萄灰霉菌的毒力测定及田间防效[J]. 北方园艺, 2019(15): 55-60.
WANG Z X, WEI Y N, GU P W. The toxicity and control effect of several botanical and biological's pesticides against[J]. Northern Horticulture, 2019(15): 55-60. (in Chinese)
[11] 石 洁, 李宝燕, 栾炳辉, 李凌云, 田园园, 王英姿. 5种生物药剂对葡萄炭疽病药效研究[J]. 中国果树, 2021(1): 74-76.
SHI J, LI B Y, LUAN B H, LI L Y, TIAN Y Y, WANG Y Z. Study on the control effect of five biological fungicides on grape anthracnose[J]. China Fruits, 2021(1): 74-76. (in Chinese)
[12] DONG N Q, LIN H X. Contribution of phenylpropanoid metabolism to plant development and plant-environment interactions[J]. Journal of Integrative Plant Biology, 2021, 63(1): 180-209.
[13] NAOUMKINA M A, ZHAO Q, GALLEGO‐GIRALDO L, DAI X, ZHAO P X, DIXON R A. Genome-wide analysis of phenylpropanoid defence pathways[J]. Molecular Plant Pathology, 2010, 11(6): 829-846.
[14] BEYER S F, BEESLEY A, ROHMANN P F W, SCHULTHEISS H, LANGENBACH C. Thenon-host defence-associated coumarin scopoletin protects soybean from Asian soybean rust[J]. The Plant Journal, 2019, 99(3): 397-413.
[15] LIU X, CUI X, JI D, ZHANG Z, TIAN S. Luteolin-induced activation of the phenylpropanoid metabolic pathway contributes to quality maintenance and disease resistance of sweet cherry[J]. Food Chemistry, 2021, 342: 128309.
[16] ZHANG M Y, WANG D J, GAO X X, YUE Z Y, ZHOU H L. Exogenous caffeic acid and epicatechin enhance resistance againstthrough activation of the phenylpropanoid pathway in apples[J]. Scientia Horticulturae, 2020, 268: 109348.
[17] YANG L, WANG Y, HE X B, XIAO QL, HAN ST, JIA Z, LI S L, DING W. Discovery of a novel plant-derived agent againstby targeting the bacterial division protein FtsZ[J]. Pesticide Biochemistry and Physiology, 2021, 177: 104892.
[18] YANG L, WEI Z L, LI S L, XIAO R, XU Q Q, RAN Y, DING W. Plant secondary metabolite, daphnetin reduces extracellular polysaccharides production and virulence factors of[J]. Pesticide Biochemistry and Physiology, 2021, 179: 104948.
[19] ROY S, NUCKLES E, ARCHBOLD D D. Effects of phenolic compounds on growth ofspp[J]. Current Microbiology, 2018, 75(5): 550-556.
[20] JIANG L Y, WU P P, YANG L Y, LIU C, GUO P F, WANG H, WANG S C, XU F P, ZHUANG Q W, TONG X Z, LIU P D, LUO L J. Transcriptomics and metabolomics reveal the induction of flavonoid biosynthesis pathway in the interaction of[J]. Genomics, 2021, 113(4): 2702-2716.
[21] 陈年春. 农药生物测定技术农药植保专业用[M]. 北京: 北京农业大学出版社, 1991.
CHEN N C. Pesticide bioassay technology for pesticide plant protection specialty[M]. Beijing: Beijing Agricultural University Press, 1991. (in Chinese)
[22] 方中达. 植病研究方法[M]. 3版. 北京: 中国农业出版社, 1998.
FANG Z D. Research methods of plant diseases[M]. 3rd edition. Beijing: China Agriculture Press, 1998. (in Chinese)
[23] TALBOT N J, EBBOLE D J, HAMER J E. Identification and characterization of, a gene involved in pathogenicity from the rice blast fungus[J]. Plant Cell, 1993, 5(11): 1575-1590.
[24] 周子骞, 李 敏, 高兆银, 王 义, 洪小雨, 李春霞, 胡美姣. 海南番木瓜炭疽病病原菌鉴定及其防治药剂筛选[J]. 西南农业学报, 2020, 33(1): 70-76.
ZHOU Z Q, LI M, GAO Z Y, WANG Y, HONG X Y, LI C X, HU M J. Pathogens identification and fungicide screening of papaya fruit anthrocnose in Hainan[J]. Southwest China Journal of Agricultural Sciences, 2020, 33(1): 70-76. (in Chinese)
[25] 曹学仁, 车海彦, 杨 毅, 罗大全. 2014年海南省橡胶炭疽病菌对多菌灵和咪鲜胺的敏感性测定[J]. 植物病理学报, 2015, 45(6): 626-631.
CAO X R, CHE H Y, YANG Y, LUO D Q. Sensitivity ofspp. fromto carbendazim and prochloraz in Hainan province in China in 2014[J]. Acta Phytopathologica Sinica, 2015, 45(6): 626-631. (in Chinese)
[26] 王万东, 刘光华, 尼章光, 罗心平, 俞艳春. 芒果炭疽病的发生规律及综合防治[J]. 广东农业科学, 2008, 35(6): 67-69.
WANG W D, LIU G H, NI Z G, LUO X P, YU Y C. Pathogenesis and comprehensive treatments of mango anthracnose[J]. Guangdong Agricultural Sciences, 2008, 35(6): 67-69. (in Chinese)
[27] 王雅君, 邵远志, 何文琪, 尤文静, 葛春晖, 李 雯. 采后番木瓜果实炭疽病病原菌分离鉴定及其拮抗菌的筛选[J]. 食品工业科技, 2020, 41(6): 111-118, 130.
WANG Y J, SHAO Y Z, HE W Q, YOU W J, GE C H, LI W. Isolation and identification of anthracnose pathogen in postharvest papaya fruits and screening of the antagonistic bacteria[J]. Science and Technology of Food Industry, 2020, 41(6): 111-118, 130. (in Chinese)
[28] WINCH J E, NEWHOOK F J, JACKSON G V H, COLE J S. Studies ofdisease on yam,, in Solomon Islands[J]. Plant Pathology, 1984, 33(4): 467-477.
[29] 张俊有, 蒋家珍. 采用半果接种法研究几种杀菌剂对芒果炭疽病的防治效果[J]. 江苏农业科学, 2020, 48(24): 102-107.
ZHANG J Y, JIANG J Z. Study on control efficacy of several fungicides on mango anthracnose by semi-fruit inoculation method[J]. Jiangsu Agricultural Sciences, 2020, 48(24): 102-107. (in Chinese)
[30] 林春花, 徐 轩, 戈玉琪, 牟保辉, 刘文波, 缪卫国, 郑服丛. 中国2种橡胶树炭疽病菌对咪鲜胺敏感性比较[J]. 热带作物学报, 2017, 38(1): 111-115.
LIN C H, XU X, GE Y Q, MOU B H, LIU W B, MIAO W G, ZHENG F C. Comparison of sensitivity between twospecies fromto prochloraz in China[J]. Chinese Journal of Tropical Crops, 2017, 38(1): 111-115. (in Chinese)
[31] LYGIN A V, HILL C B, PAWLOWSKI M, ZERNOVA O V, WIDHOLM J M, HARTMAN G, LOZOVAYA V V. Inhibitory effects of stilbenes on the growth of three soybean pathogens in culture[J]. Phytopathology, 2014, 104(8): 843-850.
[32] XU D, DENG Y, XI P, ZHU Z, KONG X, WAN L, SITU J, LI M, GAO L, JIANG Z. Biological activity of pterostilbene against, the litchi downy blight pathogen[J]. Postharvest Biology and Technology, 2018, 144: 29-35.
[33] 黄小兰, 盖智星, 王日葵, 贺明阳, 韩 冷, 周 炼. 对羟基苯甲酸处理对采后柑橘炭疽病的抑制及机理研究[J]. 食品与机械, 2016, 32(9): 121-125, 208.
HUANG X L, GAI Z X, WANG R K, HE M Y, HAN L, ZHOU L. Mechanism and inhibitory effect of p-hydrxybenzoic acid on anthracnose in postharvest citrus[J]. Food and Machinery, 2016, 32(9): 121-125, 208. (in Chinese)
[34] 杨 婷, 史红安, 李聪丽, 李建华, 王立华, 李国元, 张志林. 13种萜类化合物对胶孢炭疽菌和链格孢的抑制活性[J]. 植物保护, 2017, 43(2): 192-195.
YANG T, SHI H A, LI C L, LI J H, WANG L H, LI G Y, ZHANG Z L. Antifungal activity of 13 terpenoid compounds againstandsp[J]. Plant Protection, 2017, 43(2): 192-195. (in Chinese)
[35] 周丹丹, 王 卓, 邢梦珂, 屠 康, 周程雁. 植物精油抑制炭疽菌及对枇杷采后炭疽病与品质的影响[J]. 食品科学, 2017, 38(19): 212-217.
ZHOU D D, WANG Z, XING M K, TU K, ZHOU C Y. Inhibitory effect of plant essential oils on colletorichum acutatum and postharvest anthracnose and quality of loquat fruits[J]. Food Science, 2017, 38(19): 212-217. (in Chinese)
[36] 王娅宁, 尉亚辉, 郝浩永, 姬婧媛. 白藜芦醇代谢物的研究进展[J]. 西北植物学报, 2007, 27(4): 4852-4857.
WANG Y N, WEI Y H, HAO H Y, JI J Y. Advances in the research of resveratrol metabolins[J]. Acta Botanica Boreali-occidentalia Sinica, 2007, 27(4): 4852-4857. (in Chinese)
[37] KOLOUCHOVÁ I, MAŤÁTKOVÁ O, PALDRYCHOVÁ M, KODEŠ Z, KVASNIČKOVÁ E, SIGLER K, ČEJKOVÁ A, ŠMIDRKAL J, DEMNEROVÁ K, MASÁK J. Resveratrol, pterostilbene, and baicalein: plant-derived anti-biofilm agents[J]. Folia Microbiologica, 2018, 63(3): 261-272.
[38] PEZET R, PONT V. Ultrastructural observations of pterostilbene fungitoxicity in dormant conidia ofpers[J]. Journal of Phytopathology, 1990, 129(1): 19-30.
Antifungal Activity of 13 Phenylpropanoid Metabolites Against SixSpecies
WU Pengpeng1, AN Wei2, XU Yunfeng1, LUO Lijuan1, JIANG Lingyan1*
1. College of Tropical Crops, Hainan University / Key Laboratory of Sustainable Utilization of Tropical Biological Resources of Hainan Province, Haikou, Hainan 570228, China; 2. College of Life Science, Hainan University, Haikou, Hainan 570228, China
is a fungal pathogen which causes a destructive disease called anthracnose and affects a wide range of tropical crop plants. Development of green pesticide is important for the prevention and control of anthracnose disease. Early transcriptome and metabolome studies of stylo (spp.) have shown that the phenylpropanoid metabolic pathway is significantly up-regulated in response toinfection.In this study, anantifungal test was used to determine the inhibitory effects of 13 phenylpropanoid metabolites on the mycelial growth of six Cspecies, including stylo, rubber, rubber, yam, mangoand papayaThe metabolites with higher inhibitory effects and the pairwise combinations were used to test the activity on the inhibition of the mycelial growth of sixspecies. In addition, the effects on conidial germination of fivespecies were also examined using the metabolites and their pairwise combinations. The results showed that 13 metabolites displayed different inhibitory effects on the sixspecies. Among all the tested metabolites, pterostilbene had the best inhibitory effect on the mycelial growth of the sixspecies at both 500 μmol/L and 1000 μmol/L. The inhibition rates of pterostilbene ranged from 47.47% to 80.74% at 1000 μmol/L. Phloretin and coumarin also showed inhibitory effects on the mycelial growth of the sixspecies at a 1000 μmol/L, but the rest nine metabolites did not show significant inhibitory effects. Then, pterostilbene, phloretin, coumarin, ferulic acid, naringin, resveratrol were combined in pair to test the effects on the mycelial growth and conidial germination of the six. The results showed the combinations containing pterostilbene had a significant inhibitory effect on the mycelial growth of the sixspecies, and the inhibition rates ranging from 31.07% to 89.05%. For the conidial germination, pterostilbene and its combinations showed a significant inhibitory effect on five. Therefore, the IC50values of pterostilbene and its combinations on conidial germination of fivespecies were determined. Overall, the metabolites or combinations with best inhibition effects on stylo, rubber, rubber, mangoand papayawere pterostilbene+phloretin, pterostilbene+ferulic acid, pterostilbene+ferulic acid, pterostilbene+phloretin and pterostilbene with IC50values of 293.475 μmol/L, 67.660 μmol/L, 184.764 μmol/L, 108.671 μmol/L and 68.417 μmol/L, respectively. The metabolites and its combination identified from this study could provide candidates for further development of green pesticide.
phenylpropanoid metabolite;; antifungal activity
S432.1
A
10.3969/j.issn.1000-2561.2022.12.014
2022-01-27;
2022-03-26
海南省自然科学基金高层次人才项目(No. 320RC466);中国科协青年人才托举工程第六届项目(2020—2022年度)(No. 2020QNRC001)。
吴朋朋(1997—),男,硕士研究生,研究方向:作物遗传育种。*通信作者(Corresponding author):蒋凌雁(JIANG Lingyan),E-mail:lyjiang@hainanu.edu.cn。
