高粱高效Ubiquitin启动子的克隆及活性鉴定
2023-01-16夏启玉贺萍萍张丽丽张雨良肖苏生
夏启玉,贺萍萍,张丽丽,张雨良,肖苏生,赵 辉,3*
高粱高效启动子的克隆及活性鉴定
夏启玉1,2,贺萍萍1,2,张丽丽1,2,张雨良1,2,肖苏生1,2,赵 辉1,2,3*
1. 中国热带农业科学院三亚研究院,海南三亚 572024;2. 中国热带农业科学院热带生物技术研究所/农业农村部热带作物生物学与遗传资源利用重点实验室/海南省南繁生物安全与分子育种重点实验室,海南海口 571101;3. 中国热带农业科学院海南热带农业资源研究院,海南海口 571101
在转基因植物的研究中,启动子是影响转基因表达效率的重要因素之一。植物泛素(ubiquitin)基因启动子以启动效率高、甲基化程度相对较低、遗传性状稳定等特点成为单子叶植物中应用较为广泛的启动子。其中,玉米的是最常使用的启动子之一。本研究旨在克隆高粱高效启动子,为高粱及其他单子叶植物的遗传转化研究提供新的组成型启动子选择。本研究从NCBI数据库中查找到多个基因,下载其起始密码子上游3000 bp的序列。根据启动子的特点,选择含有5′ UTR内含子且大小合适的序列,并通过在线启动子预测网站进行启动子分析,最后选择2个基因(LOC8076096、LOC8063786)进行启动子克隆,将其启动子序列分别命名为和。将这2个启动子片段PCR扩增后,连入含有GUS报告基因的植物表达载体Ubi-GUS,得到重组表达载体U1-GUS和U5-GUS。重组载体通过农杆菌介导法转化水稻和狗尾草,PCR筛选阳性转化苗,对阳性转化苗进行GUS染色分析,鉴定和的启动子活性。GUS染色观察发现,所有以和为启动子的水稻和狗尾草阳性转化苗的根、茎和叶均呈现较深的蓝色,比以玉米为启动子的阳性转化苗的蓝色略深,且以为启动子的阳性转化苗比以为启动子的蓝色更深,而非转基因的水稻和狗尾草小苗则完全染不上蓝色。因此,启动子和在水稻和狗尾草中均具有组成型强启动子的活性,可作为新的组成型启动子应用于高粱、水稻、狗尾草及其他单子叶植物的遗传转化研究。
高粱;泛素基因;启动子;克隆;活性鉴定
高粱[(L.) Moench]是中国主要杂粮作物之一,是粮食、饲料和酿酒业原料的重要来源。现代基因工程技术的发展,为高粱新品种的获得提供了一种快速有效的途径。与水稻、玉米、大豆等其他作物相比,高粱的遗传转化研究发展比较缓慢。高粱是禾本科中最难进行组织培养和遗传转化的物种之一,其遗传转化效率受基因型的影响较大,成功获得的转基因高粱品种不多,且转化率仍较低[1-3]。
在转基因植物的研究中,启动子是影响转基因表达效率的重要因素之一,因此选择高效率的启动子是高效率表达外源基因的关键。启动子是一段位于结构基因5端上游区的DNA序列,能活化RNA聚合酶,使之与模板DNA准确地相结合并具有转录起始的特异性,控制基因表达(转录)的起始时间和表达程度,是基因表达调控的重要元件。根据启动子的转录模式可将其分为3类:组成型启动子、诱导型启动子和组织特异型启动子。组成型启动子的调控不受外界条件的影响,不同组织器官和发育阶段的基因表达没有明显差异,所启动基因的表达具有持续性,不表现时空特异性。目前广泛应用的植物组成型启动子有来自花椰菜花叶病毒的35S启动子、泛素(ubiquitin)基因启动子、肌动蛋白(actin)基因启动子等。35S启动子常应用于双子叶植物中,启动子和启动子常应用于单子叶植物中。目前,在单子叶植物中应用较广的启动子为玉米启动子和水稻启动子。大部分基因的起始转录区上游都有一段5′ UTR内含子,研究表明启动子在植物中的高效表达与其5′ UTR的内含子调控有一定关系。启动子以启动效率高、甲基化程度相对较低、遗传性状稳定等特点成为目前研究较多的启动子之一[4]。
为获得来源于高粱的高效启动子,本研究从NCBI数据库中搜索高粱的基因,选择2个高粱基因进行启动子克隆,构建了这2个启动子分别表达GUS报告基因的重组表达载体,通过农杆菌介导法转化单子叶植物中的C3模式植物水稻和C4模式植物狗尾草,对获得的阳性转化苗进行GUS染色分析,鉴定它们的启动子活性,为高粱及其他单子叶植物的遗传转化研究提供新的组成型启动子选择。
1 材料与方法
1.1 材料
1.1.1 植物材料 以高粱‘Hiro-1’品种为实验材料,种植后取叶片提取基因组DNA。‘Hiro-1’品种的种子由中国农业大学才宏伟教授馈赠。水稻转化品种为‘日本晴’,由本实验室保存;狗尾草转化品种为‘ME34’,由美国Donald Danforth Plant Science Center的Brutnell实验室提供,本实验室繁殖后保存。
1.1.2 质粒及菌株 Ubi-GUS质粒由美国Donald Danforth Plant Science Center的Brutnell实验室提供;大肠杆菌DH5α感受态和农杆菌AGL1感受态分别购自北京全式金生物技术股份有限公司和上海唯地生物技术有限公司。
1.1.3 试剂 植物基因组DNA提取试剂盒、质粒提取试剂盒和通用型DNA回收试剂盒购自天根生化科技(北京)有限公司;PrimeSTAR Max DNA聚合酶购自宝生物工程(大连)有限公司;限制性内切酶和T4 DNA连接酶购自赛默飞世尔科技(中国)有限公司;酶MIX购自北京康为世纪生物科技有限公司;MS购自Duchefa Biochemie公司;Gelzan植物凝胶购自Caisson Labs公司;潮霉素购自Gold Biotechnology公司;X-Gluc购自Sigma-Aldrich公司;蛋白胨和酵母粉购自OXOID公司;琼脂糖购自Biowest Agarose公司;其他试剂均为国产分析纯。
1.2 方法
1.2.1 启动子克隆 从NCBI数据库中搜索高粱基因,共找到17个高粱基因,单体数量介于1~6个之间,其中含6个单体的有3个,含5个单体的有2个,选择了与玉米启动子启动的基因同源性较高的基因进行下一步分析。找出其起始密码子ATG上游的3000 bp以内的核苷酸序列,利用在线预测软件Softberry中的TSSP对其进行启动子预测分析,根据启动子预测结果及与玉米启动子结构比对分析,选择2个与玉米启动子结构相似且预测含有启动子元件的基因LOC8076096和LOC8063786进行启动子克隆,并将其启动子序列分别命名为和。在和基因起始密码子上游3000 bp内设计克隆引物,使启动子核苷酸序列长度略大于2000 bp。上游引物的5端加上限制性内切酶Ⅰ的识别序列和保护碱基,下游引物的5加限制性内切酶I的识别序列和保护碱基,引物序列见表1。使用植物基因组DNA提取试剂盒提取高粱Hiro-1叶片的基因组DNA,以其为模板,利用高保真PrimeSTAR酶进行PCR扩增。PCR体系为:无菌水9.5 μL,引物(10 μmol/L)各1 μL,Primestar Mix 12.5 μL,DNA模板1 μL。启动子的PCR扩增程序为:95℃预变性5 min;98℃变性10 s,56℃退火15 s,72℃延伸15 s,进行40个循环;最后72℃延伸7 min。启动子的PCR扩增程序为:95℃预变性5 min;98℃变性10 s,52℃退火15 s,72℃延伸15 s,进行38个循环;最后72℃延伸7 min。PCR扩增产物经2%的琼脂糖凝胶电泳分离,纯化回收后,送测序公司进行全序列测序。引物合成及测序均由生工生物工程(上海)股份有限公司完成。
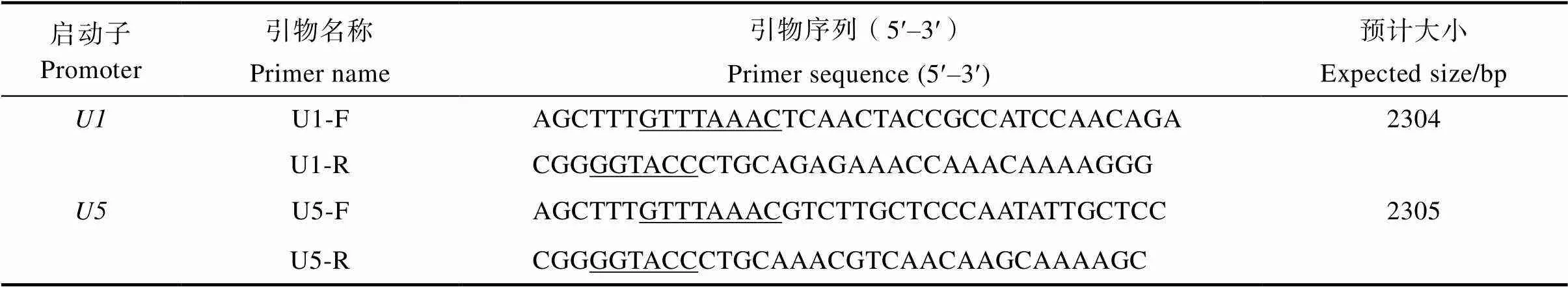
表1 启动子U1和U5的引物序列
注:下划线的序列为限制性内切酶识别序列。
Note: The underlined sequence is the restriction endonuclease recognition sequence.
1.2.2 植物重组表达载体的构建 选择植物表达载体Ubi-GUS为骨架载体进行载体改造,该载体的β-葡萄糖苷酸酶(GUS)报告基因的启动子为玉米启动子,选择Ⅰ和Ⅰ2个酶切位点,双酶切将该载体GUS基因上游的玉米启动子切除,分别连入启动子和,构建由和启动GUS基因的植物重组表达载体U1-GUS和U5-GUS(图1),可通过报告基因GUS的表达鉴定目的启动子的活性。具体构建过程为:回收和的PCR产物,用Ⅰ和Ⅰ双酶切,回收酶切产物;载体Ubi-GUS用相同的酶进行双酶切,胶回收载体大片段。将2个回收片段用T4 DNA连接酶16℃连接过夜,连接产物转化大肠杆菌DH5α,于37℃在含卡那霉素的LB平板中培养过夜。次日挑取单克隆于37℃振荡培养过夜,采用和启动子的引物进行菌液PCR检测,筛选阳性克隆。菌液PCR反应体系为:无菌水9.5 μL,引物(10 μmol/L)各1 μL,Mix 12.5 μL,菌液模板1 μL。的PCR扩增程序为:95℃预变性5 min;95℃变性30 s,60℃退火30 s,72℃延伸1 min,进行35个循环;72℃延伸7 min。的PCR扩增程序为:95℃预变性5 min;95℃变性30 s,58℃退火30 s,72℃延伸1 min,进行35个循环;72℃延伸7 min。PCR扩增产物经2%的琼脂糖凝胶电泳分离检测。根据菌液PCR检测的结果,分别选择阳性克隆送测序公司进行序列测定,保存测序正确的阳性克隆,提取质粒。将重组表达载体用液氮冻融法转化农杆菌AGL1,获得的菌株用甘油保存于‒80℃备用。

图1 重组表达载体的构建
1.2.3 重组表达载体转化水稻和狗尾草 以水稻品种‘日本晴’和狗尾草品种‘ME34’的成熟种子为外植体,诱导胚性愈伤。将分别携带重组载体U1-GUS和U5-GUS的AGL1菌株各自侵染水稻和狗尾草的胚性愈伤,以携带对照载体Ubi-GUS的AGL1菌株为对照(CK),共培养5~7 d,潮霉素筛选获得抗性愈伤,抗性愈伤分化成苗,生根后移栽至育苗盆中,水稻转化苗在温室培养,狗尾草转化苗在植物人工气候箱培养。水稻的遗传转化参照TOKI等[5]的方法进行,狗尾草的遗传转化参照赵辉等[6]的方法进行。
1.2.4 阳性转化苗的PCR筛选 待转化苗存活后,采集转化苗的叶片,提取基因组DNA,首先进行潮霉素磷酸转移酶()基因和基因的PCR检测。水稻以‘日本晴’基因组DNA为阴性对照(CK‒),狗尾草以‘ME34’基因组DNA为阴性对照(CK‒,以U1-GUS和U5-GUS质粒为阳性对照(CK+),以无菌水为空白对照(CK)。基因的检测引物来自农业部1782号公告-2-2012(转基因植物及其产品成分检测标记基因和定性PCR方法),基因的检测引物来自农业部2122号公告-3-2014(转基因植物及其产品成分检测报告基因定性PCR方法)。引物序列见表2。PCR检测反应体系为:无菌水9.5 μL,引物(10 μmoL/L)各1 μL,Mix 12.5 μL,DNA模板1 μL。PCR扩增程序为:95℃预变性5 min;95℃变性30 s,60℃退火30 s,72℃延伸30 s,进行35个循环;最后72℃延伸7 min。PCR扩增产物经2%的琼脂糖凝胶电泳检测。另外,以上述DNA为模板,用启动子和的引物进行PCR检测转化苗中的启动子和。PCR反应体系为:无菌水9.5 μL,引物(10 μmoL/L)各1 μL,Primestar Mix 12.5 μL,DNA模板1 μL。的PCR扩增程序为:95℃预变性5 min;98℃变性10 s,56℃退火15 s,72℃延伸15 s,进行40个循环;最后72℃延伸7 min。的PCR扩增程序为:95℃预变性5 min;98℃变性10 S,52℃退火15 s,72℃延伸15 s,进行38个循环;最后72℃延伸7 min。PCR扩增产物经2%的琼脂糖凝胶电泳检测。根据基因、基因和启动子和的PCR检测结果筛选出水稻和狗尾草的阳性转化苗。

表2 HPT和GUS的检测引物
1.2.5 U1-GUS和U5-GUS转化苗的GUS活性分析 按常规方法配制GUS染色液的基液和母液,临用前按比例混合。取水稻和狗尾草的阳性转化苗用水洗净泥土后,装入50 mL离心管中,加入GUS染色液,37℃暗室下染色24 h。染色完成后,倒掉GUS染色液,先用75%乙醇脱色3~5次,再用95%乙醇脱色1~2次,观察阳性转化苗的染色情况。以非转基因‘日本晴’和‘ME34’小苗为阴性对照,以转入Ubi-GUS的‘日本晴’和‘ME34’小苗为阳性对照。
2 结果与分析
2.1 启动子克隆
启动子和的PCR扩增均得到大小约为2300 bp的条带(图2),将PCR产物送测序公司测序,测序结果表明,启动子的实际大小为2361 bp,启动子的实际大小为2307 bp,均与预期的大小有差别。启动子和的核苷酸序列见图3。
M: DL2000 DNA marker.
2.2 植物重组表达载体的构建
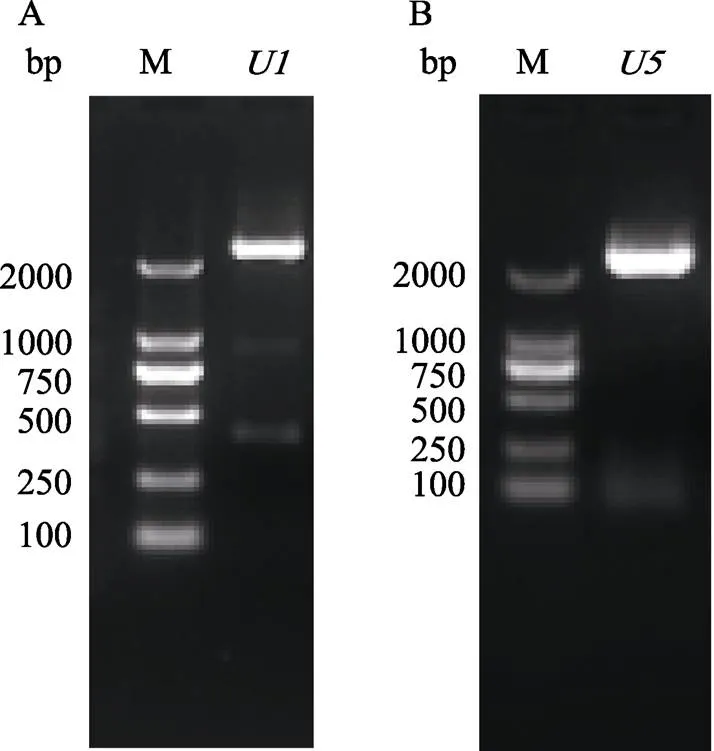
和的PCR产物经双酶切回收,与Ubi-GUS的双酶切回收产物分别进行连接反应,连接产物分别转化大肠杆菌DH5α后,从转化板上挑选单克隆,以和启动子的引物进行菌液PCR(水为空白对照,CK),结果表明,U1-GUS挑选的8个克隆和U5-GUS的7个克隆均能扩增出大于2000 bp的条带(图4),证明目的启动子和片段均已成功连入Ubi-GUS载体中。各挑选3个阳性克隆送测序公司进行全序列测定,测序结果与PCR产物的测序结果进行比对分析,挑选出测序序列与PCR产物测序序列完全一致的阳性克隆。分别将携带重组表达载体U1-GUS和U5-GUS的阳性克隆命名为U1-GUS/DH5α和U5-GUS/DH5α。提取U1-GUS和U5-GUS质粒,分别转化农杆菌AGL1,获得的农杆菌菌株命名为U1-GUS/AGL1和U5-GUS/AGL1。
2.3 水稻和狗尾草转化苗的获得及PCR鉴定
为了验证启动子和启动基因表达的能力,将携带重组载体U1-GUS和U5-GUS的AGL1以及携带对照载体Ubi-GUS的AGL1分别转化水稻和狗尾草,筛选和分化获得转化苗。将U1-GUS/ AGL1、U5-GUS/AGL1和对照菌株Ubi-GUS/ AGL1(阳性对照,CK+)转化‘日本晴’(NIP)获得的转化苗命名为NIP-U1、NIP-U5和NIP- Ubi;将U1-GUS/AGL1、U5-GUS/AGL1和对照菌株Ubi-GUS/AGL1(阳性对照,CK+)转化狗尾草‘ME34’获得的转化苗命名为ME34-U1、ME34-U5和ME34-Ubi。

图3 启动子U1(A)和U5(B)的核苷酸序列
A: U1-GUS; B: U5-GUS; M: DL2000 DNA marker.
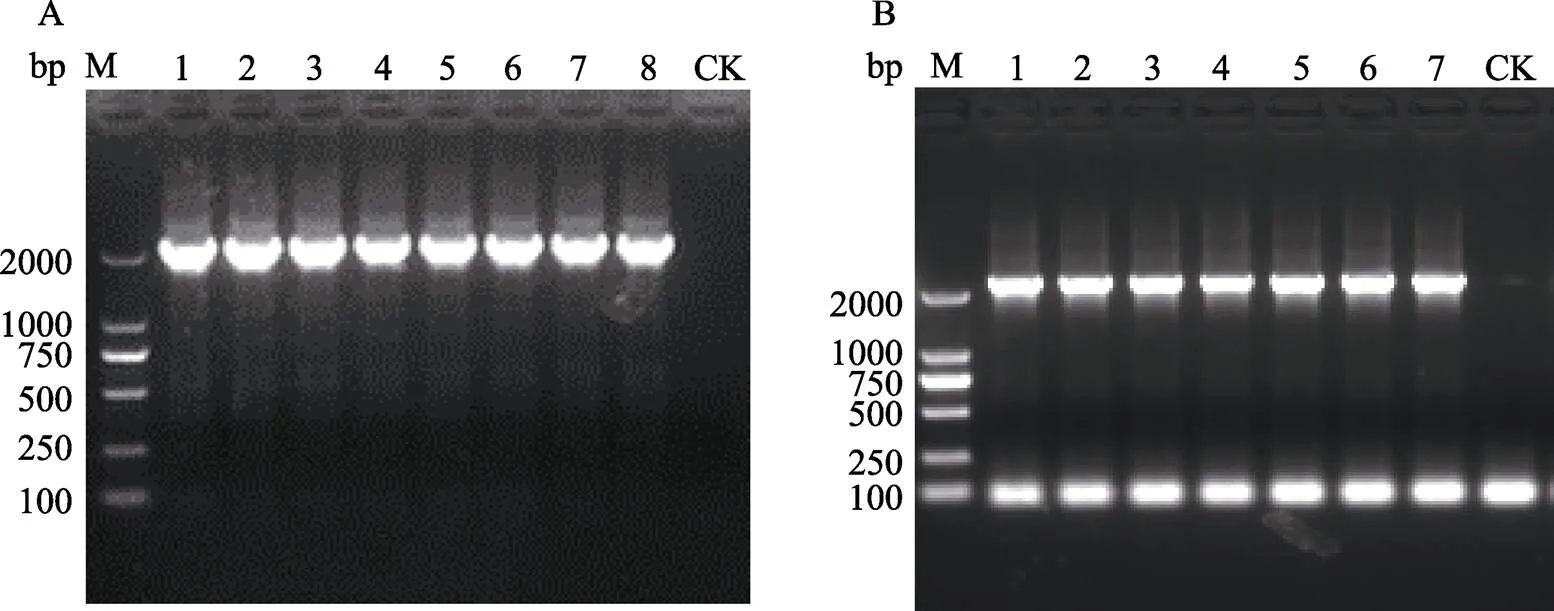
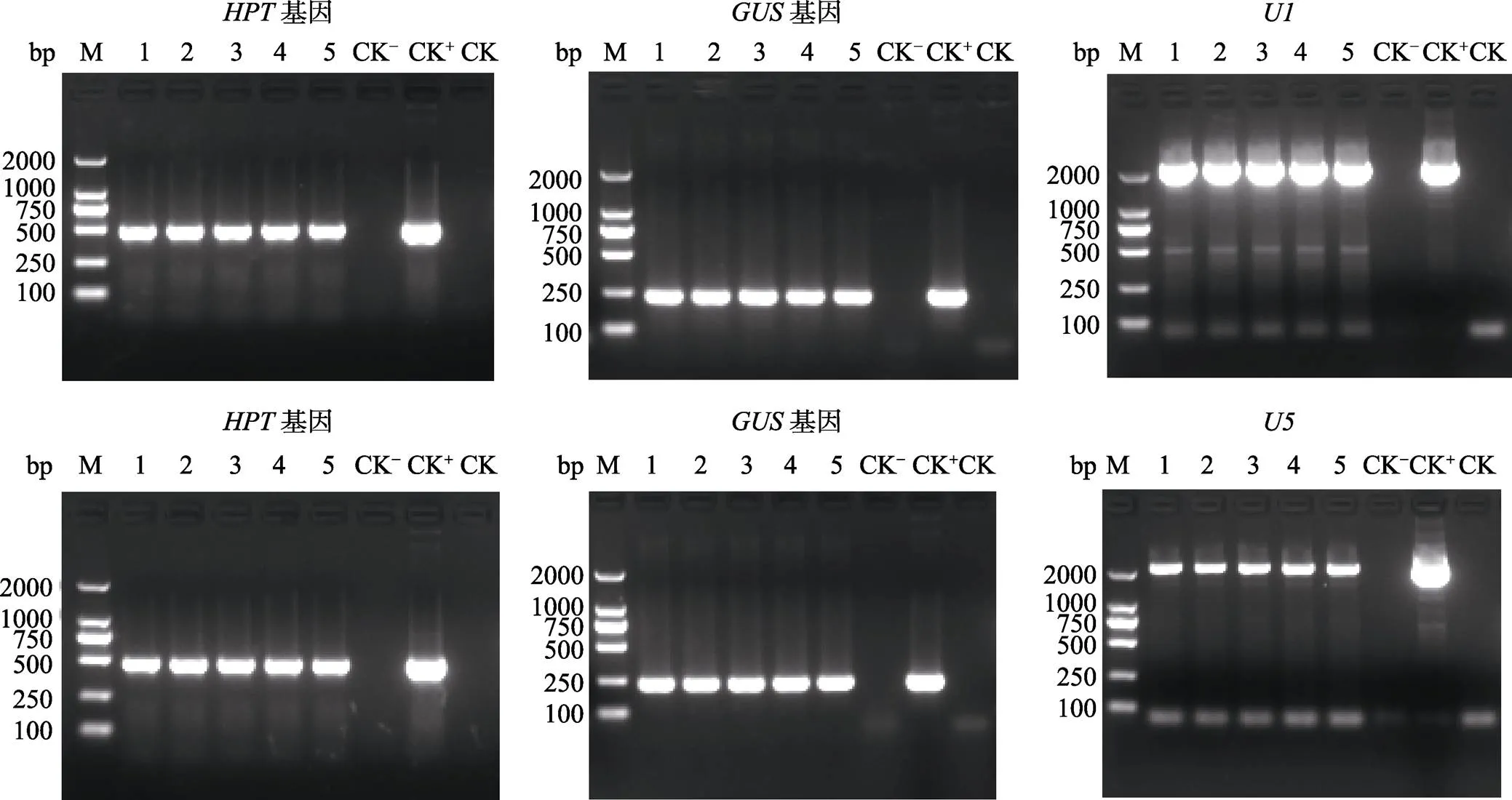
NIP-U1和NIP-U5各挑选5棵转化苗,ME34-U1和ME34-U5各挑选8棵转化苗,利用、和()引物的PCR来筛选阳性转化苗,PCR产物电泳结果显示NIP-U1、NIP-U5、ME34-U1和ME34-U5转化苗均能扩增出和基因,NIP-U1和ME34-U1转化苗均能扩增出启动子,NIP-U5和ME34-U5转化苗均能扩增出启动子,而非转基因对照(阴性对照,CK‒)和水对照(空白对照,CK)则不能扩增出这些基因和启动子片段(图5和图6),说明挑选的这些转化苗均为阳性转基因苗,均已成功地导入了目的载体。
M: DL2000 DNA marker.
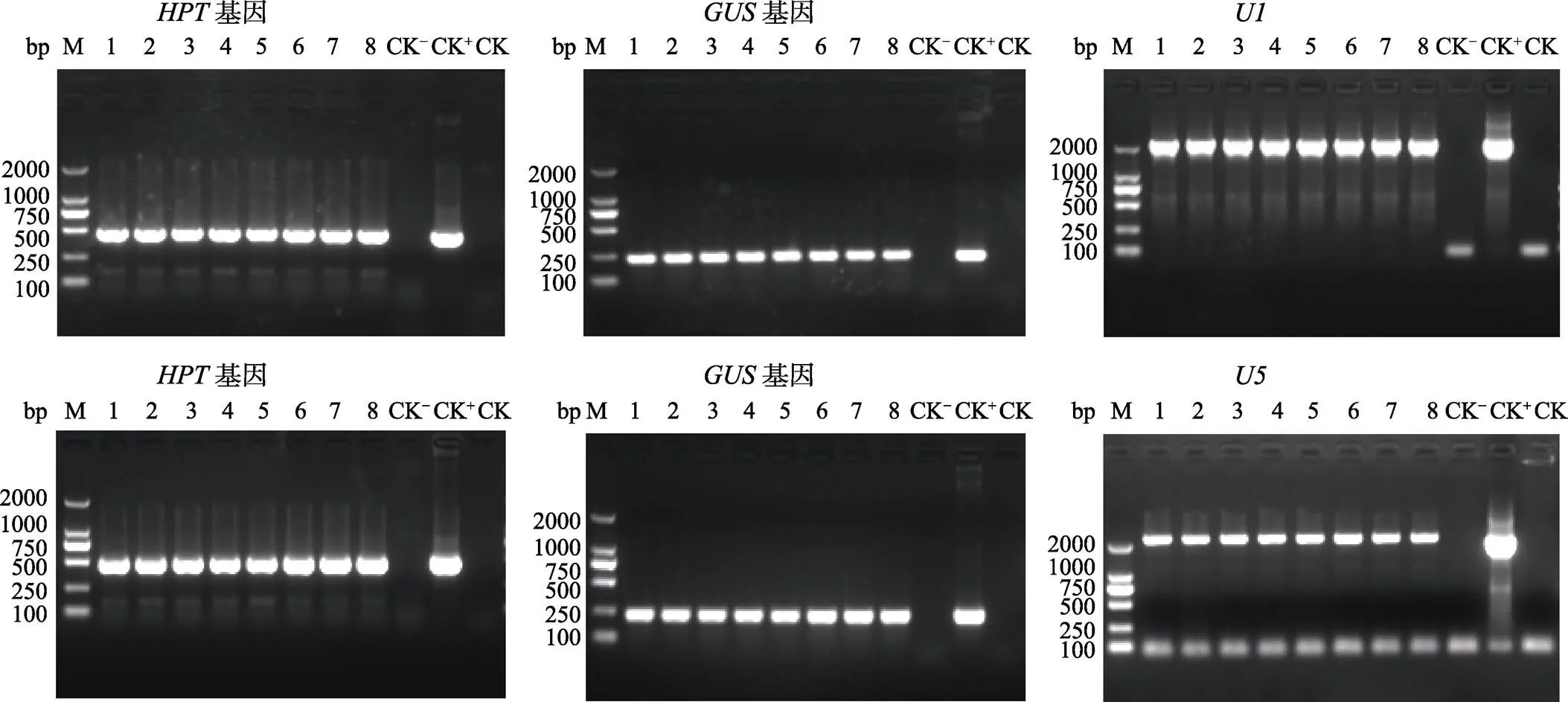
M: DL2000 DNA marker.
2.4 U1和U5的启动子活性鉴定
将阳性转化苗进行GUS染色观察分析,结果表明,所有的NIP-U1、NIP-U5、ME34-U1和ME34-U5的阳性转化苗的根、茎和叶均呈现较深的蓝色,比阳性对照NIP-Ubi和ME34-Ubi转化苗的蓝色略深,且NIP-U5和ME34-U5的阳性转化苗的蓝色较NIP-U1和ME34-U1更深,而阴性对照非转基因‘日本晴’小苗和‘ME34’小苗则完全染不上蓝色(图7)。表明启动子和在水稻和狗尾草中均能组成型启动GUS基因的表达,且具有强的启动子活性,因此启动子和可作为新的组成型启动子应用于高粱、水稻、狗尾草及其他单子叶植物的遗传转化研究。
3 讨论
植物启动子是目前单子叶植物的遗传转化中应用最为广泛的启动子之一,其中应用较多的是玉米启动子和水稻启动子。1992年,CHRISTENSEN等[7]从玉米中分离到2个泛素基因(和),这2个基因都在5′非翻译区包含1个内含子,并分别构建了以玉米的5′侧翼区及5′内含子作为启动子和以35S作为启动子表达氯霉素乙酰转移酶(CAT)基因的重组载体pUBI-CAT和p35S-CAT。玉米原生质体转化实验表明,pUBI-CAT比p35S-CAT表达的CAT活性高出10倍以上。此后,研究人员在小麦[8]、水稻[9-11]和花生[12]等植物中证实了玉米的强启动子活性。2000年,WANG等[13]分离了2个水稻泛素基因和,构建了其5′上游区和GUS编码区的表达框,通过基因枪法导入水稻悬浮细胞中,GUS活性测定结果表明,和启动子比35S启动子表达的GUS活性高10~15倍,比玉米启动子表达的GUS活性也高2~3倍。随后,的强启动子活性在甘蔗中也得到了验证。LIU等[14]将启动子与GUS报告基因连接,通过基因枪法获得了稳定的甘蔗转化植株,以为启动子比以为启动子的转基因植株中的GUS表达水平提高了1.6倍,而以35S为启动子的转基因植株中则未检测到GUS的表达。除玉米和水稻的启动子以外,还有多种植物如大豆[15]、烟草[16]、马铃薯[17]、向日葵[18]、番茄[19]、柳枝稷[20]的启动子已被成功克隆并应用。
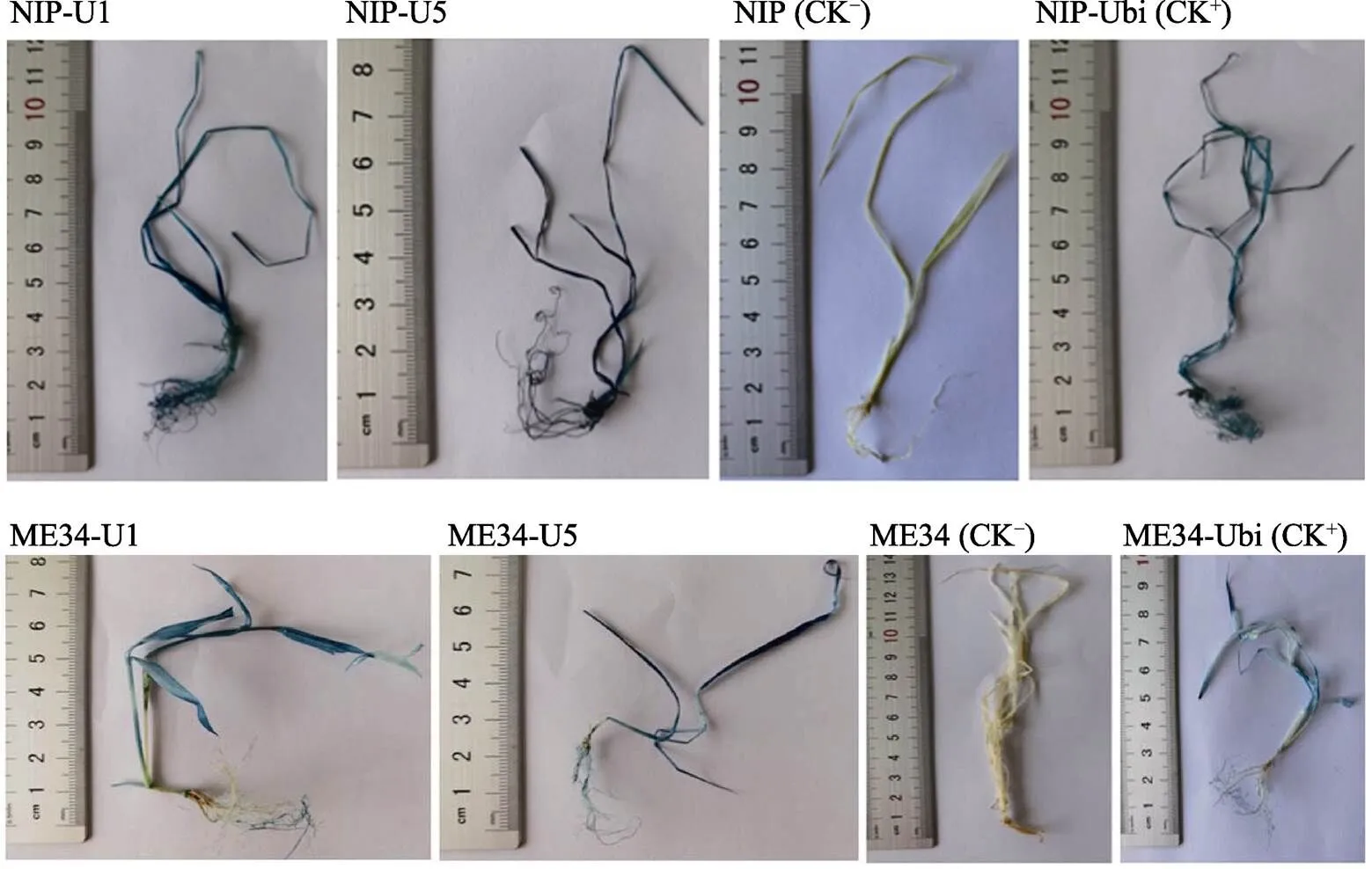
图7 NIP-U1、NIP-U5、ME34-U1和ME34-U5转化苗的GUS染色
在植物的转基因技术中,除了目的外源基因,通常还需要筛选标记等其他外源基因,而每个基因一般需要独立的启动子,因此需要使用多个启动子,但是重复使用同一启动子驱动多个基因表达可能导致基于同源性的基因沉默。此外,使用植物自身的或者接近物种的启动子可能会有更高地启动外源基因表达的效率。因此,有必要克隆更多的能在植物中高效启动基因转录的启动子,为转基因植物的生物技术育种的发展提供更多的启动子选择。
本研究中转化苗的GUS染色结果表明,以和为启动子的阳性转化苗的根、茎和叶都能染上深蓝色,比以玉米为启动子的阳性转化苗的蓝色略深,且以为启动子比以为启动子的阳性转化苗的蓝色更深,这说明高粱的不同启动子的活性有差异,比的启动子活性强。一般来说,生物的亲缘关系越近,其启动子通用的可能性越大[21]。高粱、水稻和狗尾草同属禾本科植物,其中高粱和狗尾草还同属黍亚科,亲缘关系较近,启动子的活性可能也相似。已有研究表明,黍亚科的玉米启动子在水稻[9-11]、高粱[22-23]和狗尾草[24]等禾本科科植物中均具有强的启动子活性。因此,本研究中在水稻和狗尾草中具有强启动活性的和启动子,在高粱中很可能也具有强的启动活性。
本研究虽然已经验证了和启动子的活性,但下一步还需要将和启动子的核苷酸序列进行分段截短实验,找出它们各自的核心启动子序列,进一步鉴定它们的启动子活性。本研究克隆的启动子和可以为高粱及其他单子叶植物的遗传转化提供新的组成型启动子选择。
[1] 肖 军, 石太渊, 郑秀春, 段有厚. 根癌农杆菌介导的高粱遗传转化体系的建立[J]. 杂粮作物, 2004, 24(4): 200-203.
XIAO J, SHI T Y, ZHENG X C, DUAN Y H. Establishment of sorghum genetic transformation system with mediating[J]. Rain Fed Crops, 2004, 24(4): 200-203. (in Chinese)
[2] 杜 浩, 庄义庆, 黄 萍, 杜道林. 农杆菌介导的甜高粱遗传转化研究进展[J]. 江苏农业科学, 2018, 46(4): 29-32.
DU H, ZHUANG Y Q, HUANG P, DU D L. Research progress of agrobacterium-mediated genetic transformation in sweet sorghum[J]. Jiangsu Agricultural Sciences, 2018, 46(4): 29-32. (in Chinese)
[3] GAO Z S, JAYARAJ J, MUTHUKRISHNAN S, CLAFLIN L, LIANG G H. Efficient genetic transformation ofusing a visual screening marker[J]. Genome, 2005, 48(2): 321-333.
[4] 谢 伟, 乐超银. 泛素启动子在转基因植物中的应用[J]. 三峡大学学报(自然科学版), 2007, 29(2): 176-179.
XIE W, YUE C Y. Application of ubiquitin promoter to transgenic plants[J]. Journal of China Three Gorges University (Natural Sciences), 2007, 29(2): 176-179. (in Chinese)
[5] TOKI S,HARA N,ONO K,ONODERA H,TAGIRI A,OKA S,TANAKA H. Early infection of scutellum tissue withallows high-speed transformation of rice[J]. The Plant Journal, 2006, 47(6): 969-976.
[6] 赵 辉, 郭静远, 孔 华, 郭安平. 狗尾草胚性愈伤高效农杆菌转化体系的建立[J]. 热带作物学报, 2017, 38(6): 1106-1112.
ZHAO H, GUO J Y, KONG H, GUO A P. The establishment of high efficienttransformation system of[J]. Chinese Journal of Tropical Crops, 2017, 38(6): 1106-1112. (in Chinese)
[7] CHRISTENSEN A H, SHARROCK R A, QUAIL P H. Maize polyubiquitin genes: structure, thermal perturbation of expression and transcript splicing, and promoter activity following transfer to protoplasts by electroporation[J]. Plant Molecular Biology, 1992, 18(4): 675-689.
[8] 郭殿京, 傅荣昭, 李文彬, 陈 颖, 张晓东, 张利明, 孙勇如. 小麦中外源基因瞬间表达调控研究及兔防御素(NP-1)基因的转化[J]. 遗传学报, 1999, 26(2): 168-173.
GUO D J, FU R Z, LI W B, CHEN Y, ZHANG X D, ZHANG L M, SUN Y R. Studies of regulation oftransient expression in wheat and rabbit defensin () transformation[J]. Acta Genetica Sinica, 1999, 26(2): 168-173. (in Chinese)
[9] CORNEJO M J, LUTH D, BLANKENSHIP K M, ANDERSON O D, BLECHL A E. Activity of a maize ubiquitin promoter in transgenic rice[J]. Plant Molecular Biology, 1993, 23(3): 567-581.
[10] 武 亮, 卜庆云, 周 明, 杨世湖, 万建民. 不同启动子驱动下马铃薯蛋白酶抑制剂转基因水稻的遗传、表达和对粘虫抗性分析[J]. 遗传, 2006, 28(3): 261-267.
WU L, BU Q Y, ZHOU M, YANG S H, WAN J M. Inheritance, expression and armyworm resistance of protease inhibitorⅡ gene () driven by different promoters in transgenic rice[J]. Hereditas, 2006, 28(3): 261-267. (in Chinese)
[11] 朱永生, 肖开转, 王福祥, 连 玲, 何 炜, 许惠滨, 魏毅东, 陈丽萍, 蒋家焕, 谢华安, 张建福. 不同启动子驱动下基因表达对水稻叶表皮毛发育的影响[J]. 福建农业学报, 2019, 34(2): 139-145.
ZHU Y S, XIAO K Z, WANG F X, LIAN L, HE W, XU H B, WEI Y D, CHEN L P, JIANG J H, XIE H A, ZHANG J F. Correlation betweenexpression driven by varied promoters and development of epidermal hairs on leaves of rice plant[J]. Fujian Journal of Agricultural Sciences, 2019, 34(2): 139-145. (in Chinese)
[12] 郭志鸿, 王汉宁, 陶 玲, 张金文, 白 斌, 陈正华.启动子驱动的花生芪合酶基因表达载体的构建及玉米遗传转化初报[J].甘肃农业大学学报, 2004, 39(2): 117-123.
GUO Z H, WANG H N, TAO L, ZHANG J W, BAI B, CHEN Z H. Construction ofpromoter-based plant expression vector of stilbene synthase gene and transformation of type Ⅱ callus of maize by particle bombardment[J].Journal of Gansu Agricultural University, 2004, 39(2): 117-123. (in Chinese)
[13] WANG J L, JIANG J D, OARD J H. Structure, expression and promoter activity of two poly ubiquitin genes from rice[J]. Plant Science, 2000, 156(2): 201-211.
[14] LIU D W, OARD S V, OARD J H. High transgene expression levels in sugarcane (L.) driven by the rice ubiquitin promoter RUBQ2[J]. Plant Science, 2003, 165(4): 743-750.
[15] CHIERA J M, BOUCHARD R A, DORSEY S L, PARK E, BUENROSTRO-NAVA M T, LING P P, FINER J J. Isolation of two highly active soybean ((L.) Merr.) promoters and their characterization using a new automated image collection and analysis system[J]. Plant Cell Reports, 2007, 26(9): 1501-1509.
[16] GENSCHIK P, MARBACH J, UZE M, FEUERMAN M, PLESSE B, FLECK J. Structure and promoter activity of a stress and developmentally regulated polyubiquitin- encoding gene of[J]. Gene, 1994, 148(2): 195-202.
[17] GARBARINO J E, BELKNAP W R. Isolation of a ubiquitin-ribosomal protein gene () from potato and expression of its promoter in transgenic plants[J]. Plant Molecular Biology, 1994, 24(1): 119-127.
[18] BINET M N, LEPETITM, WEIL J H, TESSIER L H. Analysis of a sunflower polyubiquitin promoter by transient expression[J]. Plant Science, 1991, 79(1): 87-94.
[19] ROLLFINKE I K, SILBER M V, PFITZNER U M. Characterization and expression of a heptaubiquitin gene from tomato[J]. Gene, 1998, 211(2): 267-276.
[20] MANN D G J, KING Z R, LIU W S, JOYCE B L, PERCIFIELD R J, HAWKINS J S, LAFAYETTE P R, ARTELT B J, BURRIS J N, MAZAREI M, BENNETZEN J L, PARROTT W A, JR C N S. Switchgrass (L.) polyubiquitin gene (and) promoters for use in plant transformation[J]. BMC Biotechnology, 2011, 11: 74.
[21] 贺飞燕, 闫建俊, 白云凤, 冯瑞云, 施俊凤. 启动子的类型及应用[J]. 山西农业科学, 2017, 45(1): 115-120.
HE F Y,YAN J J, BAI Y F, FENG R Y, SHI J F. Types and applications of promoters[J]. Journal of Shanxi Agricultural Sciences, 2017, 45(1): 115-120.
[22] BELIDE S, VANHERCKE T, PETRIE J R, SINGH S P. Robust genetic transformation of sorghum (L.) using diferentiating embryogenic callus induced from immature embryos[J]. Plant Methods, 2017, 13: 109.
[23] WANG L H, GAO L, LIU G Q, MENG R R, LIU Y L, LI J Q. An efficient sorghum transformation system using embryogenic calli derived from mature seeds[J]. Peer J, 2021, 9: e11849.
[24] SAHA P, BLUMWALD E. Spike-dip transformation of[J]. The Plant Journal, 2016, 86: 89-101.
Cloning and Activity Identification of High EfficiencyPromoters from Sorghum
XIA Qiyu1,2, HE Pingping1,2, ZHANG Lili1,2, ZHANG Yuliang1,2, XIAO Susheng1,2, ZHAO Hui1,2,3*
1. Sanya Research Institute, Chinese Academy of Tropical Agricultural Sciences, Sanya, Hainan 572024, China; 2. Institute of Tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Sciences / Key Laboratory of Biology and Genetic Resources of Tropical Crops, Ministry of Agriculture and Rural Affairs / Hainan Key Laboratory for Biosafety Monitoring and Molecular Breeding in Off-Season Reproduction Regions, Haikou, Hainan 571101, China; 3. Hainan Institute for Tropical Agricultural Resources, Chinese Academy of Tropical Agricultural Sciences, Haikou, Hainan 571101, China
In the research of transgenic plants, promoter is one of the important factors affecting the efficiency of transgenic expression. Plant ubiquitin gene promoters have been widely used in monocotyledons because of its high starting efficiency, relatively low methylation degree and stable genetic traits. Among them, thepromoter of maize is one of the most commonly usedpromoters. The purpose of this study is to obtain high-efficiency ubiquitin promoters of sorghum and provide a new constitutive promoter selection for the genetic transformation of sorghum and other monocotyledonous plants. In this study, multiple polyubiquitin genes were found from NCBI database, and the sequence of 3000 bp upstream of its starting codon was downloaded. According to the characteristics ofpromoter, the sequence with 5′ UTR intron and appropriate size was selected, and the promoter was analyzed through the online promoter prediction website. Finally, two genes LOC8076096 and LOC8063786 were selected for promoter cloning, and their promoter sequences were namedandrespectively. After PCR amplification, the two promoter fragments were connected to the plant expression vector Ubi-GUS containing Gus reporter gene to obtain recombinant expression vectors U1-GUS and U5-GUS. The recombinant vector was transformed into rice and green bristlegrass by themediated method. The positive transformed seedlings were screened by PCR. GUS staining analysis was carried out on the positive transformed seedlings to identify the promoter activities ofand. GUS staining showed that the roots, stems and leaves of all positive transformed seedlings of rice and green bristlegrass withandas promoters showed darker blue, which was slightly darker than that of positive transformed seedlings with maizeas promoter, and the blue of positive transformed seedlings withas promoter was deeper than that ofas promoter, while non-transgenic rice and green bristlegrass seedlings could not be stained with blue at all. Therefore, the promotersandhave the activity of constitutive strong promoters in rice and green bristlegrass, and can be used as new constitutive promoters to study the genetic transformation of sorghum, rice, green bristlegrass and other monocotyledonous plants.
sorghum;gene; promoter; clone; activity identification
Q781
A
10.3969/j.issn.1000-2561.2022.12.006
2022-04-23;
2022-05-18
海南省院士创新平台科研项目资金(No. YSPTZX202102);海南省朱健康院士工作站资金资助;海南省自然科学基金青年基金项目(No. 322QN388)。
夏启玉(1983—),女,硕士,助理研究员,研究方向:转基因生物安全与南繁育种。*通信作者(Corresponding author):赵 辉(ZHAO Hui),E-mail:zhaohui@itbb.org.cn。
