橡胶树HbPIP1;1基因的克隆及蛋白的亚细胞定位与多聚化分析
2023-01-16乔雪莹郑玉皎阳江华曾长英
乔雪莹,郑玉皎,阳江华,曾长英,邹 智
橡胶树基因的克隆及蛋白的亚细胞定位与多聚化分析
乔雪莹1,2,3,郑玉皎1,2,3,阳江华4,曾长英1*,邹 智2,3*
1. 海南大学热带作物学院,海南海口 570228;2. 中国热带农业科学院三亚研究院,海南三亚 572024;3. 海南省南繁生物安全与分子育种重点实验室/中国热带农业科学院热带生物技术研究所,海南海口 571101;4. 中国热带农业科学院橡胶研究所,海南海口 571101
水通道蛋白(aquaporin)是一类广泛存在生物体中高效转运水分子的膜内在蛋白,其在生物膜上以同源或异源四聚体的形式起作用。根据序列相似性及亚细胞定位,植物水通道蛋白可分为PIP (plasma membrane intrinsic protein)、TIP(tonoplast intrinsic protein)、NIP(NOD26-like intrinsic protein)、SIP(small basic intrinsic protein)和XIP(X intrinsic protein)等5大类,其中,PIP定位在细胞膜,是介导细胞间水分跨膜运输的主要通道。橡胶树最早起源于南美亚马逊河流域,是目前天然橡胶的主要商业来源。与其他植物相比,橡胶树除蒸腾耗水外,周期性的割胶活动也会造成水分的大量流失,因此,水分平衡对于橡胶树尤为重要。为揭示橡胶树水分平衡的分子机制,采用RT-PCR技术对1个PIP类水通道蛋白基因进行克隆,并在此基础上对其编码蛋白的亚细胞定位和多聚化特征进行分析。结果显示:该基因的编码区长864 bp,预测编码287 aa,其理论分子量为30.80 kDa、等电点8.59、不稳定系数49.27、脂肪族指数22.34、总平均疏水指数为0.639,属于不稳定的疏水型碱性蛋白;蛋白含有水通道蛋白家族特有的MIP(major intrinsic protein)结构域及6个典型的跨膜螺旋,每个螺旋的残基数介于20~23之间。研究构建了基因的亚细胞定位分析载体,并采用农杆菌介导法对烟草叶片进行了瞬时转化。荧光共聚焦显微镜观察显示,HbPIP1;1蛋白定位在细胞膜,与用生物信息学手段预测的结果一致。在烟草叶片中的双分子荧光互补实验显示,HbPIP1;1蛋白自身不能互作,这进一步得到了点对点的酵母双杂交实验的证实。以上结果表明HbPIP1;1蛋白可能通过异源互作的方式参与橡胶树水分的平衡。
橡胶树;亚细胞定位;多聚化;双分子荧光互补;酵母双杂交
天然橡胶是一种重要的工业原料和国防战略物资,其在航天航空、医疗器械、海洋设施及高端制造业等方面具有不可替代的作用。天然橡胶的主要来源是橡胶树(Muell. Arg.),一种热带雨林乔木,隶属于大戟科橡胶树属[1]。天然橡胶在橡胶树的乳管细胞中特异合成,并在割胶过程中以胶乳的形式被排出[2]。胶乳的含水量高达70%,是决定胶乳产量的关键因素[2-3]。由于成熟的乳管与周围的薄壁细胞间不存在胞间连丝,故乳管的水分平衡主要由水通道蛋白(aquaporin, AQP)介导[3-4]。研究表明,AQP广泛存在于不同生物体中[3, 5-9]。根据序列相似性及亚细胞定位,植物AQP可分为PIP(plasma membrane intrinsic protein)、TIP(tonoplast intrinsic protein)、NIP(NOD26-like intrinsic protein)、SIP(small basic intrinsic protein)和XIP(X intrinsic protein)等5大亚家族,其中,PIP定位在细胞膜,是介导细胞间水分跨膜运输的主要通道[8-9]。
通过前期研究,本研究组从橡胶树的基因组中鉴定出51个AQP基因,其中有15个归为PIP亚族[3, 7-8]。根据进化关系和序列特征,PIP亚族可进一步分为PIP1和PIP2两组,其分别含有5个和10个成员[3]。表达分析显示,隶属于PIP1小组的基因在树皮和胶乳中均有表达[3, 7, 10],这表明该基因同时参与了这两类组织的水分平衡,进而影响胶乳产量。为揭示可能的作用机制,本研究在基因克隆的基础上,对其编码蛋白的亚细胞定位和多聚化特征进行分析,以期为利用生物技术手段提高胶乳产量提供理论依据。
1 材料与方法
1.1 材料
1.1.1 植物材料 橡胶树品种为‘热研7-33-97’;本氏烟草由本实验室保存,种子萌发后移栽于温度25℃、湿度55%的光照培养箱中。
1.1.2 菌株及载体 大肠杆菌DH5α、植物瞬时表达载体NC-Cam1304-SubN由本实验室保存;Y2HGold购自天根生化科技(北京)有限公司;GV3101(Soup)购于海南壹田生物科技有限公司。
1.1.3 主要试剂 高保真酶PrimerSTAR Max DNA Polymerase购自宝日医生物技术(北京)有限公司;NC试剂盒购自海南壹田生物科技有限公司;胶回收试剂盒Gel Extraction Kit和质粒提取试剂盒Plasmid DNA Mini Kit I购自Omega Bio-Tek;其余试剂均为国产分析纯。引物合成和常规DNA测序委托北京六合华大基因科技有限公司完成。
1.2 方法
1.2.1 胶乳RNA的提取及cDNA的合成 胶乳总RNA的提取参照参考文献[11],经纯度、浓度和完整性检测合格后用TaKaRa PrimeScript™ RT reagent Kit with gDNA Eraser反转录试剂盒合成cDNA第一链,并置于-20℃保存备用。
1.2.2 基因克隆与载体构建 根据从基因组中获得的全长序列,利用Primer 5.0软件设计如表1所示的基因特异性引物。以胶乳来源的cDNA为模板进行PCR扩增,反应体系为模板cDNA 1 μL、Primer STAR Max premix 2×12.5 μL、HbPIP1;1F/HbPIP1;1R各0.5 μL、ddH2O 10.5 μL;扩增程序为95℃预变性1 min,98℃变性10 s、60℃退火25 s、72℃延伸1.5 min(30个循环),最后72℃延伸5 min。产物经凝胶电泳检测后回收目的条带,并利用同源重组的方法将其构建到NC- Cam1304-SubN、GADT7、GBKT7、NC- BiFC- Ecn、NC-BiFC-Enn上;重组质粒采用冻融法[12]转入DH5α感受态细胞,经菌落PCR验证后选取阳性克隆送去测序。

表1 本研究所用引物序列
1.2.3 生物信息学分析 采用Protparam (https:// web.expasy. org/protparam/)在线软件对蛋白的理化特性进行分析;用Cell-PLoc 2.0(http://www. csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)在线软件预测亚细胞定位;用TMHMM (http://www.cbs.dtu. dk/services/TMHMM)在线软件分析跨膜结螺旋;用CDD(https://www.ncbi. nlm.nih.gov/cdd)在线软件预测功能结构域;用SOPMA(https://npsa- prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/ npsa_sopma.html)在线软件预测二级结构;用SWISS-MODEL(https://swissm odel.expasy.org/ interactive)在线软件进行三级结构预测。
1.2.4 亚细胞定位 将重组质粒Cam1304-转化GV3101感受态细胞,然后倒置培养2~3 d,挑取阳性克隆并用带有相应筛选抗性的LB液体培养基摇菌至600=0.6;室温下5000 r/min离心10 min收集菌体,参照SPARKES等[13]的方法配置好浸染液重悬2次。选取生长5~6周的烟草,暗处理3 h后,用1 mL微量注射器注射烟草,并做好记号,48 h后制片进行共聚焦显微镜观察。
1.2.5 双分子荧光互补 以Cam1304-为阳性对照,将含NC-BiFC-Ecn-和NC-BiFC-Enn-的农杆菌等量混合或单独转化烟草,然后进行荧光观察。
1.2.6 酵母双杂交 自激活检测按表2所示组合共转至Y2HGold,其中SD-TL、SD-TLH和SD- TLHA分别表示二缺(-Trp/-Leu)、三缺(-Trp/- Leu/-His)和四缺(-Trp/-Leu/-His/-Ade)培养基,28℃倒置培养3~5 d后,统计转化子数量并计算其生长率。待确认GBKT7-无自激活活性后,用SD-TL和SD-TLHA进行实验筛选。
2 结果与分析
2.1 HbPIP1;1基因的克隆
以胶乳cDNA为模板、HbPIP1;1F/R为引物的PCR扩增成功获得1条约900 bp的特异条带(图1),将其切胶回收后用于构建亚细胞定位、双分子荧光互补及酵母双杂交等载体。

表2 本研究所用酵母双杂交组合
2.2 生物信息学分析
序列分析表明,编码区长度为864 bp,GC含量为48.84%;预测编码287 aa,其理论分子量为30.80 kDa、等电点(pI)为8.59、不稳定系数(II)为49.27、脂肪族指数(AI)为22.34、总平均疏水指数(GRAVY)为0.639,表明该蛋白为不稳定的疏水型碱性蛋白。Cell-PLoc 2.0分析显示,蛋白定位在细胞膜上;TMHMM分析显示,蛋白含有6个跨膜螺旋,分别位于55~77位、92~114位、135~152位、180~197位、210~232位和258~280位,每个螺旋的残基数分别为23、23、18、18、23和23;CDD分析显示蛋白含有AQP家族特有的MIP结构域,位于46~276位,包含231个残基;二级结构分析显示,蛋白的α-螺旋占30.66%,延伸链结构占18.47%,β-转角占3.14%,无规则卷曲占47.74%;三级结构预测进一步证实该蛋白含有6个保守的跨膜螺旋(图2)。

M: DL2000 DNA marker; 1: HbPIP1;1.
2.3 亚细胞定位分析
亚细胞定位结果如图3所示,转空载NC- Cam1304-SubN的荧光信号散布于细胞的各个区域,而转Cam1304-的仅见于细胞膜,这证实HbPIP1;1定位在细胞膜。
2.4 双分子荧光互补实验
双分子荧光互补结果如图4所示,与亚细胞定位分析一致,转Cam1304-的阳性对照在细胞膜发现强烈的荧光信号,而单转NC- BiFC-Enn-或NC-BiFC-Ecn-的阴性对照以及共转的实验组均未发现荧光信号,这表明HbPIP1;1自身不能互作。
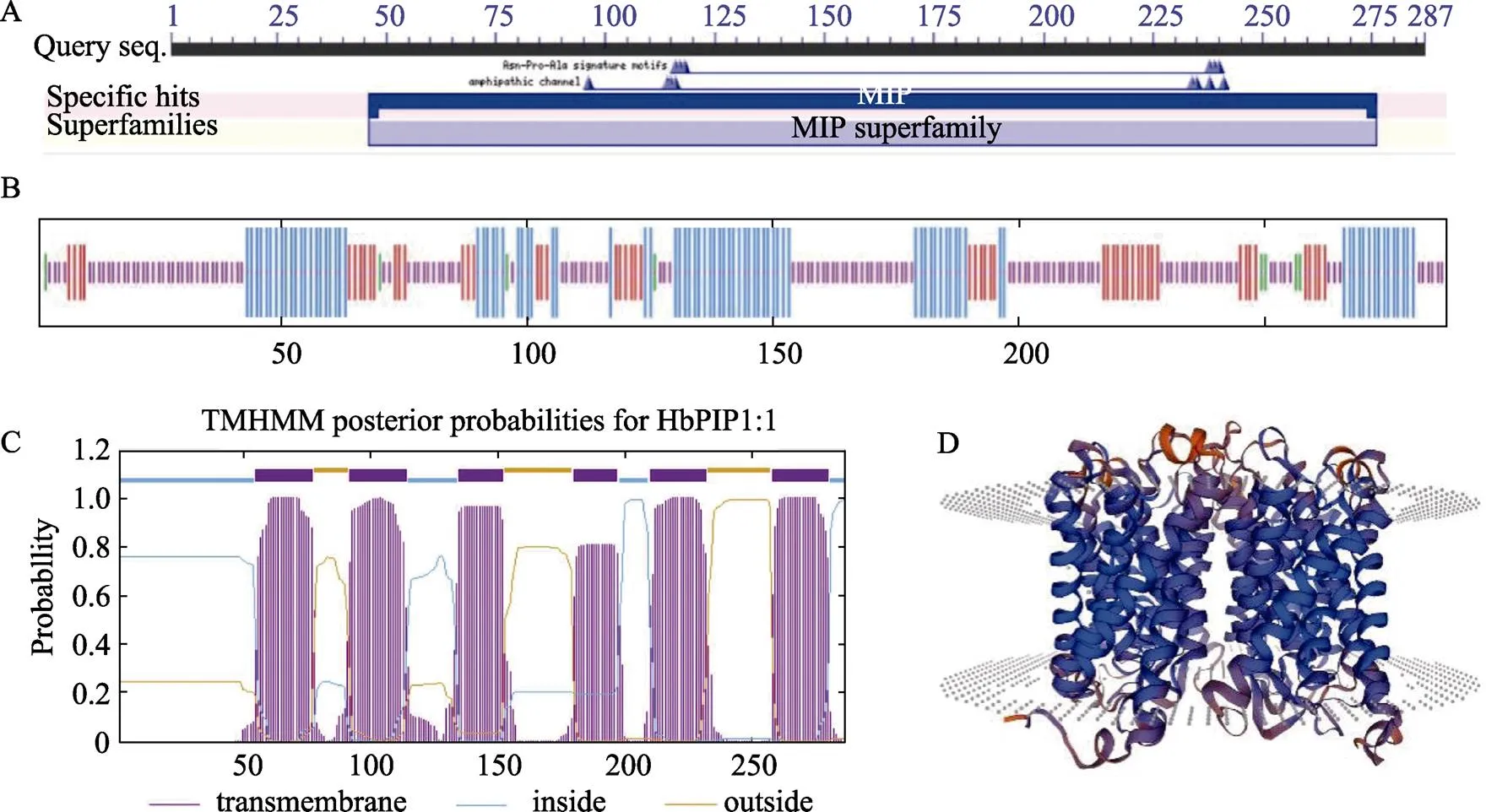
A:保守结构域预测;B:二级结构预测;C:跨膜螺旋预测;D:三级结构预测。
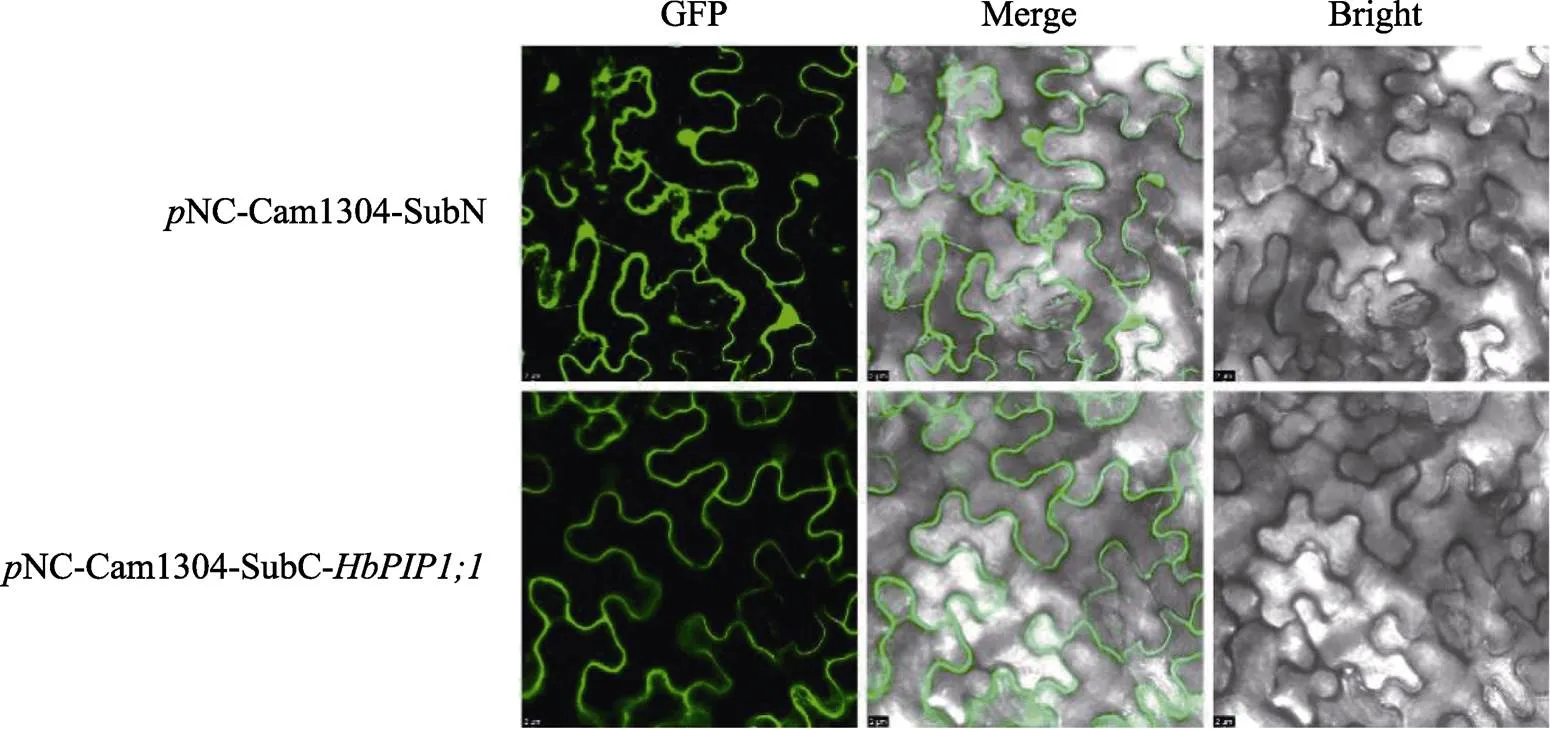
图3 HbPIP1;1的亚细胞定位分析
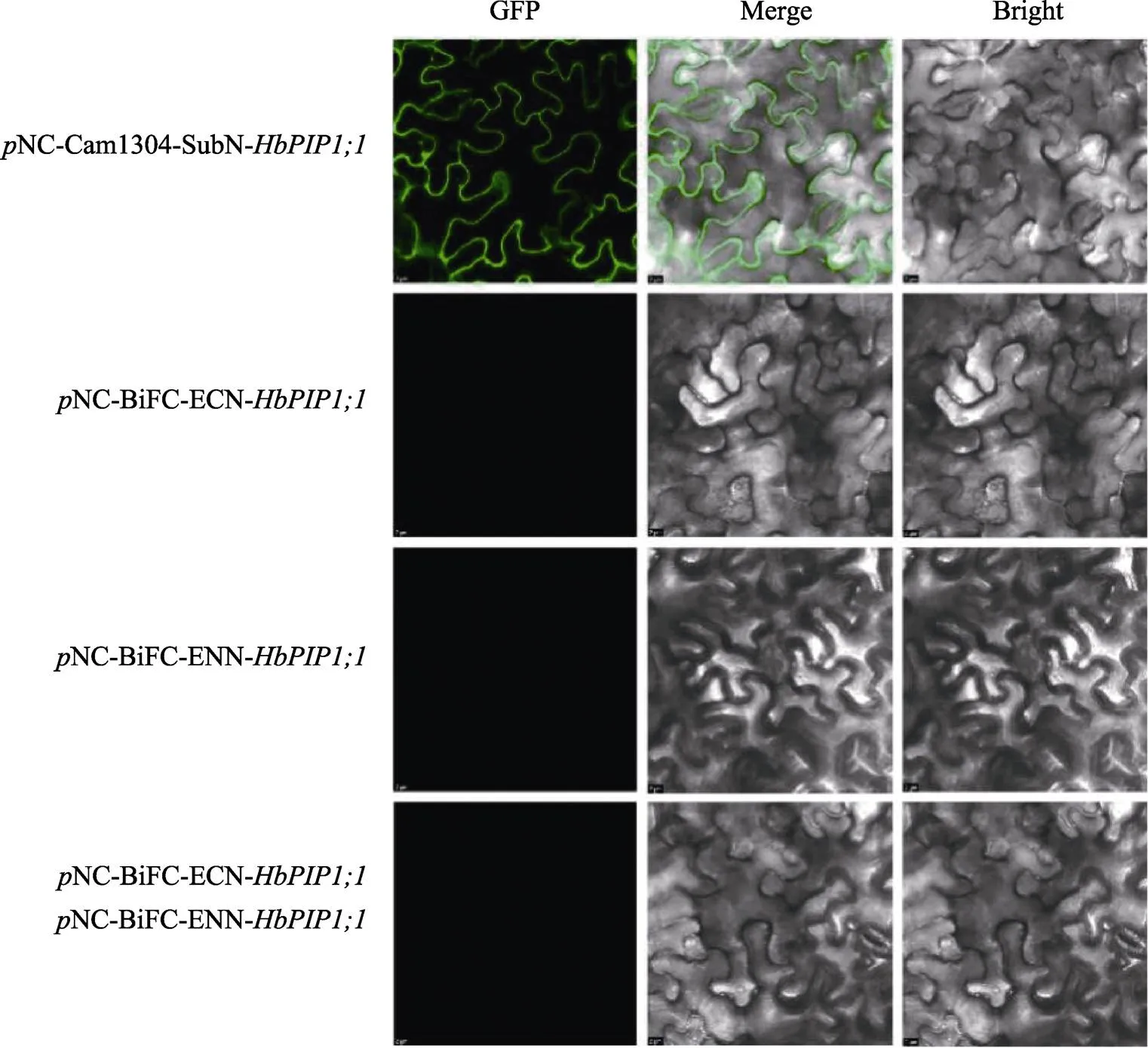
图4 基于双分子荧光互补的HbPIP1;1多聚化分析
2.5 酵母双杂交实验
2.5.1 自激活分析 如图5所示,阳性对照GADT7-LargeT和GBKT7-53m具有强互作,故在培养基SD-TL和SD-TLHA上生长旺盛,其生长率分别为85.13%和88.59%。阴性对照GADT7- LargeT和GBKT7-LaminC之间无互作,故在培养基SD-TLHA上无生长。GADT7和GBKT7-在SD-TLHA上无生长,这表明HbPIP1;1无自激活活性,可用于后续的酵母双杂交实验。
2.5.2 酵母双杂交实验 如图6所示,将GADT7-和GBKT7-配对后,以GADT7-largeT和CBKT7-53m为阳性对照,以GADT7-LargeT和CBKT7-LaminC为阴性对照,进行酵母双杂交实验,结果显示,实验组酵母未见生长,这从另一个角度证实HbPIP1;1自身不能互作。

图5 HbPIP1;1的自激活检测
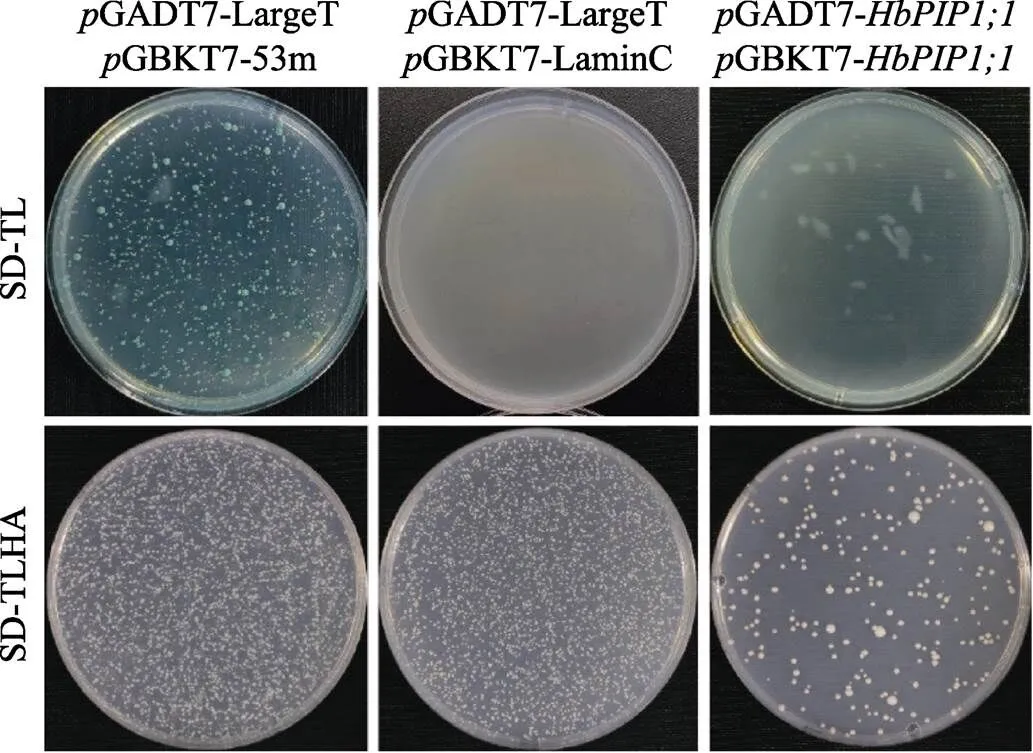
图6 基于酵母双杂交的HbPIP1;1多聚化分析
3 讨论
在植物的生长发育过程中,水作为各种小分子物质的承载物参与了植物的各项生理功能。AQP因其高效的水分转运活性而著称,是调控细胞、组织乃至植物整体水分平衡的核心[9, 14-15]。与其他植物相比,橡胶树的水分平衡显得尤为重要,因为除蒸腾耗水外,周期性的割胶活动会造成水分的大量流失。因此,分离和鉴定橡胶树AQP基因一直是该领域研究的热点[3-4, 7-8, 16-20]。虽然本研究团队已经完成了橡胶树AQP基因的全基因组鉴定[3],并系统揭示了其进化特征[7-8],但对其具体的作用机制仍知之甚少。
本研究对1个在乳管和树皮中均有表达的AQP基因进行了克隆。该基因隶属于PIP亚家族PIP1亚组,编码1个不稳定的疏水型碱性蛋白;蛋白含有AQP家族特有的MIP结构域以及6个典型的跨膜螺旋。鉴于AQP在生物膜上以同源或异源四聚体的形式行使水分转运活性[21-22],研究进一步构建了基因的亚细胞定位、双分子荧光互补以及酵母双杂交等系列载体。生物信息学预测及在烟草叶片中的亚细胞定位分析均显示,HbPIP1;1定位在细胞膜;同时,双分子荧光互补和酵母双杂交实验均表明HbPIP1;1在体外不能形成同源多聚体,因此推测其在细胞膜上主要通过异源多聚体的形式起作用。此外,作为鉴定AQP水分转运功能的重要手段,PIP1及另一个PIP亚组(PIP2)在蟾蜍卵母细胞中表现出明显不同的特性,即PIP2具有高效的水分转运活性,而PIP1无活性或活性很低[10, 16, 20-24]。深入研究发现,PIP1在蟾蜍中无水分转运活性的原因主要在于其不能有效定位到细胞膜[21-22]。当和单独在叶肉原生质中表达时,ZmPIP2定位于细胞膜,ZmPIP1定位于内质网,而当二者共表达时,ZmPIP1却定位于细胞膜,这表明ZmPIP2可介导ZmPIP1的细胞膜定位[23-24]。PIP1和PIP2的异源互作在卷柏、草莓、葡萄、小麦、甜菜等中也有报道[22]。在本研究中,HbPIP1;1之所以定位在细胞膜,很有可能是其可与烟草中的PIP2类蛋白互作进而介导其有效定位。同理,HbPIP1;1在橡胶树中也可能存在与其互作的PIP2类蛋白,并以异源多聚体的形式在水平平衡中起作用。不过,这种假说还有待进一步的实验证实。
[1] 邹 智, 杨礼富, 王真辉, 袁 坤. 巴西橡胶树转基因研究现状与展望[J]. 中国生物工程杂志, 2010, 30(1): 85-92.
ZOU Z, YANG L F, WANG Z H, YUAN K. Advances and prospects on genetic modification of[J]. Chinese Biotechnology, 2010, 30: 85-92. (in Chinese)
[2] 邹 智, 杨礼富, 王真辉, 袁 坤. 橡胶树中橡胶的生物合成与调控[J]. 植物生理学通讯, 2009, 45(12): 1231-1238.
ZOU Z, YANG L F, WANG Z H, YUAN K. Biosynthesis and regulation of natural rubber in[J]. Plant Physiology Journal, 2009, 45: 1231-1238. (in Chinese)
[3] ZOU Z, GONG J, AN F, XIE G, WANG J, MO Y, YANG L. Genome-wide identification of rubber tree (Muell. Arg.) aquaporin genes and their response to ethephon stimulation in the laticifer, a rubber-producing tissue[J]. BMC Genomics, 2015, 16(1): 1001.
[4] ZOU Z. A crucial role of the PIP subfamily in the water balance of laticifers[J]. Gene & Translational Bioinformatics, 2016, 2: e1182.
[5] DANIELSON J A, JOHANSON U. Unexpected complexity of the aquaporin gene family in the moss[J]. BMC Plant Biology, 2008, 8(1): 45.
[6] ZOU Z, GONG J, HUANG Q, MO Y Y, YANG L F, XIE G S. Gene structures, evolution, classification and expression profiles of the aquaporin gene family in castor bean (L.)[J]. PLoS One, 2015, 10(10): e0141022.
[7] ZOU Z, YANG L F, GONG J, MO Y Y, WANG J K, CAO J H, AN F, XIE G S. Genome-wide identification ofaquaporin genes and the comparative analysis provides insights into the gene family expansion and evolution in[J]. Frontiers in Plant Science, 2016, 7: 395.
[8] ZOU Z, YANG J H. Genome-wide comparison reveals divergence of cassava and rubber aquaporin family genes after the recent whole-genome duplication[J]. BMC Genomics, 2019, 20: 380.
[9] GOMES D, AGASSE A, THIEBAUD P, DELROT S, GEROS H, CHAUMONT F. Aquaporins are multifunctional water and solute transporters highly divergent in living organisms[J]. Biochimica et Biophysica Acta (BBA)- Biomembranes, 2009, 1788(6): 1213-1228.
[10] TUNGNGOEN K, VIBOONJUN U, KONGSAWADWO RAKUL P, KATSUHARA M, JULIEN J L, SAKR S, CHRESTIN H, NARANGAJAVANA J. Hormonal treatment of the bark of rubber trees () increases latex yield through latex dilution in relation with the differential expression of two aquaporin genes[J]. Journal of Plant Physiology, 2011, 168(3): 253-262.
[11] TANG C R, QI J Y, LI H P, ZHANG C L, WANG Y K. A convenient and efficient protocol for isolating high-quality RNA from latex of(para rubber tree)[J]. Journal of Biochemical and Biophysical Methods, 2007, 70(5): 749-754.
[12] 邹 智, 郭运玲, 孔 华. 橡胶树叶片衰老相关基因的克隆与表达分析[J]. 西南林业大学学报(自然科学), 2021, 41(4): 42-48.
ZOU Z, GUO Y L, KONG H. Cloning and expression analysis of, a gene associated with leaf senescence in rubber tree (Muell. Arg.)[J]. Journal of Southwest Forestry University (Natural Science), 2021, 41(4): 42-48. (in Chinese)
[13] SPARKES I A, RUNIONS J, KEARNS A, HAWES C. Rapid, transient expression of fluorescent fusion proteins in tobacco plants and generation of stably transformed plants[J]. Nature Protocols, 2006, 1(4): 2019-2025.
[14] ABASCAL F, IRISARRI I, ZARDOYA R. Diversity and evolution of membrane intrinsic proteins[J]. Biochimica et Biophysica Acta, 2014, 1840(5): 1468-1481.
[15] PRESTON G M, AGRE P. Isolation of the cDNA for erythrocyte integral membrane protein of 28 kilodaltons: member of an ancient channel family[J]. Proceedings of the National Academy of Sciences, 1991, 88(24): 11110-11114.
[16] TUNGNGOEN K, KONGSAWADWORAKUL P, VIBOONJUN U, KATSUHARA M, BRUNEL N, SAKR S, NARANGAJAVANA J, CHRESTIN H. Involvement ofandaquaporins in ethylene stimulation of latex yield through regulation of water exchanges between inner liber and latex cells in[J]. Plant Physiology, 2009, 151(2): 843-856.
[17] 邹 智, 莫业勇, 王丹华, 安 锋, 杨礼富. 橡胶死皮相关水通道蛋白编码基因的克隆与序列分析[J]. 安徽农业科学, 2013, 41(34): 13100-13102, 13114.
ZOU Z, MO Y Y, WANG D H, AN F, YANG L F. Molecular cloning and sequence analysis of an aquaporin gene related to tapping panel dryness in the rubber tree (Muell. Arg.)[J]. Anhui Agricultural Sciences, 2013, 41(34): 13100-13102, 13114. (in Chinese)
[18] 邹 智, 王丹华, 莫业勇, 安 锋, 杨礼富. 橡胶死皮相关液泡型水通道蛋白基因的克隆与序列分析[J]. 安徽农业科学, 2013, 41(36): 13851-13854.
ZOU Z, WANG D H, MO Y Y, AN F, YANG L F. Molecular cloning and sequence analysis of a tonoplast aquaporin gene TIP1 associated with tapping panel dryness occurrence in[J]. Anhui Agricultural Sciences, 2013, 41(36): 13851-13854. (in Chinese)
[19] 王 进, 安 锋, 蔡秀清, 邹 智, 张 薇, 林位夫. 橡胶树水通道蛋白基因和的功能鉴定及其表达分析[J]. 林业科学, 2014, 50(1): 69-75.
WANG J, AN F, CAI X Q, ZOU Z, ZHANG W, LIN W F. Function characterization and expression analysis of aquaporins (and) in[J]. Scientia Silvae Sinicae, 2014, 50(1): 69-75. (in Chinese)
[20] AN F, ZOU Z, CAI X Q, WANG J, ROOKES J, LIN W F, CAHILL D, KONG L X. Regulation of, a latex-abundant water transporter, is associated with latex dilution and yield in the rubber tree (Muell. Arg.)[J]. PLoS One, 2015, 10(4): e0125595.
[21] TORNROTH-HORSEFIELD S, WANG Y, HEDFALK K, JOHANSON U, KARLSSON M, TAJKHORSHID E, NEUTZE R, KJELLBOM P. Structural mechanism of plant aquaporin gating[J]. Nature, 2006, 439(7077): 688-694.
[22] BIENERT M D, DIEHN T A, RICHET N, CHAUMONT F, BIENERT G P. Heterotetramerization of plantPIP1 andPIP2 aquaporins is an evolutionary ancient feature to guide PIP1 plasma membrane localization and function[J]. Frontiers in Plant Science, 2018, 9: 382.
[23] ZELAZNY E, BORST J W, MUYLAERT M, BATOKO H, HEMMINGA M A, CHAUMONT F. FRET imaging in living maize cells reveals that plasma membrane aquaporins interact to regulate their subcellular localization[J]. Proceedings of the National Academy of Sciences, 2007, 104(30): 12359-12364.
[24] ZELAZNY E, MIECIELICA U, BORST J W, HEMMINGA M A, CHAUMONT F. An N-terminal diacidic motif is required for the trafficking of maize aquaporinsandto the plasma membrane[J]. Plant Journal, 2009, 57(2): 346-355.
Gene Cloning, Subcellular Localization and Multimerization Analysis offrom
QIAO Xueying1,2,3, ZHENG Yujiao1,2,3, YANG Jianghua4, ZENG Changying1*, ZOU Zhi2,3*
1. College of Tropical Crops, Hainan University, Haikou, Hainan 570228, China; 2. Sanya Research Institute, Chinese Academy of Tropical Agricultural Sciences, Sanya, Hainan 572024, China; 3. Hainan Key Laboratory for Biosafety Monitoring and Molecular Breeding in Off-Season Reproduction Regions / Institute of Tropical Biosciences and Biotechnology, Chinese Academy of Tropical Agricultural Sciences, Haikou, Hainan 571101, China; 4. Rubber Research Institute, Chinese Academy of Tropical Agricultural Sciences, Haikou, Hainan 571101, China
Aquaporins (AQPs),a class of integral membrane proteins facilitating the passive transport of water, are widely present in all living organisms. Evidence shows that AQPs function in homotetramers or hereotetramers in biological membranes. On the basis of the sequence similarity and subcellular localization, plant AQPs could be divided into five main subfamilies, i.e. PIP (plasma membrane intrinsic protein), TIP (tonoplast intrinsic protein), NIP (NOD26-like intrinsic protein), SIP (small basic intrinsic protein), and XIP (X intrinsic protein). Among them, PIPs, which are located in the plasma membrane, represent the main channel mediating water transport between cells. Para or Brazilian rubber tree (Muell. Arg.), a perennial big tree native to the Amazon basin, is the main commercial source of natural rubber currently. Compared with other plants, the water balance is particularly important for rubber tree, because a large amount of water loss could be caused by periodic bark-tapping as well as transpiration. Previous studies showed that the rubber tree genome encodes a high number of 51 AQP genes, which include fiveand ten. To uncover the molecular mechanism of PIP-mediated water balance in rubber tree, a key gene namedwas cloned using the RT-PCR (reverse transcription polymerase chain reaction) technique, followed by investigation of the subcellular localization and multimerization of its coding peptide. Results showed that the CDS (coding sequence) length ofis 864 bp (base pairs), putatively encoding 287 aa (amino acids), which includes a MIP (major intrinsic protein) domain specific to the AQP family; it was predicted to be an instable, hydrophobic, and basic protein that harbors the theoretical molecular weight (Mw) of 30.80 kDa, the isoelectric point (pI) of 8.59, the instability index (II) of 49.27, the aliphatic index (AI) of 22.34, and the grand average of hydropathicity (GRAVY) value of 0.639; it was also shown to contain six transmembrane regions that harbor 20‒23 residues. Moreover, various expression vectors for subcellular localization, bimolecular fluorescence complementation, and yeast two-hybrid were constructed. Consistent with the bioinformatics analysis, transient overexpression ofin tobacco () leaves via the-medicatedtransformation revealed that the protein is located in the plasma membrane. Further bimolecular fluorescence complementation and yeast two-hybrid experiments showed that HbPIP1;1 could not form a homomultimer. The findings presented in this study suggest that HbPIP1;1 may be involved in water balance in the form of heteromultimer, though detailed mechanisms are to be further studied.
; subcellular localization; multimerization; bimolecular fluorescence complementation; yeast two-hybrid
S794.1
A
10.3969/j.issn.1000-2561.2022.12.002
2022-08-01;
2022-09-15
国家自然科学基金项目(No. 31971688);海南省自然科学基金项目(No. 320RC705);中央级公益性科研院所基本科研业务费专项(No. 1630052022001)。
乔雪莹(1996—),女,硕士研究生,研究方向:作物遗传改良。*通信作者(Corresponding author):曾长英(ZENG Changying),E-mail:zengchangying@hainanu.edu.cn;邹 智(ZOU Zhi),E-mail:zouzhi2008@126.com。
