新辅助化疗治疗卵巢癌的疗效及对免疫功能的影响
2023-01-14贾惠惠程艳丽黄喜英宋迎春
贾惠惠,程艳丽,黄喜英,宋迎春
1西安市第一医院妇产科,西安 710000 2西安高新医院妇产科,西安 710000
卵巢癌是当前较常见的一种妇科恶性肿瘤,病死率较高[1],由于其早期症状不明显且缺乏特异性,约75%的患者在临床就诊时已处于Ⅲ期或Ⅳ期[2-3]。虽然经过对症治疗,患者的临床症状可以得到一定程度的改善,或卵巢癌的进展得到减缓,但该病始终存在较高的复发率,始终居女性妇科肿瘤病死率之首[4]。细胞减灭术(cytoreductive surgery,CRS)联合化疗是当前治疗晚期卵巢癌患者的标准方案[5-6],但是卵巢癌多为Ⅲ期及以上,可能会存在一定程度的脏器转移;加之机体的免疫状态相对较弱,还会出现一定程度的腹腔积液。这不仅影响了CRS的应用效果,还影响了临床其他治疗方案的缩瘤满意程度[7]。CRS联合腹腔热灌注化疗是近年来卵巢癌广泛应用的联合治疗方案[8],而新辅助化疗可以在一定程度上改善临床缩瘤的满意效果。故本研究探讨新辅助化疗治疗卵巢癌的疗效及对患者免疫功能的影响,帮助临床正确认识新辅助化疗在联合用药方案中的积极作用,现报道如下。
1 对象与方法
1.1 研究对象
选取2020年1月至2021年1月在西安市第一医院住院的76例卵巢癌患者为研究对象。纳入标准[9]:①经病理检查确诊为卵巢癌,TNM分期为Ⅲ~Ⅳ期,经临床综合评估,患者无法进行根治性手术;②腹腔内无粘连;③预期生存期>6个月,卡氏功能状态(Karnofsky performance status,KPS)评分>70分;④意识清晰,具备本研究所需的基本沟通理解能力。排除标准[10]:①心、肺、肾功能不全;②纳入本研究前1个月内接受过抗肿瘤治疗;③存在精神系统疾病;④肿瘤出现转移;⑤存在基础疾病或不具备接受本研究治疗方案的条件;⑥依从性差;⑦中途退出治疗。采用随机数字表法将76例卵巢癌患者分为两组,每组38例。对照组患者,平均年龄(55.7±2.16)岁;TNM分期:Ⅲ期25例,Ⅳ期13例;病理分型:浆液性囊腺癌19例,黏液性囊腺癌8例,混合性上皮癌8例,透明细胞癌3例。观察组患者,平均年龄(55.7±2.16)岁;TNM分期:Ⅲ期24例,Ⅳ期14例;病理分型:浆液性囊腺癌20例,黏液性囊腺癌8例,混合性上皮癌8例,透明细胞癌2例。两组患者各基线特征比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准通过,所有患者均知情同意并签署知情同意书。
1.2 治疗方法
对照组患者予以CRS+术后腹腔热灌注治疗,术后给予紫杉醇+卡铂(TC)/紫杉醇+顺铂(TP)方案化疗。观察组在对照组基础上给予术前新辅助化疗。
对照组患者经临床检查无明显手术禁忌,予以CRS:按照肝圆韧带、大/小网膜、右-左上腹、膈面-侧壁腹膜、右-左骼窝、盆底腹膜、小肠系膜的顺序,逐个对患者进行最大程度的CRS,紧接着对壁层腹膜进行针对性的区域性整片剥脱术,尤其是存在病变的肠道,对其进行精准肠管切除。与重要器官粘连的肿瘤则予以球形电刀气化、碳化局部组织进行有效处理。
在CRS实施时,首先采用预热好的43℃生理盐水对患者腹腔进行彻底冲洗,待其恒温后,将顺铂80 mg+生理盐水1800 ml+地塞米松10 mg加入腹腔灌注化疗仪内,45℃快速滴入,总灌注时间为1 h。再以2~3 L平衡盐溶液有效冲洗患者腹腔。在热灌注化疗后第2天拔除灌注治疗相关组件。术后28天末对患者进行第二次腹腔热灌注化疗。共治疗2个疗程。
术后TC化疗方案:分别于化疗前12、6 h给予患者口服10~20 mg地塞米松;于化疗前30 min,肌内注射40 mg苯海拉明;于化疗第1天给予175 mg/m2紫杉醇,静脉滴注3 h;静脉滴注卡铂,剂量为AUC=5;每3周为1个疗程,共治疗6个疗程。
术后TP化疗方案:以紫杉醇135 mg/m2联合顺铂75 mg/m2全身静脉滴注,予以护肝护胃治疗直至化疗结束,适当给予地塞米松等药物预防过敏;每3周为1个疗程,共治疗6个疗程。
术前新辅助化疗:紫杉醇150 mg/m2联合顺铂70 mg/m2化疗,每28天为一个周期,共治疗3个周期。
1.3 观察指标
比较两组患者的治疗一般情况、疗效及不良反应;比较不同时间两组患者的免疫指标;对患者随访1年,观察其复发及生存情况。
1.4 评价标准
参照世界卫生组织(WHO)实体瘤疗效评价标准[11]评价疗效。①完全缓解(CR):患者复查时,各项生化指标均在正常范围内,且卵巢癌病灶已完全消失,未出现新发病灶;②部分缓解(PR):患者复查时,肿瘤体积缩小>50%且未出现新发病灶;③稳定(SD):患者复查时,肿瘤体积缩小≤50%或增大≤25%,且未出现新发病灶;④进展(PD):患者复查时,肿瘤体积增大>25%,或出现新发病灶。
1.5 统计学分析
采用SPSS 23.0统计软件进行数据分析。计量资料以均数±标准差(±s)表示,多组间比较采用方差分析,两组间比较采用t检验,计数资料以例数及率(%)表示,组间比较采用χ2检验,等级资料的比较采用Mann-WhitneyU检验。以P<0.05为差异有统计学意义。
2 结果
2.1 治疗一般情况的比较
观察组患者手术时间、住院时间均短于对照组,腹腔积液量、术中出血量均少于对照组,术后感染发生率低于对照组,差异均有统计学意义(P<0.05)。(表1)

表1 两组患者治疗一般情况的比较
2.2 免疫指标的比较
整体分析发现,两组患者CD3+CD4+、CD3+CD56+、CD3+CD4+/CD3+CD8+的时间、组间比较,差异均有统计学意义(F时间=158.694、37.559、19.663,F组间=22.970、8.117、155.583,P<0.01),交互作用比较,差异均无统计学意义(P>0.05)。进一步两两比较,化疗前、手术后,两组患者CD3+CD4+、CD3+CD56+、CD3+CD4+/CD3+CD8+比较,差异均无统计学意义(P>0.05);腹腔热灌注后、化疗后,观察组患者 CD3+CD4+、CD3+CD56+、CD3+CD4+/CD3+CD8+均高于本组化疗前、手术后及对照组,差异均有统计学意义(P<0.05)。(表2)

表2 不同时间两组患者免疫指标的比较
2.3 近远期疗效的比较
观察组患者临床疗效优于对照组,差异有统计学意义(U=1.968,P<0.05)(表3);1年后,观察组患者复发6例,死亡1例,对照组患者复发8例,死亡2例,两组患者复发情况及生存情况比较,差异均无统计学意义(P>0.05)。
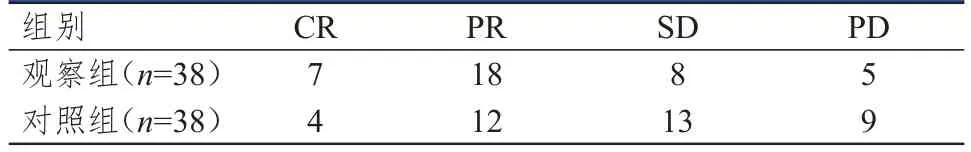
表3 两组患者的临床疗效
2.4 不良反应发生情况的比较
观察组患者不良反应总发生率为5.26%(2/38),低于对照组的26.32%(10/38),差异有统计学意义(χ2=6.333,P<0.05)。(表4)

表4 两组患者的不良反应发生情况[n(%)]
3 讨论
卵巢癌患者的5年生存率相对较低[11],晚期会出现腹腔内的种植扩散,还会出现腹腔积液、盆腔转移。虽然已经证实CRS治疗卵巢癌具有良好效果,但是仍存在转移甚至腹腔积液的情况[12],不仅会影响治疗效果,还会导致无法完整取出病灶[13],增加再次扩散的可能,严重者还会进一步造成术后复发。铂类化疗是当前学术界公认的治疗卵巢癌较好的一线方案[14]。虽然其可能有较好的预期,但是在实际治疗过程中,化疗药物通过全身途径进入腹腔后,浓度已经相对较低,不足以充分杀灭卵巢癌细胞及出现转移的腹腔、盆腔内的肿瘤细胞[15]。研究证实,温热效应在一定层面上对卵巢癌细胞有一定的杀伤作用,并且有利于进一步控制腹腔积液,采用腹腔热灌注化疗的最佳治疗时间为1 h[16]。本研究中,对照组予以CRS+术后腹腔热灌注及术后TC/TP方案治疗,而观察组则在其基础上予以术前新辅助化疗,结果显示,观察组患者手术时间、住院时间均短于对照组,腹腔积液量、术中出血量均少于对照组,术后感染发生率低于对照组,差异均有统计学意义(P<0.05),可见术前对患者采用新辅助化疗,能够在一定程度上缩短CRS的手术时间,减少腹腔积液量。新辅助化疗通过缩小卵巢癌患者局部肿瘤病灶并改善肿瘤病灶与周围组织的粘连情况[17],在术前达到降低卵巢癌病灶个数及体积的效果,一定程度上有利于实施后续治疗方案,从而达到满意的CRS目的。
同时,腹腔热灌注有利于提高化疗药物局部浓度,并且能够增强化疗药物对卵巢癌细胞的渗透能力[18],发挥有效的杀伤作用。且43~45℃环境下持续的热灌注有利于化疗药物在温热效应和持续循环的状态下,将腹腔内脱落的肿瘤细胞进行机械性冲洗[19],以彻底冲刷出体外,进而减少患者术后复发转移情况。本研究中,观察组患者临床疗效优于对照组,可见观察组的治疗方案在一定程度上有利于提高患者的疗效,而进一步研究发现,两组患者复发情况及生存情况比较,差异均无统计学意义(P>0.05)。这可能是因为卵巢癌患者已经出现局部转移的病灶中可能存在肿瘤干细胞[19],而此类细胞对于铂类药物并不敏感,甚至可能存在一定的耐药情况,因此在疗程结束后的间歇期大量增殖,从而发生远期复发,降低了治疗方案的最终效果。而本研究仅随访1年,这对于卵巢癌患者来说时间相对较短,后续的研究可进一步完善随访,进行远期观察。
卵巢癌患者大多处于晚期,并在体内存在一定程度的免疫抑制,而免疫细胞是机体抵抗肿瘤细胞增殖转移的重要细胞,以T细胞亚群为代表。本研究观察两种治疗方案对卵巢癌患者免疫功能的影响,对外周血免疫指标CD3+CD4+、CD3+CD56+、CD3+CD4+/CD3+CD8+进行检测,发现治疗后观察组患者免疫指标均有所提高,腹腔热灌注后、化疗后,观察组患者 CD3+CD4+、CD3+CD56+、CD3+CD4+/CD3+CD8+均高于本组化疗前、手术后及对照组,对照组化疗后 CD3+CD4+、CD3+CD56+、CD3+CD4+/CD3+CD8+均高于本组化疗前,说明两种治疗方案均具有一定的免疫抑制改善作用,观察组患者术前应用了新辅助化疗,进一步提升了患者的免疫功能,这不仅有利于激活机体的免疫系统[20],还能进一步改善患者的免疫抑制,提高最终的治疗效果。此外,观察组患者不良反应总发生率低于对照组,观察组的术前新辅助化疗有利于抑制肿瘤生长,改善患者预后且临床安全性相对较好。综上所述,术前应用新辅助化疗可以帮助缩短CRS的手术时间,减少患者腹腔积液量,一定程度上有利于实施后续TC/TP方案,能够达到满意的CRS目的。此外,还能进一步激活机体的免疫系统,改善患者的免疫抑制,提高最终的治疗效果,临床安全性相对较好。
