一株高效溶磷细菌的条件优化及其溶磷特性研究
2023-01-05李思思张博源符运会周佳屈建航
李思思 张博源 符运会 周佳 屈建航
(河南工业大学生物工程学院,郑州 450001)
磷是植物细胞内重要物质和结构的组成元素,对促进植株的生长发育和新陈代谢发挥着重要作用[1]。在植物吸收利用的磷元素中,95%以上是可溶性无机磷;但在土壤生态环境中,大部分的磷与金属阳离子结合,以难溶性无机磷或有机磷的无效磷形式存在,导致植物难以直接吸收利用[2-4]。第二次全国各地土壤普查以及相关资料可知,在中碱性土壤中速效磷含量低于5 mg/kg 以及酸性土壤中低于16 mg/kg 时,土壤则处于缺磷状态[5]。相关统计显示,全世界约有43%的耕地土壤缺乏能被植物直接吸收利用的有效磷,我国缺乏有效磷的耕地土壤更是占我国总耕地的70%以上[6]。为了保证农业生产,通常会向土壤中施加可溶性磷肥来满足作物对磷素的需求,但长期施肥会降低土壤对磷的吸附量,加大磷素在深层土壤的迁移,增加土壤磷渗漏率,造成水体富营养化等风险;不合理的使用磷肥也会引发土壤生态恶化[7]、有机质减少、微生物区系改变等问题,严重制约农业可持续发展[8],造成农业面源污染,进一步加重土壤矿质化污染[9]。同时,磷是一种不可再生资源,而大部分磷肥开采自磷酸盐岩,按照目前的开采速度,全球的磷酸盐岩将于50-100年内消耗殆尽[10-13]。因此,如何能够高效利用土壤中的难溶性磷是降低磷肥使用量和提高作物磷元素利用率的关键,是我国农业可持续发展中所急需解决的问题之一。
溶磷菌在土壤磷循环中起着举足轻重的作用,通过溶解难溶性磷酸盐来提高植物的有效磷库,提高磷元素利用率,减少磷肥施用量[14]。近年来溶磷菌剂逐渐成为现代农业可持续发展中的新型肥料,而高效溶磷菌的筛选和应用,是当今土壤微生物资源开发研究的热点。在所报道的溶磷菌中,假单胞菌属是降解难溶性磷源的优选菌种之一,典型代表有铜绿假单胞菌(Pseudomonas aeruginosa)、荧光假单胞菌(Pseudomonas fluorescens)等。胡珊等[15]从中药渣堆肥中筛选出一株对卵磷脂具有较强溶解效果的铜绿假单胞菌;朱梦卓等[16]从野大豆中分离出一株假单胞菌YDX26,该菌株可以溶解磷酸钙,通过提高酶活等促进水稻生长;沈佳佳等[17]在油用牡丹根际筛选出的假单胞菌FD4-13,对植酸钙具有较强的溶解能力。不同假单胞菌溶解能力有一定差异,且于土壤中的应用研究报道较少,高效溶磷菌种的筛选和性能考察仍是当前研究的重要内容之一。本研究以从湖泊沉积物中筛选出的高效溶磷菌1616X1 为研究对象,优化和研究其溶磷特性;明确其在土壤中的定殖和溶磷能力,为该菌在微生物肥料方面的开发及应用提供依据。
1 材料与方法
1.1 材料
1.1.1 菌种 细菌1616X1 是本实验室从湖泊沉积物中分离筛选获得。
1.1.2 培养基 LB 培养基(g/L):胰蛋白胨10.00,酵 母 粉5.00,NaCl 10.00,pH 7.0-7.2,121℃ 灭菌20 min[18]。NBRIP(National Botanical Research Institute’s Phosphate)培养基(g/L):葡萄糖10.00,MgCl2·6H2O 5.00,MgSO4·7H2O 0.25,KC1 0.20,(NH4)2SO40.10,Ca3(PO4)25.00,pH 7.0,115℃灭菌30 min[19]。
1.2 方法
1.2.1 菌种鉴定 形态学观察及生理生化测定,参考《伯杰细菌鉴定手册》[20]和《常见细菌系统鉴定手册》[21]。采用SDS-碱裂解法提取细菌DNA,利用通用引物27F 和1492R 进行16S rRNA 基因PCR扩增[22],扩增产物琼脂糖凝胶电泳检测并进行核苷酸序列测定,所得序列在GenBank 数据库中进行对比,利用MEGA7.0 软件邻近法构建系统发育树。
1.2.2 磷标准曲线制作 取比色管,分别加入2 mg/L KH2PO4标准溶液0.00、0.25、0.50、1.50、2.50、5.00、7.50 mL,定容至25 mL;加入4 mL 钼锑抗显色液,混匀,静置15 min 后测定880 nm 吸光值。以磷浓度为横坐标,吸光值为纵坐标绘制磷标准曲线[23]。
1.2.3 溶磷曲线 将1616X1 单菌落接种于液体LB培养基,28℃、150 r/min 培养12 h,种子液离心,用无菌水将菌株1616X1 种子液制备成OD600为1 的菌悬液,以5%(V/V)接种于NBRIP 液体培养基中,28℃,150 r/min 摇床培养,每24 h 取样,8 000 r/min离心10 min,钼锑抗比色法测定上清液中可溶性磷浓度[24]。
1.2.4 溶磷条件优化
(1)单因素试验 培养基组分优化:采用不同碳源(葡萄糖、蔗糖、柠檬酸钠、乙酸钠、可溶性淀粉、麦芽糖、果糖)代替NBRIP 基础培养基中碳源,通过钼锑抗比色法测定上清液中的有效磷含量。改变最佳碳源浓度(2.5、5、10、15、20、30 g/L)进行发酵培养以确定最佳碳源浓度[25]。最佳氮源(尿素、硝酸钾、氯化铵、蛋白胨、硫酸铵)及最适氮源浓度(0.02、0.05、0.10、0.15、0.20、0.40 g/L)的确定采用相同方式[18,26]。培养条件优化:在其他条件不变的情况下,分别改变培养液的pH(4、5、6、7、8、9)、装液量(50、75、100、125、150 mL)、接种量(1%、3%、5%、7%、10%)、培养温度(20、24、28、32、37℃),以上清液中可溶性磷含量最高的条件为最适[4]。
(2)响应面法优化 通过SAS 9.2 对单因素进行显著性分析,采用Design Expert 12 对显著影响溶磷菌溶磷的氮源浓度(A)、温度(B)和pH(C)进行编码,以溶磷量为响应值,采用Box-Behnken试验设计响应面试验。试验因素的设计水平及编码见表1。实验结果利用Design Expert 12 软件进行统计分析,利用各因子两两交互响应面,等高线以及响应面回归模型进行优化,找出1616X1 的最大溶磷量对应各因子的最优值,并进行验证试验。

表1 响应面试验的因素及水平Table 1 Factors and levels of response surface experiment
1.2.5 土壤培养试验 供试土壤取自校园周边菜地以及某宿舍楼花圃(34°83′N,113°55′E),使用表层以下5-10 cm 土壤,土质黄褐色,其中菜地土壤pH 7.94,全磷含量13.85 mg/kg,速效磷4.53 mg/kg;花圃土壤pH 7.93,全磷含量26.74 mg/kg,速效磷含量4.2 mg/kg。自然风干后过20 目筛,250 mL 三角瓶分装100 g 土壤,121℃ 30 min,间歇灭菌3 次,灭菌土壤加入1%(V/W)葡萄糖,接种2 mL 1616X1 菌悬液(接种后的起始浓度为4×107CFU/g),同时以加入等量无菌水的处理作为对照,土壤湿度40%,每个处理设置平行,28℃恒温培养,分别在0、1、3、5、8、12、17、23 d 采样[27-30],以LB 固体培养基为基础,采用稀释涂布平板法测定菌株1616X1 的定殖情况,利用NaHCO3浸提法和pH 计测定土壤速效磷含量以及pH 值[5,31-32]。
1.2.6 数据处理 用Excel 2010 软件进行数据处理,SAS 9.2 软件[33]进行显著性分析,Origin 9.0 软件[34]作图,Design-Expert 12.0 软件[35]进行响应面优化及回归方程方差分析。
2 结果
2.1 菌种鉴定结果
细菌1616X1 为革兰氏阴性菌,杆状,菌落白色圆形,接触酶、氧化酶、荧光反应、硝酸盐还原、脲酶反应阳性,淀粉水解、明胶水解反应阴性,在0-5% NaCl 条件下生长,在pH 5-9 之间生长。
将菌株1616X1 的16S rRNA 的基因序列(登录号:MK041527.1) 输入GenBank 数据库中进行BLAST 比对,分析结果表明,菌株1616X1 与Pseudomonas putidaNBRC 14164(NR 113651.1) 的相似度99.37%,利用MEGA7.0 邻接法构建系统发育树(图1),聚集在一起。根据菌落形态及生理生化特征,结合系统发育分析,初步鉴定菌株1616X1为假单胞菌(Pseudomonassp.)。
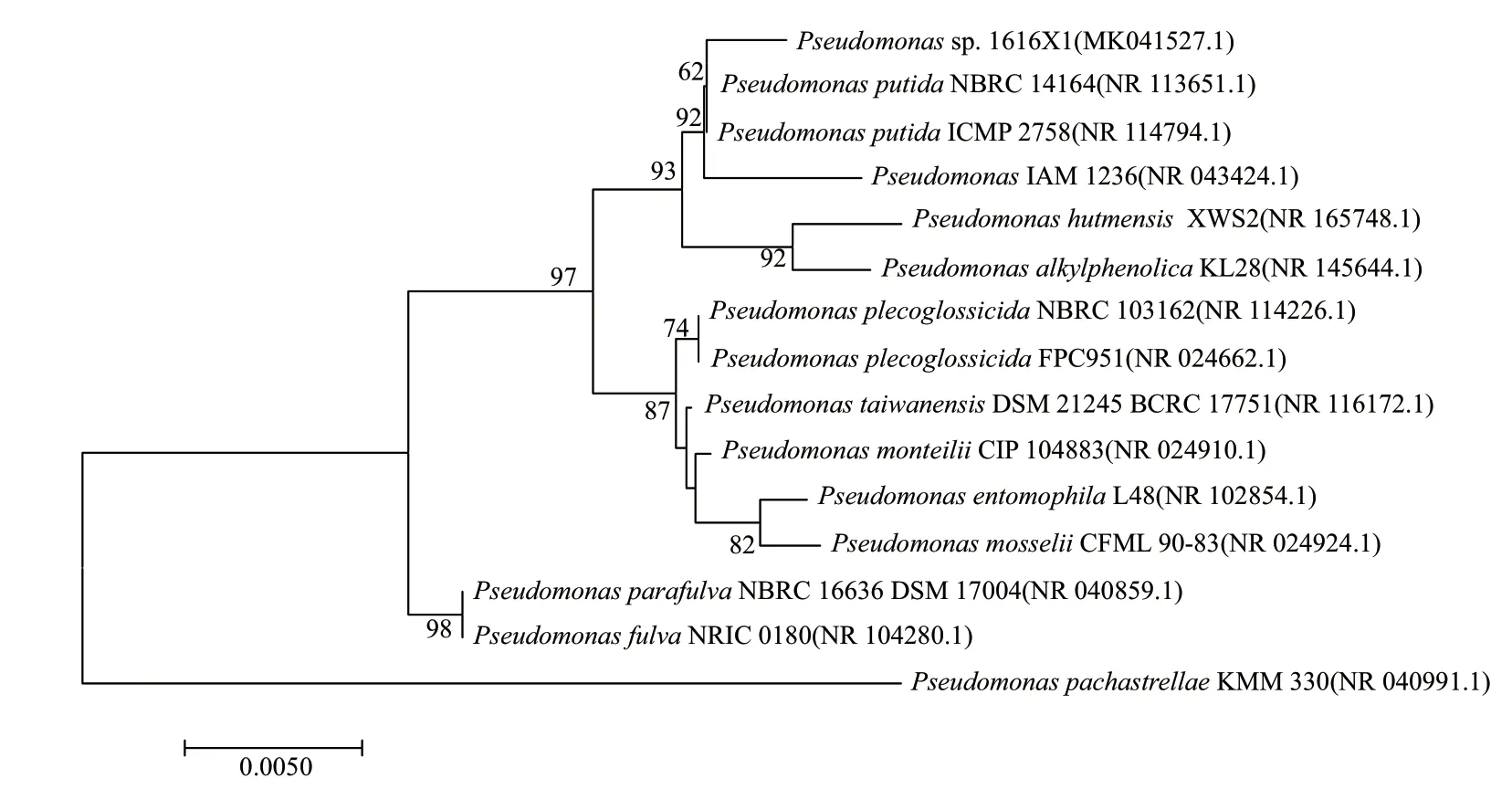
图1 菌株1616X1 基于16S rRNA 基因序列的系统发育树Fig.1 Phylogenetic tree of strain 1616X1 based on 16S rRNA sequences
2.2 溶磷曲线
在NBRIP 培养基中接种菌株1616X1,每24 h测试发酵液中的可溶性磷含量及pH 值,其结果如图2所示。
由图2-a 可知,在0-96 h,1616X1 的溶磷量不断增加,在96 h 时,溶磷量达到最大值,为568.76 mg/L,随后开始下降;pH 在96 h 时达到最低3.85。由图2-b Pearson 相关性分析可知,菌株1616X1 溶磷量与pH 值之间存在显著负相关关系(r=-0.976,P<0.01),同时结合图2-a,发酵液中pH 值随溶磷量的上升而下降,可能是溶磷菌在发挥作用时分泌出某些酸性物质所致。
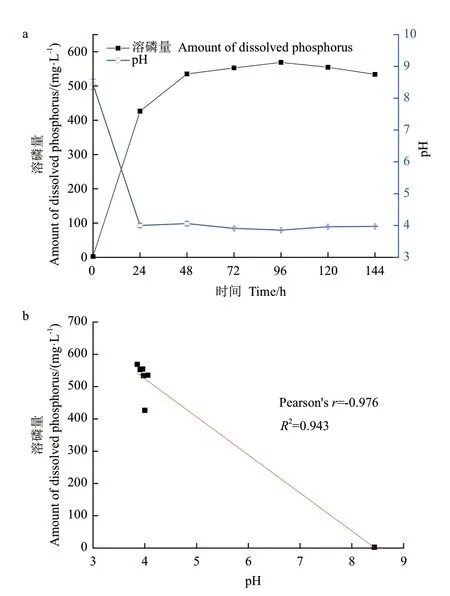
图2 1616X1 溶磷曲线及溶磷量与pH 相关性分析Fig.2 1616X1 phosphate-dissolving curve and correlation analysis of solubilized phosphorus amount and pH
2.3 溶磷条件优化结果
2.3.1 碳源 将1616X1 菌接种于含有等质量不同碳源的培养基中,探究碳源对1616X1 菌株溶磷能力的影响。由图3-a 可知,当葡萄糖为碳源时,1616X1溶磷量最高为585.67 mg/L,对应pH 为4.24;将葡萄糖用相同质量的其他碳源替换后,溶磷量均显著降低,说明菌株1616X1 对其他碳源的利用力差,以葡萄糖为最佳碳源。进一步对葡萄糖浓度进行优化,由图3-b 可知,当葡萄糖浓度为2.50-5.00 g/L 时,由于碳源不足而导致菌体量较少,溶磷量低,最终pH 相比于其他梯度较高;而葡萄糖浓度在10-30 g/L范围时溶磷量与浓度为10 g/L 时结果无显著性差异,发酵液中最终pH 也无明显变化,选取葡萄糖浓度10 g/L 作为最佳碳源浓度。
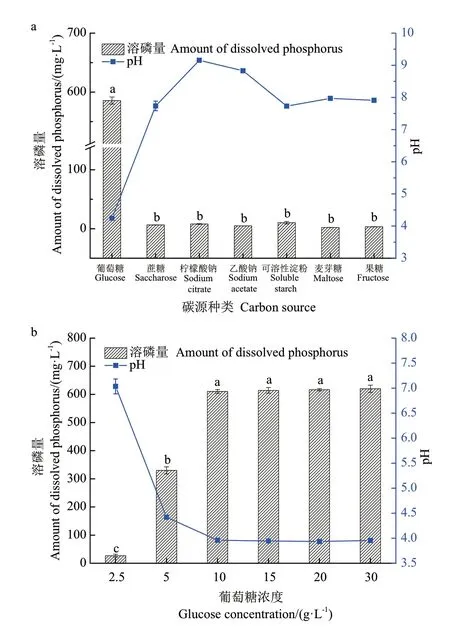
图3 碳源种类和浓度对1616X1 溶磷能力的影响Fig.3 Effects of carbon source type and concentration on the phosphate-dissolving ability of 1616X1
2.3.2 氮源 氮是细菌细胞中核酸与蛋白质的重要组成部分,在菌株生长代谢过程中不可或缺。氮源对1616X1 溶磷能力的影响如图4-a 所示,在以硫酸铵和氯化铵为氮源时,溶磷量分别为576.38 mg/L 和575.45 mg/L,与其他氮源物质在溶磷能力之间存在显著性差异(P<0.01);6 种氮源的溶磷体系pH 变化与对氮源的利用顺序一致,pH 由低到高依次为硫酸铵、氯化铵、硝酸钾、蛋白胨、胰蛋白胨、尿素,在以硫酸铵为氮源时,pH 最低,为3.92,而以胰蛋白胨为氮源时,pH 最高,为4.12,进一步说明溶磷量与pH 的负相关性,选择硫酸铵为最佳氮源。将硫酸铵在0.025-0.40 g/L 范围内分为6 个浓度,结果如图4-b 所示,其浓度为0.10 g/L 时菌株1616X1 溶磷量最高,为632.03 mg/L,故选取硫酸铵浓度为0.10 g/L 时作为最佳氮源浓度。
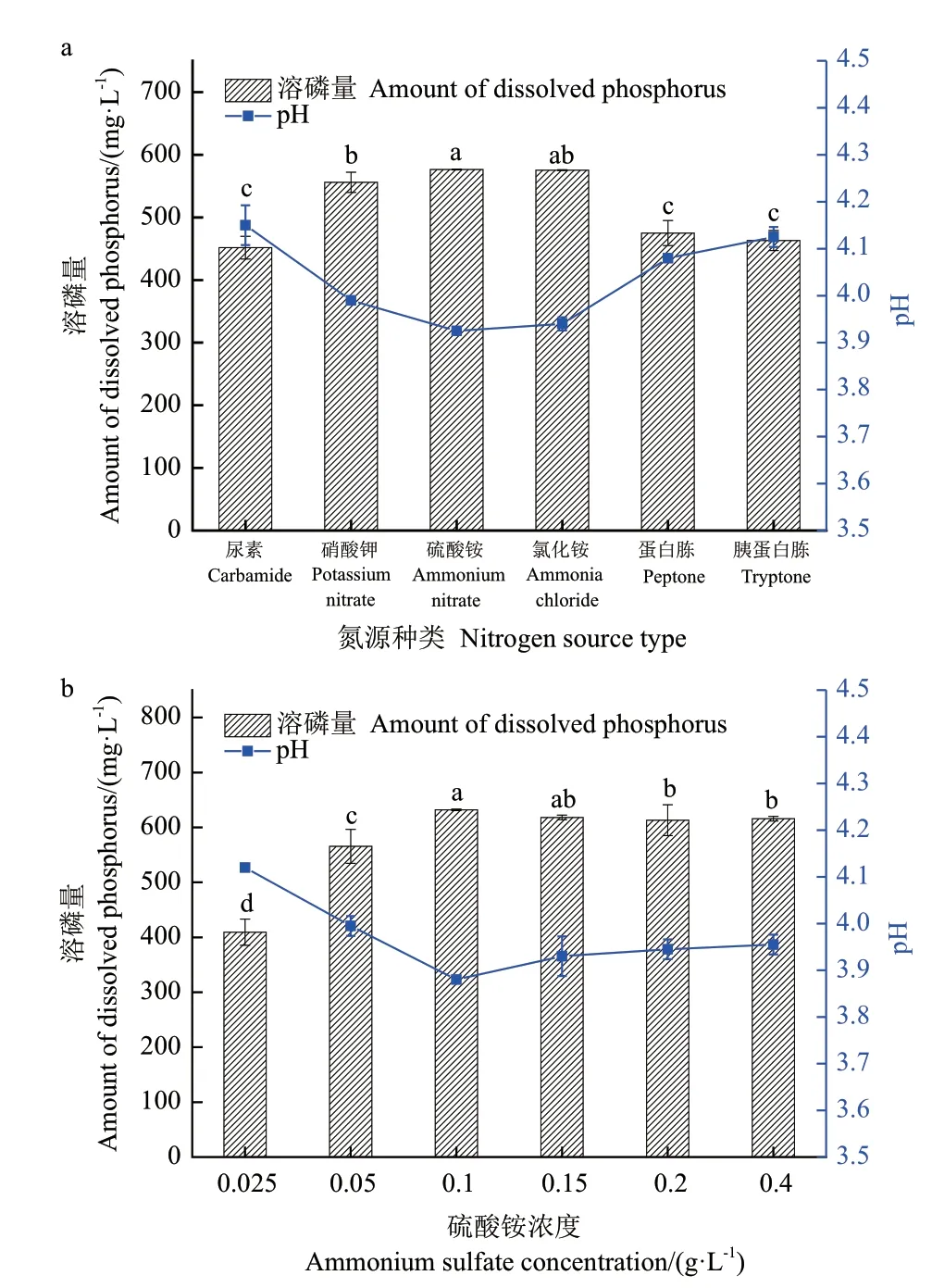
图4 氮源种类和浓度对1616X1 溶磷能力的影响Fig.4 Effects of nitrogen source type and concentration on the phosphate-dissolving ability of 1616X1
2.3.3 温度 从图5可知,菌株在24℃培养时,溶磷量最高,为627.89 mg/L,温度为37℃时,溶磷量最低为400.46 mg/L;当发酵温度高于或低于24℃时,菌株1616X1 的溶磷能力均有下降,并且差异显著(P<0.01),选取24℃为最佳发酵温度。

图5 温度对1616X1 溶磷能力的影响Fig.5 Effect of temperature on the ability of 1616X1 dissolving phosphate
2.3.4 初始pH 由图6可知,菌株1616X1 在pH 4-9 的范围内具有较好的溶磷能力;当初始pH 在4-6时,溶磷量较高,差异不显著(P>0.05);pH 为6 时,溶磷量最高,为619.03 mg/L;pH 9 时,溶磷量最低,为532.19 mg/L,原因可能是体系中碱性较强,溶磷菌分泌的有机酸有限,影响了溶磷效果,故选取pH为6 时为最佳初始pH。

图6 初始pH 对1616X1 溶磷能力的影响Fig.6 Effects of initial pH on the ability of 1616X1 dissolving phosphate
2.3.5 接种量 如图7所示,接种量为5%时,溶磷量最高,为637.45 mg/L;接种量为10%时,溶磷量最低,为585.02 mg/L;接种量高时,虽然能够缩短菌株生长周期,充分利用养分,但菌株生长繁殖时也会产生对菌株具有抑制作用的代谢物,从而影响菌株的溶磷量。经显著性分析,接种量在1%-7%之间时,菌株1616X1 溶磷差异不显著(P>0.05),接种量为5%是菌株1616X1 溶磷的最佳接种量。

图7 接种量对1616X1 溶磷能力的影响Fig.7 Effect of inoculum quantity on the phosphate-dissolving ability of 1616X1
2.3.6 装液量 如图8所示,装液量为75 mL/250 mL 时,溶磷量最高,为606.72 mg/L,当装液量为150 mL/250 mL,溶磷量为585.02 mg/L;经方差分析和显著性检验表明,装液量对菌株1616X1 的溶磷差异不显著(P>0.05),故选择75 mL/250 mL 为最佳装液量。

图8 装液量对1616X1 溶磷能力的影响Fig.8 Effect of liquid loading on the ability of 1616X1 dissolving phosphate
2.4 方差分析
在单因素实验基础上,进行方差分析来确定各因素对1616X1 溶磷量的影响,方差分析结果如表2所示。葡萄糖浓度、硫酸铵浓度、温度、初始pH均对1616X1 溶磷产生极显著影响,结合单因素分析结果,最终选择硫酸铵浓度、pH、温度3 个因素进行响应面优化。
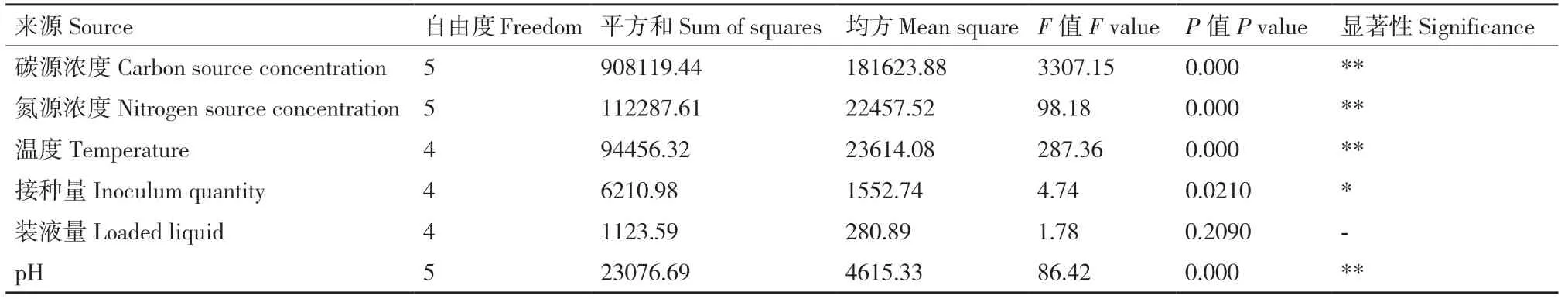
表2 方差分析Table 2 Analysis of variance
2.5 响应面法优化结果
2.5.1 响应面实验结果 Box-Behnken 试验设计及结果如表3。其中,A 为硫酸铵浓度,B 为pH,C 为温度,Y 为溶磷量。对其进行多元回归拟合分析,得到响应值为菌株1616X1 溶磷量的回归方程:
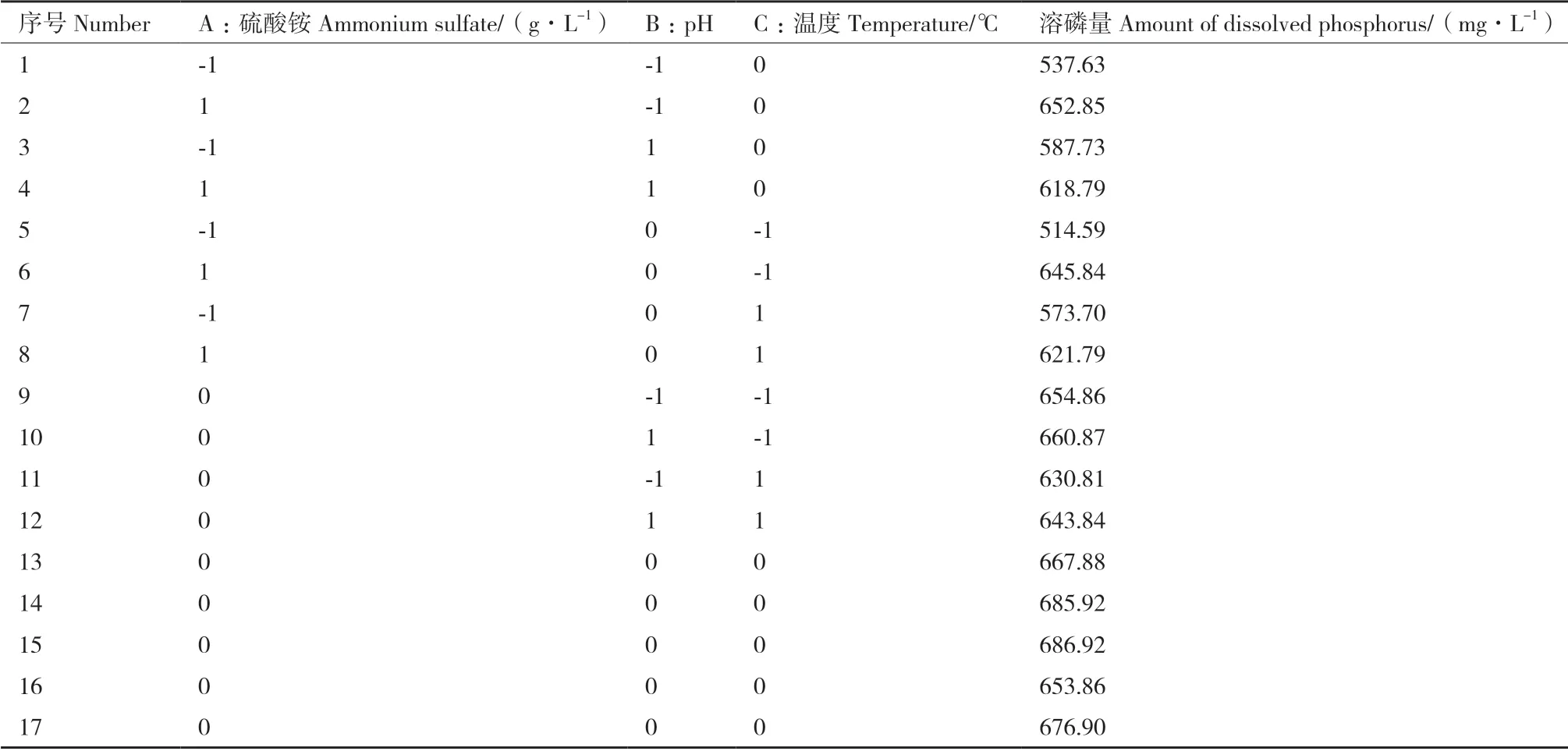
表3 Box-Behnken 试验设计与结果Table 3 Box-Behnken experiment design and results
Y=674.29+40.70*A+4.38*B-0.7514*C-21.04*AB-20.79*AC+1.75*BC-66.83*A2-8.22*B2-18.49*C2
对此方程进行方差分析:此回归模型的F=18.45,P<0.01,差异极显著,并且失拟项P=0.34>0.05,不显著。模型的R2=0.959 5,AdjR2=0.907 5,说明实际值与预测值拟合度较好,该模型可以用来分析和预测菌株1616X1 的最佳溶磷条件。由表4可知,三因素对菌株1616X1 溶磷能力的影响从大到小依次为硫酸铵浓度>pH>温度。由其二次项显著性分析可知,A2、C2对1616X1 溶磷能力有显著影响;交互相中AB、AC 的P<0.05,对1616X1 溶磷能力影响显著,而BC 的P>0.05,说明两者交互作用对溶磷量无显著性影响。

表4 二次模拟的方差分析Table 4 Analysis of variance in quadratic model
2.5.2 响应面交互作用分析 通过Design Expert 12软件,得到三因素交互作用的响应面和等高线见图9。在氮源浓度与pH 的响应面中,氮源浓度的倾斜度大于pH,说明在两者交互作用中,氮源浓度对1616X1 溶磷能力的影响大于pH,而等高线稀疏并呈现椭圆状,表明硫酸铵浓度与pH 两因素之间交互作用显著;同理,在氮源浓度与温度的响应面中,在交互作用中,氮源浓度的影响大于温度,两个因素交互作用显著;而pH 与温度的响应曲面变化平缓,等高线密集,呈现微椭圆状,说明两因素交互作用不显著。

图9 各因素间对菌株1616X1 溶磷能力影响的响应曲面与等高线Fig.9 Contour and response surface about the effects of two factors on the ability of strain 1616X1 dissolving phosphate
2.5.3 溶磷菌1616X1 最优培养条件验证结果 由上述响应面与等高线图可知,响应值R 存在极大值,通过Design-Expert 12 对回归模型分析得到菌株1616X1 溶磷最佳条件为:硫酸铵浓度为0.17 g/L,初始pH 5.70,温度为23.3℃时,预测理论响应值为681.24 mg/L。为了方便实际操作,将上述培养条件调整为硫酸铵浓度0.17 g/L,初始pH 为5.70,温度为23.3℃,按此条件进行试验,重复3 次取平均值,测得溶磷量为684.92 mg/L,与预测值相近,说明此模型具有较好的可信度,可用于后续研究。
2.6 限菌条件下土壤速效磷、pH和溶磷菌1616X1定殖变化
2.6.1 细菌1616X1 在土壤中的定殖情况 菌株在土壤中的定殖情况影响菌株在土壤中的溶磷作用,一般而言,溶磷菌在土壤中的定殖能力越强,代谢分泌物越多,其功能就越显著。菌株1616X1 在土壤中的定殖情况如图10。将细菌1616X1 接种到菜地土壤中,培养到第3 天时,菌落数达到最大,为3.65×108CFU/g,之后开始逐渐下降,在第23 天时,菌落数低于初始浓度;在花圃土壤中,1616X1 接入土壤之后,培养到第5 天时,菌落数达到3.15×108CFU/g,虽然在之后的培养时间内菌落数呈现下降的趋势,但在23 d 时,其菌落数仍高于初始菌落数,为初始菌落数的2.13 倍。综上所述,菌株1616X1 在土壤中能够有很好的定殖能力。
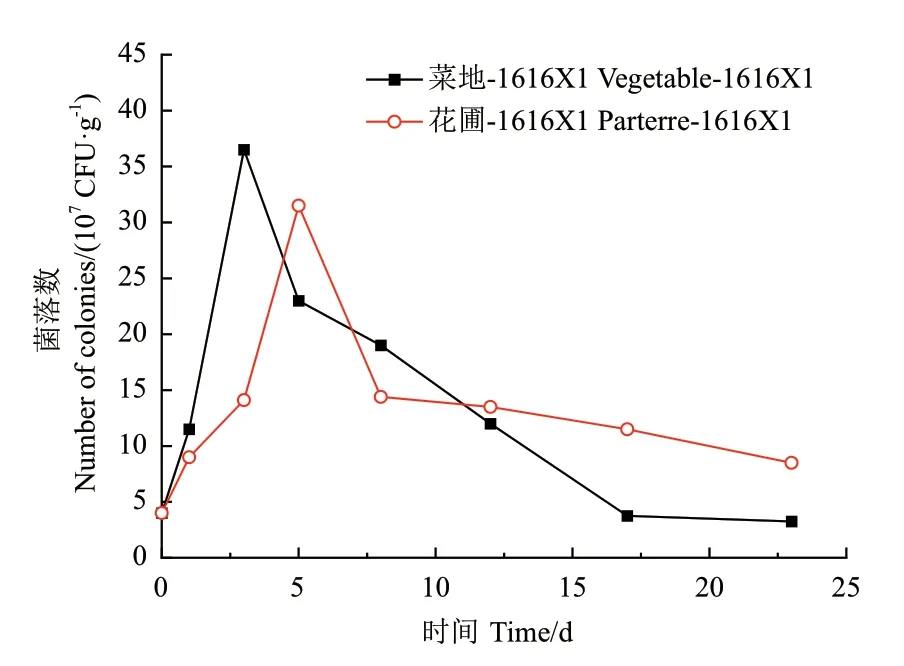
图10 细菌1616X1 在土壤中的定殖情况Fig.10 Colonization of bacteria 1616X1 in soil
2.6.2 细菌1616X1 对土壤速效磷含量及pH 变化的影响 由图11可知,在限菌条件下,接种1616X1的土壤pH 值均低于对照组,且速效磷含量均高于对照组,可能是与溶磷菌在生长代谢过程中分泌有机酸和质子有关。结果表明,溶磷菌1616X1 能够降低菜地土壤的pH 值,在培养第1 天时,pH 明显下降,同时也提高了土壤中的速效磷含量,在第3天达到最高值,为7.38 mg/kg,速效磷含量增加了62.52%;同时,在加入溶磷菌1616X1 的花圃土壤中,pH 值最低时比初始pH 值下降了0.60 个单位,在第5 天时,速效磷达到最大值,为8.08 mg/kg,比初始速效磷含量增加了92.08%。综上所述,在接种了1616X1 的两种土壤中,速效磷含量显著高于对照组,说明细菌1616X1 在土壤中具有较好的溶磷效果。
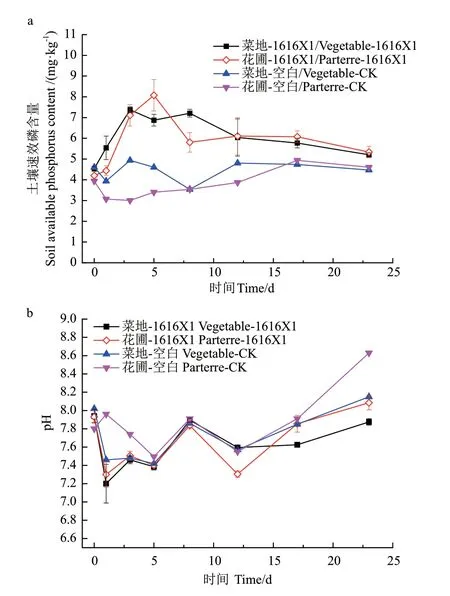
图11 细菌1616X1 对土壤速效磷含量以及pH 的影响Fig.11 Effects of bacterium 1616X1 on soil available phosphorus content and pH
3 讨论
溶磷菌在土壤磷循环过程中起着不可忽视的作用。目前国内外报道的溶磷菌主要有假单胞菌属(Pseudomonas)[2,16]、伯克霍尔德菌属[36](Burkholderia)、固氮菌属(Azotobacter)、芽孢杆菌属(Bacillus)[1,18]、欧文氏菌属(Erwinia)、不动杆菌属(Acinetobacter)[4,37]、根瘤菌属(Bradyrhizobium)[38]、青霉属(Penicillium)[9]、链霉菌属(Streptomyces)等。本研究中的菌株1616X1,经初步鉴定为Pseudomonassp.,并且菌株1616X1 在同属中具有较好的溶磷优势。
不同的溶磷菌在溶磷能力方面存在差异,庄馥璐等[2]分离筛选得到的溶磷菌假单胞菌属菌株PsbM10 在无机磷液体培养时,溶磷量最高达到104.12 mg/L;赵君等[4]分离的不动杆菌属的菌株W1,溶磷量为238.08 mg/L;于淼等[23]研究的恶臭假单胞菌623-3 的溶磷量最高为371.25 mg/L。优化菌株的发酵条件,不仅可以了解细菌在培养过程中的特性,还能够提高菌株的存活率和功能酶活性[39]。在菌株的优化研究中,通常会使用单因素试验以及响应面试验对菌株的生长及发酵条件进行优化。韦宜慧等[25]分离的Burkholderia ubonensis菌株P5,经优化后的溶磷量为268.69 mg/L;陈言柳等[40]对一株油茶根际解磷菌NC285 进行了培养条件优化,优化后溶磷量可达586.73 mg/L;陈容彬等[41]分离得到的伯克霍尔德菌菌株PB,经优化后的溶磷量为569.33 mg/L。本研究中的菌株1616X1 液体培养96 h 时,溶磷量可达到568.76 mg/L,优化后溶磷量可以达到684.92 mg/L,与目前已报道出的菌株相比,1616X1 的溶磷能力有着显著优势,为开发微生物肥料等提供了优良的菌种资源。
对于溶磷菌的研究,国内外已有较多相关研究,而大多数的溶磷细菌却不能很好的适应土壤环境,因此在实际应用中受到了限制。在本研究中,将1616X1 菌液施加到菜地和花圃的土壤中,速效磷含量分别提高了62.52%和92.08%,在整个培养周期内,实验组中速效磷的含量均高于对照组,说明该菌在土壤中具有较好的溶磷活性;但随着时间的延长,实验组中的速效磷含量呈现下降的趋势,该变化与何迪[29]和虞伟斌等[28]报道的结果相似,主要原因是土壤组成成分复杂,并且受金属离子等多种因素的影响,所以溶出的速效磷会被再次固定;同时,随着土壤中营养物质的消耗,有害物质逐渐积累,导致1616X1 活性降低,从而导致速效磷含量降低。土壤中速效磷含量降低,是多种因素共同作用的结果,揭示各因素之间的相互关系,是后期研究的重点。有研究表明,微生物在土壤中的存活率受多种因素影响,如土壤环境变化、与其他土著微生物的生态位竞争等[26]。在本研究的土壤定殖实验中,由于菜地土壤中初始速效磷含量高于花圃土壤,有利于细菌的快速繁殖,因此菜地土壤的菌落数在第3 天达到最高,但是花圃土壤中的总磷含量为26.74 mg/L,远高于菜地土壤总磷,并且菌株1616X1 在土壤的溶磷过程中,花圃土壤中速效磷含量增加量高于菜地土壤,为1616X1 的长期定殖提供了更多磷源,故菌株在花圃土壤中的定殖时间更长,证明了该菌株具有较强的定殖能力,更有助于此菌种在生产应用中的推广。因此,在后续试验中,将对菌株1616X1在农业应用以及溶磷机理等方面进行研究。
4 结论
从湖泊沉积物中筛选高效溶磷菌1616X1,鉴定为Pseudomonassp.。菌株1616X1 的最佳溶磷条件为:葡萄糖10 g/L、硫酸铵0.17 g/L、初始pH 5.70、接种量5%、装液量75 mL,培养温度为23.3℃,在该培养条件下,菌株的溶磷量为684.92 mg/L,相比优化前的568.76 mg/L,提高了17.26%。土壤溶磷试验证明菌株1616X1 在土壤中具有较好的溶磷能力和定殖能力。